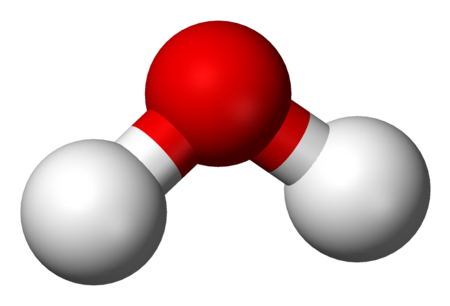
هيدروكسيد الأمونيوم سائل شفاف ينتج عند ذوبان غاز الأمونياك في الماء وتأثيره قوي التأثير على مشعر عباد الشمس ويستخدم في الكشف عن أنيونات عناصر النحاس والحديد الثنائي والثلاثي والألومنيوم وهو يكون معها راسب يتوقف لونه وخواصه على نوع الأنيون.
| هيدروكسيد الأمونيوم | |
|---|---|
| المعرفات | |
| رقم CAS | 1336-21-6  |
| بوب كيم | 12896473 |
| الخواص | |
| الصيغة الجزيئية | NH5O |
| الكتلة المولية | 35.04 g/mol |
| المظهر | Colourless liquid |
| الرائحة | "Fishy", highly pungent |
| الكثافة | 0.91 g/cm3 (25 % w/w) 0.88 g/cm3 (35 % w/w) |
| نقطة الانصهار | −57.5 °س، 216 °ك، -72 °ف |
| نقطة الغليان | 37.7 °س، 311 °ك، 100 °ف |
| الذوبانية في الماء | Miscible |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−80 kJ·mol−1[1] |
| إنتروبيا مولية قياسية S |
111 J·mol−1·K−1[1] |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| مركبات متعلقة | |
| أنيونات أخرى | كلوريد الأمونيوم Ammonium cyanide |
| كتيونات أخرى | Tetramethylammonium hydroxide |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
رمزه الكيميائي NH4OH.
استخداماته
وعلى النقيض من الأمونيا اللامائية، فإن الأمونيا المائية تستخدم في القليل من الاستخدامات غير المتخصصة خارج عوامل التنظيف.
المنظفات منزلية
تدخل الأمونيا الماءية (1-3 ٪) في تطوين العديد من عوامل التنظيف، بما في ذلك العديد من عوامل تنظيف النوافذ.[2]
بالإضافة إلى استخدامها كمكون في المنظفات مع مكونات التطهير الأخرى، تُباع الأمونيا المائية كعامل تنظيف في حد ذاته، وعادةً ما توصف بأنها "الأمونيا". يمكن بيعها برائحة الليمون المعطرة (باللون الأصفر)، أو برائحة الصنوبر (باللون الأخضر). ومن المعروف أن الأمونيا المتاحة مع الصابون المضافة تسمى "الأمونيا الغائمة".
الكيل أمين
يمكن استخدام الأمونيا المائية في الصناعة كمقدمة لبعض الألكيل أمينات، على الرغم من أن الأمونيا اللامائية عادةً ما تكون مُفضلة. يتشكل سداسي ميثيلين رباعي أمين Hexamethylenetetramine بسهولة من الأمونيا المائية والفورمالدهيد (ميثانال). يتكوّن الإيثيلنديامين من 2،1 - ثنائي كلورو الايثان والأمونيا المائية.[3]
معالجة المياه
تستخدم الأمونيا لإنتاج أحادي كلورامين، والذي يُستخدم كمطهر.[4] يفضل الكلورامين على كلورة المياه لقدرته على البقاء نشطًا في أنابيب المياه الراكدة لفترة أطول، مما يقلل من خطر العدوى المنقولة بالماء.
تستخدم الأمونيا في تربية أسماك الزينة لأغراض إنشاء خزان أسماك جديد باستخدام عملية الأمونيا تدعى الدراجات بدون أسماك.[5] هذا يتطلب ألا تحتويالأمونيا على إضافات.
إنتاج الغذاء
كانت أمونيا الخبز (بيكربونات الأمونيوم) واحدة من أولى عوامل التخمر الكيميائي التي تم اختراعها. تم حصادها في الأصل من طحن قرون الغزلان إلى مسحوق.[6] تستخدم الأمونيا كعامل تخمر لأن كربونات الأمونيوم تنشط بالحرارة، وهذا يسمح للخبازين بتجنب وقت الانتظار الطويل للخميرة وتجنب تشتيت [CO2] سريع من صودا الخبز في صنع الخبز والكوكيز. ولا تزال تستخدم لصنع الكعك وغيرها من المخبوزات، ولكن تضاءلت شعبيتها بسبب الرائحة المنبعثة من الأمونيا والمخاوف بشأن استخدامها كمكون غذائي بالمقارنة مع مساحيق تخمر الخبز اليوم.
هيدروكسيد الأمونيا هو قاعدة يمكن استخدامها كمنظم للحموضة لتقليل مستويات الحموضة في الغذاء. وتُصنف في الولايات المتحدة الأمريكية من قِبَل إدارة الغذاء والدواء على النحو المعترف به من قبل GRAS عند استخدامها الطعام.[7] تجعل قدرات الأمونيا على التحكم في الأس الهيدروجيني عكامل فعال مضاد للميكروبات.
صناعة الأثاث
تم استخدام محلول الأمونيا في صناعة الأثاث تقليديًا لتغميق أو تلوين الخشب المحتوي على حمض التانيك. بعد أن يتم مزجها داخل حاوية خشبية، تتفاعل الأبخرة من المحلول مع حمض التانيك وأملاح الحديد الموجودة في الخشب بشكل طبيعي، مما يخلق لمعة غنية وغامقة على الخشب. وقد استخدم هذا بشكل شائع خلال حركة الفنون والحرف اليدوية في الأثاث - وهم نمط للأثاث كان مبنيًا في الأساس من خشب البلوط والملون باستخدام هذه الطرق.[8]
معالجة القش للماشية
يستخدم محلول الأمونيا لعلاج القش، وإنتاج "قش الأمونيا" مما يجعلها أكثر صالح للأكل للبقر.[9]
استخدامات الأمونيا في المختبر
تُستخدم الأمونيا المائية في التحليل غير العضوي النوعي التقليدي كمعقّد وقاعدة. مثل العديد من الأمينات، فإن الأمونيا تُعطي اللون الأزرق الداكن عند تفاعلها مع النحاس (II). يمكن حل الأمونيا باستخدام بقايا أكسيد الفضة، مثل تلك التي تشكلت من كاشف تولنز. غالباً ما توجد الأمونيا في المحاليل المستخدمة في تنظيف الذهب والفضة والمجوهرات البلاتينية، ولكن قد يكون لها تأثيرات سلبية على الأحجار الكريمة المسامية مثل الأوبال واللآلئ.[10]
عندما يتم خلط محلول الأمونيا مع بيروكسيد الهيدروجين المخفففي وجود أيونات المعادن،مثل CU2 +، فإن بيروكسيد الهيدروجين يتحلل سريعًا.
مراجع
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. صفحة A22. .
- Christian Nitsch, Hans-Joachim Heitland, Horst Marsen, Hans-Joachim Schlüussler (2005). "Cleansing Agents". Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a07_137.
- Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). "Amines, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a02_001. .
- "Chloramines in Drinking Water". EPA. US Environmental Protection Agency. مؤرشف من الأصل في 18 يونيو 201806 مارس 2018.
- "Fishless Cycling". Aquarium Advice. مؤرشف من الأصل في 12 يونيو 201806 مارس 2018.
- "Ammonia Cookies". Food Timeline. مؤرشف من الأصل في 14 ديسمبر 201706 مارس 2018.
- Database of Select Committee on GRAS Substances (SCOGS) Reviews: Ammonium hydroxide, [[إدارة الغذاء والدواء (الولايات المتحدة)|]] نسخة محفوظة 25 أغسطس 2014 على موقع واي باك مشين.
- Rigers, Shayne; Umney, Nick. "Acidic and alkaline stains". Wood Coatings: Theory and Practice. Amsterdam: Elsevier. صفحات 618–9. .
- "Is it Bedding or is it Feed? | Ohio BEEF Cattle Letter". u.osu.edu (باللغة الإنجليزية). مؤرشف من الأصل في 1 نوفمبر 201807 يونيو 2018.
- The Jeweler's Bench. 2015. Fine Jewelry Cleaner. Littleton, CO.