الوحدة الفرعية ألفا الخاصة بالبروتين ج (G alpha subunit) هي إحدى ثلاث وحدات فرعية مكونة للبروتين المرتبط بنوكليوتيد الغوانين (بروتين ج).(ملاحظة 1) بروتينات ج هي بروتينات ثلاثية متغايرة مرتبطة بالغشاء تتكون من ثلاث وحدات فرعية: ألفا، بيتا، وغاما.[1] تشكل بروتينات ج مع مستقبلاتها أحد أكثر أنظمة التأشير انتشارا في خلايا الثدييات، وتنظم أنظمة متنوعة متعددة مثل: الإدراك الحسي، نمو الخلية والتنظيم الهرموني.[2]
| ج-ألفا | |
|---|---|
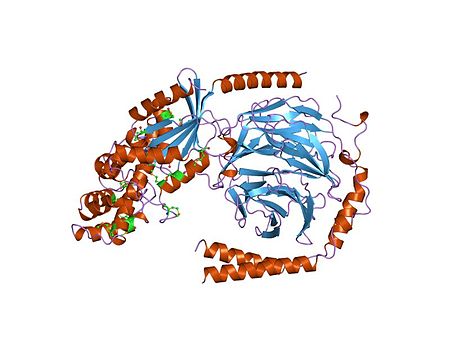
| |
| مركب ثلاثي مغاير مكون من الوحدة الفرعية Gi والوحدتين الفرعيتين بيتا-غاما G. | |
| معرف | |
| رمز | ج-ألفا |
| قاعدة بيانات عوائل البروتينات | PF00503 |
| قاعدة بيانات عوائل البروتينات clan | CL0023 |
| إنتربرو | IPR001019 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1gia |
في سطح الخلية، يُنشِّط ارتباط الربائط مثل الهرمونات والنواقل العصبية بالمستقبلات المقترنة بالبروتين ج هذه المستقبلات عبر التسبب في تغير بنيوي في بنيتها. هذا التغير بدوره ينشط البروتين ج المرتبط بها والمتواجد في الجزء الداخل خلوي من الغشاء. يُعزز المستقبل المنشَّط تبديل ارتباط الوحدة الفرعية ألفا في البروتين ج من الارتباط بثنائي فوسفات الغوانوزين (GDP) إلى الارتباط بثلاثي فوسفات الغوانوزين (GTP). يغير الارتباط بثلاثي فوسفات الغوانوزين تصاوغ مناطق محوِّلة
تتكون الوحدة الفرعية ألفا من نطاقين: نطاق يرتبط بالـGTP ونطاق إدخال لولبي.[7] النطاق المرتبط بالـGTP مماثل للجتبازات الصغيرة من النوع راس، ويحتوي على منطقتي تحويل 1 و2 اللتان تغيران من تصاوغهما البنيوي أثناء التنشيط. مناطق التحويل هي لفات من لوالب ألفا ذات تصاوغات حساسة لنوكليوتيدات الغوانين. نطاق الإدخال اللولبي يتم إدخاله في النطاق المرتبط بالـGTP قبل منطقة التحويل 1، وهو مميز وفريد في بروتينات ج الثلاثية المغايرة. يعمل نطاق الإدخال اللولبي على عزل نوكليوتيد الغوانين في مكان ارتباطه مع النطاق المرتبط بالـGTP، ويجب فصل هذا النطاق لتمكين تفكك النوكليوتيد.[8]
ملاحظات
- ملاحظة 1 سُمي البروتين ج (G protein) كذلك نسبة للحرف الأول (وهوالجيم) في نوكليوتيد الجوانين الذي يرتبط به (Guanine).
مراجع
- Preininger AM, Hamm HE (February 2004). "G protein signaling: insights from new structures". Sci. STKE. 2004 (218): re3. doi:10.1126/stke.2182004re3. PMID 14762218.
- Roberts DJ, Waelbroeck M (September 2004). "G protein activation by G protein coupled receptors: ternary complex formation or catalyzed reaction?". Biochem. Pharmacol. 68 (5): 799–806. doi:10.1016/j.bcp.2004.05.044. PMID 15294442.
- Svoboda P, Teisinger J, Novotný J, Bourová L, Drmota T, Hejnová L, Moravcová Z, Lisý V, Rudajev V, Stöhr J, Vokurková A, Svandová I, Durchánková D (2004). "Biochemistry of transmembrane signaling mediated by trimeric G proteins". Physiol Res. 53 Suppl 1: S141–52. PMID 15119945.
- Chen CA, Manning DR (March 2001). "Regulation of G proteins by covalent modification". Oncogene. 20 (13): 1643–52. doi:10.1038/sj.onc.1204185. PMID 11313912.
- Hildebrandt JD (August 1997). "Role of subunit diversity in signaling by heterotrimeric G proteins". Biochem. Pharmacol. 54 (3): 325–39. doi:10.1016/S0006-2952(97)00269-4. PMID 9278091.
- Albert PR, Robillard L (May 2002). "G protein specificity: traffic direction required". Cell. Signal. 14 (5): 407–18. doi:10.1016/S0898-6568(01)00259-5. PMID 11882385.
- إنتربرو: IPR011025
- Cherfils J, Chabre M (2003) Activation of G-protein Galpha subunits by receptors through Galpha-Gbeta and Galpha-Ggamma interactions. Trends Biochem Sci 28 (1):13-7. DOI:10.1016/s0968-0004(02)00006-3 PMID: 12517447