| Acétylcholine | ||
| ||
 | ||
| Acétylcholine | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-acétoxyéthyl-triméthylammonium | |
| Synonymes |
ACh |
|
| No CAS | ||
| No ECHA | 100.000.118 | |
| No CE | 200-128-9 | |
| Code ATC | S01 | |
| DrugBank | DB03128 | |
| PubChem | 187 | |
| No E | E1001(i) | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C7H16NO2 [Isomères] |
|
| Masse molaire[1] | 146,207 4 ± 0,007 5 g/mol C 57,5 %, H 11,03 %, N 9,58 %, O 21,89 %, |
|
| Précautions | ||
| Directive 67/548/EEC | ||
 Xi |
||
| Écotoxicologie | ||
| DL50 | 11 mg·kg-1 (souris, i.v.) 170 mg·kg-1 (souris, i.p.)[2] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
L'acétylcholine, abrégée en ACh, est un neurotransmetteur qui joue un rôle important aussi bien dans le système nerveux central, où elle est impliquée dans la mémoire et l'apprentissage, que dans le système nerveux périphérique, notamment dans l'activité musculaire et les fonctions végétatives. L'acétylcholine est un ester produit par l'enzyme choline acétyltransférase à partir de l'acétyl-CoA dont l'action est médiée par les récepteurs nicotiniques et muscariniques. L’ACh fut l’objet d’études pionnières qui conduisirent à la formulation des grands principes de la neurotransmission. En effet, dans la première moitié du XXe siècle, l'ACh fut le premier neurotransmetteur identifié dans le système nerveux, d'abord pour son rôle inhibiteur sur l'activité cardiaque. Néanmoins, au niveau de la jonction neuromusculaire, l'ACh a un effet excitateur et au sein du système nerveux central son action combine des effets neuromodulateurs sur la plasticité synaptique, l'apprentissage et l'activation physiologique.
Historique
En 1914, le physiologiste anglais Henry Hallett Dale fut le premier à isoler l'acétylcholine à partir d'un organisme, l'ergot du seigle. L’ACh était une molécule déjà connue puisque sa synthèse chimique fut réalisée dès 1867 par le chimiste allemand Adolf von Baeyer. En 1905, le physiologiste anglais John Newport Langley mit en évidence l'activité biologique de l'ACh qui, lorsqu'elle est appliquée sur un muscle squelettique, provoque sa contraction. De la même manière, Dale démontra en 1914 l'action parasympathomimétique de l'ACh sur les organes et tissus périphériques.
En 1921, le pharmacologiste allemand Otto Loewi mit en évidence l'existence du premier neurotransmetteur jamais découvert. Loewi stimula le nerf vague (nerf X) parasympathique d’un cœur isolé de grenouille, ce qui avait logiquement pour conséquence de le ralentir. L’application du liquide de perfusion de ce cœur sur un autre cœur dénervé provoqua également son ralentissement. Ceci prouvait qu’une substance à l'origine de l'action du système nerveux parasympathique était libérée (et diffusait en l’occurrence dans le liquide de perfusion) lors de la stimulation du nerf vague. Cette substance, un neurotransmetteur, fut dénommée dans un premier temps vagustoff (terme dérivé de « vague »), car l'on ne détermina que bien plus tard qu'il s'agissait en fait de l'ACh. En effet, ce n'est qu'en 1929 que Dale et son collègue le physiologiste anglais Harold Ward Dudley (de) révélèrent l'existence de l'ACh dans des organismes animaux, par extraction de celle-ci à partir de la rate du bœuf et du cheval. En 1936, Dale et ses collègues montrèrent que l'ACh est libérée à la jonction neuromusculaire et qu'elle est donc bien le neurotransmetteur responsable de la contraction volontaire des muscles squelettiques.
Otto Loewi et Henry Hallett Dale reçurent conjointement le Prix Nobel de physiologie ou médecine en 1936 pour leurs travaux sur l'ACh.
Chimie
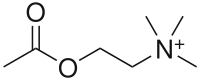
De formule chimique CH3COOCH2CH2N+(CH3)3 et de masse molaire de 146,2 g·mol-1, l'acétylcholine est dérivée de l'acide acétique CH3COOH et de la choline HOCH2CH2N+(CH3)3.
Localisation
Au cours de l'influx nerveux, l'acétylcholine est libérée au niveau des synapses des neurones dites cholinergiques du système nerveux, pour transmettre l'information nerveuse d'un neurone au suivant. Ces synapses qui utilisent l'acétylcholine comme neurotransmetteur sont appelées synapses cholinergiques.
- Dans le système nerveux périphérique végétatif, l'acétylcholine intervient dans la synapse préganglionnaire des fibres orthosympathiques et parasympathiques ainsi que dans la synapse neuro-effectrice du système parasympathique (Figure 2).
- L'acétylcholine est impliquée dans les jonctions neuromusculaires reliant les motoneurones aux muscles squelettiques.
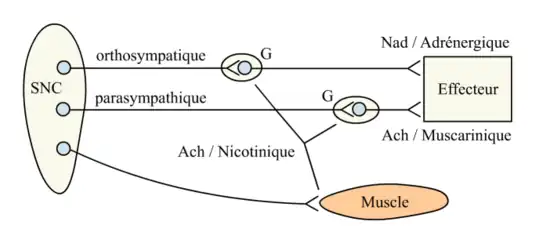
Au niveau de chaque synapse sont indiqués le neurotransmetteur et le récepteur impliqués.
Ach : Acétylcholine, G : Ganglions, Nad : Noradrénaline, SNC : Système nerveux central.
- Dans le système nerveux central, les neurones cholinergiques sont généralement mélangés à d'autres neurones non cholinergiques[3]. Les voies cholinergiques sont diffuses mais un groupe de neurones cholinergiques a été localisé dans la région du noyau septal médian (située dans la partie basse de la face médiale du lobe frontal et sous le bec du corps calleux). Ils innervent l'hippocampe et joueraient un rôle dans la mémorisation, l'apprentissage et le contrôle de l'humeur. Un autre groupe situé aussi dans la zone septale et nommé le noyau basal de Meynert, innerve tout le cortex cérébral et également l'amygdale. Il participerait à la régulation du comportement et de l'humeur.
L'acétylcholine intervient donc au niveau central dans de nombreuses fonctions, comme la régulation de la motricité, perturbée dans la maladie de Parkinson, ou la mémoire, perturbée dans la maladie d'Alzheimer.
Métabolisme de l'acétylcholine


- Synthèse :
La synthèse se fait dans la fibre nerveuse elle-même à partir de la choline et de l’acétyl-coenzyme A. La choline provient soit de l'alimentation soit d'une biosynthèse endogène à partir de la sérine. L'acétyl-coenzyme A est une co-enzyme formée dans les mitochondries de la cellule nerveuse à partir du métabolisme des glucides et des lipides (Beta oxydation).
La synthèse de l'acétylcholine demande de l'énergie mais elle est facilitée par une enzyme : la choline-acétyl-transférase. Celle-ci est synthétisée dans le corps cellulaire puis migre vers la terminaison nerveuse.
- Stockage :
Après sa synthèse, l'acétylcholine est stockée dans les vésicules de la membrane présynaptique. On évalue à 300 000 le nombre de vésicules d'une terminaison présynaptique, contenant chacune de 1 000 à 50 000 molécules d'acétylcholine[3].
- Libération :
L'arrivée d'un potentiel d'action au niveau d'une terminaison axonale induit l'ouverture des canaux à Ca++ dépendants du potentiel. L'entrée des ions Ca++ qui s'ensuit provoque la fusion des vésicules à la membrane plasmique et la libération de l'Ach dans la fente synaptique. L’ACh diffuse ensuite de l’autre côté de la synapse et en se fixant sur des récepteurs postsynaptiques, il provoque une modification de la perméabilité ionique membranaire (via des récepteurs ionotropes et/ou métabotropes).
- Destruction :
L’ACh doit disparaître de cette synapse. Si on veut que l’influx nerveux produise une décharge de 100 Hz (100 potentiels d'action par seconde), l’ACh doit être détruite en moins d’un centième de seconde. Et en effet, l'acétylcholine subit une hydrolyse en quelques millisecondes par l’acétylcholinestérase, une enzyme présente dans la fente synaptique et associée à la face externe des cellules. L'ACh est hydrolysée en acétate et choline, immédiatement recaptée par le neurone présynaptique via un transporteur sélectif à 12 hélices transmembranaires.
C’est un des moyens pour que le médiateur arrête son action dans la synapse. Un deuxième moyen existe : l’ACh n’est pas détruite mais diffuse en dehors de la synapse.
Les récepteurs cholinergiques
L'acétylcholine se fixe sur les récepteurs présents à la surface du neurone postsynaptique. Ces récepteurs sont principalement de deux types : nicotiniques et muscariniques. Les premiers sont des canaux cationiques activés par l'acétylcholine, provoquant très rapidement, en quelques millisecondes, une dépolarisation et une excitation. Les seconds, les récepteurs muscariniques, couplés aux protéines G et donc plus lents, peuvent induire des réponses inhibitrices.
Dans le système nerveux végétatif, les récepteurs cholinergiques sont :
- nicotiniques au niveau du ganglion, pour le sympathique et le parasympathique ;
- muscariniques au niveau de la cible du parasympathique (fig. 2).
Récepteurs muscariniques
Les récepteurs muscariniques font partie de la famille des récepteurs métabotropes à sept domaines transmembranaires (7TM), tout comme les récepteurs adrénergiques. Ils sont largement distribués dans l'organisme et sont très représentés dans le cerveau (M1, M3 et M4).
Ils sont divisés en cinq classes (M1 à M5), issus de gènes distincts, tous clonés.
- Les récepteurs M1, M3 et M5 sont couplés aux protéines Gq/11 et possèdent une activité excitatrice. Les récepteurs M1 (système nerveux central, estomac et ganglions), M3 et M5 activent une phospholipase C (PLC) qui peut entraîner, selon les tissus, la contraction musculaire, la libération d'adrénaline ou la modulation de l'excitabilité des neurones.
- Les récepteurs M3 (muscles lisses des bronches, de l'intestin, des vaisseaux...) sont couplés à une PLC. Cette dernière provoque l'accumulation de calcium dans le cytoplasme qui, en se liant avec la calmoduline, provoque la phosphorylation de la MLCK. Celle-ci se détache de la myosine, qui peut alors se lier à l'actine, ce qui provoque une constriction des bronches. Les glandes sécrétrices, comme les glandes salivaires, sont aussi stimulées via les récepteurs M3.
- Les récepteurs M2 et M4 sont couplés principalement aux protéines Gi et sont inhibiteurs. Les récepteurs M2 (cœur, muscles lisses) et M4 inhibent l'adénylate cyclase via l'activation de la sous-unité alpha d'une protéine Gi. Ils sont également responsables de l'ouverture de canaux potassium créant une hyperpolarisation de la membrane postsynaptique.
- Le rythme cardiaque est diminué par stimulation parasympathique via les récepteurs M2.
Récepteurs nicotiniques
Les récepteurs nicotiniques font partie de la famille des récepteurs ionotropes. Ils sont présents dans le cerveau, la moelle épinière, les ganglions des systèmes nerveux orthosympathiques et parasympathiques et dans la synapse entre les neurones moteurs et les effecteurs (en). Ces récepteurs pentamériques (deux sous-unités α, une β, une δ et une γ ou ε) d'une masse moléculaire de 280 kDa forment un canal d'un diamètre de 6,5 Å, qui ne s'ouvre qu'après fixation de deux molécules d'acétylcholine sur les sous-unités α. Les deux sous-unités α changent alors de conformation pour permettre le passage d'ions dans le canal ionique. L'acétylcholine est ensuite rapidement dégradée par des acétylcholinestérases pour refermer le canal ionique et stopper l'influx nerveux. En 2009, 17 sous-unités sont connues et séquencées[3] : α1 à α10, β 1 à β 4, γ, δ et ε. Sur le nombre de pentamères possibles assez considérable, seuls une dizaine sont actuellement caractérisés.
L'activation des récepteurs nicotiniques neuronaux N1 (système nerveux central et ganglions périphériques) produit l'ouverture de canaux perméables aux ions sodium Na+ et potassium K+. L'entrée importante d'ions sodium dans le neurone postsynaptique crée une dépolarisation rapide de la membrane et assure la propagation de l'influx nerveux.
Les récepteurs nicotiniques de type musculaire N2 situés sur les jonctions neuromusculaires sont couplés à des canaux sodiques. Leur activation provoque l'entrée de Na+, ce qui produit une dépolarisation localisée appelée potentiel de plaque motrice (PPM). Ce PPM ouvre les canaux Na+ voltage-dépendant et déclenchent un potentiel d'action classique. Celui-ci parcourt la fibre musculaire et pénètre dans le tubule transverse, où il stimulera la libération du calcium contenu dans le réticulum sarcoplasmique. L'élévation de la concentration intracellulaire en ions calcium provoque la contraction des muscles squelettiques.
Synthèse de l'action de l'acétylcholine
| Tissu | Effet de l'acétylcholine | Récepteurs impliqués |
| Système nerveux | Mémorisation et apprentissage | M1 |
| Cœur | Diminution de la fréquence cardiaque | M2 |
| Vaisseaux | Vasodilatation, baisse de la pression artérielle | M3 |
| Poumon | Contraction des bronches, sécrétion | M3 |
| Intestins, Estomac | Contractions, sécrétions | M3 |
| Glandes salivaires | Sécrétion | M3 |
| Œil | Contraction de la pupille, larmes | M3 |
| Glande médullosurrénale | Inhibe la sécrétion d'adrénaline (qui n'est plus
stimulée par le système orthosympathique) |
N |
| muscle squelettique | Contraction | N |
Pharmacologie
- Agonistes des récepteurs cholinergiques
- De nombreux analogues non hydrolysables de l'acétylcholine ont été synthétisés au début du XXe siècle. Des substances comme la métacholine (1911) ou le carbochol (1932) sont non sélectives, c'est-à-dire qu'elles ont une affinité semblable pour les récepteurs muscariniques et nicotiniques.
- Actuellement, plusieurs agonistes cholinergiques muscariniques ont été trouvés : la muscarine isolée à partir de champignon comme l'amanite tue-mouches (Amanita muscaria), le béthanéchol (carbamyl bêta-méthylcholine), ou des alcaloïdes extraits des feuilles d'un arbuste brésilien (Pilocarpus microphyllus) ou de la noix d'arec issue d'un palmier (Areca catechu), nommés respectivement pilocarpine et arécoline.
- L'agoniste prototypique des récepteurs nicotiniques neuronaux est bien sûr la nicotine, extraite de la feuille de tabac (Nicotiana tabacum). La nicotine possède une action stimulatrice à faible concentration et inhibitrice et toxique à forte concentration.
- Il y a aussi la lobéline extraite de Lobelia inflata, la coniine extraite de la grande ciguë (Conium maculatum) ou la cytisine extraite de l'aubour Laburnum anagyroides.
- Inhibiteurs des acétylcholinestérases
- Pour accroître la transmission cholinergique, une alternative à l'apport d'agonistes exogènes consiste à bloquer la dégradation de l'acétylcholine. Les inhibiteurs de l'enzyme de dégradation, l'acétylcholinestérase, peuvent manifester des effets muscariniques et nicotiniques, centraux ou périphériques suivant leur aptitude à franchir la barrière hématoencéphalique.
- La physostigmine ou ésérine est un alcaloïde extrait de la fève de Calabar, une graine de Fabacées du genre Physostigma. C'est un inhibiteur de l'acétylcholinestérase capable de passer la barrière hématoencéphalique et développant des effets muscariniques. Il manifeste un renforcement du tonus vagal (troubles dyspeptiques). La pyridostigmine (Mestinon) est utilisée dans le traitement de la myasthénie (faiblesse des muscles volontaires) et de l'atonie intestinale.
- Divers inhibiteurs de l'acétylcholinestérase ont été essayés pour traiter les déficiences cholinergiques associées à la maladie d'Alzheimer. Les molécules les plus récentes sont rivastigmine (Exelon), le donépézil (Aricept) ou la galantamine (Reminyl).
- Enfin, les composés insecticides très toxiques, de la classe des organophosphorés, sont des inhibiteurs irréversibles de l'acétylcholinestérase. C'est le cas du malathion, un insecticide neurotoxique dangereux interdit[4] en France depuis le .
- Des gaz de combat comme le sarin, le soman ou le tabun utilisent aussi l'activité anticholinestérase.
- Antagonistes des récepteurs cholinergiques
- Les antagonistes des récepteurs muscariniques ont sur le plan périphérique une activité parasympatholytique directe.
- Diverses plantes de la famille des Solanacées, comme le datura, la belladone ou la jusquiame sont riches en alcaloïdes tropaniques aux propriétés hallucinogènes connues depuis l'antiquité. Les substances les plus abondantes[5] sont la scopolamine, l'hyoscyamine et l'atropine (formée par racémisation à partir de l'hyoscyamine lors du processus d'extraction). Ce sont des antagonistes muscariniques non sélectifs, capable de passer la barrière hématoencéphalique et donc d'avoir des effets aussi bien centraux que périphériques.
- L'atropine est un médicament d'urgence, indiquée dans le malaise vagal, l'infarctus, les troubles aigus du tube digestif. Elle est aussi utilisée en tant que collyre, comme mydriatique dans les examens du fond de l’œil. Ces antagonistes muscariniques peuvent avoir des effets anticholinergiques indésirables : sécheresse buccale, diminution des sécrétions lacrymales, risques de glaucome, tachycardie etc.
- En vue de mieux cibler l'effet thérapeutique, des antagonistes muscariniques sélectifs des sous-types M1 à M5 ont été recherchés : pirenzépine, antagoniste M1 (anti-ulcéreux), méthoctramine, antagoniste M2, l'hexahydro-sila-diffénidol (HHSiD), antagoniste M3, la tropicamide antagoniste M.
- Les antagonistes des récepteurs nicotiniques musculaires sont des alcaloïdes de la famille du curare qui se fixent sur les récepteurs nicotiniques postsynaptiques de façon compétitive et empêchent l'action de l'acétylcholine. Ces substances agissent au niveau de la plaque motrice et entraînent une paralysie. En vue d'une utilisation en anesthésie, des analogues ont été synthétisés comme l'atracurium (Tracrium), le mivacurium (Mivacron) ou le pancuronium (Pavulon), capables de provoquer une relaxation musculaire contrôlée, facilitant les interventions chirurgicales.
- L'alpha-bungarotoxine, extraite du venin de serpent Bungarus, se fixe sur les récepteurs nicotiniques, induit aussi une paralysie musculaire.
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) « Acétylcholine », sur ChemIDplus, consulté le 8 février 2009
- 1 2 3 4 Yves Landry, Jean-Pierre Gies, Pharmacologie Des cibles vers l'indication thérapeutique, Dunod, 2009 (2e édition)
- ↑ « Malathion - Retrait de l'autorisation de mise sur marché. », JOURNAL OFFICIEL DE LA RÉPUBLIQUE FRANÇAISE.
- ↑ Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
Liens externes
- Compendium suisse des médicaments : spécialités contenant Acétylcholine