| Acide picrique | |
| |
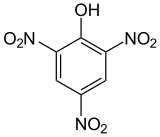
| Structure de l'acide picrique. | |
| Identification | |
|---|---|
| Nom UICPA | 2,4,6-trinitrophénol |
| Synonymes |
acide carbo-azotique |
| No CAS | |
| No ECHA | 100.001.696 |
| No CE | 201-865-9 |
| PubChem | 6954 |
| ChEBI | 46149 |
| SMILES | |
| InChI | |
| Apparence | cristaux jaunes, inodores[1] |
| Propriétés chimiques | |
| Formule | C6H3N3O7 [Isomères] |
| Masse molaire[2] | 229,103 9 ± 0,007 7 g/mol C 31,45 %, H 1,32 %, N 18,34 %, O 48,88 %, |
| pKa | 0,38 |
| Propriétés physiques | |
| T° fusion | 121,85 °C[3] |
| T° ébullition | 300 °C (explosion)[4] |
| Solubilité | 14 g l−1 (eau, 20 °C)[4] |
| Masse volumique | 1,76 g cm−3 à 20 °C[4] |
| T° d'auto-inflammation | 300 °C[1] |
| Point d’éclair | 150 °C[1] |
| Thermochimie | |
| ΔfH0solide | −217,9 kJ mol−1[3] |
| ΔfusH° | 17,1 kJ mol−1 à 120,95 °C[3] |
| Cp | 239,7 J mol−1 K−1 (solide, 19,85 °C)[3] |
| PCI | −2 570,0 kJ mol−1[3] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | Pca21[5] |
| Paramètres de maille | a = 9,254 Å b = 19,127 Å |
| Volume | 1 717,62 Å3[5] |
| Précautions | |
| SGH[6] | |
  Danger |
|
| SIMDUT[7] | |
   D1B, D2B, E, F, |
|
| NFPA 704 | |
| Transport | |
| Écotoxicologie | |
| DL50 | 200 mg kg−1 (rat, oral) 56,3 mg kg−1 (souris, i.p.)[8] |
| LogP | 1,64[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Acide picrique est l'expression commune pour le composé chimique 2,4,6‑trinitrophénol, également appelé acide carbo-azotique ou mélinite, de formule (NO2)3C6H2–OH.
Il a été découvert par Peter Woulfe en 1771 à la suite de l'action de l'acide nitrique sur l'indigo. En 1885, le chimiste Eugène Turpin l'a redécouvert et stabilisé dans du coton pressé, pour le rendre utilisable comme explosif sous le nom de mélinite.
En 1799, le chimiste français Jean-Joseph Welter l'obtint par action de l'acide nitrique sur de la soie. Le produit recueilli, jaune et amer, fut longtemps désigné sous le nom de « Jaune amer de Welter »[9]. C'est un solide cristallin jaune fabriqué à partir du chlorobenzène. C'est un composé très réactif (explosif, comme tous les composés hautement nitrés, par exemple le trinitrotoluène ou la nitroglycérine), de puissance dépassant légèrement celle du TNT. Il attaque la plupart des métaux en produisant des picrates très instables et également explosifs (choc, friction, feu ou autre sources d'ignition).
C'est un produit irritant pour la peau, les yeux et les voies respiratoires et toxique par inhalation, par contact avec la peau et/ou par ingestion.
Explosivité
La vitesse de détonation de l'acide picrique est 7 650 m/s à sa densité maximale obtenue par compression. Sec, il est plus sensible aux chocs et aux frottements qu'additionné d'eau (on dit que l'eau le « flegmatise »), mais un peu moins que le TNT et beaucoup moins que l'hexogène ou la penthrite. C'est un des explosifs secondaires les plus stables. Il est encore plus stable s'il est recristallisé après fusion. Mais, pour des raisons de sécurité, son transport s'effectue sous forme humide (30 % ou plus d'eau), et les laboratoires qui l'utilisent le conservent également ainsi, toujours dans des contenants en verre (pas en cristal, qui contient du plomb, ni en métal, car cet acide peut former avec certains métaux, notamment le cuivre, des sels (picrates), explosifs et instables, particulièrement dangereux).
Caractéristiques
- Peu soluble dans l'eau, l'éther, l'éthanol ; soluble dans le benzène et l'acétone (propanone).
- Explose au-dessus de 300 °C.
- Utilisations : explosifs, colorant, thérapeutique, fixation en microscopie (liquide de Bouin).
- Risque majeur : explosion par choc, friction, feu. Voir l'article du wikilivre de tribologie.
- Il produit des sels (composés métalliques) explosifs très sensibles, des picrates.
- Couleur : jaunâtre.
Classement de sécurité
Au Canada, il est classé comme « dangereusement réactif » au titre du classement SIMDUT (Système d'information sur les matières dangereuses utilisées au travail).
Utilisations
- Les propriétés de l’acide picrique comme explosif furent découvertes par Eugène Turpin (qui la commercialisa sous le nom de mélinite ou lyddite) : alors que la houille dont on extrait son principe de base (le phénol) était abondante, l’acide picrique fut très utilisé durant la Première Guerre mondiale, surtout dans les obus dont le remplissage était facilité par un point de fusion relativement bas (122,5 °C) par rapport à sa température de décomposition (300 °C), assurant aux opérateurs une bonne marge de sécurité. Certains soldats ingérèrent de l'acide picrique pour simuler une jaunisse et être retirés du front[10].
- Tests cutanés (autrefois).
- Colorant (teinture de la laine) (autrefois).
- Tannage des coussinets des pattes de lapins pour les rendre plus résistantes aux grillages de clapiers (autrefois).
- Colorant jaune vif pour le placage de bois, utilisé dilué (proportion d'1,5 à 3 ‰) sous forme de bain, souvent en combinaison avec le sulfate de fer (celui-ci sert d'accrocheur et donne une teinte gris-bleu) pour obtenir un vert vif notamment utilisé pour les pointes de trictrac (équivalent du jacquet ou backgammon au XVIIIe siècle).
- De nos jours, l’acide picrique à faible dose est un des ingrédients du liquide de Bouin, un milieu de conservation utilisé pour les prélèvements en anatomo-pathologie et en histologie.
- C'est un composant du réactif dosant la créatinine dans le sang par la méthode de Jaffé.
- C'est un remède efficace contre les brûlures (mais peu utilisé en raison de son caractère dangereux (explosif)).
- L'acide picrique peut être utilisé en métallurgie pour révéler la microstructure d'aciers.
- Dans certains sports tel l’aviron, il est utilisé pour durcir la peau des mains, créer artificiellement des cals et ainsi éviter les ampoules.
Écotoxicologie
Les impacts globaux de l'acide picrique sur l'environnement (champignons, flore, faune, bactéries, etc.) ne semblent pas avoir été très étudiés. Cet acide est le principal explosif (mélinite) des millions d'obus non explosés de la Première Guerre mondiale, pour partie récupérés après guerre, mais souvent immergés. Il est susceptible de contaminer l'environnement[11], au XXIe siècle quand ces obus seront suffisamment corrodés. Outre le risque toxique et écotoxique, existe un risque d'explosion à la suite de la formation de picrates. Or de l'acide picrique peut être présent dans des armes chimiques non explosées ou dans des munitions stockées à proximité de ces dernières.
Notes et références
- 1 2 3 ACIDE PICRIQUE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 4 5 (en) « 2,4,6-Trinitrophenol », sur NIST/WebBook (consulté le 28 août 2009).
- 1 2 3 4 Entrée « Picric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 août 2009 (JavaScript nécessaire).
- 1 2 3 « Picric acid », sur reciprocalnet.org (consulté le ).
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- ↑ « Acide picrique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- ↑ (en) « Acide picrique », sur ChemIDplus (consulté le 28 août 2009).
- ↑ « Produit du jour », sur societechimiquedefrance.fr.
- ↑ Patrick Loodts et Isabelle Masson-Loodts, La grande guerre des soignants (médecins, infirmières et brancardiers de 1914-1918), Bruxelles, les Éditions de la mémoire, 2008, p. 123.
- ↑ INERIS, Fiche toxicologique du chlorobenzène, p. 11/20 (version 2006 04 05).
Voir aussi
Articles connexes
- Poudre sans fumée
- Cordite
- Munition, munition immergée, munition non explosée
- Liste de composés explosifs
Liens externes
- Fiche de sécurité de l'acide picrique, sur micromega-hatier.com


