| Acide salicylique | |
| |
| Identification | |
|---|---|
| Nom UICPA | Acide 2-hydroxybenzoïque |
| Synonymes |
Acide ortho-hydroxybenzoïque |
| No CAS | |
| No ECHA | 100.000.648 |
| No CE | 200-712-3 |
| Code ATC | D01, D11, N02, S01 |
| PubChem | |
| FEMA | 3985 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline incolore ou cristaux en forme d'aiguilles[1] |
| Propriétés chimiques | |
| Formule | C7H6O3 [Isomères] |
| Masse molaire[2] | 138,120 7 ± 0,006 9 g/mol C 60,87 %, H 4,38 %, O 34,75 %, |
| pKa | pKa1 = 2,98 à 20 °C (acide carboxylique); pKa2 = 13,6 (phénol)[3] |
| Propriétés physiques | |
| T° fusion | 159 °C[1], Point de sublimation : 76 °C[1] |
| T° ébullition | 211 °C à 20 Torr[3] |
| Solubilité | 1,2 g·kg-1 (eau, 0 °C), 1,4 g·kg-1 (eau, 10 °C), |
| Masse volumique | 1,443 g·cm-3 (20 °C/4 °C)[4] |
| T° d'auto-inflammation | 540 °C[1] |
| Point d’éclair | 157 °C (coupelle fermée)[4] |
| Pression de vapeur saturante | 0,0 Pa (20 °C), 0,1 Pa (40 °C), |
| Thermochimie | |
| Cp | |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P21/a [6] |
| Paramètres de maille | a = 11,520 Å b = 11,210 Å |
| Volume | 635,30 Å3 [6] |
| Propriétés optiques | |
| Indice de réfraction | 1,565 [3] |
| Précautions | |
| SIMDUT[7] | |
 D2A, |
|
| NFPA 704 | |
| Directive 67/548/EEC | |
 Xn |
|
| Écotoxicologie | |
| LogP | 2,26 [3] |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide salicylique ou acide 2-hydroxybenzoïque est un composé organique aromatique, l'un des trois isomères de l'acide hydroxybenzoïque, constitué d'un noyau benzénique substitué par un groupe carboxyle (acide benzoïque) et un groupe hydroxyle (phénol) en position ortho. C'est un solide cristallin incolore qu'on trouve naturellement dans certains végétaux, dont le saule blanc (d'où il tire son nom) et la fausse-spirée (d'où le nom désuet acide spirique), utilisé comme médicament et comme précurseur de l'acide acétylsalicylique, l'aspirine.
Occurrence naturelle
L'acide salicylique est naturellement synthétisé par certains végétaux (comme la reine-des-prés ou le saule), on le retrouve notamment dans des fruits, sous forme estérifiée de salicylate de méthyle. Il peut agir comme un signal hormonal pouvant déclencher, dans certains cas, une thermogenèse végétale[8].
Propriétés
Ingéré en grandes quantités, c'est un produit toxique, mais en de moindres quantités il est utilisé comme conservateur alimentaire et antiseptique.
Les propriétés médicales de l'acide salicylique sont connues depuis longtemps, surtout pour son action contre la fièvre. On l'extrayait principalement du saule, salix en latin dont il tire son nom. Dans la lutte contre la fièvre, il est désormais supplanté par d'autres médicaments plus efficaces comme l'aspirine (qui en est un dérivé), ou le paracétamol.
Il n'est désormais plus utilisé pour son action apaisante (antalgique) et on le retrouve dans de nombreux produits en dermatologie en complément d'un autre principe actif. Il est par exemple utilisé dans le traitement de l'acné, des verrues ou de l'hyperhidrose.
Synthèse et propriétés chimiques
Le groupement acide carboxylique (-COOH) peut réagir avec un alcool en donnant de nombreux esters. Le groupe hydroxyle peut réagir avec l'acide acétique pour former de l'acide acétylsalicylique, ou aspirine.
Industriellement, l'acide salicylique est synthétisé par la réaction de Kolbe :
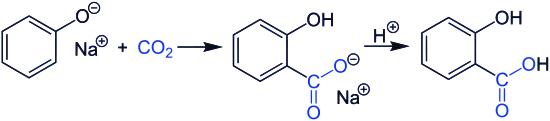
L'acide salicylique forme avec l'ion salicylate un couple acide/base de formule C6H4OHCOOH / C6H4OHCOO−.
Toxicité
Vapeurs irritantes pour les muqueuses oculaires et respiratoires. Produit inflammable.
L'acide salicylique est également suspecté d'être reprotoxique[9].
Implication dans la résistance systémique acquise
L’accumulation d’acide salicylique, produit à la suite de la reconnaissance de pathogènes, est nécessaire à l’activation de la résistance systémique acquise[10]. Par conséquent, la biosynthèse d’acide salicylique va augmenter lorsque la plante reconnaît un pathogène viral ou non-viral. Cette accumulation va stimuler une résistance contre la réplication virale et sa propagation intracellulaire. Grâce à cette résistance, l’infection aura moins de risque de devenir systémique. Et pourtant, certains virus (par exemple : le virus de la mosaïque du tabac) vont stimuler la biosynthèse d’acide salicylique dans l'hôte. Ce phénomène suggère que l’acide salicylique va modérer la réplication virale et par conséquent, empêcher la nécrose et d’autres symptômes exacerbés chez la plante. Via la nécrose, les particules virales vont être inactivées dans le tissu nécrosé et le virus ne pourra pas se propager dans la plante. En d’autres mots, le virus va promouvoir la synthèse d’acide salicylique afin de ralentir sa réplication. En ralentissant sa réplication, les symptômes de la plante seront modérés et le virus pourra mieux se propager et se répliquer[11].
Divers
L'acide salicylique fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé[12].
Notes et références
- 1 2 3 4 ACIDE SALICYLIQUE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 4 5 6 « Salicylic acid », sur Hazardous Substances Data Bank (consulté le )
- 1 2 3 4 (en) Mary R. Thomas, Kirk-Othmer encyclopedia of chemical technology 4th ed. : Salicylic acid and related compounds, vol. 21, John Wiley & Sons.
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-858-6)
- 1 2 3 « Salicylic acid », sur www.reciprocalnet.org (consulté le )
- ↑ « Acide salicylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail)
- ↑ Giberneau M et Brabé D, « Des fleurs « à sang chaud » », Pour la Science, , p. 50-56/
- ↑ « Brief Profile - ECHA », sur echa.europa.eu (consulté le )
- ↑ (en) J. Ryals, K. A. Lawton, T. P. Delaney et L. Friedrich, « Signal transduction in systemic acquired resistance », Proceedings of the National Academy of Sciences, vol. 92, no 10, , p. 4202–4205 (ISSN 0027-8424 et 1091-6490, PMID 11607545, DOI 10.1073/pnas.92.10.4202, lire en ligne, consulté le )
- ↑ (en) Alex M Murphy, Tao Zhou et John P Carr, « An update on salicylic acid biosynthesis, its induction and potential exploitation by plant viruses », Current Opinion in Virology, vol. 42, , p. 8–17 (ISSN 1879-6257, DOI 10.1016/j.coviro.2020.02.008, lire en ligne, consulté le )
- ↑ Organisation mondiale de la santé, « Liste modèle de l'OMS des médicaments essentiels » [PDF], sur who.int, (consulté le ), p. 24.
Voir aussi
- Acide thiosalicylique




