| Carbonate de sodium | |
| |
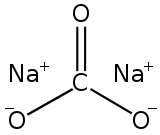
| Structure du carbonate de sodium | |
| Identification | |
|---|---|
| Nom UICPA | carbonate de sodium |
| Synonymes |
trioxocarbonate de disodium ; carbonate de soude anhydre |
| No CAS | |
| No ECHA | 100.007.127 |
| No CE | 207-838-8 |
| PubChem | 10340 |
| No E | E500(i) |
| Apparence | poudre blanche hygroscopique. (anhydre)[1] |
| Propriétés chimiques | |
| Formule | Na2CO3 |
| Masse molaire[2] | 105,988 4 ± 0,001 7 g/mol C 11,33 %, Na 43,38 %, O 45,29 %, |
| pKa | 10,33 ou 10,35 (couple acido-basique HCO3 −/CO3 2−) |
| Propriétés physiques | |
| T° fusion | 851 °C (anhydre)[1]; 109 °C (monohydrate ou thermonatrite); 32 °C (heptahydrate); 34 °C (décahydrate ou natron) |
| T° ébullition | se décompose avant |
| Solubilité | dans l'eau à 20 °C : 300 g·l-1 (anhydre)[1] |
| Masse volumique | 2,532 g·cm-3 (anhydre)[1] |
| Cristallographie | |
| Système cristallin | Monoclinique pour les formes polymorphiques (γ, β, δ)[3] |
| Classe cristalline ou groupe d’espace | groupe de point 2/m pour γ, β, δ, anhydrous)[3] groupe d'espace C2/m pour γ, β, δ |
| Propriétés optiques | |
| Indice de réfraction | 1,535 1,485 raie D |
| Précautions | |
| SGH[4] | |
 Attention |
|
| SIMDUT[5] | |
  D2B, E, |
|
| Écotoxicologie | |
| DL50 | 4 090 mg·kg-1 (rats, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |

Le carbonate de sodium est un composé chimique de formule Na2CO3 et correspondant à l'espèce minérale naturelle dénommée natrite. Il s'agit d'un sel de sodium de l'acide carbonique. Il représente un des grands produits polyvalents de la chimie moderne. Dans le langage courant, ce solide ionique, le plus souvent sous forme poudreuse, et ses solutions aqueuses sont dénommés communément respectivement cristaux de soude et soude, du nom ancien de cet alcali minéral, utilisé précocement dans l'industrie verrière antique[6].
Il ne faut pas confondre le carbonate de sodium Na2CO3 avec l'hydroxyde de sodium NaOH, dit « soude caustique », ni avec le bicarbonate de sodium NaHCO3, autrefois nommé communément « bicarbonate de soude ».
Obtention
Le carbonate de sodium peut être obtenu à partir de gisements de natron Na2(CO3) • 10 H2O, souvent stocké en réserve géologique sous forme de thermonatrite Na2(CO3) • H2O, ou encore de trona Na2CO3 • NaHCO3 • 2H2O[7]. En Égypte antique, on le trouvait dans la fleur de natron des lacs Amers ou dans les cendres lessivées des nombreuses plantes de la famille des chénopodiacées poussant sur les salisols. La salicorne sur les rivages de Méditerranée ou diverses plantes des rivages atlantiques, dénommées communément soude, donnaient par combustion des cendres, dont on tirait un sel soluble ou alcali nommé soude[8]. Il s'agit de l'« alcali minéral » des Anciens.
Les déserts alcalins et surtout leurs lacs endoréiques alcalins offrent de nombreuses ressources en carbonate de sodium ; par exemple le lac Magadi au Kenya, le lac Owens et les nombreux lac Soda ou Alkali lake en Californie, en Oregon, en Colombie-Britannique[9]. Il y a aussi pléthore d'anciens lacs, comme le lac Searles.
Le procédé Leblanc a été élaboré entre 1771 et 1791. Il a connu un essor vigoureux après 1830, mais s'est effondré vers 1870[10].
Le procédé Solvay ou procédé à l'ammoniac qui produit du carbonate de sodium à partir de sel et de craie l'a supplanté avant 1870 car moins coûteux en charge de combustible et relativement moins polluant[11]. Il exploite souvent les saumures de sel gemme peu coûteuses et la grande solubilité du bicarbonate d'ammonium dans l'eau, a contrario de la faible solubilité à froid du bicarbonate de sodium NaHCO3. Le carbonate de sodium ou soude Solvay est obtenu finalement en chauffant du bicarbonate de sodium à la température de 100 °C. Les soudières produisent un composé Na2CO3 pulvérulent, nommé soude légère. Sa densité apparente est de l'ordre de 0,5 t/m3. Pour diverses applications industrielles, une recristallisation du monohydrate, puis une calcination au four tournant est nécessaire pour obtenir différents carbonates de sodium denses : ce sont les soudes denses (marquées souvent d'une majuscule indiquant l'application), de densité apparente de l'ordre de 1 t/m3.
Les procédés de fabrication de Na2CO3, anhydre et purifié, à partir d'extractions minières, natron ou trona, l'emportent sur le procédé Solvay, qui n'en conserve au mieux que les deux tiers de la production mondiale. Celle-ci est estimée à 40 millions de tonnes au début des années 1990[12].
Propriétés physico-chimiques
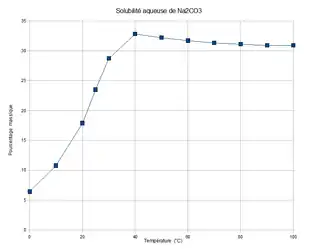
La solubilité du carbonate de sodium dans l'eau croît avec la température, jusqu'à 33 % en masse à 40 °C, puis décroît au-delà, pour tendre vers une valeur légèrement inférieure, à 30 % en masse. La solubilité à saturation pour 100 g d'eau pure est de 7,1 g à 0 °C, de 45,5 g à 100 °C.
Une solution à 50 g/L présente une masse volumique de 1,045 g/mL dans les conditions normales de température et de pression. Son pH mettant en jeu le couple hydrogénocarbonate HCO3−/carbonate CO32− est 11,9.
Exposé à l'air humide, le carbonate de sodium anhydre se dégrade en bicarbonate de sodium.
Na2CO3 solide anhydre + H2O vapeur d'eau ou par condensation + CO2 gaz au ras du sol → 2 NaHCO3 solide
Na2CO3 est peu soluble dans l'éthanol et insoluble dans l'acétone.
Le carbonate de sodium réagit avec la plupart des acides pour donner du dioxyde de carbone. Il précipite aussi par échange d'ions, plusieurs sels métalliques solubles.
Toxicité
Le carbonate de sodium n'est pas toxique pour l'environnement. Il peut être irritant sur la peau et il est donc préférable de le manipuler avec des gants.
Utilisation
Dès l'Antiquité égyptienne, il y a 4 000 ans, cet alcali a servi à la fabrication du verre. Dans l'industrie verrière, il sert toujours à apporter du Na2O ou oxyde de sodium à la composition verrière[13]. Elle porte le nom technique de soude V. Cette dernière peut être aussi nécessaire à la fabrication d'émail, de couverte, d'émaux pour la céramique.
L'alcali minéral a été utilisé en quantité industrielle en savonnerie à l'époque moderne. Il l'est toujours dans l'industrie des savons et des détergents, en particulier les lessives. Utilisé en complément de la lessive lorsque l'eau est dure, il en augmente l'efficacité mais n'empêche pas les dépôts de calcaire[14].
Il a été et est abondamment utilisé comme alcali dans l'industrie de la cellulose et du papier.
En sidérurgie, le carbonate de sodium Na2CO3 est tout à la fois un fondant, un désulfurant, un désiliciant, déphosphorant et un dénitrurant. Les opérations de désulfuration entre hauts-fourneaux et convertisseurs d'aciérie utilisent des briquettes de carbonate de sodium.
La métallurgie des métaux non ferreux, par exemple Cr, V ou U, emploie du carbonate de sodium, souvent marquée M.
Le carbonate de sodium est très utilisée en synthèse chimique. Pour résumer ces emplois pléthoriques, son adjonction permet souvent de préparer des dérivés sodiques d'un ou des composé(s), ce(s) dérivé(s) devenant beaucoup plus soluble(s) dans l'eau que le composé initial[15]. Quelques produits obtenus à partir du carbonate de sodium sont le bicarbonate de sodium purifié, le silicate de sodium et ses dérivés, les phosphates, le percarbonate de sodium, le bichromate de potassium, les sulfites, des engrais...
Le carbonate de sodium est utilisé dans l'alimentation comme additif alimentaire et réglementé sous le numéro E500(i). Il sert comme anti-agglomérant, régulateur alimentaire de pH et agent de levuration[16].
Il entre dans la composition de certains isolants à base de chanvre, en usage dans le secteur du bâtiment.
C'est un agent de neutralisation pour les eaux agressives, il intervient dans la production des eaux potables suivant des normes officielles. Il neutralise aussi l'acide sulfurique des batteries.
Nettoyant ménager
De plus en plus, le carbonate de sodium (vendu sous le nom ancien de « cristaux de soude ») est utilisé par les particuliers comme produit ménager écologique.
En effet, l'ion carbonate étant une base moyenne (pH de 11,5 à 12,5), il aura la capacité d'hydrolyser et donc de saponifier les graisses présentes (des esters d'acides gras hydrophobes).
En clair, alors que dans le lave-linge ou le lave-vaisselle, les tensioactifs ou savons vont attraper les particules hydrophobes avec leur queue apolaire et les mélanger à l'eau pour les évacuer avec leur tête polaire, le carbonate de sodium va venir transformer sur place les graisses en savon capable de se lier à l'eau.
Ainsi le carbonate de sodium ne va pas « laver » au sens premier du terme, mais solubiliser les molécules de corps gras, en les hydrolysant pour les transformer en molécules de savon qui agit en tant que tel ou part directement avec l'eau de lavage.
Au laboratoire
Le carbonate de sodium est une base faible facile d'emploi. Le carbonate de sodium, en dehors de son rôle évoqué en synthèse chimique, est utilisée, en laboratoire de recherche, pour stabiliser le milieu acido-basique, afin de conduire des réactions simples.
De même, en biochimie, une solution définie permet de stopper une réaction enzymatique.
Il entre dans le processus d'extraction de nombreux alcaloïdes, substances qui sont définies en particulier de la cocaïne de la feuille de coca.
Le carbonate de sodium entre dans la composition du Caffenol, un révélateur film noir et blanc que l'on peut aisément préparer chez soi[17].
Le carbonate de sodium est aussi utilisé dans le processus de fabrication de la nitroglycérine (plus précisément dans le lavage de celle-ci).
Histoire
À la Belle Époque, le carbonate de sodium figure déjà parmi les substances les plus utilisées dans l'industrie. C'est véritablement le procédé Solvay qui a permis la banalisation du produit et de ses dérivés dans de nombreux usages quotidiens, artisanaux ou industriels, au point que ceux-ci étaient désignés de façon populaire comme la « soude Solvay ».
Quant à l'heureux industriel belge devenu millionnaire, Ernest Solvay, il devint un mécène européen des sciences et techniques en favorisant l'essor des sciences (appliquées) et les rencontres ou sommets scientifiques, notamment ceux qui entreront dans l'histoire des sciences sous l’appellation de « congrès Solvay ».
Notes et références
- 1 2 3 4 CARBONATE DE SODIUM ANHYDRE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 Michal Dusek, Gervais Chapuis, Mathias Meyer et Vaclav Petricek, « Sodium carbonate revisited », Acta Crystallographica Section B, International Union of Crystallography, vol. 59, no 3, , p. 337–352 (ISSN 0108-7681, DOI 10.1107/S0108768103009017, lire en ligne, consulté le )
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Carbonate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Le terme latin adapté du copte ou ancien égyptien nous a donné le mot "natron" qui désigne aujourd'hui précisément le décahydrate naturel de carbonate de sodium, le mot grec correspondant était nitrum.
- ↑ L'ensemble des minéraux x Na2CO3 • y NaHCO3 • z H2O (x entier non nul, contrairement à y et z) sont dénommés par les géologues les natrons.
- ↑ Ce qu'on appelle communément soude de varech, est produit sur les rivages atlantiques ou de Manche, par exemple à partir de cendres de feux d'algues brunes ou de fucus drossés ou présents sur les rivages ou de four à goémon en Bretagne. Ces sels de varech sont constitués de sel marin NaCl et de sels de potasse de type chlorure de potassium KCl ou sulfate de potassium K2SO4, qui possède certes une partie, très réduite, de carbonate de sodium Na2CO3. Billon, op. cit., § « Sels de potasse ».
- ↑ Lac Soda
- ↑ Des installations ont subsisté jusqu'en 1920, dans des environnements locaux dépourvus de calcaire ou d'alcali.
- ↑ La température maximum de la seule phase énergétique du procédé n'excède pas 200 °C.
- ↑ La France ne produit qu'à peine 1,3 Mt début 1990. Les gisements de carbonates naturels se développent alors dans le monde. L'estimation des deux tiers est proposée par Robert Perrin, Jean-Pierre Scharff, dans le tome 1 de Chimie industrielle, op. cit.
- ↑ C'est un fondant très commun avec CaO.
- ↑ « BBC - GCSE Bitesize Science - Hard and soft water : Revision, Page 4 » (consulté le )
- ↑ C'est la propriété miraculeuse, et connue de l'Antiquité, des alcalis.
- ↑ Codex Alimentarius (1989) Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p. 1-35.
- ↑ Ross den Otter, « Le Caffenol : Développer vos films argentiques avec du café et d’autres ingrédients d’épiceries », sur le blog photo, (consulté le )
Voir aussi
Bibliographie
- F. Billon, « Soudes et potasses », Petite encyclopédie de chimie industrielle pratique no 3, E. Bernard et Cie imprimeurs-éditeurs, Paris, 1898, 160 p.
- Henri Guérin, Chimie industrielle, coll. « Euclide », 2 tomes format in 8°, PUF, 1969, en particulier tome 2 Du sel au téflon. Le chlorure de sodium et les industries dérivées ou connexe, 58 figures, 567 p., préface du professeur Georges Champetier (pour mémoire : tome 1, La Grande Industrie chimique. Les industries du soufre et de ses composés, 1962, 415 p., préface de Louis Hackspill)
- Robert Perrin, Jean-Pierre Scharff, Chimie industrielle, Masson, Paris, 1993, 1136 p. en deux tomes avec bibliographie et index (ISBN 978-2-225-84037-1 et 978-2-225-84181-1) (en particulier, petite partie du tome 1 sur le carbonate de sodium)
- Karl Winnaker, Léopold Kuchler, Auguste Zundel, Technologie minérale, Paris, 1962, 3 tomes ; en particulier le tome I par Karl Winnaker et Léopold Kuchler (sommaire : eau ; liquéfaction et séparation des gaz; industrie de la potasse ; le bore et ses combinaisons ; sel de cuisine, soude et potasse ; chlore ; fluor ; combinaisons peroxydées, 647 p.)
Liens externes
- Données de base avec solubilité
- Fiche technique d'octobre 2002 pour le SIAM 15
- Natrite
- « Les algues, hier et aujourd’hui. Une industrie chimique en Bretagne »