| Hydroxyde de sodium | |
| |
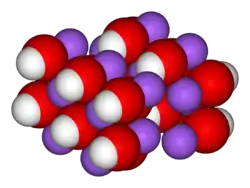
| __ Na+ __ OH− Structure du réseau cristallin de l'hydroxyde de sodium. |
|
| Identification | |
|---|---|
| Nom UICPA | hydroxyde de sodium |
| No CAS | (anhydre) (·H2O) |
| No ECHA | 100.013.805 |
| No CE | 215-185-5 (anhydre) 215-185-5 (·H2O) |
| PubChem | 14798 |
| No E | E524 |
| SMILES | |
| InChI | |
| Apparence | solide de formes variables, blanc, déliquescent, inodore[1] |
| Propriétés chimiques | |
| Formule | NaOH |
| Masse molaire[2] | 39,997 1 ± 0,000 4 g/mol H 2,52 %, Na 57,48 %, O 40 %, |
| pKa | 15,7 (base forte) |
| Propriétés physiques | |
| T° fusion | 318 °C[1] |
| T° ébullition | 1 390 °C[1] |
| Solubilité | dans l'eau à 20 °C : 1 090 g·L-1[1] |
| Masse volumique | 2,1 g·cm-3[1] |
| Pression de vapeur saturante | 0,13 kPa à 739 °C 2,67 kPa à 953 °C 13,3 kPa à 1 111 °C 53,3 kPa à 1 286 °C |
| Thermochimie | |
| ΔvapH° | 175 kJ·mol-1 (1 atm, 1 388 °C)[3] |
| Propriétés optiques | |
| Indice de réfraction | 1,357 |
| Précautions | |
| SGH[4] | |
 Danger |
|
| SIMDUT[5] | |
 E, |
|
| NFPA 704 | |
| Transport | |
| Peau | Irritant |
| Yeux | Irritant |
| Composés apparentés | |
| Autres cations | Hydroxyde de potassium |
| Unités du SI et CNTP, sauf indication contraire. | |
L'hydroxyde de sodium est un solide blanc de formule chimique NaOH. Pur, il est appelé communément soude caustique[6] ou soude mais ce dernier terme est ambigu car il est aussi utilisé pour désigner le carbonate de soude (soude Solvay). À température et pression ambiantes, il se trouve sous la forme cristalline d'un solide ionique. Il est fusible vers 318 °C, il se présente généralement sous forme de pastilles, de paillettes ou de billes blanches ou d'aspect translucide, corrosives. Il est très hygroscopique, il est d'ailleurs aussi souvent commercialisé sous la forme dissoute dans l'eau. Il y est en effet très soluble. Il est également très soluble dans l'éthanol[7]. Sa dose journalière admissible est non spécifiée depuis 1966[7]. Le code du travail français ne permet pas à des mineurs de fabriquer ou de manipuler ce produit chimique[8].
Sa présentation la plus connue est celle dissoute dans l'eau, c'est-à dire en solution aqueuse, souvent appelée soude, ou encore lessive de soude. C'est une solution basique, transparente, visqueuse, encore plus corrosive qu'à l'état pur en raison de son aspect mouillant, qui augmente l'action et le contact avec la peau.
Ce produit, matière importante de l'industrie chimique, capitale pour le contrôle d'un milieu alcalin ou la régulation d'acidité dans un procédé, est aussi courant dans le commerce, sous forme de paillette ou de solution ; il est vendu par exemple comme déboucheur de canalisations, produit de nettoyage ou agent de neutralisation (d'acides).
Propriétés physico-chimiques
Les propriétés chimiques de l'hydroxyde de sodium sont surtout liées à l'ion hydroxyde HO− qui est une base forte. En outre, l'hydroxyde de sodium réagit avec le dioxyde de carbone (CO2) de l'air et se carbonate.
Solubilité

La solubilité de l'hydroxyde de sodium caustique dans l'eau augmente avec la température, à pression constante ou ambiante[9]. Elle est de 1 090 g/l à 20 °C (solution à 50 %) et atteint 3 137 g/l à 80 °C[10].
Cette solubilité élevée, très supérieure par exemple à celle de la chaux ou des autres hydroxydes alcalino-terreux, l'abondance de sa production industrielle et son prix de revient inférieur à la potasse caustique, en font la base minérale la plus utilisée dans le monde.
Propriétés physiques à 20 °C
Évolution de la masse volumique de la solution aqueuse en fonction de la concentration[11] :
| Titre massique (%) | Molarité (mol/L) | Masse volumique (g/cm3) |
|---|---|---|
| 0,5 | 0,125 | 1,0039 |
| 1,0 | 0,252 | 1,0095 |
| 2,0 | 0,510 | 1,0207 |
| 3,0 | 0,774 | 1,0318 |
| 4,0 | 1,043 | 1,0428 |
| 5,0 | 1,317 | 1,0538 |
| 6,0 | 1,597 | 1,0648 |
| 7,0 | 1,883 | 1,0758 |
| 8,0 | 2,174 | 1,0869 |
| 9,0 | 2,470 | 1,0979 |
| 10,0 | 2,772 | 1,1089 |
| 11,0 | 3,080 | 1,1199 |
| 12,0 | 3,393 | 1,1309 |
| 13,0 | 3,711 | 1,1419 |
| 14,0 | 4,036 | 1,1530 |
| 15,0 | 4,365 | 1,1640 |
| 16,0 | 4,701 | 1,1751 |
| 17,0 | 5,041 | 1,1861 |
| 18,0 | 5,387 | 1,1971 |
| 19,0 | 5,739 | 1,2082 |
| 20,0 | 6,096 | 1,2192 |
| 22,0 | 6,827 | 1,2412 |
| 24,0 | 7,579 | 1,2631 |
| 26,0 | 8,352 | 1,2848 |
| 28,0 | 9,145 | 1,3064 |
| 30,0 | 9,958 | 1,3277 |
| 32,0 | 10,791 | 1,3488 |
| 34,0 | 11,643 | 1,3697 |
| 36,0 | 12,512 | 1,3901 |
| 38,0 | 13,398 | 1,4102 |
| 40,0 | 14,300 | 1,4299 |
Techniques de fabrication
.jpg.webp)
.jpg.webp)
Historique
Dans l'Antiquité, on utilisait la soude soit d'origine minérale soit d'origine végétale. La soude, prototype de l'alcali minéral, désigne alors un carbonate de sodium plus ou moins pur, qui provenait dans le premier cas de dépôts lacustres à base de natron, éventuellement purifiés et séchés, et dans le second, des sels de lixiviation des cendres obtenues par la combustion de plantes halophytes comme la salicorne ou les Soudes. L'hydroxyde de sodium était ensuite obtenu par caustification du carbonate (voir ci-dessous).
Entre 1771 et 1791, le chimiste Nicolas Leblanc invente un procédé permettant d'obtenir du carbonate de sodium à partir d'eau de mer, procédé coûteux en combustible qui sera supplanté par le procédé Solvay plus économique entre 1861 et 1864 (mis au point par l'entrepreneur et chimiste belge Ernest Solvay). Ces procédés, surtout le second, permettent de réduire les coûts de revient de la soude et font disparaître les anciennes techniques.
À la fin du XIXe siècle, l'avènement de l'électricité permet la production directe d'hydroxyde de sodium par électrolyse d'une solution aqueuse de chlorure de sodium, dont les deux compartiments d'électrode sont séparés par une membrane évitant la migration des gaz dissous.
On a ainsi les deux demi-réactions suivantes :
- l'ion chlorure dissous est oxydé en chlore gazeux au contact de l'anode : 2 Cl−(solvaté) → Cl2(gaz) + 2 e− ;
- la molécule d'eau, préalablement décomposée à la cathode en proton solvaté ou ion hydronium et ion hydroxyde, permet d'expliquer le dégagement du gaz hydrogène par réduction du proton H+ et l'alcalinisation corrélative du milieu aqueux : 2 H2O(solvant liquide) + 2 e− → H2(gaz) + 2 HO−(solvaté)
soit la réaction globale caractéristique de l'électrolyse de l'eau salée : 2 NaCl(aq.) + 2 H2O → 2 NaOH(aq.)+ Cl2(gaz) + H2(gaz)
Aujourd'hui, 99 % de l'hydroxyde de sodium produit est d'origine électrochimique.

Électrolyse de saumure (eau saturée en sel)
La soude est obtenue par électrolyse du chlorure de sodium (NaCl).
Il s'obtenait majoritairement par une électrolyse avec cathode de mercure (anode : titane ; cathode : mercure). Cette opération produit en même temps du chlore, de l'hydroxyde de sodium en solution et de l'hydrogène. Mais le mercure est un métal lourd nocif à très faible dose par bioaccumulation, plus encore lorsqu'il est transformé en mono- ou di-méthylmercure par les bactéries. Il est volatil et non dégradable, et passe facilement la barrière des poumons, ce qui en fait un des polluants majeurs de l'environnement, en augmentation dans toutes les mers. C'est l'une des raisons pour lesquelles les sociétés européennes impliquées se sont engagées à faire disparaître ce procédé à l'horizon 2020, procédé en cours de remplacement par des électrolyses à membranes[12].
Il existe un autre procédé : électrolyse à diaphragme, qui comportait de l'amiante, substituée en France par un matériau composite depuis la fin des années 1990.
À partir de carbonate de sodium
Cette technique était celle utilisée autrefois en Égypte ou en Turquie. Elle est encore utilisée en Amérique du Nord où se trouvent des gisements naturels de carbonate de sodium. C'est un ajout de chaux au carbonate de sodium. On parle de caustification ou de caustication. La réaction s'écrit :
- Na2CO3(solide) + Ca(OH)2(aq.) → CaCO3 + 2 NaOH(solide après évaporation de l'eau du lait de chaux)
Utilisations industrielles importantes
La production annuelle mondiale entre 1991 et 1998 est estimée à 45 millions de tonnes[13].
Dans l'industrie chimique
L'hydroxyde de sodium est utilisé en grande quantité par plusieurs industries. La moitié de la production reste dans l'industrie chimique, où elle participe à l'élaboration de plus de 400 produits de base, par des procédés de chimie minérale ou de synthèse organique.
L'autre emploi, principalement en tant que base, la rend indispensable, par ordre décroissant des besoins :
- à la fabrication des pâtes à papier ;
- à l'industrie des produits de nettoyage :
- savons,
- détergents,
- les déboucheurs chimiques sont souvent à base d'hydroxyde de sodium ;
- au traitement des eaux[14] ;
- au lavage des gaz ;
- dans l'industrie pétrolière ;
- dans l'industrie de l'aluminium :
- à la préparation du minerai (attaque ou traitement de la bauxite du procédé Bayer),
- lors des préparations par immersion dans une solution plus ou moins concentrée, décapages des pièces avant les traitements anticorrosion par anodisation et les préparations de soudure ;
- dans l'industrie textile :
- dans l'industrie des colorants…
La soude est utilisée dans certains produits défrisant pour cheveux, mais a tendance à être abandonnée dans les cosmétiques modernes.
Dans l'agroalimentaire
L'hydroxyde de sodium sert à :
- nettoyer les installations (circuits, bouteilles) ;
- modifier l'amidon ;
- dans le raffinage de l'huile alimentaire[15] ;
- épluchage chimique ;
- c'est aussi un additif alimentaire (E524)[16], il sert comme régulateur de l’acidité[17] et il est utilisé dans une large gamme de produits[18].
Dans l'énergétique
La soude peut être utilisé pour stocker de l'énergie solaire sous forme chimique. En effet, la réaction entre l'hydroxyde de sodium (ou la soude, sa solution aqueuse) et l'eau est fortement exothermique. Une fois la soude diluée, il suffit d'utiliser directement l'énergie solaire pour faire s'évaporer l'eau et revenir à l'état initial.
La réaction de l'hydroxyde de sodium avec l'eau et l'aluminium produit un dégagement d'hydrogène qui peut faire fonctionner un moteur à explosion sans émission de dioxyde de carbone.
Dans les laboratoires d'analyse et industries chimiques
L'hydroxyde de sodium est la base la plus communément utilisée en laboratoire. Elle sert à de nombreux dosages, ainsi qu'à la précipitation d'hydroxydes. Elle intervient dans les réactions d'hydrolyse.
La soude est également utilisée comme un réactif pour des tests de chimie. En effet, en présence de certains cations métalliques, elle forme un précipité d'une certaine couleur (et de formule générale M(OH)n, où M est le métal).
| Cation métallique | Couleur du précipité |
|---|---|
| Cu2+ | bleu |
| Fe2+ | vert |
| Fe3+ | rouille |
| Zn2+ | blanc |
| Al3+ | blanc |
| Ag+ | blanc |
Dangers
Effets sur la santé

L'hydroxyde de sodium est un produit dangereux, non par sa toxicité métabolique (il est utilisé dans certaines saumures alimentaires et la réaction chimique avec l'acide chlorhydrique du suc gastrique produit simplement du sel qui n'est pas toxique), mais plutôt parce qu'il est extrêmement corrosif dès 0,5 % de concentration et son contact direct détruit les tissus organiques.
Au même titre que l'acide sulfurique, et contrairement à l'acide chlorhydrique, le danger ne réside pas tant dans sa caractéristique de base forte, que dans son avidité pour l'eau qui « brûle » les tissus en les déshydratant, tout en rendant la réaction fortement exothermique. De plus, le caractère visqueux des solutions concentrées (par exemple à 50 %) aggrave les contacts accidentels.
Précautions
La dissolution de NaOH dans l'eau étant fortement exothermique, la préparation ou dilution présente des risques d'éclaboussures par ébullition : il faut donc verser le produit dans l'eau et jamais l'inverse. On verse lentement, en agitant avec précaution pour homogénéiser la température du récipient qui peut être élevée et produire des vapeurs.
La soude réagit également très violemment avec les acides et certains métaux[19] et il ne faut donc pas plus la diluer dans un récipient métallique tel qu'un seau en aluminium ou en zinc.
L'hydroxyde de sodium est irritant et corrosif pour la peau, les yeux, les voies respiratoires et digestives. Il doit être manipulé avec des gants, des lunettes de protection et une protection intégrale du visage et des voies respiratoires si présence de poussière ou d'aérosol. En cas de contact très important, l'hydroxyde de sodium peut interférer avec les transmissions nerveuses, atténuant la douleur de la brûlure et retardant la prise de mesures.
En cas d'accident
En cas de contact avec la peau, il faut tout d'abord essuyer l'endroit de contact puis rincer le plus rapidement possible avec de l'eau[20], retirer les vêtements imprégnés en évitant de propager le contact de la base avec la peau, et consulter un médecin.
En cas d'ingestion accidentelle, il ne faut pas faire vomir à cause du risque de double brûlure (aller et retour). Il faut appeler les secours ou un centre antipoison le plus vite possible.
En cas de contact avec les yeux, il faut rincer à l'eau, ou au sérum physiologique, pendant quinze à vingt minutes, et ensuite consulter un médecin ophtalmologiste[20]. La soude caustique traverse toute la cornée de l'œil en moins de quarante secondes.
Notes et références
- 1 2 3 4 5 HYDROXIDE DE SODIUM, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du Règlement CE N° 1272/2008, 16 décembre 2008.
- ↑ « Hydroxyde de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ L'appellation Soude caustique provient de la caustification ou caustication, opération d'ajout de chaux vive ou de lait de chaux, décrite infra, provoquant (à chaud c'est-à-dire à ébullition du lait de chaux) une réaction chimique que les Anciens faisaient subir à l'alcali carbonate de sodium, pour disposer de soude caustique. La soude dite minérale était à base de carbonate de sodium (Na2CO3). L'hydroxyde de sodium est décrit dans le Grand Larousse du début du XXe siècle en ces termes désuets : « hydrate de sodium ».
- 1 2 (en) FAO, Monograph 1 (2006) Sodium hydroxyde INS number: 524 [PDF]
- ↑ http://www.legifrance.gouv.fr/affichCode.do?idSectionTA=LEGISCTA000018532678&cidTexte=LEGITEXT000006072050&dateTexte=20121229
- ↑ Fiche technique sur NaOH et ses caractéristiques de solubilité.
- ↑ Tableau de solubilité des principaux produits chimiques, in H. Ibert, Chimie technique, formulaire des éditions Mac-Graw Hill, Paris, 1985, traduit en français par Francis Pichon (ISBN 2-7042-1108-6).
- ↑ (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 93e éd., 2670 p. (ISBN 9781439880494), p. 5-123.
- ↑ (en) Rapport final de la Commission européenne sur le cycle du mercure, février 2004.
- ↑ La France n'en produisait que 3,2 %.
- ↑ La soude, agent de neutralisation, sert à réguler le pH et régénérer les résines échangeuses d'ions des stations de traitement des eaux.
- ↑ Karleskind Alain, Manuel des corps gras, 1992, Éd. Lavoisier, 1500 p.
- ↑ Parlement européen et Conseil de l'Europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », Journal officiel de l'Union européenne, no L 61, , p. 1-56 (lire en ligne [PDF]).
- ↑ « Noms de catégorie et système international de numérotation des additifs alimentaires » [PDF], CAC/GL 361989, sur codexalimentarius.net, Codex Alimentarius, (consulté le ), p. 1-35.
- ↑ (en) Codex Alimentarius Commission, « Updated up to the 31st Session of the Codex Alimentarius Commission for Sodium hydroxide (524) », GSFA Online, sur codexalimentarius.net, Codex Alimentarius, (consulté le ).
- ↑ « cdc.gov/niosh/ipcsnfrn/nfrn036… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- 1 2 Fiche CSST, premiers secours.
Voir aussi
Articles connexes
- Composés apparentés :
- carbonate de sodium
- hydroxyde de lithium
- potasse
- peu connus :
- rubidine
- césine
- Procédé Leblanc
- Procédé Solvay

