| Diméthylsulfoxyde | |
  Structure du diméthylsulfoxyde. 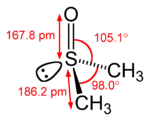  Dimensions et densité électronique de la molécule. |
|
| Identification | |
|---|---|
| Nom UICPA | diméthylsulfoxyde |
| Synonymes |
sulfinylbisméthane |
| No CAS | |
| No ECHA | 100.000.604 |
| No CE | 200-664-3 |
| No RTECS | PV6210000 |
| Code ATC | G04 M02 |
| DrugBank | DB01093 |
| PubChem | 679 |
| FEMA | 3875 |
| SMILES | |
| InChI | |
| Apparence | liquide hygroscopique, incolore[1]. |
| Propriétés chimiques | |
| Formule | C2H6OS [Isomères] |
| Masse molaire[2] | 78,133 ± 0,007 g/mol C 30,74 %, H 7,74 %, O 20,48 %, S 41,04 %, |
| Moment dipolaire | 4,06 D[3] |
| Diamètre moléculaire | 0,513 nm[3] |
| Propriétés physiques | |
| T° fusion | 18,5 °C[4] |
| T° ébullition | 190,85 °C[4] |
| Solubilité | 1 000 g l−1 à 20 °C[5] |
| Paramètre de solubilité δ | 24,5 MPa1/2 (25 °C)[6]
26,6 J1/2 cm−3/2 (25 °C)[3] |
| Masse volumique | 1,1 g cm−3[1] |
| T° d'auto-inflammation | 270 °C[5] |
| Point d’éclair | 88 °C[5] |
| Limites d’explosivité dans l’air | 1,8 %vol[5] |
| Pression de vapeur saturante | à 20 °C : 59,4 Pa[1] |
| Viscosité dynamique | 1,996 mPa s à 20 °C |
| Thermochimie | |
| S0liquide, 1 bar | 188,78 J mol−1[4] |
| ΔfH0gaz | −150,5 kJ mol−1 à 25 °C[4] |
| ΔfH0liquide | −203,4 kJ mol−1 à 25 °C[4] |
| ΔfusH° | 14,368 kJ mol−1 à 18,52 °C[4] |
| ΔvapH° | 52,9 kJ mol−1 à 25 °C[4] |
| Cp | 149,39 J mol−1 K−1 à 25 °C[4]
|
| PCI | −2 037,3 kJ mol−1[4] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 9,10 ± 0,03 eV (gaz)[8] |
| Propriétés optiques | |
| Indice de réfraction | 1,477[3] |
| Précautions | |
| SGH | |
 [9] |
|
| SIMDUT[10] | |
 B3, |
|
| NFPA 704 | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le diméthylsulfoxyde noté aussi DMSO est un solvant polaire organosulfuré, aprotique, de formule C2H6OS.
Il se présente comme un liquide incolore, qui dissout à la fois des composés polaires et non-polaires, et qui est miscible dans une large gamme de solvants organiques, ainsi que dans l'eau. Il pénètre très facilement et rapidement la peau avant de diffuser dans tout l'organisme, ce qui explique qu'une personne en ayant reçu sur la peau peut ensuite rapidement ressentir un goût d'ail dans la bouche[11].
Histoire
Il aurait été synthétisé pour la première fois en 1866 par le chimiste russe Alexandre Zaïtsev, qui a décrit cette expérience en 1867. Le diméthylsulfoxyde est aujourd'hui un produit secondaire de l'industrie papetière ; issu de la production de pâte à papier à partir de bois (papier de type Kraft)[12].
Utilisations
Dans l'industrie et la chimie

Il est utilisé en chimie et en pharmaceutique pour sa capacité à solubiliser de nombreux composés organiques, mais également des sels du fait de sa forte polarité[13].
Il est utilisé comme dégraissant industriel[14].
Utilisation médicale
Dilué de 5 à 20 %, il est utilisé comme agent cryoprotecteur lors de la congélation de cellules, organes ou gamètes.
Il présente également des propriétés anesthésiques et anti-bactériennes[13].
Le DMSO est également utilisé dans certains cas pour soulager les patients atteints d'amylose inflammatoire, malgré des effets secondaires importants (nausées, mauvaise haleine due au soufre)[15].
Il est utilisé comme liniment en médecine vétérinaire pour le traitement d'entorses et de douleurs musculaires.
On l’étudie actuellement sous forme purifiée (en vue de l’administration orale, intraveineuse ou cutanée) pour voir s’il peut favoriser le transport des médicaments dans les cellules et ainsi augmenter l’efficacité de ces derniers dans le traitement de certaines maladies.
Les études sur les animaux ont révélé qu’il avait un effet immunosuppresseur ; on étudie actuellement la possibilité de l’utiliser dans le traitement des maladies auto-immunes. La FDA[16] a approuvé l’emploi du DMSO, dilué à 50 % et injecté dans la vessie pour traiter une forme d’inflammation vésicale chronique, rare et opiniâtre (cystite interstitielle).
Propriétés physico-chimiques
En tant que solvant aprotique polaire, le diméthylsulfoxyde est aussi un produit entraînant une plus grande absorption des toxines par les pores de la peau lorsqu'il est mis en contact avec celles-ci.
Production et synthèse
La production industrielle de DMSO consiste en l'oxydation catalytique du sulfure de diméthyle en présence d'oxygène ou de dioxyde d'azote[13],[12]. Sans catalyseur, la réaction est possible à une pression de 7,2 MPa et à 105 °C avec un rendement supérieur à 90 %[17].
Toxicité
Pour le système nerveux
Il a été mis en évidence que l'injection de DMSO dans l'humeur vitrée, même à de faibles doses — 1 % v/v soit une concentration finale de 0,1 % — induisait une apoptose des cellules ganglionnaires de la rétine[18]. Alors qu'à des concentrations plus fortes (>10 %), le DMSO conduit à la formation de pores dans la membrane plasmique, à plus faibles doses, il inhiberait la respiration mitochondriale. Ceci conduirait à une augmentation de la concentration intracellulaire en suivit d'une externalisation des phosphatidylsérines.
S'ensuivrait une oligomérisation de la protéine Bax induisant une perméabilisation de la mitochondrie permettant la sortie du facteur inducteur de l'apoptose (AIF) (en), l'activation de PARP et finalement la mort cellulaire. Étant donné l'usage généralisé du DMSO comme solvant en biologie, et l’idée selon laquelle il n'est pas toxique en dessous de 10 %, les auteurs de l'étude recommandent d'utiliser des méthodes de substitutions pour distribuer des composés aux cellules nerveuses ; si cela n'est pas possible, d'utiliser des concentrations inférieures à 1 % et d'ajouter un contrôle sans solvant afin d’évaluer la toxicité du DMSO[18].
Effets neurodéveloppementaux
Parce qu'il est utilisé comme agent cryoprotecteur lors des greffes de moelle osseuse ou d'organes, notamment chez l'enfant, une équipe de recherche s'est intéressée à la toxicité potentielle du DMSO lors du développement du système nerveux central[19]. Les auteurs de l'étude ont injecté du DMSO à des souris durant leur développement postnatal — correspondant à la période de vulnérabilité chez l'humain située entre le troisième trimestre de grossesse et les premières années de la vie postnatale.
Ils mettent alors en évidence un phénomène d'apoptose dans de nombreuses régions cérébrales. Sept jours après la naissance, au pic de la sensibilité, même la dose la plus faible (0,3 mg/kg) a un effet significatif ; sur des neurones en culture, une concentration de 0,5 % induit de l'apoptose. Les auteurs concluent en comparant l'effet du DMSO à celui d'une exposition prénatale à l'alcool, et suggèrent que ce composé conduirait également à des altérations des capacités d’apprentissage et de mémorisation[19].
Références
- 1 2 3 DIMETHYLSULFOXYDE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 4 (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 978-0-471-98369-9, LCCN 98018212).
- 1 2 3 4 5 6 7 8 9 « Dimethyl sulfoxide », sur webbook.nist.gov (consulté le ).
- 1 2 3 4 Entrée « Dimethyl sulfoxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 mars 2009 (JavaScript nécessaire).
- ↑ (en) Christian Reichardt, Solvents and Solvent Effects in Organic Chemistry, Weinheim, Wiley-VCH, , 3e éd., 629 p. (ISBN 3-527-30618-8), p. 66.
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub., (ISBN 978-0-88415-857-8, LCCN 96036328).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- ↑ Dimethyl sulfoxide (réf. 679) sur PubChem.
- ↑ « Sulfoxyde de diméthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- ↑ (en) K. M. Novak (éditeur), Drug Facts and Comparisons, St. Louis, Missouri, Wolters Kluwer Health, , 56e éd. (ISBN 1-57439-110-0), p. 619.
- 1 2 (en) Kathrin-Maria Roy, Sulfones and Sulfoxides, Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim, DOI 10.1002/14356007.a25_487.
- 1 2 3 (en) Kathrin-Maria Roy, Ullmann's Encyclopedia of Industrial Chemistry, Sulfones and Sulfoxides, Wiley-VCH Verlag, .
- ↑ Multiple sclerosis international federation, Fiche Diméthylsulfoxyde (consulté le 6 février 2012).
- ↑ (en) Ozkaya-Bayazit E, Kavak A, Güngör H, Ozarmagan G., Intermittent use of topical dimethyl sulfoxide in macular and papular amyloidosis, Int. J. Dermatol., 1998, 37, 949-954.
- ↑ Organisme américain de contrôle des aliments et des médicaments.
- ↑ (en) Paul E. Correa et Dennis P. Riley, « Highly selective direct oxidation of thioethers to sulfoxides using molecular oxygen », Journal of Organic Chemistry, vol. 50, no 10, , p. 1787-1788 (DOI 10.1021/jo00210a055).
- 1 2 (en) Galvao J, Davis B, Tilley M, Normando E, Duchen MR et Cordeiro MF., « Unexpected low-dose toxicity of the universal solvent DMSO. », FASEB J., vol. 28, no 3, , p. 1317-30 (PMID 24327606, DOI 10.1096/fj.13-235440, lire en ligne [PDF], consulté le )
 .
. - 1 2 (en) Hanslick JL, Lau K, Noguchi KK, Olney JW, Zorumski CF, Mennerick S et Farber NB., « Dimethyl sulfoxide (DMSO) produces widespread apoptosis in the developing central nervous system. », Neurobiol Dis., vol. 34, no 1, , p. 1-10 (PMID 19100327, PMCID 2682536, lire en ligne [PDF], consulté le )
 .
.
Voir aussi
Articles connexes
- Gloria Ramirez
- Solvant
- Solvant polaire aprotique





