| Fluorure de sodium | |
| |
| Identification | |
|---|---|
| Nom UICPA | Fluorure de sodium |
| No CAS | |
| No ECHA | 100.028.789 |
| No CE | 231-667-8 |
| Code ATC | ,A12 |
| Apparence | cristaux blancs ou poudre[1]. |
| Propriétés chimiques | |
| Formule | NaF |
| Masse molaire[2] | 41,988 172 5 ± 5,0E−7 g/mol F 45,25 %, Na 54,75 %, |
| Moment dipolaire | 8,156 ± 0,001 D[3] |
| Propriétés physiques | |
| T° fusion | 993 °C[1] |
| T° ébullition | 1 700 °C[1] |
| Solubilité | dans l'eau à 20 °C : 40 g·l-1[1] |
| Masse volumique | 2,8 g·cm-3[1] |
| Cristallographie | |
| Symbole de Pearson | [4] |
| Classe cristalline ou groupe d’espace | Fm3m (n°225)[4] |
| Strukturbericht | B1[4] |
| Structure type | NaCl[4] |
| Précautions | |
| SGH[5] | |
 Danger |
|
| SIMDUT[6] | |
 D1B, D2A, D2B, |
|
| NFPA 704 | |
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le fluorure de sodium est un composé chimique de formule NaF. Il s'agit d'un solide incolore utilisé comme source d'ions fluorures dans diverses applications. Il est moins cher et moins hygroscopique que le fluorure de potassium.
Le fluorure de sodium fait partie des « médicaments essentiels » listés par l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[7].
Propriétés
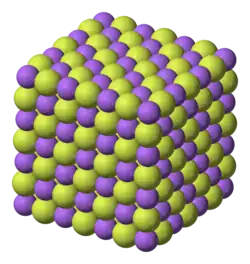
Le fluorure de sodium est un composé ionique qui se dissout pour donner les ions Na+ et F−. Il cristallise avec une structure cubique type NaCl où les cations et les anions occupent tous les sites octaédriques[8],[9]. La forme minérale de NaF est la villiaumite, plutôt rare[10].
Production
NaF est préparé par neutralisation de l'acide fluorhydrique ou de l'acide hexafluorosilicique, sous-produits de la production d'engrais à base de monophosphate de calcium. La neutralisation se fait avec l'hydroxyde de sodium et le carbonate de sodium par exemple. Des alcools peuvent être utilisés pour faire précipiter NaF:
- HF + NaOH → NaF + H2O
Dans des solutions contenant HF, le fluorure de sodium précipite sous forme de sel bifluorure NaHF2. NaF est obtenu par chauffage.
- HF + NaF ⇌ NaHF2
Selon un rapport de 1986, la consommation mondiale de NaF s'élevait à 7 millions de tonnes[11].
Précautions d'emploi
Le fluorure de sodium est très toxique, et le seul fait de respirer ou de l'inhaler peut être dangereux. Il affecte le système circulatoire, le cœur, le squelette, le système nerveux central et les reins. À terme, il peut même causer la mort. D'autre part, il est très irritant pour la peau, les yeux et le tractus respiratoire[12].
En cas d'inhalation, il est nécessaire de s'écarter de toute source de poussières, de se moucher, de respirer sous oxygène artificiel si nécessaire et de consulter un médecin. En cas de contact avec les yeux et la peau, il faut se rincer abondamment à l'eau et surveiller s'il y a des complications[13],[14].
Dans la fiction
- Dans son roman La Vengeance du Kremlin (2013), l'écrivain Gérard de Villiers suppose que c'est Vladimir Poutine qui a donné l'ordre à ses services secrets d'assassiner Boris Berezovsky par empoisonnement (utilisation de fluorure de sodium), d'une manière telle que la mort puisse raisonnablement apparaître comme étant un suicide. Un autre produit chimique létal est employé dans le roman pour tenter d'assassiner Malko Linge, la ricine.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium fluoride » (voir la liste des auteurs).
- 1 2 3 4 5 FLUORURE DE SODIUM, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- 1 2 3 4 « The NaCl (B1) Structure », sur cst-www.nrl.navy.mil (consulté le ).
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Fluorure de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ WHO Model List of Essential Medicines, 18th list, avril 2013
- ↑ Wells, A.F. (1984), Structural Inorganic Chemistry, Oxford: Clarendon Press, (ISBN 0-19-855370-6)
- ↑ "Chemical and physical information" (PDF), Toxicological profile for fluorides, hydrogen fluoride, and fluorine, Agen allahcy for Toxic Substances and Disease Registry (ATDSR), September 2003, pp. 187, http://www.atsdr.cdc.gov/toxprofiles/tp11.pdf, retrieved 2008-11-01
- ↑ "Mineral Handbook" (PDF). Mineral Data Publishing. 2005. http://rruff.geo.arizona.edu/doclib/hom/villiaumite.pdf.
- ↑ ^ a b c Aigueperse, Jean; Paul Mollard, Didier Devilliers, Marius Chemla, Robert Faron, Renée Romano, Jean Pierre Cuer (2005), "Fluorine Compounds, Inorganic", in Ullmann, Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, DOI 10.1002/14356007.a11_307
- ↑ D’après Scientific Committee on Cosmetic Products and non-food Products Intended for Consumers, « The Safety of Fluorine compounds in Oral Hygiene Products for Children under the Age of 6 Years » [PDF], sur Public Health in the European Union.
- ↑ D’après « Villiaumite: Health risks », sur mindat.org.
- ↑ http://www.solvaychemicals.us/static/wma/pdf/1/4/8/8/5/SF_CAN_FR.pdf


