| Guanine | ||
| ||
 | ||
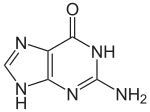
| Structure de la 1,9H-guanine | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-amino-1,9-dihydro-6H-purin-6-one | |
| Synonymes |
1,9H-guanine 1,9-dihydro-2-amino-6-oxopurine 1,9-dihydro-2-aminopurin-6-one |
|
| No CAS | (1,7H-Guanine) | |
| No ECHA | 100.000.727 | |
| No CE | 200-799-8 (7,11H-Guanine) | |
| PubChem | 764 (3,7H-Guanine) | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C5H5N5O [Isomères] |
|
| Masse molaire[1] | 151,126 1 ± 0,005 7 g/mol C 39,74 %, H 3,33 %, N 46,34 %, O 10,59 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
La guanine /ɡwa.nin/ est une base nucléique, et plus exactement une base purique (voir aussi ADN et ARN). On la trouve sous forme de nucléotide : dans l'ADN c'est la dGMP pour désoxyguanosine monophosphate ou désoxyguanylate, et dans l'ARN la GMP pour guanosine monophosphate ou guanylate. La guanine s'apparie avec la cytosine dans l'ADN comme dans l'ARN et existe sous 6 formes tautomères dont 4 stéréoisomères (1,9H, 1,7H, 3,9H et 3,7H) et 2 tautomères avec un groupe fonctionnel différent (7,11H et 9,11H : oxo- en hydroxy-).
Généralités
Comme l'adénine et la cytosine, la guanine est présente à la fois dans l'ARN et dans l'ADN. Elle s'apparie à la cytosine par 3 liaisons hydrogène. Le groupe aminé de la cytosine agit comme donneur pour la création des liaisons hydrogène, tandis que les groupes carbonyle C-2 et amine N-3 agissent comme récepteurs. À l'inverse, le groupe carbonyle C-6 de la guanine agit comme receveur tandis que les groupes N-1 et C-2 agissent comme donneurs.

La guanine a été isolée pour la première fois en 1844 à partir d'excréments d'oiseaux[2] qui étaient utilisés comme fertilisants. Entre 1882 et 1906, Fischer en détermina la structure et démontra que l'acide urique pouvait être converti en guanine[3].
La guanine peut être hydrolysée en glycine, ammoniac, dioxyde de carbone et monoxyde de carbone à l'aide d'acides forts. La guanine est tout d'abord désaminée en xanthine[4].
La guanine s'oxyde plus facilement que l'adénine, qui est l'autre base purique de l'ADN. Son point de fusion élevé (plus de 350 °C) reflète les ponts hydrogène entre les groupes oxo et amino entre les molécules. À cause de ces liaisons intermoléculaires, la guanine est relativement insoluble dans l'eau, mais soluble dans les acides dilués et les bases.
Synthèses
Des traces de guanine se forment par polymérisation de cyanure d'ammonium (NH4CN). Deux expériences conduites par Levy et al. ont montré que chauffer 10 mol·L−1 de NH4CN à 80 °C pendant 24 heures donnait un rendement de 0,0007 %, tandis qu'utiliser 0.1 mol·L−1 de NH4CN congelé à −20 °C depuis 25 ans donnait un rendement de 0,0035 %. Ces résultats indiquent que la guanine pourrait venir des régions de la Terre primitive. En 1984, Yuasa a rapporté une proportion de 0,00017 % de guanine après la décharge électrique de NH3, CH4, C2H6, et 50 mL d'eau, suivie d'une hydrolyse acide. Cependant, il est possible que la présence de guanine soit le fruit d'une contamination de la réaction[5].
10 NH3 + 2 CH4 + 4 C2H6 + 2 H2O → 2 C5H8N5O (guanine) + 25 H2
Une synthèse selon le procédé de Fischer-Tropsch peut aussi être utilisée pour former de la guanine, simultanément à de l'adénine, de l'uracile et de la thymine. Le chauffage d'un mélange équimolaire gazeux de CO, H2 et NH3 à 700 °C pendant 15 à 24 minutes, suivi d'un refroidissement rapide puis à nouveau d'un chauffage à 100-200 °C pendant 16 à 44 heures avec de l'alumine pour catalyseur a donné de la guanine et de l'uracile :
10 CO + H2 + 10 NH3 → 2 C5H8N5O (guanine) + 8 H2O
Une autre méthode a été testée, consistant à porter un mélange gazeux (90%N2–10%CO–H2O) à très haute température[6].
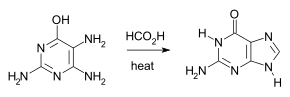
La synthèse de purine de Traube consiste à chauffer du 2,4,5-triamino-1,6-dihydro-6-oxypyrimidine sous forme de sulfate avec de l'acide formique pendant plusieurs heures.
Autres utilisations
Le mot guanine vient de l'espagnol guano (excréments d'oiseaux marins et des chauves-souris), lui-même originaire du mot quechua huanu ou wanu, signifiant « fumier, excrément ». Selon le Dictionnaire de l'Académie Française, la guanine est « ainsi nommée parce qu'on la trouve dans le guano »[7].
En 1656, François Jaquin extrait d'écailles de poisson ladite molécule sous forme de complexes cristallins appelés G-quadruplexes. Dans l'industrie cosmétique, la guanine cristalline est utilisée comme additif dans de nombreux produits comme les shampooings afin de donner un effet irisé nacré. Ces cristaux sont aussi utilisés dans les peintures métalliques et les perles et plastiques simulés. Ils prodiguent un éclat chatoyant aux ombres à paupières et aux vernis à ongles. Des soins faciaux à base de guano de rossignol du Japon ont été utilisés au Japon et ailleurs, la guanine des excréments étant censée donner un ton clair et brillant[8] désiré par les consommateurs. Les cristaux de guanine sont des plaquettes de forme losange composées de plusieurs couches transparentes ayant un indice de réfraction élevé qui, partiellement, reflète et transmet la lumière d'une couche à une autre, produisant ainsi un éclat nacré. Elle peut être appliquée par pulvérisation, peinture ou trempage mais peut irriter les yeux. Ses alternatives sont notamment l'utilisation de mica, de perles de coquillage et de particules d'aluminium et de bronze.
Les araignées et les scorpions convertissent l'ammoniac - produit du métabolisme cellulaire - en guanine afin d'utiliser un minimum d'eau lors de l'excrétion.
On trouve de la guanine dans le système tégumentaire de nombreux poissons comme l'esturgeon et dans les yeux des poissons d'eau profonde et chez certains reptiles comme les crocodiles[9].
Le , un rapport basé sur les études de la NASA d'une météorite trouvée sur Terre a suggéré que les blocs constitutifs de l'ARN et de l'ADN (les nucléotides, issus des bases nucléiques, dont fait partie la guanine) pourraient s'être formés dans l'espace extra-terrestre[10],[11],[12].
Voir aussi
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ George H. Hitchings et Elvira A. Falco, « The Identification of Guanine in Extracts of Girella Nigricans », PNAS, vol. 30, no 10, , p. 294–7 (PMCID PMC1078714, DOI 10.1073/pnas.30.10.294, lire en ligne [PDF])
- ↑ (en) « The Nobel Prize in Chemistry 1902 », sur NobelPrize.org (consulté le ).
- ↑ Angstadt. Purines and pyrimidines. Retrieved 2008-03-27
- ↑ Matthew Levy, Stanley L. Miller et John Oró, « Production of Guanine from NH4CN Polymerizations », Journal of Molecular Evolution, vol. 49, no 2, , p. 165–8 (PMID 10441668, DOI 10.1007/PL00006539). - quotes the Yuasa paper and cites the possibility of there being a contaminant in the reaction
- ↑ S. Miyakawa, K. Murasawa, K. Kobayashi et A.B. Sawaoka, « Abiotic synthesis of guanine with high-temperature plasma », Orig Life Evol Biosph., vol. 30, no 6, , p. 557–66 (PMID 11196576, DOI 10.1023/A:1026587607264)
- ↑ Dictionnaire de l'Académie Française, 9e édition, "guanine"
- ↑ Melissa Whitworth, « Geisha facial, the 'latest beauty secret' of Victoria Beckham, brought to the masses », Lifestyle Telegraph.uk, (lire en ligne)
- ↑ D.L. Fox, Biochromy, natural coloration of living things, University of California Press, (ISBN 978-0-520-03699-4)
- ↑ M.P. Callahana, K.E. Smith, H.J. Cleaves II, J. Ruzickad, J.C. Sterna, D.P. Glavina, C.H. Houseb et J.P. Dworkin, « Carbonaceous meteorites contain a wide range of extraterrestrial nucleobases », PNAS, (DOI 10.1073/pnas.1106493108, lire en ligne)
- ↑ Steigerwald, John (8 August 2011). "NASA Researchers: DNA Building Blocks Can Be Made in Space". NASA. Retrieved 2011-08-10.
- ↑ ScienceDaily Staff (9 August 2011). "DNA Building Blocks Can Be Made in Space, NASA Evidence Suggests". ScienceDaily. Retrieved 2011-08-09.
Sources
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Guanine » (voir la liste des auteurs).
- Les 4 nucléotides, site de l'Académie d'Amiens, page pédagogique consultée le .