Lepus europaeus • Lièvre brun
-cropped.jpg.webp)
Répartition géographique
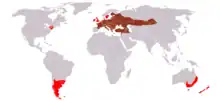
Le Lièvre d'Europe ou Lièvre brun (Lepus europaeus) est une espèce de lièvres originaire d'Europe et de l'ouest de l'Asie. Elle fut introduite en Afrique, en Amérique du Nord, en Amérique du Sud et en Océanie. C'est un mammifère classé dans l'ordre des lagomorphes, dans la famille des léporidés. Il fait partie de la « petite faune sédentaire de plaine »[1].
Le lièvre d'Europe est herbivore et se nourrit principalement de plantes herbacées, auxquelles il ajoute des brindilles, des bourgeons, de l'écorce et des céréales, en particulier l'hiver. Ses prédateurs naturels comprennent les grands oiseaux de proie, les canidés et les félidés. Ses longs et puissants membres lui permettent d'atteindre une grande vitesse de déplacement et donc, un moyen d'échapper à ses prédateurs. Le mâle s'appelle le « bouquin », la femelle s'appelle la « hase » et le petit s'appelle le « levraut »[2].
Généralement nocturne et timide, le lièvre d'Europe change de comportement au printemps, où l'on peut l'apercevoir en plein jour se pourchasser avec ses semblables dans les champs. Ceci est un comportement nuptial précédant l'accouplement. Au cours de cette frénésie printanière, les lièvres se frappent parfois les uns les autres avec leurs pattes antérieures (« bouquinage »). Ces « combats » sont intersexuels (entre mâles et femelles), lorsque la femelle n'est pas disponible pour l'accouplement. La femelle niche dans un affaissement à la surface du sol plutôt que dans un terrier. Les portées peuvent être composées de trois ou quatre jeunes et une femelle peut avoir trois portées par an. Le lièvre d'Europe peut vivre jusqu'à douze ans. La saison de reproduction dure de janvier à août.
Le lièvre européen est répertorié comme étant de préoccupation mineure par l'Union internationale pour la conservation de la nature, car il est répandu et localement commun. Cependant, les populations d'Europe continentale ont connu des diminutions depuis les années 1960, pour des raisons mal connues. Le lièvre est chassé à travers l'Europe depuis des siècles et on estime que plus de cinq millions d'individus sont abattus chaque année. En Europe occidentale, le lièvre a été traditionnellement chassé à l'aide de meutes de chiens renifleurs. La vénerie est aujourd'hui illégale dans nombreux pays, mais demeure néanmoins toujours légale en France.
Le lièvre a longtemps été un symbole de fertilité et de reproduction dans certaines cultures. En littérature, ses attributs physiques et son comportement ont inspiré de nombreux auteurs tels que Jean de la Fontaine, Lewis Caroll ou encore Arto Paasilinna.
Description de l'espèce

Morphologie
Il s'agit du plus grand lagomorphe du Paléarctique occidental. Il mesure de 42 à 68 cm de longueur (tête et corps), avec des oreilles de 8,5 à 12,9 cm et une queue de 6,2 à 13,3 cm. Son poids varie de 2,5 kg à 6,4 kg. Le pelage de son dos est brun-fauve foncé à brun-roux foncé avec des tons jaunâtres, avec des poils de garde courbés et des poils de bourre blancs à la base. Le bas des flancs, le cou et la tête sont à dominante brun clair avec des reflets roussâtres ou vineux. Le ventre est blanc crème. Les oreilles sont gris clair avec tache noire triangulaire bien marquée à leur extrémité. La queue est noire au-dessus et blanche en dessous. En hiver il y a plus de blanc sur la tête et à la base des oreilles, et les hanches deviennent plus grises[3].
Différences avec le lapin
Bien qu'étant tous les deux des léporidés apparentés, le lièvre d'Europe est un animal très typé et très différent du lapin de garenne qui peut être présent dans son habitat. Il s'en distingue par les caractères suivants[4] :
- il est plus grand et nettement plus longiligne, avec de longues pattes ;
- son poids moyen (3,8 kg pour l'adulte) est plus élevé que celui d'un lapin de garenne (1,4 kg) ;
- ses oreilles sont aussi plus grandes, et leur pointe (comme la queue) est noire ;
- sa robe est plus colorée, tirant sur le brun-fauve à brun-roux mêlé de gris ;
- l'iris de l’œil est plus clair et bien distinct de la pupille ;
- ses bonds sont plus importants, plus amples et fluides, et sa course est beaucoup plus rapide, c'est un véritable sprinter sur de longues distances, lui permettant souvent d'échapper à ses prédateurs sur de vastes terrains découverts où il n'a aucun refuge (le lapin se contente de sautiller sur de courtes distances, et de bondir s'il est surpris, jusqu'à un refuge généralement pas bien loin : son terrier ou la végétation dense) ;
- sa distance de fuite est aussi plus grande lorsqu'il est en activité, et il est plus difficile à observer de près ;
- il ne creuse pas de terrier ;
- il élève ses petits à découvert à même le sol (seulement 1 à 3 par portée, rarement plus), ils naissent déjà pourvus d'une fourrure et deviennent rapidement autonomes.
Risque de confusion
Localement, il peut être confondu avec 5 autres espèces de lièvres vivant dans le paléarctique occidental :
- lièvre ibérique (Lepus granatensis) présent au Portugal et dans presque toute l’Espagne, mais dont la taille est toutefois plus petite. Il est aussi plus roux et taché de blanc sur la poitrine, les flancs et le haut des pattes, dont sur les faces antérieures et externes des pattes antérieures. Quelques noyaux de populations ont été formés (par introduction) dans le sud de la France, en zone sèche [4];
- lièvre d’Italie (Lepus corsicanus), légèrement plus grand et plus sombre que le précédent, mais un peu moins grand que le lièvre d'Europe, et sans partie blanche sur la face externe des pattes antérieures, occupe la Sicile et le sud de l’Italie. Il a été introduit en Corse vers la fin du Moyen Âge, alors qu’il n’existait antérieurement aucune espèce de lièvre sur cette île. Actuellement, cette espèce ne paraît subsister en Corse que dans quelques zones d’altitude, là où le lièvre d’Europe n’a semble-t-il jamais été introduit ;
- lièvre variable (Lepus timidus), moins grand, plus rond (presque aussi rond qu'un lapin de garenne) et surtout devenant blanc en hiver (nord de l’Europe, Irlande, Écosse et Alpes)[4] ;
- lièvre des Monts Cantabriques, ou lièvre des genêts (Lepus castroviejoi), proches de Lepus corsicanus, rare et uniquement présent dans les hauteurs de la cordillère Cantabrique (Espagne)[4] ;
- lièvre de la Méditerranée (Lepus capensis mediterraneus), très petit et typique des milieux semi-arides nord-africains et du Moyen-Orient, mais aussi présent en Sardaigne[4].
Dimorphisme sexuel

Il n'y a pas de dimorphisme sexuel et l'identification des sexes est difficile même en ayant l'animal en main[5]. Mais les comportements permettent de distinguer mâles et femelles en période de reproduction.
Croissance et durée de vie
Les jeunes grandissent rapidement, et dès l'âge de deux mois, il est difficile de distinguer les jeunes de l’année des adultes[5].
Un poids moyen de 2,5 kg est atteint à l'âge de 2 mois et demi, soit à peu près le poids d'un adulte chétif.
A 4 mois le jeune lièvre approche la taille et le poids d'un adulte moyen ou le dépasse (jusqu'à 4 kg). Ni le poids, ni la taille sont donc de bons critères pour identifier les jeunes de l'année dans un tableau de chasse[4]. Le lièvre d'Europe vit environ 10 ans.
Méthode de détermination de l'âge
- Les spécialistes évaluent l'âge d'un lièvre fraichement mort en pesant son cristallin (après dessiccation de l'œil dans une solution de formol puis passage à l'étuve). Un abaque permet d’estimer l'âge à 2-3 semaines près pour les individus de moins de trois mois, et avec une précision de six semaines jusqu'à l'âge de 5 à 6 mois, puis avec une précision de quatre mois environ pour des lièvres âgés de un an et de 18 mois pour ceux qui dont de 1 à 3 ans. Ceci permet lors d'études démographiques ou écoépidémiologiques parmi les animaux trouvés tués par des voitures, empoisonnés ou tués à la chasse de déterminer le taux de jeunes et d'animaux nés les années précédentes (adultes)[4].
- Une autre méthode est la mesure du cartilage de conjugaison de la face externe de la base du cubitus de l'animal mort. À cet endroit, le cartilage forme une excroissance qui diminue peu à peu jusque vers l'âge de six mois. La classe d'âge des individus de moins de 6 ou 7 mois peut ainsi être identifiée parmi les lièvres plus âgés[4].
Mode de vie
Alimentation
Il se nourrit principalement des parties vertes de diverses plantes herbacées, et en particulier des graminées, dans les prairies naturelles, zones humides, dans les champs (les céréales en herbe de l'automne au printemps, comme le blé d'hiver), et dans les banquettes herbeuses des bordures de parcelles. Il consomme aussi les adventices des cultures (celles qui poussent rapidement entre les chaumes après la moisson en même temps que les repousses des plantes cultivées). Il ne consomme parfois que les parties les plus nutritives comme les jeunes pousses et les boutons floraux.
Il mange aussi des fruits, graines et racines (betteraves notamment) ou des plantules d'arbres et arbustes, notamment en période d'enneigement. Il consomme parfois les jeunes plants de vigne[4].
En période sèche, il peut se rabattre sur des plantes cultivées riches en eau, telles que les pousses de tournesol ou d'asperge. Il peut se passer d'eau, la rosée et l'eau des végétaux lui suffisent[4].
Dans un groupe, les individus dominants peuvent avoir un accès privilégié à la nourriture[6].
Comportement et reproduction

Les lièvres sont très sociables, mais avec une hiérarchie plus marquée lors de l'alimentation[7] et au moment de la reproduction.
Ils montrent une préférence pour certains types de paysages ou d'éléments paysagers, éventuellement en zone d'agriculture intensive[8], et y sont alors plutôt grégaires, sans comportement de défense du territoire. La plupart des jeunes ne se dispersent pas loin, ils se choisissent un territoire qui est rarement éloigné de plus de 2 km de leur lieu de naissance. Quelques individus « disperseurs » sont retrouvés jusqu'à 9 km de leur lieu de naissance[9].
Leur domaine vital n'atteint généralement pas 2 km2. Mais il peut varier de moins de 0,5 à plus de 4 km2 selon les individus et la ressource alimentaire[4].
Le lièvre est plutôt lucifuge ; c'est-à-dire qu'il vit surtout la nuit, où il part se nourrir, par groupes de 2 à 6 individus (parfois jusqu'à une quinzaine[4]). Il pourrait donc peut-être souffrir de la dégradation générale de l'environnement nocturne et de la pollution lumineuse, mais ceci ne semble pas encore avoir fait l'objet d'études.
Le parade nuptiale est collective. La femelle en œstrus cherche à s'accoupler avec les mâles les plus endurants et tenaces et va donc entamer des courses-poursuites en terrain ouvert où les mâles vont la poursuivre. Seuls le ou les mâles qui n'auront pas abandonné, de fatigue, les courses-poursuites effrénées auront la possibilité de s'accoupler.
Les naturalistes parlent de « bouquinage » pour décrire les combats entre lièvres à cette époque[4]. Contrairement aux idées reçues répandues dans la littérature et le monde depuis des siècles, le bouquinage n'est habituellement pas pratiqué entre mâles mais entre une femelle et un mâle. Ce comportement remarquable est un exemple de combats intersexuels. Le mâle en rut cherche à s'accoupler à une femelle non-réceptive. Celle-ci cherche donc à repousser le mâle en donnant de puissants coups de pattes antérieures, orientés vers la tête du mâle. Il s'ensuit généralement une série de courses-poursuites suivies de courts combats jusqu'à ce que le mâle abandonne sa poursuite[10].
Après la reproduction et l'élevage des jeunes, les levrauts se dispersent rapidement.
La maturité sexuelle est acquise dès 3 ou 4 mois. La reproduction débute en décembre, avec des naissances se succédant potentiellement de fin janvier à début octobre de l'année suivante.
La gestation ne dure que 41 jours. Deux portées peuvent se succéder voire se chevaucher (en 37-38 jours), phénomène dit de superfœtation. En effet, la hase peut retomber enceinte alors qu'elle l'est déjà et porte encore le ou les fœtus d'une précédente fécondation :
« Déjà enceinte, la femelle du lièvre brun (Lepus europaeus) peut entamer une seconde grossesse. Ce phénomène de « superfétation », suspecté depuis Aristote, a été visualisé à Berlin par Kathleen Röllig grâce à une échographie haute résolution : de nouveaux embryons se développent dans l’oviducte et migrent vers l’utérus, déjà occupé par des fœtus plus anciens. La hase augmente ainsi sa progéniture [et ses chances de succès reproductif] de plus de 30% à chaque période de reproduction »[11].
Ceci permet à une femelle de produire 5 portées par an, en 6 mois seulement (des derniers jours de janvier à début octobre). En France, selon l'ONCFS, 13 jeunes sont en moyenne produits par femelle reproductrice chaque année, mais ce chiffre peut fortement varier dans certains contextes. Une portée contient de 1 à 3 levrauts et rarement 4 ou 5 (2,6 en moyenne par femelle en France). C'est moins que chez le lapin ou d'autres animaux comparables, mais ces levrauts sont précoces. Nés couverts d'une fourrure dense, ils sont thermorégulés et bien camouflés au sol. Sevrés à 3 ou 5 semaines ils sont rapidement totalement autonomes[4].
Répartition

Le lièvre d'Europe est originaire d'Eurasie occidentale, depuis l'ouest de la France jusqu'à l'Altaï en Asie centrale, et du nord du Moyen-Orient jusqu'à la Finlande. En Europe occidentale il est absent de la majeure partie de la péninsule ibérique (où il est remplacé par le lièvre ibérique). Il était à l'origine absent des iles Britanniques et de la péninsule Scandinave mais il y a été introduit.
Il fut introduit également en Amérique du Nord aux États-Unis dans l'État de New York en 1893 et au Canada dans la province de l'Ontario en 1912[12], mais aussi en Argentine, au Chili, en Nouvelle-Zélande, en Australie et dans certaines régions de l'Afrique[12].
Habitat
Cette espèce est vraisemblablement originaire de la steppe eurasiatique. Elle se serait répandue en Europe occidentale principalement grâce aux déboisements effectués par l'Homme à partir du Néolithique, qui ont créé des milieux ouverts (les champs et les prairies pastorales) qui lui sont favorables. Les forêts qui couvraient l'Europe avant cette période lui étaient défavorables[13].
C'est un spécialiste des milieux ouverts et dégagés à végétation herbacée: les prairies aussi bien sèches qu'humides et les champs cultivés. Il est cependant très plastique et très peu exigeant sur les autres paramètres de l'habitat. On le trouve dans les marais, les vastes pâturages extensifs secs (causses), les landes à bruyères, les garrigues, les champs cultivés, les vergers et les vignes, les steppes et jusqu'aux zones semi-désertiques d'Asie centrale, mais aussi les clairières et les lisières des bois et parfois dans les forêts claires à végétation herbeuse au sol. Il tend cependant à éviter les zones entièrement vouées à l'herbage intensif permanent, car la structure très basse et la couleur uniformément verte toute l'année de l'herbe des pâtures tondues par les bovins ou les moutons ne conviennent guère à sa stratégie mimétique (la couleur de son pelage), notamment en période de reproduction (les jeunes sont très vulnérables aux prédateurs), et il est donc moins abondant dans les régions de bocage.
Il est l'une des rares espèces à pouvoir s'adapter aux zones d'agriculture intensive au paysage complètement ouvert ou presque, où il est plus abondant qu'ailleurs (en France, la Flandre, l'Artois, la Picardie, la Champagne, la Beauce, le Berry, font partie des régions où il est le plus abondant). Il est présent notamment là où sont cultivées des céréales d'hiver, qui lui fournissent une nourriture herbacée de qualité durant toute la mauvaise saison au lieu d'une terre nue, favorisant de hautes densités de lièvres au km², mais aussi des cultures de plantes sarclées. À défaut la présence de bandes enherbées, de banquettes herbeuses des bordures ou de prairies intercalaires, favorise sa subsistance. Malgré sa grande tolérance et sa préférence nette pour les grands espaces de monoculture, une homogénéisation excessive des cultures sur d'immenses surfaces et certains changements de pratiques agricoles peuvent dans certains cas finir par lui devenir défavorables.
Classification et génétique

Le lièvre européen a été décrit pour la première fois en 1778 par le naturaliste allemand Peter Simon Pallas[14]. Il partage le genre Lepus (« lièvre » en latin[15]) avec 31 autres espèces de lièvre et de jackrabbit, soit le nom donné à certaines espèces de lièvre originaires de l’Amérique du Nord. De plus, il est classée par plusieurs auteurs[16] dans le sous-genre Eulagus[17]. Ce lièvre se distingue des autres léporidés (lièvres et lapins) par ses jambes plus longues, ses narines plus larges et l'activité précoce de ses levrauts[18]. Le lièvre corse, le lièvre des monts Cantabriques et le lièvre ibérique ont tout d'abord été considéré comme sous-espèces du lièvre européen. Toutefois, le séquençage de l'ADN et l'analyse morphologique ont confirmé leur statut d'espèce distincte[19],[20].
.jpg.webp)
Il existe une théorie qui affirme que le lièvre d'Europe et le lièvre du Cap sont en fait la même espèce. Une étude de 2005 sur leurs gènes nucléaires a suggéré qu'ils le sont[21]. Cependant, une seconde étude de 2006 sur l'ADN mitochondrial de ces mêmes animaux a conclu qu'ils avaient divergé suffisamment pour être considérés comme des espèces à part entière[22]. Enfin, une étude de 2008 affirme que, dans le cas des espèces du genre Lepus, la désignation d’espèce ne peut être basée uniquement que sur l’ADN en raison de leur évolution rapide. Les recherches génétiques doivent donc également inclure un examen de l'ensemble des gènes nucléaires. Il est de ce fait possible que les différences génétiques entre le lièvre d'Europe et le lièvre du Cap soient dues à une séparation géographique plutôt qu'à une divergence réelle. On a supposé qu'au Proche-Orient, les populations de lièvre s'intercalent et connaissent un flux de gènes[23]. Une autre étude de 2008 suggère que davantage de recherches sont nécessaires avant de pouvoir déterminer s’il existe un complexe d’espèces[24]. Le lièvre d'Europe reste donc aujourd'hui classé comme une seule espèce jusqu'à ce que d'autres données contredisent cette hypothèse[25].
L'analyse cladogénétique suggère que les lièvres européens ont survécu à la dernière période glaciaire du Pléistocène en se réfugiant dans le sud de l'Europe (péninsule italienne et Balkans) et en Asie mineure. Les colonisations ultérieures en Europe centrale semblent avoir été initiées par des changements environnementaux causés par l'homme[26]. La diversité génétique dans les populations actuelles est élevée, sans aucun signe de consanguinité. Le flux de gènes semble être biaisé vers les mâles, mais la population globale est structurée de façon matrilinéaire. Il existe un degré particulièrement élevé de diversité génétique chez les lièvres du land de Rhénanie-du-Nord-Westphalie en Allemagne. Il est toutefois possible que le flux génétique limité réduise la diversité génétique au sein des populations isolées[27].
Historiquement, jusqu'à 30 sous-espèces de lièvres européens ont été décrites, bien que leur statut ait été contesté[18]. Ces sous-espèces ont été distinguées par des différences de coloration du pelage, de taille, de mensurations externes, de morphologie du crâne et de forme des dents[28].
Seize sous-espèces sont répertoriées dans la liste rouge de l'UICN[29]:
- Lepus europaeus caspicus
- L. e. connori
- L. e. creticus
- L. e. cyprius
- L. e. cyrensis
- L. e. europaeus
- L. e. hybridus
- L. e. judeae
- L. e. karpathorum
- L. e. medius
- L. e. occidentalis
- L. e. parnassius
- L. e. ponticus
- L. e. rhodius
- L. e. syriacus
- L. e. transsylvanicus
Les biologistes Joseph Chapman et John Flux ont, quant à eux, répertorié 29 sous-espèces à « statut très variable » dans leur ouvrage sur les lagomorphes, y compris les sous-espèces susmentionnées (à l'exception de L. e. Connori, L. e. Ceticus, L. e. Cyprius, L e. judeae, L. e. rhodius et L. e. syriacus) et en plus[18]:
- L. e. alba
- L. e. argenteogrisea
- L. e. biarmicus
- L. e. borealis
- L. e. caspicus
- L. e. caucasicus
- L. e. flavus
- L. e. gallaecius
- L. e. hispanicus
- L. e. hyemalis
- L. e. granatensis
- L. e. iturissius
- L. e. kalmykorum
- L. e. meridiei
- L. e. meridionalis
- L. e. niethammeri
- L. e. niger
- L. e. tesquorum
- L. e. tumak
Le lièvre d'Europe dans la culture

Antiquité
_-_c03757_07.jpg.webp)
Dans l'Antiquité classique, chez les Grecs et les Romains, le lièvre d'Europe est vu comme l'incarnation d'une créature traquée ne pouvant survivre uniquement grâce à une reproduction prolifique. C'est pourquoi des auteurs tels qu'Aristote, Hérodote et Claude Élien ont tous décrit le lièvre comme l'un des animaux les plus fertiles. D'ailleurs, Pline l'Ancien recommandait de manger de la viande de lièvre, qu'il considérait aphrodisiaque, comme remède à la stérilité. Le lièvre incarne ainsi un symbole de vitalité, de désir sexuel et de fertilité. De par cette réputation, il devient donc un cadeau prisé entre amants.
À cette période, le lièvre d'Europe est souvent représenté dans l'art et la mythologie antiques aux côtés des dieux associés à l'amour et aux loisirs, soit Dionysos et Aphrodite. Cette dernière, selon les mythes et légendes, considérait l'animal sacré car il possédait « le don d'Aphrodite » en grande abondance, soit la fertilité. Il est ainsi un compagnon de choix pour les satyres et les cupidons. Le lièvre d'Europe est également un symbole de chasse. Selon les croyances de l'époque, Artémis protégeait et interdisait de tuer les levrauts sous peine de malédiction.
Dans l'Antiquité tardive, il est utilisé comme symbole de bonne chance. Cette croyance serait reliée aux anciennes traditions funéraires gréco-romaines. En effet, le lièvre d'Europe est associé au cycle de la vie. De nombreuses sépultures de l'époque incorporent des sculptures de lièvres mangeant des raisins et des figues, représentant ainsi le stades de la vie, de la mort et de la renaissance.
Moyen-Âge
L’Église chrétienne a ensuite associé ce lièvre à la luxure et à l’homosexualité, mais elle l’a également associée à la persécution de l’Église en raison de la façon dont les premiers chrétiens étaient chassés et persécutés.
Époque contemporaine
En Europe du Nord, les célébrations de Pâques intègrent souvent le lièvre d'Europe ou le lapin domestique. Dans son étude sur les coutumes et la mythologie populaires au XIXe siècle, Charles J. Billsoncite avance que les traditions folkloriques concernant le lièvre de Pâques prendraient source avec le culte d'Éostre, divinité anglo-saxonne. Celle-ci était célébrée au cours de l’équinoxe de printemps et possédait pour compagnon un lièvre d'Europe, le rendant de facto un animal sacré dans la Grande-Bretagne antique. Dans son ouvrage Alice au pays des merveilles, Lewis Carroll propose le personnage du Lièvre de mars avec lequel Alice prendra le thé aux côtés du Chapelier fou. Carroll s'inspire de l'expression courante anglaise « Fou comme un lièvre de mars » (en anglais : Mad as a March hare) qui se veut une analogie entre la folie et le comportement des lièvres d'Europe en période de rut, soit de février à septembre.
Menaces et protection
État des populations, menaces
Le lièvre est une espèce commune dans les campagnes européennes et l'un des petits gibiers les plus recherchés par les chasseurs. Il a cependant connu une forte diminution de ses effectifs entre les années 1960 et 1980, puis une stabilisation voire une remontée assez forte dans certaines régions, puis de nouvelles diminutions à partir des années 1990 par endroits. Il y a cependant de fortes disparités régionales dans ces fluctuations, et les causes semblent multiples et souvent mal comprises, difficiles à hiérarchiser. Cela provoque périodiquement des inquiétudes chez les écologistes, les chasseurs et les biologistes. Mais actuellement on ne peut pas considérer l'espèce comme en danger, elle reste localement abondante, mais rare ailleurs, et demeure toujours un des gibiers les plus chassés en France[13].
La prédation, les parasitoses et les maladies sont les facteurs normaux de contrôle démographique, avec des impacts ponctuels et locaux parfois alarmants sur les populations, mais qui n'expliquent pas la « forte mortalité supplémentaire »[30] constatée depuis les années 1960 et qui « n'ont probablement pas d'influence sur la tendance de la population à long terme »[30]. De même, une mauvaise gestion cynégétique (trop de chasse), constitue une cause de régression seulement localement et temporairement, étant donné que la pression de chasse varie localement.
Le lièvre a décliné en effet de manière « spectaculaire »[31] dans de nombreuses régions d'Europe de l'Ouest à partir des années 1960, pour des causes probablement multiples[30]. En France, selon l'ONCFS, la dynamique de population de cette espèce est préoccupante. Il est en régression depuis la fin des années 1990 « sans que l'on puisse identifier avec certitude les raisons de ce recul »[5].
On a beaucoup avancé comme causes principales les remembrements, le recul des prairies et des zones humides, l'artificialisation, l'homogénéisation ou la dégradation des paysages agricoles[32],[33], ce qui aurait privé le lièvre d'une partie de ses habitats[34] Cependant, rien n'est venu prouver que de tels facteurs auraient une influence sur la baisse des populations de lièvres. Car bien au contraire, c'est dans les régions de vastes monocultures intensives qu'il reste de loin plus abondant qu'ailleurs, comme en Beauce ou en Artois entre autres. Ces paysages d'agriculture intensive correspondent en réalité à l'habitat idéal pour cette espèce très spécialisée des milieux ouverts et homogènes, et il parvient encore à y trouver sa nourriture. Les chercheurs abandonnent donc aujourd'hui cette piste[13]. La nourriture verte peut temporairement devenir rare en été dans les monocultures trop vastes et homogènes, du fait de la disparition de nombreuses plantes adventices des cultures et des bordures par l'utilisation des herbicides, ayant fait disparaitre une partie de sa ressource alimentaire. Mais il est rare que les monocultures atteignent une homogénéité si extrême qu'il ne puisse pas trouver de nourriture dans les parages en cette saison, car il se déplace facilement si nécessaire. On a aussi soupçonné les pesticides[35], mais il ne semble pas en souffrir directement de nos jours (du moins, on n'a pas pu le démontrer, bien que cela pourrait éventuellement avoir été une cause importante dans les décennies passées).
C'est plutôt la spécialisation dans l'élevage de certaines régions, avec soit la généralisation des herbages, ou soit le remplacement des parcelles de céréaliculture par des cultures fourragères (le maïs notamment, mais aussi les prairies artificielles trop régulièrement fauchées qui ne lui conviennent pas), qui explique la diminution des effectifs de lièvres dans ces régions (ce serait notamment le cas en Suisse et en Bretagne par exemple), alors que le paysage y reste plus diversifié qu'ailleurs. Dans d'autres régions c'est la déprise agricole qui est la principale cause de sa disparition, du fait des reboisements (ces régions redeviennent en fait plus naturelles) avec des zones agricoles devenues trop petites et isolées pour le lièvre.
La fragmentation écopaysagère des paysages agricoles a aussi été étudiée[36].
La chasse est également une cause de mortalité, notamment pour les animaux en phase de transit vers un nouveau territoire[1]. Le braconnage l'est aussi parfois (par exemple, pour 60 % des cas identifiés de mort chez soixante lièvres suivis par Radio-tracking durant 4 ans (de novembre 2005 à novembre 2009) dans le centre de la Pologne, 13 % ont été tués par des braconniers, ce qui est deux fois plus que la mortalité par roadkill (7 %)[37]. Ce chiffre est peut-être sous-estimé car les braconniers détruisent les radioémetteurs des lièvres qu'ils capturent, et 40 % des causes de mortalités n'ont pu être identifiées lors de cette étude)[37].
À la suite des modifications du paysage agricole du XXe siècle, qui a vu le renforcement des spécialisations régionales dans les productions, on peut dire aujourd'hui que les populations les plus florissantes de lièvre d'Europe se concentrent désormais principalement dans des zones où l'agriculture est la plus intensive, simplement parce que c'est là que les paysages ouverts avec de vastes espaces interconnectés de céréaliculture persistent et même se généralisent, alors qu'il est devenu plus rare ailleurs. Dans cet habitat, on peut considérer le lièvre comme l'une des espèces les plus tolérantes qui soient aux pratiques de l'agriculture moderne, adaptation que très peu d'espèces sont parvenues à acquérir (l'écologie du lièvre le rendait préalablement adapté à ce milieu). C'est donc dans ces zones que sa conservation doit être prise en compte dans les pratiques agricoles dont il est dépendant. Des mesures simples et peu coûteuses peuvent le favoriser, d'autant qu'il n'est pas considéré comme un ravageur potentiel des cultures à la différence du lapin de garenne, et que sa présence est au contraire très appréciée en tant que gibier.
Aujourd’hui, la maladie est la première cause de mortalité des levrauts, devant la prédation, la chasse, le braconnage et les collisions avec des véhicules.
Statut juridique
C'est une espèce gibier dans de nombreux pays européens, dont la France.
Il peut faire l'objet de mesures réglementaires et de plans de gestion. Localement, il a été réintroduit ou on a tenté de le faire pour repeupler certaines zones en animaux pour la chasse[38].
Mesures de gestion
De nature cynégétique ou naturaliste, la gestion de populations de lièvres a deux objectifs, qui peuvent être contradictoires ;
- augmenter les populations et la densité d'individus car l'espèce est en régression
- contrôler ou limiter les populations là où elles sont jugées indésirables pour l'agriculture, bien que cette espèce à densités de populations relativement faibles, et à large rayon d'action diffus, fasse beaucoup moins de dégâts que le lapin [4].
Les maladies du lièvre
Le lièvre européen est notamment infecté par :
- un virus (Leporipoxvirus proche du virus du myxome et découvert en 1931 en Amérique du Nord où il est transmis entre lapins par des tiques ou via des insectes piqueurs et/ou suceurs de sang (hématophage) ; virus de papillome Shope, virus Shope du fibrome ou virus Leporipox) ;
- la yersiniose du lièvre (aussi dite pseudotuberculose) ;
- la coccidiose aiguë (qui touche les jeunes lièvres surtout) ;
- Un Leporipoxvirus proche est responsable de maladies fibromateuses du lièvre[39], encore mal connu;
- le virus de l’hépatite virale du lièvre (ou HS :European brown hare syndrom), qui semble plus fréquemment toucher les lièvres depuis les années 1990, au point d'être devenu la première cause de mortalité observée par le réseau SAGIR (de veille écoépidémiologique) en France.
Une mortalité importante observée à l'automne 2004 semble pouvoir être attribuée à un variant muté de ce virus[40] ; - le virus calicivirus de la Maladie hémorragique virale du lapin (RHD (ou syndrome du lièvre brun européen, EBHS), cause d'une maladie mortelle et très contagieuse décimant localement et périodiquement le lapin européen (Oryctolagus cuniculus). Le calcivirus qui infecte le lapin est différent de celui qui infecte le lièvre.
Écoépidémiologie
Le manque de prédateurs variés et spécialisés (souvent inféodés à des structures écopaysagères en régression telles que lisières forestières, zones humides, les haies, bosquets, arbres-perchoirs, zones à forte naturalité) pourrait faciliter la diffusion et persistance de ses maladies, le prédateur naturel consommant généralement d'abord les animaux malades en limitant les risques d'épidémies.
Les élevages et leurs conditions de promiscuité et d'absence de sélection naturelle pourraient parfois être source de dispersion de virus mutants. En 2010, un virus hémorragique génétiquement nettement différent des autres a été repéré dans des élevages, puis chez certaines populations de lièvre sauvage qu'il a décimé dans le Nord de la France. Des syndromes oculaires évoquant la myxomatose sont également sporadiquement détectés chez le lièvre (en 2010, on ne savait pas encore s'il s'agissait exactement du même virus que celui qui infecte le lapin[41]).
Élevage
Cette espèce fait depuis longtemps l'objet d'élevage qui produisaient de la viande et des peaux/fourrures. Il se pratique en cages et/ou parcs au sol. Dans les élevages le levraut commence à s'alimenter dès deux semaines alors que la lactation diminue chez la mère. Le sevrage est accompli vers 3 à 4 semaines (le levraut pesant alors de 600 grammes à 1 kg et il pèsera environ 1,5 kg à l'âge de deux mois).
Depuis la régression du lièvre, les animaux d'élevage servent surtout à faire des réintroductions de gibier pour les chasseurs.
Élevage en France : Il existe en France un organisme syndical regroupant les professionnels de cet élevage, la Fédération des éleveurs de lièvres de France (FELF), elle-même adhérente du Syndicat National des Producteurs de Gibier de Chasse, lui-même partie intégrante de la Confédération française de l'aviculture. Selon son site internet, la FELF regroupe en 2012 environ 40 éleveurs, produisant chaque année environ 30000 lièvres à partir d'environ 5000 couples de lièvres reproducteurs, soit un chiffre d'affaires de 15 millions de francs environ. Elle a édité des fiches conseils de repeuplement destinés aux sociétés de chasse (recommandant notamment de faire passer le lièvre par un parc de transition (ou de parc de pré lâcher) pour l'accoutumer à une vie sauvage avant de lui donner une totale liberté.
Débats sur le repeuplement artificiel (par réintroduction)
Face à la forte régression de cette espèce (les prélèvements se sont effondrés de moitié en 15 ans (de 1983 à 1998) dans de nombreuses régions françaises[42]), de nombreux repeuplements ont été faits depuis la fin du XXe siècle[43].
Dans le monde cynégétique, comme dans le domaine de la pisciculture et de la pêche, à la suite du constat des nombreux échecs de repeuplements à fin de restaurer des populations de « petit gibier », constatés par les sociétés de chasse qui les ont pratiqué et par l'ONCFS[44], il existe un débat de fond sur l'intérêt des repeuplements et les risques qu'ils présentent.
Deux attitudes se dessinent face aux repeuplements :
- Certains biologistes, écologues, techniciens ou conseillers cynégétiques recommandant comme priorité de lutter contre les facteurs de régression du lièvre, de limiter les tableaux de chasse quand et où il régresse et le temps de la reconstitution de populations normalement denses, et dans le même temps ou ensuite de restaurer les habitats, corridors biologiques et milieux refuges favorables à cette espèce, afin d'en favoriser la dispersion et des échanges génétiques normaux dans le cadre de la restauration d'une trame verte et bleue, et notamment en profitant des bandes enherbées imposées par la nouvelle Politique agricole commune. Ainsi, selon eux, les populations pourront s'y reconstituer spontanément, entretenues par la sélection naturelle (les animaux d'élevages étant génétiquement peu diversifiés et risquant d'introduire des maladies ou d'y être plus vulnérables), et sans pulluler ni être source de dégâts sur l'agriculture s'ils sont exposés à leurs prédateurs naturels.
- En 2013, les éleveurs de la FELF estiment de leur côté que les souches de lièvres qu'ils utilisent sont « bien adaptées au pays, prolifiques, et résistantes aux maladies » et que « remonter les populations de lièvres n'est pas une gageure comme sembleraient le croire certains défaitistes ou certains conseillers anti-repeuplement ou anti élevage ». Ils reconnaissent que « certains rapports sont négatifs » mais estiment que « d'autres lorsque les conditions sont réunies (qualité des lièvres et préparation du biotope d'accueil) sont positifs » avec selon eux des « taux de survie allant jusqu'à 60 voire 70 % trois mois après le lâcher »[45]. Selon le syndicat des éleveurs, le repeuplement doit idéalement se faire via un parc de pré-lâcher construit en deux parties : « un parc d'adaptation et un grand parc »[45].
Études et recherche
De nombreuses études ont porté sur cette espèce, notamment pour tenter de comprendre pourquoi elle a régressé si vite et dans toute l'Europe de l'Ouest, et pourquoi les opérations de réintroduction étaient souvent des échecs à court ou moyen terme (ce qui n'est pas propre à cette seule espèce[46]).
L'un des meilleurs moyens de le suivre dans ses déplacements (ou tanières) et le radiotracking[47]. Une autre technique de suivi de population et de dispersion d'individus est la méthode Capture-marquage-recapture[48]. Des analyses génétiques peuvent aussi être utilisées.
Selon le CNERA, les méthodes de suivi des lagomorphes donnent des indices d'abondance plus précis pour le lièvre que pour le lapin mais « aucune méthode d’estimation avant chasse du succès de la reproduction n’est disponible, ce qui complique la gestion des prélèvements cynégétiques et suppose encore des phases de recherche ou de tests. L’étude de la dynamique spatio-temporelle des populations de ces espèces est le thème principal des travaux du CNERA, en particulier en relation avec les maladies virales qui les touchent (myxomatose, RHD et EBHS) »[49].
On teste aussi depuis peu une méthode de mesure de l’« âge-ratio » des animaux prélevés à la chasse par radiographie des pattes. Cette méthode permettrait aussi d'éviter d'avoir à tuer l'animal pour déterminer son âge et éventuellement de donner des indices sur le saturnisme animal chez les lièvres vivant en zone à risque de pollution par le plomb où l'on a montré que le lièvre présente des plombémies anormalement élevées[50]).
Notes et références
- 1 2 ONCFS (2011), Impact de la dispersion et de la chasse sur la survie juvénile du lièvre d’Europe, Rapport scientifique 2011, PDF, p. 13, consulté 2013-05-23
- ↑ « Le bouquin et la hase : Lepus europaeus, le lièvre d'Europe », sur ekolien.fr (consulté le ), légendes photos.
- ↑ S.Aulagier, P.Haffner, A.J Mitchell-Jones, F. Moutou, J. Zima, Guide des mammifères d'Europe, d'Afrique du Nord et du Moyen-Orient, Delachaux & Niestlé, 2008, (ISBN 978-2-603-01505-6)
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 ONCFS, Le Lièvre d’Europe, consulté 2015-05-23
- 1 2 3 Colloque Lièvre d’Europe, 15 et 16 mai à Troyes, coorganisé par l'office national de la chasse et de la faune sauvage (ONCFS) et divers organismes de représentation des chasseurs (FNC, la FRC FDC) et plusieurs collectivités]
- ↑ Lindlöf B (1978) Aggressive dominance rank in relation to feeding by European hare. Viltrevy 10:145–158
- ↑ Monaghan P, Metcalfe NB (1985) Group foraging in wild brown hares: effects of resource distribution and social status. Anim Behav 33:993–999
- ↑ (en) Reitz F., Léonard Y. (1994), Characteristics of European hare Lepus europaeus use of space in a French agricultural region of intensive farming, Acta Theriol 39:143–157.
- ↑ (en) Devillard S. & Bray Y. (2009), « Assessing the effect on survival of natal dispersal using multistate capture-recapture models », Ecology 90: 2902-2912.
- ↑ (en) Anthony J. F. Holley et Paul J. Greenwood, « The myth of the mad March hare », Nature, vol. 309, no 5968, , p. 549–550 (ISSN 1476-4687, DOI 10.1038/309549a0, lire en ligne, consulté le )
- ↑ « Embryologie : la hase peut tomber enceinte alors qu'elle l'est déjà ! », Science & Vie n° 1119, (lire en ligne, consulté le ).
- 1 2 Mammifères du Québec et de l'est du Canada, p. 90-92
- 1 2 3 La fiche de l'espèce sur le site de l'ONCFS, consultée en 2017,
- ↑ (la) Peter Simon Pallas, Novae Species Quadrupedum e Glirium Ordine, W. Waltheri, , 406 p. (ISBN 0282429085, lire en ligne), p. 30
- ↑ (en) « leveret (n.) », sur Online Etymology Dictionary, (consulté le ) : « from Latin lepore, from lepus "a hare." »
- ↑ Averianov, 1998; Gromov and Baranova, 1981; Gureev, 1964
- ↑ Mammal Species of the World (version 3, 2005), consulté le 1 décembre 2014
- 1 2 3 (en) Joseph A. Chapman et John E. C. Flux, Rabbits, Hares and Pikas: Status Survey and Conservation Action Plan, Gland, Union internationale pour la conservation de la nature, , 168 p. (ISBN 978-2-8317-0019-9, lire en ligne), p. 76-78
- ↑ (en) F. Palacios, « Biometric and morphologic features of the species of the genus Lepus in Spain », Mammalia, vol. 53, no 2, , p. 227-264 (10.1515/mamm.1989.53.2.227)
- ↑ (en) F. Riga, V. Trocchi, E. Randi et S. Toso, « Morphometric differentiation between the Italian hare (Lepus corsicanus De Winton, 1898) and the European brown hare (Lepus europaeus Pallas, 1778) », Journal of Zoology, vol. 253, no 2, , p. 241-252 (10.1017/S0952836901000218)
- ↑ (en) H. Ben Slimen, F. Suchentrunk, A. Memmi et A. Ben Ammar Elgaaied, « Biochemical genetic relationships among Tunisian hares (Lepus sp.), South African Cape hares (L. capensis), and European brown hares (L. europaeus) », Biochemical Genetics, vol. 43, nos 11-12, , p. 577-596 (lire en ligne)
- ↑ (en) H. Ben Slimen, F. Suchentrunk, A. Memmi, H. Sert, U. Kryger, P. C. Alves et A. Elgaaied, « Evolutionary relationships among hares from North Africa (Lepus sp. or Lepus spp.), Cape Hares (L. capensis) from South Africa, and brown hares (L. europaeus), as inferred from mtDNA PCR-RFLP and allozyme data », Journal of Zoological Systematics and Evolutionary Research, vol. 44, no 1, , p. 88-89 (lire en ligne)
- ↑ (en) H. Ben Slimen, F. Suchentrunk et A. Ben Ammar Elgaaied, « On shortcomings of using mtDNA sequence divergence for the systematics of hares (genus Lepus): An example from Cape hares », Mammalian Biology, vol. 73, no 1, , p. 25-32 (lire en ligne)
- ↑ (en) H. Ben Slimen, F. Suchentrunk, C. Stamatis, Z. Mamuris, H. Sert, P. C. Alves, U. Kryger, A. B. Shahin et A. Ben Ammar Elgaaied, « Population genetics of Cape and brown hares (Lepus capensis and L. europaeus): A test of Petter's hypothesis of conspecificity », Biochemical Systematics and Ecology, vol. 36, no 1, , p. 22-39 (lire en ligne)
- ↑ (en) K. Hacklander et S. Schai-Braun, « Lepus europaeus », sur The IUCN Red List of Threatened Species, (consulté le )
- ↑ (en) J. Fickel, H. C. Hauffe, E. Pecchioli, R. Soriguer, L. Vapa et C. Pitra, « Cladogenesis of the European brown hare (Lepus europaeus Pallas, 1778) », European Journal of Wildlife Research, vol. 53, no 3, , p. 495-510 (lire en ligne)
- ↑ (en) J. Fickel, A. Schmidt, M. Putze, H. Spittler, A. Ludwig, W. J. Streich et C. Pitra, « Genetic structure of populations of European brown hare: Implications for management », Journal of Wildlife Management, vol. 69, no 2, , p. 760-770 (lire en ligne)
- ↑ (en) F. Suchentrunk, Z. Mamuris, I. A. Sfougaris et C. Stamatis, « Biochemical genetic variability in brown hares (Lepus europaeus) from Greece », Biochemical Genetics, vol. 41, nos 5-6, , p. 127-140 (lire en ligne)
- ↑ (en) « Lepus europaeus », sur IUCN Red List, (consulté le )
- 1 2 3 Edwards PJ, Fletcher MR, Berny P. Review of the factors affecting the decline of the European brown hare, Lepus europaeus (Pallas, 1778) and the use of wildlife incident data to evaluate the significance of paraquat. Agric Ecosyst Environ. 2000;79:95–103. doi: 10.1016/S0167-8809(99)00153-X
- ↑ Thomas Reichlin . Erich Klansek . Klaus Hackländer Diet selection by hares (Lepus europaeus) in arable land and its implications for habitat management, Eur J Wildl Res (2006) 52: 109–118 ; DOI:10.1007/s10344-005-0013-3en ligne 2006-01-10
- ↑ Robinson RA, Sutherland WJ (2002) Post-war changes in arable farming and biodiversity in Great Britain. J Appl Ecol 39:157– 176
- ↑ Panek M, Kamieniarz R (1999) Relationships between density of brown hare Lepus europaeus and landscape structure in Poland in the years 1981–1995. Acta Theriol 44:67–75
- ↑ Lewandowski K, Nowakowski JJ (1993) Spatial distribution of brown hare Lepus europaeus populations in habitats of various types of agriculture. Acta Theriol 38:435–442
- ↑ Tapper SC, Barnes RFW (1986) Influence of farming practice on the ecology of the brown hare (Lepus europaeus). J Appl Ecol 23:39–52
- ↑ Smith RK, Jennings NV, Harris S (2005) A quantitative analysis of the abundance and demography of European hares Lepus europaeus in relation to habitat type, intensity of agriculture and climate. Mamm Rev 35:1–24
- 1 2 Magdalena Misiorowska et Michał Wasilewski (2012) Survival and causes of death among released brown hares (Lepus europaeus Pallas, 1778) in Central Poland ; Acta Theriol (Warsz). octobre 2012; 57(4): 305–312. En ligne 2012-05-02 ; Doi:10.1007/s13364-012-0081-1 PMCID:PMC3443339
- ↑ Angelici FM (1995) Ecologia della leper europea Lepus europaeusPallas 1778 nel Pre-Appennino Laziale. Analisi di individui immessi per il ripopolamento venatorio. PhD thesis, University of Rome ‘La Sapienza’, 68 pp (en Italien)
- ↑ Dr Esther van Praag Les lapins avec cornes existent-ils vraiment ? Fibromatose ; Medirabbit.com
- ↑ Le Gall-Reculé G., Zwingelstein F., Portejoie Y., Péroux R. & J.-S. Guitton (2007) Mise en évidence d’un nouveau génotype d’EBH SV à la suite de mortalités inhabituelles de lièvres bruns dans l’est et le sud-est de la France à l’automne 2004. Virologie, 11: S72-S73
- ↑ ONCFS Communiqué de presse Maladies virales des Lapins et des lièvres ; Le point sur les épidémies de VHD (Viral Hemorrhagic Disease) et d'EBHS (European brown hare syndrome) de l'automne 2010
- ↑ Péroux, R. 2000. Enquête nationale sur les tableaux de chasse à tir, saison 1998-1999. Le lièvre d'Europe. Faune Sauvage, Cahiers Techniques no 251 : 26-37
- ↑ Péroux, R. 1995. Le lièvre d'Europe. Bull. Mens. ONC no 204. 96 p.
- ↑ François Reitz, ONCFS, chef du CNERA Petite faune sédentaire de plaine, Repeuplement en petit gibier sédentaire de plaine : une ancienne problématique toujours d’actualité
- 1 2 Yves Mercier, Président de la FELF texte de présentation de la Fédération des éleveurs de lièvres de France, Revuegibieretchasse.fr, consulté 2015-05-25
- ↑ Havet, P. & Biadi, F. 1990. Réintroductions et soutiens de populations d'espèces de petit gibier. Rev. Ecol. (Terre & Vie), suppl . no 5 : 261-289
- ↑ Angelici FM, Riga F, Boitani L, Luiselli L. (1999) Use of dens by radiotracked brown hares Lepus europaeus. Behav Process ;47:205–209. doi: 10.1016/S0376-6357(99)00064-9
- ↑ Benmergui M, Reitz F, Fiechter A. Taux de reprise et dispersion de lièvres (Lepus europaeus) sauvages d’Europe centrale relâchés dans l’Est de la France. Gibier Faune Sauvage. 1990;7:255–274.
- ↑ CNERA Les études du C.N.E.R.A. Petite Faune Sédentaire de Plaine , ONCFS, page mise à jour le 19/01/2010 et consultée 2013-05-25
- ↑ Kolesarova A, Slamecka J, Jurcik R, Tataruch F, Lukac N, Kovacik J, ... & Massanyi P (2008) Environmental levels of cadmium, lead and mercury in brown hares and their relation to blood metabolic parameters. Journal of Environmental Science and Health, Part A, 43(6), 646-650| résumé.
Voir aussi
Articles connexes
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- Jacques Prescott et Pierre Richard, Mammifères du Québec et de l'est du Canada, Waterloo (Québec), Édition Michel Quintin, , 400 p. (ISBN 2-89435-270-0)

- (it) Angelici FM (1995) Ecologia della leper europea Lepus europaeusPallas 1778 nel Pre-Appennino Laziale. Analisi di individui immessi per il ripopolamento venatorio. PhD thesis, University of Rome ‘La Sapienza’, 68 pp
- Avril A., Léonard Y., Letty J., Péroux R., Guitton J.S. & D. Pontier (2011) Natal dispersal of European hare in a high-density population. Mammalian Biology 76:148–156. – avril
- A., Letty J., Pradel R., Léonard Y., Santin-Janin H. & D. Pontier (2009) A multi-event model to study stage-dependence dispersal in radio-collared hares : when hunting promotes costly transience. Ecology. – Devillard, S. & Bray, Y. 2009. Assessing the effect on survival of natal dispersal using multistate capture-recapture models. Ecology 90: 2902-2912
- Guitton J.-S., Le Gall-Reculé G., Puech C., Zwingelstein F., Portejoie Y., Ruvoen-Clouet N. & M.-E. Terrier. (2007) Was a new EBHSV genotype responsible for unusual wild hares mortalities observed in south-eastern France during the fall 2004 ? Ecology and management of wildlife diseases conference, York: 42
- (en) Kolesarova A, Slamecka J, Jurcik R, Tataruch F, Lukac N, Kovacik J, ... & Massanyi P (2008) Environmental levels of cadmium, lead and mercury in brown hares and their relation to blood metabolic parameters. Journal of Environmental Science and Health, Part A, 43(6), 646-650| résumé.
- ONCFS Communiqué de presse Maladies virales des Lapins et des lièvres ; Le point sur les épidémies de VHD (Viral Hemorrhagic Disease) et d'EBHS (European brown hare syndrome) de l'automne 2010
- (de) Späth V (1989) Untersuchungen zur Populationsökologie des Feldhasen (Lepus europaeus Pallas) in der Oberrheinebene. PhD thesis, University of Freiburg, Freiburg im Breisgau
- (en) Vaughan N, Lucas E-A, Harris S, White PCL (2003) Habitat associations of European hares Lepus europaeus in England and Wales: implications for farmland management. J Appl Ecol 40:163–175
- (de) Zörner H (1977) Ergebnisse der Untersuchungen über die Ernährung des Feldhasen (Lepus europaeus) im Wildforschungsgebiet Hakel. Beitr Jagd Wildforsch 10:255–266
- (de) Zörner H (1996) Der Feldhase. 2nd edn. Westarp Wissenschaften, Magdeburg
Bases taxinomiques
- (en) Référence Catalogue of Life : Lepus europaeus Pallas, 1778 (consulté le ).
- (en) Référence Paleobiology Database : Lepus europaeus Pallas 1778 (consulté le ).
- (en) Référence GISD : espèce Lepus europaeus (consulté le ).
- (fr+en) Référence ITIS : Lepus europaeus Pallas, 1778 (consulté le ).
- (en) Référence Mammal Species of the World (3e éd., 2005) : (Eulagos) europaeus Pallas, 1778 (consulté le ).
Liens externes
- (en) Référence Animal Diversity Web : Lepus europaeus (consulté le ).
- (en) Référence Fauna Europaea : Lepus europaeus Pallas, 1778 (consulté le )
- (fr) Référence INPN : Lepus europaeus Pallas, 1778 (TAXREF) (consulté le ).
- (en) Référence NCBI : Lepus europaeus (taxons inclus) (consulté le ).
- (en) Référence UICN : espèce Lepus europaeus Pallas, 1778 (consulté le ).
