
Un Chacal doré, un Dhole,
un Lycaon, un Renard des savanes
un Loup à crinière, un Chien des buissons
un Renard des steppes, un Chien viverrin
un Otocyon et un Renard gris américain.
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Cohorte | Placentalia |
| Ordre | Carnivora |
| Sous-ordre | Caniformia |
Sous-familles de rang inférieur
- Caninae (avec les espèces actuelles)
- † Borophaginae
- † Hesperocyoninae
Les Canidés (Canidae) sont une famille de mammifères de l'ordre des Carnivores, éponyme de la branche des Caniformes, et comprenant entre autres les loups (et donc le chien), les chacals et les renards.
Les Canidés se trouvent sur tous les continents, à l'exception de l'Antarctique, où ils sont arrivés indépendamment ou accompagnés d'êtres humains sur de longues périodes. Les espèces varient en taille, du loup gris de 2 mètres de long au fennec de 24 centimètres de long. Les formes corporelles des Canidés sont similaires, ayant généralement des oreilles droites, de longs museaux, aux canines développées et aux molaires nombreuses, adaptées pour casser les os et trancher la chair, de longues pattes, des griffes non rétractiles (contrairement aux Félidés) et des queues touffues. Ce sont pour la plupart des animaux sociaux, vivant ensemble en unités familiales ou en petits groupes et se comportant de manière coopérative. En règle générale, seul le couple dominant d'un groupe se reproduit et une portée de jeunes est élevée chaque année dans une tanière souterraine. Les Canidés communiquent par des signaux olfactifs et des vocalisations. Le chien issu du loup gris, est né d'une relation symbiotique avec les humains du Paléolithique supérieur et reste aujourd'hui l'un des animaux domestiques les plus largement conservés.
Caractéristiques
Les Canidés ont un bulbe tympanique non cloisonné. Leurs griffes ne sont pas rétractiles. Ils possèdent 5 doigts sur les pattes antérieures et 4 sur les pattes postérieures[1].
Les Canidés sauvages sont présents sur tous les continents à l'exception de l'Antarctique et peuplent une grande variété d'habitats, dont les déserts, les massifs montagneux, les forêts et les prairies. Ils présentent des tailles variables, du Fennec qui peut ne pas dépasser 24 cm de long et peser 0,6 kg[2] au Loup gris qui peut atteindre 160 cm de long et dépasser 70 kg[3]. Seuls le Renard gris, le Renard gris insulaire (étroitement apparenté au premier)[4] et le Chien viverrin sont capables de grimper aux arbres[5],[6],[7].
Tous les Canidés ont la même forme de base, bien que les tailles relatives du museau, des membres, des oreilles et de la queue varient considérablement d'une espèce à l'autre. Les Canidés ont des pattes relativement longues et un corps souple, adapté à la chasse, à l'exception du chien des buissons, du chien viverrin et de certaines races de chiens domestiques. La queue est touffue et la longueur du pelage change avec la saison. Le museau est nettement plus allongé que celui des félins. Les arcades zygomatiques sont larges, le crâne présente une crête lambdoïde transversale à l'arrière et chez quelques espèces, une crête sagittale. L'orbite osseuse autour de l’œil ne forme jamais un anneau complet et les bulles tympanales sont lisses et arrondies[8]. Les femelles ont trois à sept paires de mamelles[9].

Tous les Canidés sont digitigrades (ils marchent sur les orteils). L'extrémité du nez, la truffe, est toujours dépourvue de poils, tout comme les coussinets sous les pattes. Ces derniers sont situés sous chaque doigt tandis qu'un coussinet plus grand est situé sous l'extrémité des doigts. Des poils poussent entre les coussinets et chez le Renard polaire le dessous des pattes est même couvert d'une fourrure dense à certaines périodes de l'année. Les Canidés ont cinq doigts sur les pattes antérieures (à l'exception du lycaon qui en a quatre), mais le pouce est atrophié et ne touche pas le sol. Les pattes postérieures ont quatre doigts mais certains chiens domestiques présentent un cinquième doigt atrophié qui n'a cependant aucune connexion anatomique avec le reste du membre. Les griffes incurvées ne sont pas rétractiles et sont plus ou moins émoussées[8].
Le pénis chez le mâle contient un os, le baculum. Il contient également une structure à la base appelée bulbe glandis, qui aide à créer un lien copulatoire pendant l'accouplement, enfermant les animaux ensemble pendant jusqu'à une heure[10]. Les jeunes Canidés naissent aveugles, leurs yeux s'ouvrant quelques semaines après la naissance[11]. Tous les Canidés actuels (famille des Caninae) ont un ligament similaire au ligament nuchal des Ungulata et qui sert à maintenir la position de la tête et du cou avec peu d'effort musculaire. Ce ligament permet d'économiser de l'énergie lorsque l'animal parcourt de grandes distances tout en maintenant le nez au sol pour suivre une piste. Cependant, d'après les détails des os du cou, il semble qu'au moins certains des Borophaginae (tel que Aelurodon) aient été dépourvus de ce ligament[12].
Denture
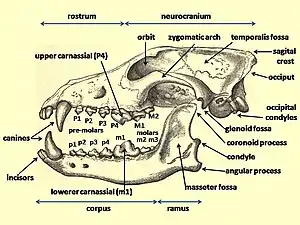

La denture désigne la disposition des dents dans la bouche. La formule dentaire de la mâchoire supérieure est notée en lettres majuscules, I pour les incisives, C pour les canines, P pour les prémolaires et M pour les molaires, tandis que les lettres minuscules i, c, p et m sont utilisées pour les dents de la mâchoire inférieure. Les dents de chaque côté de la bouche sont numérotées à partir des dents de devant jusqu'aux dents de derrière. Chez les carnivores, les carnassières correspondent à la prémolaire supérieure P4 et à la molaire inférieure m1 et sont utilisées ensemble pour trancher les muscles et les tendons de la proie[13].
Les Canidés utilisent leurs prémolaires pour la coupe et l'écrasement, à l'exception de la quatrième prémolaire supérieure P4 (la carnassière supérieure) qui n'est utilisée que pour la coupe. Ils utilisent leurs molaires pour le broyage à l'exception de la première molaire inférieure m1 (la carnassière inférieure) qui a évolué à la fois pour le découpage et le broyage en fonction de l'adaptation alimentaire du canidé. Sur le carnassier inférieur, le trigonide est utilisé pour le tranchage et le talonide est utilisé pour le broyage. Le rapport entre le trigonide et le talonide indique les habitudes alimentaires d'un carnivore, un trigonide plus grand indiquant un hypercarnivore et un talonide plus grand indiquant un régime plus omnivore[14], [15]. En raison de sa faible variabilité, la longueur du carnassier inférieur est utilisée pour fournir une estimation de la taille du corps d'un carnivore[14].
La plupart des Canidés ont 42 dents suivant la formule 3.1.4.23.1.4.3, mais le Chien des buissons n'a qu'une seule paire de molaires supérieures et deux inférieures, le Dhole en a deux supérieures et deux inférieures, et le Renard à oreilles de chauve-souris a trois ou quatre paires de molaires supérieures et quatre inférieures[8]. Les molaires sont puissantes chez la plupart des espèces et leur permettent de casser les os pour atteindre la moelle. La formule des dents de lait chez les Canidés est 3.1.33.1.3, les molaires étant complètement absentes[8].
Une étude portant sur une estimation de la puissance de la morsure parmi un large échantillon de mammifères prédateurs, a découvert que rapporté à la masse corporelle, le canidé qui avait la morsure la plus puissante était Canis dirus (163) suivi par quatre canidés modernes hypercarnivores qui s'attaquent souvent à des proies plus grosses qu'eux : le Lycaon (142), le Loup gris (136), le Dhole (112) et le Dingo (108). La taille maximale des proies d'un prédateur dépend fortement de ses limites biomécaniques[16].
Comportements
Comportement social

Presque tous les Canidés sont des animaux sociaux et vivent en groupe. En général, ils sont territoriaux ou ont un domaine vital et dorment à l'air libre, n'utilisant leurs tanières que pour la reproduction et parfois par mauvais temps[17]. Chez la plupart des renards, et chez beaucoup de vrais chiens, un couple travaille ensemble pour chasser et élever leurs petits. Les loups gris et certains autres grands canidés vivent en groupes plus importants appelés meutes. Les chiens sauvages africains ont des meutes qui peuvent comprendre de 20 à 40 animaux et des meutes de moins d'environ sept individus peuvent être incapables de se reproduire avec succès[18]. La chasse en meute a l'avantage de pouvoir s'attaquer à des proies plus grosses. Certaines espèces forment des meutes ou vivent en petits groupes familiaux selon les circonstances, notamment le type de nourriture disponible. Chez la plupart des espèces, certains individus vivent seuls. Au sein d'une meute de canidés, il existe un système de dominance pour que les animaux les plus forts et les plus expérimentés mènent la meute. Dans la plupart des cas, le mâle et la femelle dominants sont les seuls membres de la meute à se reproduire[19].
Les Canidés communiquent entre eux par des signaux olfactifs, par des indices visuels et des gestes, et par des vocalisations telles que des grognements, des aboiements et des hurlements. Dans la plupart des cas, les groupes ont un territoire d'origine d'où ils chassent d'autres congénères. Le territoire est marqué en laissant des marques d'odeur d'urine, qui avertissent les individus intrusifs[20]. Le comportement social est également médié par les sécrétions des glandes sur la surface supérieure de la queue près de sa racine et des glandes anales[19], des glandes préputiales[21], et des glandes supracaudales[22].
Reproduction
.jpg.webp)
.jpg.webp)

Les Canidés en tant que groupe présentent plusieurs traits de reproduction qui sont rares chez les mammifères dans leur ensemble. Ils sont généralement monogames, fournissent des soins paternels à leur progéniture, ont des cycles de reproduction avec de longues phases prœstrales et diœstrales et ont un lien copulatoire pendant l'accouplement. Ils retiennent également la progéniture adulte dans le groupe social, supprimant leur capacité à se reproduire tout en utilisant les soins alloparentaux qu'ils peuvent fournir pour aider à élever la prochaine génération de progéniture[23].
Pendant la période prœstrale, des niveaux accrus d'estradiol rendent la femelle attirante pour le mâle. Il y a une augmentation de la progestérone pendant la phase œstrale lorsque la femelle est réceptive. À la suite de cela, le niveau d'œstradiol fluctue et il y a une longue phase diœstrale pendant laquelle la femelle est enceinte. La pseudo-grossesse survient fréquemment chez les canidés qui ont ovulé mais n'ont pas réussi à concevoir. Une période d'anœstrus suit la gestation ou la pseudo-grossesse, il n'y a qu'une seule période œstrale au cours de chaque saison de reproduction. Les canidés de petite et moyenne taille ont pour la plupart une période de gestation de 50 à 60 jours, tandis que les espèces plus grandes ont en moyenne 60 à 65 jours. La période de l'année à laquelle la saison de reproduction a lieu est liée à la longueur du jour, comme cela a été démontré dans le cas de plusieurs espèces qui ont été déplacées de l'équateur vers l'autre hémisphère et connaissent un décalage de phase de six mois. Les chiens domestiques et certains petits canidés en captivité peuvent entrer en œstrus plus fréquemment, peut-être parce que le stimulus photopériodique se décompose dans des conditions d'éclairage artificiel[23].
La taille d'une portée varie, de un à 16 chiots ou plus naissent. Les jeunes naissent petits, aveugles et impuissants et nécessitent une longue période de soins parentaux. Ils sont conservés dans une tanière, le plus souvent creusée dans le sol, pour plus de chaleur et de protection[8]. Lorsque les jeunes commencent à manger de la nourriture solide, les deux parents, et souvent d'autres membres de la meute, leur rapportent de la nourriture de la chasse. C'est le plus souvent vomi de l'estomac de l'adulte. Lorsqu'une telle implication de la meute dans l'alimentation de la portée se produit, le taux de réussite de reproduction est plus élevé que dans le cas où les femelles se séparent du groupe et élèvent leurs petits de manière isolée[24]. Les jeunes canidés peuvent mettre un an à mûrir et à acquérir les compétences dont ils ont besoin pour survivre[25]. Chez certaines espèces, comme le chien sauvage d'Afrique, la progéniture mâle reste généralement dans la meute natale, tandis que les femelles se dispersent en groupe et rejoignent un autre petit groupe du sexe opposé pour former une nouvelle meute[26].
Taxinomie
Dans l'histoire des carnivores, la famille des Canidae est représentée par les deux sous-familles éteintes désignées comme Hesperocyoninae et Borophaginae, et la sous-famille existante des Caninae[27]. Cette sous-famille comprend tous les canidés vivants et leurs parents fossiles les plus récents[28]. Tous les Canidés vivants en tant que groupe forment un groupe dentaire monophylétique avec les borophaginés éteints, les deux groupes ayant une prémolaire (deux points) sur la molaire carnassière inférieur, ce qui confère à cette dent une capacité supplémentaire de mastication. Ceci, avec le développement d'une cuspide entoconide distincte et l'élargissement du talonide de la première molaire inférieure, et l'élargissement correspondant du talon de la première molaire supérieure et la réduction de son parastyle distinguent ces canidés du Cénozoïque tardif et sont les différences essentielles qui identifient leur clade[28].
Les feliformia ressemblant à des chats et les caniformes ressemblant à des chiens ont émergé au sein des Carnivoramorpha voici 45-42 millions d'années[29]. Les Canidés sont apparus pour la première fois en Amérique du Nord à l'Éocène supérieur (37,8-33,9 Ma). Ils n'atteignirent l'Eurasie qu'au Miocène ou l'Amérique du Sud avant le Pliocène supérieur[28].
Classification
Genres et espèces actuelles
Liste des espèces actuelles selon l'ITIS[30], basé sur Mammal Species of the World (MSW3)[31] :
- genre Atelocynus :
- Atelocynus microtis (Chien des buissons aux oreilles courtes)
- genre Canis :
- Canis anthus (Loup doré)
- Canis adustus(Chacal à flancs rayés)
- Canis aureus (Chacal doré)
- Canis latrans (Coyote)
- Canis lupus (Loup, chien)
- Canis mesomelas (Chacal à chabraque)
- Canis simensis (Loup d'Éthiopie ou Loup d'Abyssinie)
- genre Cerdocyon :
- Cerdocyon thous (Renard des savanes)
- genre Chrysocyon :
- Chrysocyon brachyurus (Loup à crinière)
- genre Cuon :
- Cuon alpinus (Dhole)
- genre Dusicyon
- Dusicyon australis (Loup des Malouines)
- genre Lycalopex :
- Lycalopex culpaeus (Renard de Magellan)
- Lycalopex fulvipes (Renard de Darwin)
- Lycalopex griseus (Renard gris d'Argentine)
- Lycalopex gymnocercus (Renard d'Aszara)
- Lycalopex sechurae (Renard du désert austral)
- Lycalopex vetulus (Renard chenu)
- genre Lycaon :
- Lycaon pictus (Lycaon)
- genre Nyctereutes :
- Nyctereutes procyonoides (Chien viverrin)
- genre Otocyon :
- Otocyon megalotis (Renard à oreilles de chauve-souris ou Otocyon)
- genre Speothos :
- Speothos venaticus (Chien des buissons)
- genre Urocyon :
- Urocyon cinereoargenteus (Renard gris d'Amérique)
- Urocyon littoralis (Renard gris insulaire)
- genre Vulpes :
- Vulpes bengalensis (Renard du Bengale)
- Vulpes cana (Renard de Blanford)
- Vulpes chama (Renard du Cap)
- Vulpes corsac (Renard corsac)
- Vulpes ferrilata (Renard du Tibet)
- Vulpes lagopus (Renard arctique)
- Vulpes macrotis (Renard nain)
- Vulpes pallida (Renard pâle)
- Vulpes rueppellii (Renard de Rüppell)
- Vulpes velox (Renard véloce)
- Vulpes vulpes (Renard roux)
- Vulpes zerda (Fennec)
Les espèces du Chacal à flancs rayés et du Chacal à chabraque ont été proposé dans le genre à part Lupulella Hilzheimer, 1906[32],[33],[34].
Toutes les espèces actuelles font partie de la sous-famille des Caninés (Caninae).
Taxons fossiles
Sous-familles
Liste des sous-famille fossiles selon la Paleobiology Database[35] :
- sous-famille † Hesperocyoninae Tedford 1978
- sous-famille † Borophaginae Simpson, 1945
Le détail des genres fossiles est disponible sur les articles de ces sous-familles.
Genres des Caninés
La sous-famille des Caninés (Caninae), qui comprend les espèces actuelles, contient également de nombreux genres éteints.
Classification des genres fossiles et actuels de Caninés d'après Wang Xiaoming, et al. (2008)[36], Zrzavý et al. (2018)[37] et la Paleobiology Database[35] :
Sous-famille Caninae Gill, 1872 :
- † Leptocyon Matthew, 1918 (genre basal paraphylétique)
- tribu † Canini Fischer de Waldheim, 1817 :
- sous-tribu Canina Gray, 1825 :
- († Aenocyon Merriam, 1918 pour Canis dirus)
- Canis Linnaeus, 1758 (paraphylétique)
- Cuon Hodgson, 1838
- † Cynotherium Studiati, 1857
- † Eucyon Tedford and Qiu, 1996
- Lupulella Hilzheimer, 1906
- Lycaon Brookes, 1827
- † Xenocyon Kretzoi, 1938
- sous-tribu † Cerdocyonina Tedford et al., 2009 :
- Atelocynus Cabrera, 1940
- Cerdocyon Hamilton-Smith, 1839
- Chrysocyon Hamilton-Smith, 1839
- Dusicyon Hamilton Smith, 1839
- Lycalopex Burmeister, 1854
- † Protocyon Giebel, 1855
- Speothos Lund, 1839
- † Theriodictis Mercerat, 1891
- † Sinicuon Kretzoi, 1941
- sous-tribu Canina Gray, 1825 :
- tribu Vulpini Hemprich and Ehrenberg, 1832 :
- † Ferrucyon Ruiz-Ramoni et al., 2020
- † Nurocyon Sotnikova, 2006
- Nyctereutes Temminck, 1839 (position incertaine)
- † Metalopex Tedford et Wang, 2008
- Otocyon Müller, 1835
- † Prototocyon Pohle, 1928
- Urocyon Baird, 1857
- Vulpes Frisch, 1775
Dans la phylogénie de 2018, le clade regroupant les genres † Metalopex et Urocyon est basal par rapport aux deux tribus.
Phylogénie
Position phylogénétique des Canidés au sein des Caniformes, sur la base de découvertes de fossiles[28] :
| Caniformia |
| ||||||||||||||||||||||||
Origine et évolution

Les canidés actuels constituent un groupe de 34 espèces de taille et d'apparence variées, du Loup à crinière à la silhouette élancée au Chien des buissons court sur patte. Les relations évolutives entre les espèces ont été étudiées à travers la morphologie, mais aussi plus récemment en recourant à des études moléculaires. Chez certaines espèces la divergence génétique a disparu en raison d'un important flux génétique entre différentes populations[38].
Éocène
Les carnivores ont évolué à partir des Miacidae il y a environ 55 millions d'années, pendant le Paléocène tardif. Environ 5 millions d'années plus tard, les carnivores se sont séparés en deux branches principales, les caniformes et les féliformes. Le premier véritable canidé est apparu il y a environ 40 millions d'années. Appelé Prohesperocyon (en), ses restes ont été découverts dans le sud-ouest de l'actuel Texas. Il présentait des traits caractéristiques des Canidés, notamment la perte de la troisième molaire supérieure (qui contribue à rendre la morsure plus cisaillante), et la structure de l'oreille moyenne qui possède un os tympanal élargi (structure osseuse creuse qui protège les parties les plus fragiles de l'oreille). Prohesperocyon avait probablement des membres légèrement plus longs que ses prédécesseurs, ainsi que des orteils parallèles et serrés les uns contre les autres qui diffèrent notablement des doigts écartés des ours[39].
Les Canidés se sont ensuite subdivisés en trois sous-familles, toutes apparues pendant l'Éocène : Hesperocyoninae (environ 39.7- 15 millions d'années), Borophaginae (environ 34 - 2 millions d'années) et Caninae (environ 34 millions d'années à aujourd'hui). Les Caninae sont la seule sous-famille encore existante et inclut les loups, les renards, les coyotes, les chacals et les chiens domestiques. Les membres de chaque sous-famille ont gagné en masse avec le temps et certains présentaient un régime spécialisé hypercarnivore qui a favorisé leur extinction[40].
Oligocène
Pendant l'Oligocène, les trois sous-familles de Canidés (Hesperocyoninae, Borophaginae, et Caninae) sont présentes en Amérique du Nord, d'après les fossiles conservés. La branche la plus ancienne et la plus primitive des Canidés est celle des Hesperocyoninae, qui inclut le genre Mesocyon (38-24 millions d'années). Ces canidés primitifs étaient probablement adaptés à la poursuite rapide de proies dans un milieu de prairie ; ils ressemblaient aux actuels viverrides. Les Hesperocyonines ont fini par disparaître au milieu du Miocène. Certains des premiers membres des Hesperocyonines, les espèces du genre Hesperocyon, ont donné naissance aux genres Archaeocyon et Leptocyon. Ces branches ont ensuite mené aux Borophagines et aux Caninés[41].
Miocène
Il y a environ 9-10 millions d'années, pendant le Miocène tardif, les genres Canis, Urocyon et Vulpes ont commencé leur expansion à partir du Sud-Ouest de l'Amérique du Nord, là où les caninés ont commencé à se diversifier. Le succès de ces caninés est lié à l'apparition des carnassières inférieures leur permettant à la fois de mastiquer et d'arracher la viande[41] . Il y a environ 8 millions d'années, le pont terrestre de la Béringie a permis aux membres du genre Eucyon d'atteindre l'Asie puis l'Europe[42].
Pliocène
Pendant le Pliocène, il y a environ 4-5 millions d'années, Canis lepophagus est apparu en Amérique du Nord. Cette espèce était de petite taille, certains spécimens ressemblaient aux coyotes et d'autres aux loups. Canis latrans (le coyote) pourrait descendre de Canis lepophagus[43].
La formation de l'isthme de Panama il y a environ 3 millions d'années, en reliant les deux Amériques, a permis aux Canidés d'atteindre l'Amérique du Sud où ils se sont diversifiés. Cependant l'ancêtre commun le plus récent des canidés sud-américains vivait en Amérique du Nord il y a 4 millions d'années et il est probable qu'il y eut plus d'un passage à travers l'isthme. L'une des lignées issues de cette migration comprend le renard gris (Urocyon cinereoargentus) ainsi que Canis dirus, maintenant éteint. Une autre lignée est composée d'espèces endémiques de l'Amérique du Sud : le Loup à crinière (Chrysocyon brachyurus), le Chien des buissons aux oreilles courtes (Atelocynus microtis), le Chien des buissons (Speothos venaticus), le Renard crabier (Cerdocyon thous) et les renards sud-américains (Lycalopex spp.). La phylogénie de ce groupe a été établie grâce à des études moléculaires[42].
Pléistocène
Durant le Pléistocène est apparu la lignée du loup d'Amérique du Nord avec Canis edwardii, clairement identifié comme un loup, et Canis rufus, un probable descendant de Canis edwardii. Il y a 800 000 ans environ Canis armbrusteri est apparu en Amérique du Nord. Ce grand loup était présent dans toute l'Amérique du Nord et l'Amérique centrale avant d'être supplanté par son descendant, Canis dirus, qui atteignit l'Amérique du Sud à la fin du Pléistocène[44].
Il y a 300 000 ans un certain nombre de sous-espèces du loup gris (Canis lupus) étaient apparues à travers l'Europe et le Nord de l'Asie[45]. Le loup gris a colonisé l'Amérique du Nord à la fin du Rancholabréen en traversant le pont de la Béringie. Il y eut au moins trois passages différents, chacun ayant été effectué par au moins un clade du loup gris d'Eurasie[46]. L'étude de l'ADN mitochondrial montre qu'il existe actuellement au moins quatre lignée de Canis lupus[47]. Canis dirus cohabita un temps avec Canis lupus mais disparut lors de l'extinction massive qui survint il y a 11 500 ans. Ce canidé était probablement plus un charognard qu'un prédateur : il semble que ses molaire étaient faites pour écraser les os et il a probablement été victime de la disparition des grands herbivores dont les charognes l'alimentaient[44].
En 2015, une étude portant sur le génome mitochondrial et le génome nucléaire des canidés d'Afrique et d'Eurasie a établi que les Canidés avaient colonisé l'Afrique depuis l'Eurasie au moins cinq fois au cours du Pliocène et du Pléistocène, ce que confirme les découvertes de fossiles. Cela suggère que la diversité des canidés africains est le résultat de vagues d'immigration de canidés eurasiatiques, probablement à l'occasion des changements climatiques (entre climat aride et climat humide) du Pliocène et du Pléistocène. Après avoir comparé les Chacals dorés d'Afrique et d'Eurasie, l'étude conclut que les spécimens africains appartiennent à une lignée monophylétique distincte qui devrait être reconnue comme une espèce à part entière, Canis anthus (le Loup doré). D'après une étude phylogénétique effectuée à partir de séquences d'ADN nucléaire, le Chacal doré d'Eurasie (Canis aureus) s'est séparé de la lignée du loup et du coyote il y a 1,9 million d'années, alors que le Loup doré s'en est séparé il y a 1,3 million d'années. Les séquences du génome mitochondrial indique que le Loup d'Abyssinie a divergé de la lignée du loup et du coyote peu de temps avant[48].
Canidés et humains

Un canidé, le chien domestique, a noué un partenariat avec les humains il y a longtemps. Le chien a été la première espèce domestiquée[49],[50],[51],[52]. Les archives archéologiques montrent que les premiers restes de chiens incontestés ont été enterrés à côté des humains il y a 14 700 ans[53], avec des restes contestés il y a 36 000 ans[54]. Ces dates impliquent que les premiers chiens sont apparus à l'époque des chasseurs-cueilleurs humains et non des agriculteurs[55],[56].
Le fait que les loups soient des bêtes de somme avec des structures sociales coopératives peut avoir été la raison pour laquelle la relation s'est développée. Les humains ont bénéficié de la loyauté, de la coopération, du travail d'équipe, de la vigilance et des capacités de suivi du canidé, tandis que le loup a peut-être bénéficié de l'utilisation d'armes pour s'attaquer à des proies plus grosses et du partage de nourriture. Les humains et les chiens peuvent avoir évolué ensemble[57].
Parmi les Canidés, seul le loup gris est connu pour s'attaquer aux humains[58]. Néanmoins, au moins deux enregistrements de coyotes tuant des humains ont été publiés[59], et au moins deux autres rapports de chacals dorés tuant des enfants[60]. Les êtres humains ont piégé et chassé certaines espèces de Canidés pour leur fourrure et d'autres, en particulier le loup gris, le coyote et le renard roux, pour le sport[61]. Les Canidés tels que le dhole sont maintenant menacés dans la nature en raison de la persécution, de la perte d'habitat, de l'épuisement des espèces de proies d'ongulés et de la transmission de maladies par les chiens domestiques[62].
Galerie
 Atelocynus microtis
Atelocynus microtis Dusicyon australis
Dusicyon australis
 Cerdocyon thous
Cerdocyon thous

.jpg.webp)
.jpg.webp)
%252C_Laguna_Colorada%252C_Bolivia%252C_2016-02-02%252C_DD_101.JPG.webp) Lycalopex culpaeus
Lycalopex culpaeus Speothos venaticus
Speothos venaticus Otocyon megalotis
Otocyon megalotis Urocyon cinereoargenteus
Urocyon cinereoargenteus
 Fossile de Eucyon davisi
Fossile de Eucyon davisi
Références taxinomiques
- (en) Référence Animal Diversity Web : Canidae (consulté le )
- (en) Référence Fauna Europaea : Canidae (consulté le )
- (fr+en) Référence ITIS : Canidae Fischer, 1817 (consulté le )
- (en) Référence Mammal Species of the World (3e éd., 2005) : Canidae Fischer, 1817 (consulté le )
- (en) Référence North American Mammals : Canidae (consulté le )
- (en) Référence NCBI : Canidae (taxons inclus) (consulté le )
- (en) Référence Tree of Life Web Project : Canidae (consulté le )
- (en) Référence Paleobiology Database : Canidae Fischer 1817 (consulté le )
- (en) Référence World Register of Marine Species : Canidae Fischer, 1817 (+ liste genres + liste espèces) (consulté le )
Liens externes
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- (en) Animal Diversity Web
- (en) Australian Faunal Directory
- (sv) Dyntaxa
- (en) EPPO Global Database
- (en) EU-nomen
- (en) Fauna Europaea
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) Mammal Species of the World
- (en) NBN Atlas
- (nl) Nederlands Soortenregister
- (en + en) New Zealand Organisms Register
- (en) Système d'information taxonomique intégré
- (en) World Register of Marine Species
- Ressource relative à la santé :
Notes et références
- ↑ « Canidae », sur /kimura.univ-montp2.fr
- ↑ Marc Tyler Nobleman, Foxes, Marshall Cavendish, (ISBN 978-0-7614-2237-2, lire en ligne), p. 35
- ↑ Heptner, V. G.; Naumov, N. P. (1998), Mammals of the Soviet Union Vol. II Part 1a, Sirenia and Carnivora (Sea cows; Wolves and Bears), Science Publishers, Inc. USA., pp. 166–176, (ISBN 1-886106-81-9)
- ↑ « ADW: Urocyon littoralis: Information », Animaldiversity.ummz.umich.edu, (consulté le )
- ↑ Kauhala, K.; Saeki, M. (2004). Raccoon Dog«. Canid Species Accounts. IUCN/SSC Canid Specialist Group. Pridobljeno 15 April 2009.
- ↑ Ikeda, Hiroshi, « Old dogs, new tricks: Asia's raccoon dog, a venerable member of the canid family is pushing into new frontiers », Natural History, vol. 95, no #8, , p. 40, 44
- ↑ « Raccoon dog – Nyctereutes procyonoides. WAZA – World Association of Zoos and Aquariums. » [archive du ] (consulté le )
- 1 2 3 4 5 St. George Jackson Mivart, Dogs, Jackals, Wolves, and Foxes: A Monograph of the Canidae, London : R.H. Porter : Dulau, , xiv–xxxvi (lire en ligne)
- ↑ Ronald M. Nowak, Walker's Carnivores of the World, JHU Press, (ISBN 978-0-8018-8032-2, lire en ligne)
- ↑ Ewer, R. F., The Carnivores, Cornell University Press, (ISBN 978-0-8014-8493-3, lire en ligne)
- ↑ Macdonald, D., The Encyclopedia of Mammals, New York, Facts on File, (ISBN 978-0-87196-871-5, lire en ligne), 57
- ↑ Wang et Tedford 2008, p. 97–98.
- ↑ Wang et Tedford 2008, p. 74.
- 1 2 Gabriele Sansalone, Davide Federico Bertè, Leonardo Maiorino et Luca Pandolfi, « Evolutionary trends and stasis in carnassial teeth of European Pleistocene wolf Canis lupus (Mammalia, Canidae) », Quaternary Science Reviews, vol. 110, , p. 36–48 (DOI 10.1016/j.quascirev.2014.12.009)
- ↑ Marco Cherin, Davide Federico Bertè, Raffaele Sardella et Lorenzo Rook, « Canis etruscus (Canidae, Mammalia) and its role in the faunal assemblage from Pantalla (Perugia, central Italy): comparison with the Late Villafranchian large carnivore guild of Italy », Bollettino della Società Paleontologica Italiana, vol. 52, no #1, , p. 11–18 (lire en ligne)
- ↑ S. Wroe, C. McHenry et J. Thomason, « Bite club: Comparative bite force in big biting mammals and the prediction of predatory behaviour in fossil taxa », Proceedings of the Royal Society B: Biological Sciences, vol. 272, no #1563, , p. 619–25 (PMID 15817436, PMCID 1564077, DOI 10.1098/rspb.2004.2986)
- ↑ Stephen Harris et Derek Yalden, Mammals of the British Isles, Mammal Society, , 4th revised éd. (ISBN 978-0-906282-65-6), p. 413
- ↑ McConnell, Patricia B., « Comparative canid behaviour », sur The other end of the leash, (consulté le )
- 1 2 « Canidae: Coyotes, dogs, foxes, jackals, and wolves », sur Animal Diversity Web, University of Michigan (consulté le )
- ↑ Nowak, R. M.; Paradiso, J. L. 1983. Walker's Mammals of the World. Baltimore, Maryland: The Johns Hopkins University Press. (ISBN 0-8018-2525-3).
- ↑ Van Heerden, Joseph. "The role of integumental glands in the social and mating behaviour of the hunting dog Lycaon pictus (Temminck, 1820)." (1981).
- ↑ Fox, Michael W., and James A. Cohen. "Canid communication." How animals communicate (1977): 728-748.
- 1 2 A review of Small Canid Reproduction: in The Swift Fox: Ecology and Conservation of Swift Foxes in a Changing World, University of Regina Press, , 117–123 p. (ISBN 978-0-88977-154-3, lire en ligne)
- ↑ The Behavioural Biology of Dogs, CABI, , 158–159 p. (ISBN 978-1-84593-188-9, lire en ligne)
- ↑ Voelker, W. 1986. The Natural History of Living Mammals. Medford, New Jersey: Plexus Publishing. (ISBN 0-937548-08-1)
- ↑ « Lycaon pictus », sur Animal Info: Endangered animals of the world, (consulté le )
- ↑ Adam Miklosi, Dog Behaviour, Evolution, and Cognition, Oxford University Press, coll. « Oxford Biology », , 2nd éd., 103–107 p. (ISBN 978-0199545667, lire en ligne)
- 1 2 3 4 Richard Tedford, Xiaoming Wang et Beryl E. Taylor, « Phylogenetic systematics of the North American fossil Caninae (Carnivora: Canidae) », Bulletin of the American Museum of Natural History, vol. 325, , p. 1–218 (DOI 10.1206/574.1, hdl 2246/5999, S2CID 83594819, lire en ligne)
- ↑ John J. Flynn et Gina D. Wesley-Hunt, « Phylogeny of the Carnivora: Basal Relationships Among the Carnivoramorphans, and Assessment of the Position of 'Miacoidea' Relative to Carnivora », Journal of Systematic Palaeontology, vol. 3, , p. 1–28 (DOI 10.1017/s1477201904001518, S2CID 86755875)
- ↑ Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 1er août 2023
- ↑ Mammal Species of the World, 3 rd edition (MSW3), 2007
- ↑ Francisco Alvares, Wieslaw Bogdanowicz, Liz A.D. Campbell, Rachel Godinho, Jennifer Hatlauf, Yadvendradev V. Jhala, Andrew C. Kitchener, Klaus-Peter Koepfli, Miha Krofel, Patricia D. Moehlman, Helen Senn, Claudio Sillero-Zubiri, Suvi Viranta et Geraldine Werhahn, « Old World Canis spp. with taxonomic ambiguity: Workshop conclusions and recommendations. CIBIO. Vairão, Portugal, 28th - 30th May 2019 », sur IUCN/SSC Canid Specialist Group, (consulté le )
- ↑ José R. Castelló, Canids of the world : wolves, wild dogs, foxes, jackals, coyotes, and their relatives, (ISBN 978-0-691-18541-5, 0-691-18541-7 et 978-0-691-18372-5, OCLC 1043555560, lire en ligne)
- ↑ « Mammal Diversity Database », American Society of Mammalogists (consulté le )
- 1 2 Fossilworks Paleobiology Database, consulté le 1er août 2023
- ↑ (en) Wang Xiaoming, Antón Mauricio et Richard H. Tedford, Dogs : their fossil relatives and evolutionary history [« Les chiens : leurs parents fossiles et leur histoire évolutive »], New York, Columbia University Press, (ISBN 978-0-231-13528-3, OCLC 185095648, lire en ligne)
- ↑ https://onlinelibrary.wiley.com/doi/abs/10.1111/zsc.12293
- ↑ Wayne, Robert K., « Molecular evolution of the dog family » (consulté le )
- ↑ Xiaoming Wang, « How Dogs Came to Run the World », Natural History Magazine, vol. July/August, (lire en ligne, consulté le )
- ↑ B. Van Valkenburgh, X. Wang et J. Damuth, « Cope's Rule, Hypercarnivory, and Extinction in North American Canids », Science, vol. 306, no #5693, , p. 101–104 (ISSN 0036-8075, PMID 15459388, DOI 10.1126/science.1102417, Bibcode 2004Sci...306..101V, S2CID 12017658)
- 1 2 Martin, L.D. 1989. Fossil history of the terrestrial carnivora. Pages 536–568 in J.L. Gittleman, editor. Carnivore Behavior, Ecology, and Evolution, Vol. 1. Comstock Publishing Associates: Ithaca.
- 1 2 Perini, F. A., Russo, C. A. M. et Schrago, C. G., « The evolution of South American endemic canids: a history of rapid diversification and morphological parallelism », Journal of Evolutionary Biology, vol. 23, no #2, , p. 311–322 (PMID 20002250, DOI 10.1111/j.1420-9101.2009.01901.x, S2CID 20763999)
- ↑ Nowak, R.M. 1979. North American Quaternary Canis. Monograph of the Museum of Natural History, University of Kansas 6:1 – 154.
- 1 2 Larson, Robert, « Wolves, coyotes and dogs (Genus Canis) », sur The Midwestern United States 16,000 years ago, Illinois State Museum (consulté le )
- ↑ Nowak, R. 1992. "Wolves: The great travelers of evolution". International Wolf 2 (#4):3 – 7.
- ↑ Chambers, S. M., Fain, S. R., Fazio, B. et Amaral, M., « An account of the taxonomy of North American wolves from morphological and genetic analyses », North American Fauna, vol. 77, , p. 1–67 (DOI 10.3996/nafa.77.0001
 )
) - ↑ Gaubert, P., Bloch, C., Benyacoub, S., Abdelhamid, A., Pagani, P. et al., « Reviving the African Wolf Canis lupus lupaster in North and West Africa: A Mitochondrial Lineage Ranging More than 6,000 km Wide », PLOS ONE, vol. 7, no #8, , e42740 (PMID 22900047, PMCID 3416759, DOI 10.1371/journal.pone.0042740
 , Bibcode 2012PLoSO...742740G)
, Bibcode 2012PLoSO...742740G) - ↑ Klaus-Peter Koepfli, John Pollinger, Raquel Godinho, Jacqueline Robinson, Amanda Lea, Sarah Hendricks, Rena M. Schweizer, Olaf Thalmann, Pedro Silva, Zhenxin Fan, Andrey A. Yurchenko, Pavel Dobrynin, Alexey Makunin, James A. Cahill, Beth Shapiro, Francisco Álvares, José C. Brito, Eli Geffen, Jennifer A. Leonard, Kristofer M. Helgen, Warren E. Johnson, Stephen J. o'Brien, Blaire Van Valkenburgh et Robert K. Wayne, « Genome-wide Evidence Reveals that African and Eurasian Golden Jackals Are Distinct Species », Current Biology, vol. 25, no #16, , p. 2158–65 (PMID 26234211, DOI 10.1016/j.cub.2015.06.060
 )
) - ↑ Larson G, Bradley DG, « How Much Is That in Dog Years? The Advent of Canine Population Genomics », PLOS Genetics, vol. 10, no #1, , e1004093 (PMID 24453989, PMCID 3894154, DOI 10.1371/journal.pgen.1004093)
- ↑ Larson G, « Rethinking dog domestication by integrating genetics, archeology, and biogeography », PNAS, vol. 109, no #23, , p. 8878–8883 (PMID 22615366, PMCID 3384140, DOI 10.1073/pnas.1203005109
 , Bibcode 2012PNAS..109.8878L)
, Bibcode 2012PNAS..109.8878L) - ↑ « Domestication », dans Encyclopædia Britannica, (lire en ligne) (consulté le )
- ↑ Angela Perri, « A wolf in dog's clothing: Initial dog domestication and Pleistocene wolf variation », Journal of Archaeological Science, vol. 68, , p. 1–4 (DOI 10.1016/j.jas.2016.02.003)
- ↑ Liane Giemsch, Susanne C. Feine, Kurt W. Alt, Qiaomei Fu, Corina Knipper, Johannes Krause, Sarah Lacy, Olaf Nehlich, Constanze Niess, Svante Pääbo, Alfred Pawlik, Michael P. Richards, Verena Schünemann, Martin Street, Olaf Thalmann, Johann Tinnes, Erik Trinkaus & Ralf W. Schmitz. "Interdisciplinary investigations of the late glacial double burial from Bonn-Oberkassel". Hugo Obermaier Society for Quaternary Research and Archaeology of the Stone Age: 57th Annual Meeting in Heidenheim, 7th – 11 April 2015, 36-37
- ↑ Germonpre, M., « Fossil dogs and wolves from Palaeolithic sites in Belgium, the Ukraine and Russia: Osteometry, ancient DNA and stable isotopes », Journal of Archaeological Science, vol. 36, no #2, , p. 473–490 (DOI 10.1016/j.jas.2008.09.033)
- ↑ Thalmann, O., « Complete mitochondrial genomes of ancient canids suggest a European origin of domestic dogs », Science, vol. 342, no #6160, , p. 871–4 (PMID 24233726, DOI 10.1126/science.1243650, Bibcode 2013Sci...342..871T, S2CID 1526260, lire en ligne)
- ↑ Freedman, A., « Genome sequencing highlights the dynamic early history of dogs », PLOS Genetics, vol. 10, no #1, , e1004016 (PMID 24453982, PMCID 3894170, DOI 10.1371/journal.pgen.1004016)
- ↑ Schleidt, Wolfgang M. et Shalter, Michael D., « Co-evolution of humans and canids: An alternative view of dog domestication: Homo homini lupus? », Evolution and Cognition, vol. 9, no 1, , p. 57–72 (lire en ligne [archive du ])
- ↑ Kruuk, H., Hunter and Hunted: Relationships between carnivores and people, Cambridge, UK, Cambridge University Press, (ISBN 0-521-81410-3)
- ↑ « Coyote attacks: An increasing suburban problem » [archive du ], San Diego County, California (consulté le )
- ↑ « Canis aureus », sur Animal Diversity Web, University of Michigan (consulté le )
- ↑ « Fox hunting worldwide », BBC News, (lire en ligne, consulté le )
- ↑ Modèle:Cite iucn