
Musée des sciences de Milan, ((it) voir sur le site du musée).
La loi de Boyle-Mariotte ou loi de Mariotte, souvent appelée loi de Boyle dans le monde anglo-saxon, du nom du physicien et chimiste irlandais Robert Boyle et de l'abbé physicien et botaniste français Edme Mariotte, est l'une des lois de la thermodynamique constituant la loi des gaz parfaits. Elle relie la pression et le volume d'un gaz parfait à température constante.
Énoncé
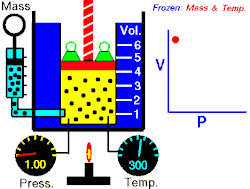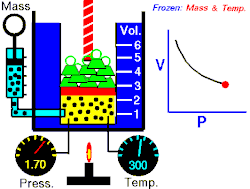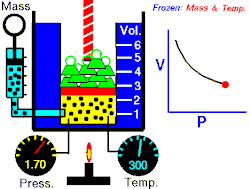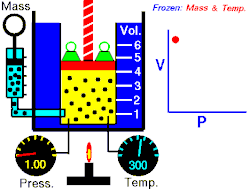
La loi de Boyle-Mariotte relie la pression et le volume d'un gaz parfait à température constante. On trace ainsi une courbe isotherme du gaz. Boyle et Mariotte ont constaté que la courbe était proche, à quelques pourcents près, d'une branche d'hyperbole équilatère en coordonnées de Clapeyron , soit pour une température donnée constante.
En d'autres termes, à une température donnée et maintenue constante, une diminution du volume d'un gaz entraîne une augmentation de sa pression. Inversement, la diminution de la pression du gaz se traduit par une augmentation de son volume. La valeur exacte de la constante n'a pas besoin d'être connue pour appliquer la loi entre deux volumes de gaz sous des pressions différentes, à la même température :
La loi a été découverte à quelques années d'intervalle par l'Irlandais Robert Boyle (en 1662) et par le Français Edme Mariotte (en 1676). Le Français Guillaume Amontons précisa en 1702 que cette loi n'est valable qu'à température constante et est plus précise aux basses pressions.
Limites
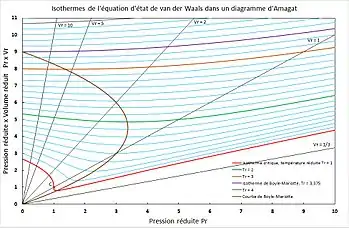
En marron : courbe de Boyle-Mariotte ; en violet : isotherme de Boyle-Mariotte ; en rouge : isotherme critique.
Dans ce type de diagramme, les courbes isothermes d'un gaz parfait sont des droites horizontales en vertu de la loi de Boyle-Mariotte.
Lorsque l'on trace dans un diagramme d'Amagat, à température et quantité de matière constantes, le produit en fonction de la pression pour un gaz parfait, on obtient, en vertu de la loi de Boyle-Mariotte, une droite horizontale. En faisant varier la température, on obtient un faisceau de droites parallèles appelées isothermes. Plus la température est élevée, plus l'isotherme est haute dans le diagramme.
Il n'en va pas de même pour les gaz réels, pour lesquels le produit , à température et quantité de matière constantes, varie en fonction de la pression. La figure ci-contre représente le diagramme d'Amagat d'un gaz répondant à l'équation d'état de van der Waals : cette équation d'état représente qualitativement le phénomène physique réel.
Les isothermes d'un gaz réel dans un diagramme d'Amagat décroissent avec une pression croissante aux basses pressions, puis croissent avec la pression aux hautes pressions. Le point auquel la tangente à l'isotherme est horizontale, soit , et auquel la pente de l'isotherme s'inverse, est appelé point de Boyle-Mariotte de l'isotherme. Le lieu géométrique des points de Boyle-Mariotte, qui sont les minimums des isothermes, est appelé courbe de Boyle-Mariotte[1],[2]. Il existe une température appelée température de Boyle-Mariotte au-delà de laquelle les isothermes sont croissantes monotones, l'isotherme correspondante est appelée isotherme de Boyle-Mariotte.
Par contre, lorsque la pression tend vers zéro, quelle que soit la température , le comportement d'un gaz réel, quel qu'il soit, tend vers celui du gaz parfait et la valeur de du gaz réel tend vers (avec la constante universelle des gaz parfaits). La loi de Boyle-Mariotte n'est donc applicable qu'aux basses pressions, généralement moins de 10 bar ou 10 atm.
Applications
Loi des gaz parfaits
La loi de Boyle-Mariotte est l'une des composantes de la loi des gaz parfaits :
avec :
- la pression ;
- le volume ;
- la quantité de matière (nombre de moles) ;
- la constante universelle des gaz parfaits (8,314 J mol−1 K−1) ;
- la température absolue.
Ainsi pour une quantité de matière donnée, à une température donnée, quel que soit le gaz .
Autonomie d'une bouteille de gaz
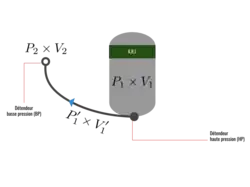
La loi de Boyle-Mariotte permet de déterminer l'autonomie d'une source de gaz en fonction du débit de consommation :
avec :
- l'autonomie de la bouteille (en minutes) ;
- la pression relative du gaz contenu dans la bouteille (en bars relatifs) ;
- le volume de la bouteille (en litres) ;
- la consommation moyenne, soit le débit volumique de gaz après détente (en litres par minute, l/min).
Pour démontrer cette relation, on considère une bouteille de gaz ayant les caractéristiques suivantes :
- la pression dans la bouteille ;
- le volume de la bouteille.
On considère également :
- la pression atmosphérique (environ 101 325 Pa) ;
- le volume produit par la détente du contenu de la bouteille à pression atmosphérique (en considérant la détente à température constante).
L'autonomie permise par la bouteille est donnée par :
La loi de Boyle-Mariotte donne :
on a :
En considérant les deux pressions en bars, puisque 1 bar = 100 000 Pa, ≈ 1 bar, on retrouve la relation donnée plus haut.
- Remarque
- La pression dans la bouteille est la pression relative et non la pression absolue du gaz, qui est égale à . En effet, lorsque la pression dans la bouteille atteint la pression atmosphérique la bouteille cesse de se vider et le reliquat de gaz dans la bouteille, égal au volume à , n'est pas utilisable. Considérer la pression absolue dans le calcul précédent fausse donc le calcul de l'autonomie de la bouteille en produisant une valeur surestimée.
- Exemple
- La loi de Boyle-Mariotte permet par exemple d'estimer l'autonomie permise par les bouteilles de plongée, les ARI utilisés par les pompiers, les mono-bouteilles utilisées en oxygénothérapie.
- Pour une bouteille d'ARI portée par un sapeur-pompier ayant un matériel normé et une condition physique normale :
- la pression minimale nécessaire pour l'engagement d'une mono-bouteille d'un ARI est de = 280 bar (pression relative) ;
- le volume d'une mono-bouteille = 6,8 litres ;
- la consommation moyenne d'air d'un individu normal lors d'un entrainement = 90 l/min.
- On a :
- ≈ 21,155 minutes.
Voir aussi
Références
- ↑ Lucien Borel et Daniel Favrat, Thermodynamique et énergétique, vol. 1, Presses polytechniques et universitaires romandes (PPUR), , 814 p. (ISBN 9782880745455, lire en ligne), p. 264.
- ↑ Richard Taillet, Loïc Villain et Pascal Febvre, Dictionnaire de physique, Louvain-la-Neuve, De Boeck Supérieur, , 956 p. (ISBN 978-2-8073-0744-5, lire en ligne), p. 538.
Bibliographie
- Danielle Baeyens-Volant, Pascal Laurent et Nathalie Warzée, Chimie générale : Exercices et méthodes, Dunod, , 384 p. (ISBN 978-2-10-080272-2, lire en ligne), p. 188.
- Michel Lagière, Physique industrielle des fluides : Notions fondamentales et applications numériques, Paris, Éditions Technip, , 394 p. (ISBN 2-7108-0701-7, lire en ligne), p. 122.
Liens externes
- Loi de Boyle-Mariotte sur le site Bibliothèque virtuelle Allô Prof.
Articles connexes
- Diagramme d'Amagat


























