
Le point critique d'un corps pur est le point du diagramme température-pression, généralement noté C, où s'arrête la courbe d'équilibre liquide-gaz. La température TC et la pression PC du point critique sont appelées température critique et pression critique du corps pur. Le volume molaire et la masse volumique du corps pur à ces température et pression (VC et ρC) sont appelés volume critique et masse volumique critique (plus souvent, mais improprement, densité critique).
Au-dessus de la température critique comme au-dessus de la pression critique on ne peut pas observer de changement d'état liquide-gaz, le fluide est dit supercritique.
Caractéristiques

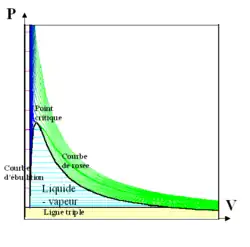
Le long de la courbe d'équilibre liquide-gaz (qui part du point triple solide-liquide-gaz, généralement noté T), la différence de masse volumique entre le liquide et le gaz, , diminue jusqu'à s'annuler au point critique C. En ce point, toutes les propriétés des deux phases (indice de réfraction, chaleurs massiques, etc.) deviennent identiques.
Aux températures et pressions supérieures à celles du point critique le fluide est supercritique : on ne peut plus distinguer une phase liquide d'une phase gaz, on passe continûment des propriétés d'un liquide (à haute pression et relativement basse température) à celles d'un gaz (à relativement basse pression et haute température) : le corps pur est alors qualifié de fluide supercritique.
Si l'on fait varier la température et la pression de telle sorte que le point représentatif dans le diagramme température-pression se déplace sans franchir la courbe d'équilibre on n'observe qu'une évolution continue, même si l'on part d'un point du domaine liquide pour arriver à un point du domaine gazeux. C'est seulement au franchissement de cette ligne qu'on peut observer une transition de phase liquide → gaz (vaporisation) ou gaz → liquide (liquéfaction).
On parle parfois d'état critique pour un fluide dont la température et la pression sont proches du point critique, cet « état » possédant des propriétés inhabituelles comme l'opalescence critique. Mais ce n'est pas un état de la matière au sens de la thermodynamique (absence de délimitation par des changements d'état).
On parle aussi d'état supercritique pour l'état d'un fluide supercritique. À proprement parler ce n'est pas un état de la matière au sens de la thermodynamique, mais une situation intermédiaire entre l'état liquide et l'état gazeux, et en continuité avec ces deux états.
Opalescence critique
Si l’on considère une transition à une température constante très proche du point critique, on voit qu'une différence de pression « faible » produit un changement de volume « important » : la compressibilité est infinie au point critique, une différence de pression infime provoque alors des variations de volume et de densité sensibles. Les propriétés dépendant de la densité (constante diélectrique, indice de réfraction) sont mal définies au passage du point critique. Les fluctuations statistiques deviennent macroscopiques : le fluide se comporte vis-à-vis de la lumière comme un brouillard concentré ; on parle de « phénomène d'opalescence critique ». Historiquement, la description de ces fluctuations par Einstein et Smoluchowski fut une étape importante du triomphe des théories atomistes.
Contournement du point critique
On peut assez facilement réaliser l'expérience dite de « contournement du point critique » qui consiste à transformer un corps de la phase liquide à la phase gazeuse en franchissant la ligne de transition de phase dans le diagramme T-P (par exemple par élévation de la température à pression constante), puis à revenir aux conditions initiales sans la franchir (en modifiant à la fois la pression et la température de telle sorte qu'on contourne le point critique) donc sans transition visible, puis à recommencer autant de fois qu'on le désire : on observe ainsi une succession de phénomènes d'ébullition séparés par des évolutions continues sans manifestation visible, et donc sans jamais observer de condensation. Ce phénomène de contournement du point critique est mis à profit, sous le nom de séchage supercritique, pour sécher totalement un échantillon sans le détruire, notamment en microscopie électronique.
Exemples
Chaque corps chimique possède un point critique, caractérisé par une température critique (TC), une pression critique (PC) et une masse volumique (ou un volume massique) critique (VC ou ρC).
Notes et références
- ↑ (en) Properties of Water and Steam in SI-Units - 1969 Prepared by Ernst Schmidt, Springer, Verlag Berlin Heidelberg New York - R. Oldenburg München
- ↑ (en) « eau », sur NIST/WebBook
- ↑ Communiqué CNRS (France) intitulé Premiers résultats scientifiques de l'instrument DECLIC, parti sur l'ISS le 25 août (Paris, 31 mars 2010)
- 1 2 (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », Journal of Physical and Chemical Reference Data, vol. 32, no 4, , p. 1411 (DOI 10.1063/1.1556431).
- 1 2 (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », Journal of Physical and Chemical Reference Data, vol. 35, no 4, , p. 1461 (DOI 10.1063/1.2201061).
Voir aussi
Articles connexes
- Fluide supercritique
- Formule de Clapeyron
- Méthode de Joback
- Gaz parfait
- Gaz réel
- Point triple
Liens externes
- La page du Pr Pierre Carlès, chercheur au CNRS (France) et professeur de mécanique des fluides à Jussieu.
- Équilibre liquide-vapeur, du cours de thermodynamique du Pr Claude Saint-Blanquet, maître de conférence, spécialiste des transferts thermiques.
- Point critique du CO2 : une vidéo de l'expérience.
