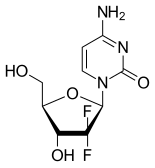
جيمسيتابين ( بالانجليزية : Gemcitabine )، مُباعًا تحت الاسم التجاري Gemzar و غيره،[1] هو دواء علاج كيميائي يستخدم في علاج عدة أنواع من السرطان[2]، تتضمن سرطان الثدي، سرطان المبيض، سرطان الرئة ذو حجم الخلية غير الصغير، سرطان البنكرياس، و سرطان المثانة.[2][3] يتم إعطاؤه بالحقن الوريدي البطيء.[2]
| جيمسيتابين | |
|---|---|
| الاسم النظامي | |
| 4-Amino-1-(2-deoxy-2,2-difluoro-β-D-erythro-pentofuranosyl)pyrimidin-2(1H)-on | |
| يعالج | سرطانة الخلايا الانتقالية، وسرطان الخلايا الجنسية، وسرطانة لسانية حرشفية الخلايا، وسرطانة حرشفية الخلايا في الرأس والعنق، وسرطان المثانة، ولمفوما الخلايا القاتلة الطبيعة والخلايا التائية الناضجة، والورم السرطاني الذي لا يصيب الخلايا الصغيرة بالرئة، وسرطان القنوات الغازية، وسرطانة حرشفية الخلايا الرئوية، ولمفوما لاهودجكينية، وفطار فطراني، وساركوما العظم، ولمفوما، ولمفوما بي منتشرة كبيرة الخلايا |
| اعتبارات علاجية | |
| اسم تجاري | Gemzar, others[1] |
| مرادفات | 2', 2'-difluoro 2'deoxycytidine, dFdC |
| ASHPDrugs.com | أفرودة |
| فئة السلامة أثناء الحمل | D (أستراليا) D (الولايات المتحدة) |
| طرق إعطاء الدواء | علاج عن طريق الوريد |
| بيانات دوائية | |
| ربط بروتيني | <10% |
| عمر النصف الحيوي | Short infusions: 32–94 minutes Long infusions: 245–638 minutes |
| معرّفات | |
| CAS | 95058-81-4  |
| ك ع ت | L01L01BC05 BC05 |
| بوب كيم | CID 60750 |
| IUPHAR | 4793 |
| ECHA InfoCard ID | 100.124.343 |
| درغ بنك | DB00441 |
| كيم سبايدر | 54753  |
| المكون الفريد | B76N6SBZ8R  |
| كيوتو | D02368  |
| ChEBI | CHEBI:175901  |
| ChEMBL | CHEMBL888  |
| ترادف | 2', 2'-difluoro 2'deoxycytidine, dFdC |
| بيانات كيميائية | |
| الصيغة الكيميائية | C9H11F2N3O4 |
| الكتلة الجزيئية | 263.198 g/mol |
الأعراض الجانبية العامة هي تثبيط نخاع العظم، مشاكل في الكبد و الكلية، غثيان ، حمّى، طفح، قصر النفس، و فقدان الشعر.[2]كما أن استعماله أثناء الحمل يُحتمل أن يلحق الضرر بالجنين.[2]. جيمسيتابين ينتمي لعائلة الأدوية المماثلة للنوكليوزيد[2]. و هو يعمل على إيقاف تصنيع جزيئات حمض نووي ريبوزي منقوص الأكسجين جديدة مما يؤدي إلى موت الخلية[2]
و قد حصل جيمسيتابين على براءة الابتكار وسُجِّلَ عام 1983 و حصل على الموافقة الرسمية عام 1995.[4]و قد تم طرح الأدوية الجنيسة في أوروبا عام 2009 و في الولايات المتحدة عام 2010.[5][6] و هو على قائمة الأدوية الأساسية النموذجية لمنظمة الصحة العالمية؛ الأدوية الأكثر فاعليةً وأمانًا ضمن ما يحتاجه نظام الرعاية الصحية.[7]تبلغ التكلفة الإجمالية له فيالدول النامية ما يقارب 24.41 إلى 316.99 دولار أمريكي لكل أمبولة ( غرام واحد )،[8] بينما تُكلِّف هذه الأمبولة ذات الغرام الواحد هيئة الخدمات الصحية الوطنية 155 باوند في المملكة المتحدة.[9]
الاستخدامات الطبية
يستعمل جيمسيتابين في علاج أنواع متنوعة من السرطانات. يستعمل مُنفردًا كخيار أول لعلاج سرطان البنكرياس، كما يستعمل كتوليفة دوائية مع دواء السيسبلاتين ( Cisplatin ) لعلاج سرطان المثانة المتقدِّم أو النَقيليّ ولعلاج سرطان الرئة ذو حجم الخلية غير الصغير المتقدِّم أو النَقيليّ. كما يستعمل خيارًا ثانيا ضمن توليفة مع دواء الكاربوبلاتين ( Carboplatin ) لعلاج سرطان المبيض و بتوليفة مع دواء الباكليتاكسيل ( Paclitaxel ) لعلاج سرطان الثدي النَقيليّ أو الذي لا يُمكن استئصالًُه جراحيًّا.[10][11][12] من المتعارف أن جيمسيتابين يستعمل لعلاج سرطان الأوعية الصفراوية[13] و غيره من سرطانات الجهاز الصفراوي [14]
كاستعمال آخر غير الاستعمال الأصلي الذي طُوِّرَ هذا الدواء لأجله.
و يتم إعطاء جيمسيتابين بالحقن الوريدي في عيادة العلاج الكيميائي.[2]
محاظير الاستعمال والتداخلات الدوائية
التداوي بجيمسيتابين من الممكن أن يؤثر على خصوبة الرجال والنساء، حياتهم الجنسية، و الدورة الشهرية. يُمنَع أن تحمل المرأة التي تأخذ جيمسيتابين، كما يُحظر استعماله عند المرأة الحامل أو المُرضِع رضاعة طبيعية.[15] لم تتم دراسة التداخلات الدوائية لهذا الدواء.[11][10]
الآثار الجانبية
جيمسيتابين هو علاج كيميائي يعمل على قتل أي خلية تقوم بالانقسام والتكاثر.[10]. الخلايا السرطانية تنقسم وتتكاثر بسرعة وبالتالي يتم استهدافها من قِبَل جيمسيتابين بمعدَّلات أكبر من بقية الخلايا السليمة، لكن هناك العديد من الخلايا الأساسية التي تنقسم بسرعة أيضًا! بما في ذلك خلايا الجلد، فروة الرأس، الخلايا المُبطِّنة للمعدة ونخاع العظم مما يتسبَّب بالآثار الجانبية للدواء[16]
تحمل اللّصاقة التعريفية للدواء التحذيرات التالية :
- جيمسيتابين يقوم بتثبيط وظائف نخاع العظم مما يسبِّب قلة الكريات البيض، قلة الصفيحات الدموية، و فقر الدم (أنيميا).
- يجب استعماله بحذر مع مرضى الكبد، الكلية، أو القلب والأوعية الدموية.
- يُمنع من يأخذ جيمسيتابين من أخذ المطاعيم الحيّة.
- من الممكن أن يسبب متلازمة اعتلال الدماغ الخلفي المُنعكسة ( بالانجليزية : posterior reversible encephalopathy syndrome ).
- من الممكن أن يسبب متلازمة التسرّب الشعيري.
- من الممكن أن يسبب مضاعفات خطيرة على الرئة مثل وذمة الرئة، ذات الرئة، و متلازمة الضائقة التنفسية الحادة.
- من الممكن أن يُلحِقَ الأذى بالحيوانات المنوية.[10][17]
الأعراض الجانبية الشائعة جدا ( الأعراض التي تظهر عند أكثر من 10% ممَّن يأخذه من المرضى ) تتضمَّن:
- صعوبة التنفس
- أعداد متدنية لكريات الدم البيضاء والحمراء و للصفائح الدموية
- غثيان وتقيؤ
- ارتفاع في انزيمات الكبد ( Transaminases )
- طفح وحساسية و حكة في الجلد
- فقدان الشعر
- خروج الدم والبروتينات في الدم
- أعراض مشابهة لأعراض نزلة البرد
- تنفّخ من السوائل[10][15]
الأعراض الجانبية الشائعة ( الأعراض التي تظهر عند 1% إلى 10% ممَّن يأخذه من المرضى ) تتضمن:
حمّى، فقدان الشهيّة، صداع، إيجاد صعوبة في النوم، وهن وتعب عام، سعلة، سيلان الأنف، إسهال، تقرّحات في الفم والشفتين، التعرّق، آلام الظهر، ألم في العضلات.[10]
في علم الأدوية
جيمسيتابين هو مركب محبّ للماءو يجب أن يتم نقله إلى الخلايا عبر نواقل النيوكليوسيدات الجزيئية ( أكثر نواقل الجيمسيتابين شيوعًا همSLC28A1 و SLC29A1 و SLC28A3 ).[18][19] بعد أن يدخل الخلية، يتم التعديل على جيمسيتابين بربطه بمجموعة فوسفاتفيصبح جيمسيتابين أحادي الفوسفات،[18][19] و هذه هي الخطوة المعدِّلة للتفاعل و التي يتم تحفيزها عبر الإنزيم المُفسفِر للستيدين منزوع الأكسجين.[18][19] ثم تتم إضافة مجموعتي فوسفات عبر إنزيمات أخرى. بعد إضافة ثلاث مجموعات فوسفات يصبح الجيمسيتابين فعّال دوائيٍّا على شكل جيمسيتابين ثلاثيّ الفوسفات.[18] بعد أن يتم فسفرته ثلاث مرات، فإنَّ جيمسيتابين سيتنكِّر ليبدو وكأنَّه جزيء سيتيدين ( بالانجليزية: Cytidine )فيتمّ دمجه ضمن حبل الحمض النووي الريبوزي منقوص الأكسجين (الـ DNA) الجديد الذي يتم تصنيعه أثناء تضاعف الخلية.[2][18][19] عندما يتحدّ الجيمسيتابين ضمن الـ DNA فإنَّهُ يسمح لقاعدة نيوكلوسيد أصيلة، طبيعية، بأن تُضاف إلى جانبه. و هذا يؤدي إلى "إنهاء مُقنَّع لبناء سلسلة القواعد" و ذلك لأنَّ الجيمسيتابين هو قاعدة نيتروجينية "ذات عيوب" أي أنها مختلفة عن القواعد الطبيعية مع احتفاظها بالشبه، ولكن بسبب وجود قاعدة النيوكليوسيد الطبيعية بجانبه فإنَّهُ يُراوغ النظام الطبيعي لإصلاح الـ DNA في الخلية( إصلاح القواعد باستئصالها ). و بذلك فإنَّ اتحاد الجيمسيتابين بـ DNA الخلية سيخق طفرة غير قابلة للإصلاح، مما يؤدي لتثبيط صناعة الـ DNA، وبالتالي يؤدي إلى موت الخلية.[2][18][19]
شكل الجيمسيتابين المرتبط بمجموعتيّ فوسفات له فاعلية أيضا؛ حيث يقوم بتثبيط الإنزيم المُختزل للريبونيوكليوتيد، وهو إنزيم مهم في تصنيع نيوكلوتيدات جديدة. نقص النيوكليوتيدات هذا سيقود الخلية إلى امتصاص المزيد من العناصر التي تحتاجها لتصنيع النيوكليوتيدات من خارج الخلية، مما يؤدي إلى زيادة امتصاص الجيمسيتابين أيضًا.[2][18][19][20]
كيميائيًا
جيمسيتابين هو دواء أولي مُصنَّع لنوع النيوكليوسيد : البيريميدين ، فالجيمسيتابين هو مضاهئ نوكليوزيد بحيث تم استبدال ذرات الهيدروجين على الكربونة رقم 2' من السيتيدين منزوع الأكسجين بذرات الفلور.[2][21][22]
شرح خطوات التصنيع كما يلي في الصورة هو طريقة التصنيع الأصلية التي تمت في مختبرات شركة Eli Lilly. التصنيع يبدأ بالغليسيرألديهايد يمينيّ التماثل البصريّ النقيّ (بالانجليزية: D-glyceraldehyde (R)-2) كمادة أولية يُمكن تصنيعها من مادة المانيتول يمينيّ التماثل البصريّ (بالانجليزية: D-mannitol) عبر خطوتين إلى 7 خطوات. ثم يتم إضافة الفلور بمنهجية"حجر البناء" باستعمال الإيثيل برومأيدفلورأسيتيت. ثم بعمل تفاعل ريفورماتسكي(الذي يقوم بدمج الألدهايد أو الكيتون مع ألفا هالو إستر للحصول على بيتا هيدروكسي إستر باستعمال الزينك )تحت الظروف المعيارية سنحصل على 1:3 ترانس/سيس كخليط مقابل غير ضوئي، بالأغلبية لناتج واحد. فصل المقابلات غير الضوئية يتم عبر استشراب السائل رفيع الإنجاز(HPLC)، و بالتالي نحصل على ترانس-3 جيمسيتابين بحاصل 65% من الناتج الكلي. تم تطوير طريقتي تصنيع كامل -على الأقل- على يد مجموعات أخرى.[21][22] At least two other full synthesis methods have also been developed by different groups.[22]
تاريخيًا
تم تركيب جيمسيتابين للمرة الأولى في بدايات العقد 1980 في مختبر لاري هيرتل في شركة إيلي ليلي. و قد كان القصدُ من تركيبه أن يكون دواءً مضادًا للفيروسات، و لكن الاختبارات قبل السريرية أظهرت مقدرته على قتل خلايا ابيضاض الدم في أنابيب الاختبار.[23]
و في بدايات العقد 1990 تم دراسة جيمسيتابين في التجارب السريرية. التجارب القائمة على سرطان البنكرياس أظهرت بوضوح مهم أن جيمسيتابين يزيد من فترة البقاء سنة واحدة، وقد حصل على الموافقة الرسمية في المملكة المتحدة عام 1995[10] و حصل على الموافقة الرسمية من إدارة الغذاء و الدواء (الولايات المتحدة) عام 1996 لعلاج سرطان البنكرياس.[3] في عام 1998 حصل على الموافقة الرسمية من إدارة الغذاء والدواء لعلاج سرطان الرئة ذو حجم الخلية غير الصغير وبعام 2004 حصل على الموافقة لعلاج سرطان الثدي النَقيليّ.[3] تم توحيد الملصقات البيانية لهذا الدواء في أوروبا بواسطة وكالة الأدوية الأوروبية عام 2008. [24]
في عام 2008، بلغت قيمة المبيعات الإجمالية لجيمسيتابين من شركة ليلي ما يقارب 1.7 بليون دولار أمريكي؛ في الوقت الذي كانت ستنتهي صلاحية براءة الاختراع الأمريكية في عام 2013 و الأوروبية في عام 2009.[25] تم إطلاق أول دواء جنيس(غير محدود الملكية) في أوروبا بعام 2009،[5] و قد بلغت مشاكل تحديات براءة الاختراع ذروتها في الولايات المتحدة مما أدى إلى إبطال براءة الاختراع لشركة ليلي في كيفية عمل الدواء.[26][27] فبدأت الشركات الجنيسة ببيع هذا الدواء في الولايات المتحدة بعام 2010 عندما انتهت صلاحية براءة الاختراع للمركب الكيميائي بحدّ ذاته. و قد احتلَّ التقاضِ بشأن البراءات العناوين الرئيسية في الصين، وحُسِم الأمر بعام 2010.[27][6] Patent litigation in China made headlines there and was resolved in 2010.[28]
مجتمعيًا
يجري تسويق جيمسيتابين عالميا تحت العديد من الأسماء التجارية: Abine, Accogem, Acytabin, Antoril, axigem, Bendacitabin, Biogem, Boligem, Celzar, Citegin, Cytigem, Cytogem, Daplax, DBL, Demozar, Dercin, Emcitab, Enekamub, Eriogem, Fotinex, Gebina, Gemalata, Gembin, Gembine, Gembio, Gemcel, Gemcetin, Gemcibine, Gemcikal, Gemcipen, Gemcired, Gemcirena, Gemcit, Gemcitabin, Gemcitabina, Gemcitabine, Gemcitabinum, Gemcitan, Gemedac, Gemflor, Gemful, Gemita, Gemko, Gemliquid, Gemmis, Gemnil, Gempower, Gemsol, Gemstad, Gemstada, Gemtabine, Gemtavis, Gemtaz, Gemtero, Gemtra, Gemtro, Gemvic, Gemxit, Gemzar, Gentabim, Genuten, Genvir, Geroam, Gestredos, Getanosan, Getmisi, Gezt, Gitrabin, Gramagen, Haxanit, Jemta, Kalbezar, Medigem, Meditabine,
[1].Nabigem, Nallian, Oncogem, Oncoril, Pamigeno, Ribozar, Santabin, Sitagem, Symtabin, Yu Jie, Ze Fei, and Zefei
في الأبحاث
بما أنه يُعتبر ذو أهمية علاجية ولكن الطريقة الوحيدة لإعطائه هي بالحقن الوريدي فإن هناك توجُّهًا بالأبحاث في كيفية إعادة صياغة وتركيب جيمسيتابين بحيث يُصبح متاحًا للتناول عبر الفم.[29][30][31]
و قد حظي علم الصيدلة الجيني و الصيدلة الجينية بالاهتمام المستمر. في عام 2014 لم يكن الأمر واضحًا فيما لو كانت التجارب الجينية والاختبارات على جينات المرضى ستفيد في عملية تحديد الجرعات التي ستحقق أفضل استجابة للدواء.[18] و لكنَّ الدراسات اللاحقة أظهرت أن التباين في التعبير الجيني للبروتينات ( SLC28A1 و SLC29A1 و SLC28A3 )؛ المُستخدمة في نقل جيمساتيبين إلى داخل الخلية، سيسبب التباين في فاعلية الدواء. و بشكل مشابه فإن التباين بالجينات المُعبِّرة عن البروتينات التي تسببب إبطال فاعلية جيمسيتابين ( نازع الأمين من السيتيدين منزوع الأكسجين- Deoxycytidine deaminase- ، نازع الأمين من السيتيدين-Cytidine deaminase- و 5'(3')-deoxyribonucleotidase NT5C ) و التباين بالجينات المُعبِّرة عن المكوِّنات الخلوية التي يستهدفها الدواء (RRM1, RRM2, and RRM2B) سيؤدي إلى التباين بالاستجابة للدواء من مريض لآخر.[18] كما تجري الأبحاث لاكتشاف كيف أن ماهية الطفرات في سرطان البنكرياس ستحدد الاستجابة للعلاج بجيمسيتابين.[32]
كما تمت دراسته لعلاج غرنة كابوزي؛ و هو نوع معروف من السرطان لدى مرضى نقص المناعة المكتسبة الإيدز ، و الإيدز بالأساس مرض غير شائع في الدول المتقدمة ولكنه ليس بلا شيوع في الدول النامية.[33]
مقالات ذات صلة
المصادر
- "Gemcitabine International Brands". Drugs.com. مؤرشف من الأصل في 25 مايو 201406 مايو 2017.
- "Gemcitabine Hydrochloride". The American Society of Health-System Pharmacists. مؤرشف من الأصل في 02 فبراير 201708 ديسمبر 2016.
- National Cancer Institute. "FDA Approval for Gemcitabine Hydrochloride". National Cancer Institute. مؤرشف من الأصل في 05 أبريل 201722 أبريل 2017.
- Fischer, Janos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery (باللغة الإنجليزية). John Wiley & Sons. صفحة 511. . مؤرشف من الأصل في 20 ديسمبر 2016.
- Myers, Calisha (13 March 2009). "Gemcitabine from Actavis launched on patent expiry in EU markets". FierceBiotech (باللغة الإنجليزية). مؤرشف من الأصل في 11 سبتمبر 2017.
- "Press release: Hospira launches two-gram vial of gemcitabine hydrochloride for injection" (باللغة الإنجليزية). Hospira via News-Medical.Net. 16 November 2010. مؤرشف من الأصل في 02 أكتوبر 2015.
- "WHO Model List of Essential Medicines (19th List)" ( كتاب إلكتروني PDF ). World Health Organization. April 2015. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 13 ديسمبر 201608 ديسمبر 2016.
- "Gemcitabine". International Drug Price Indicator Guide. مؤرشف من الأصل في 22 يناير 201808 ديسمبر 2016.
- British national formulary: BNF 69 (الطبعة 69). British Medical Association. 2015. صفحة 590. .
- "UK label" (باللغة الإنجليزية). UK Electronic Medicines Compendium. 5 June 2014. مؤرشف من الأصل في 10 يوليو 201706 مايو 2017.
- "US Label" ( كتاب إلكتروني PDF ). FDA. June 2014. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 16 فبراير 201706 مايو 2017. For label updates see FDA index page for NDA 020509
- Zhang, XW; Ma, YX; Sun, Y; Cao, YB; Li, Q; Xu, CA (29 March 2017). "Gemcitabine in Combination with a Second Cytotoxic Agent in the First-Line Treatment of Locally Advanced or Metastatic Pancreatic Cancer: A Systematic Review and Meta-Analysis". Targeted Oncology. doi:10.1007/s11523-017-0486-5. PMID 28353074.
- Plentz, RR; Malek, NP (December 2016). "Systemic Therapy of Cholangiocarcinoma". Visceral Medicine. 32 (6): 427–430. doi:10.1159/000453084. PMC . PMID 28229078.
- Jain, A; Kwong, LN; Javle, M (November 2016). "Genomic Profiling of Biliary Tract Cancers and Implications for Clinical Practice". Current Treatment Options in Oncology. 17 (11): 58. doi:10.1007/s11864-016-0432-2. PMID 27658789.
- Macmillan Cancer Support. "Gemcitabine". Macmillan Cancer Support. مؤرشف من الأصل في 25 مارس 201706 مايو 2017.
- Rachel Airley (2009). Cancer Chemotherapy. Wiley-Blackwell. .
- Siddall, E; Khatri, M; Radhakrishnan, J (16 March 2017). "Capillary leak syndrome: etiologies, pathophysiology, and management". Kidney International. doi:10.1016/j.kint.2016.11.029. PMID 28318633.
- Alvarellos, ML; Lamba, J; Sangkuhl, K; Thorn, CF; Wang, L; Klein, DJ; Altman, RB; Klein, TE (November 2014). "PharmGKB summary: gemcitabine pathway". Pharmacogenetics and genomics. 24 (11): 564–74. doi:10.1097/fpc.0000000000000086. PMC . PMID 25162786.
- Mini, E; Nobili, S; Caciagli, B; Landini, I; Mazzei, T (May 2006). "Cellular pharmacology of gemcitabine". Annals of Oncology. 17 Suppl 5: v7-12. doi:10.1093/annonc/mdj941. PMID 16807468.
- Cerqueira NM, Fernandes PA, Ramos MJ (2007). "Understanding ribonucleotide reductase inactivation by gemcitabine". Chemistry: A European Journal. 13 (30): 8507–15. doi:10.1002/chem.200700260. PMID 17636467.
- Brown, K; Weymouth-Wilson, A; Linclau, B (10 April 2015). "A linear synthesis of gemcitabine". Carbohydrate research. 406: 71–5. doi:10.1016/j.carres.2015.01.001. PMID 25681996. مؤرشف من الأصل في 12 فبراير 2020.
- Brown, K; Dixey, M; Weymouth-Wilson, A; Linclau, B (31 March 2014). "The synthesis of gemcitabine". Carbohydrate research. 387: 59–73. doi:10.1016/j.carres.2014.01.024. PMID 24636495.
- Sneader, Walter (2005). Drug discovery: a history. New York: Wiley. صفحة 259. .
- "Gemzar" (باللغة الإنجليزية). European Medicines Agency. 24 September 2008. مؤرشف من الأصل في 11 سبتمبر 2017.
- Myers, Calisha (18 August 2009). "Patent for Lilly's cancer drug Gemzar invalidated". FiercePharma (باللغة الإنجليزية). مؤرشف من الأصل في 11 سبتمبر 2017.
- Holman, Christopher M. (Summer 2011). "Unpredictability in Patent Law and Its Effect on Pharmaceutical Innovation" ( كتاب إلكتروني PDF ). Missouri Law Review. 76 (3): 645–693. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 11 سبتمبر 2017.
- Ravicher, Daniel B. (28 July 2010). "On the Generic Gemzar Patent Fight". Seeking Alpha. مؤرشف من الأصل في 09 ديسمبر 2012.
- Wang, Mei-Hsin; Alexandre, Daniele (2015). "Analysis of Cases on Pharmaceutical Patent Infringement in Great China". In Rader, Randall R.; et al. (المحررون). Law, Politics and Revenue Extraction on Intellectual Property (باللغة الإنجليزية). Cambridge Scholars Publishing. صفحة 119. . مؤرشف من الأصل في 11 سبتمبر 2017.
- Dyawanapelly, S; Kumar, A; Chourasia, MK (2017). "Lessons Learned from Gemcitabine: Impact of Therapeutic Carrier Systems and Gemcitabine's Drug Conjugates on Cancer Therapy". Critical reviews in therapeutic drug carrier systems. 34 (1): 63–96. doi:10.1615/CritRevTherDrugCarrierSyst.2017017912. PMID 28322141.
- Birhanu, G; Javar, HA; Seyedjafari, E; Zandi-Karimi, A (April 2017). "Nanotechnology for delivery of gemcitabine to treat pancreatic cancer". Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie. 88: 635–643. doi:10.1016/j.biopha.2017.01.071. PMID 28142120.
- Dubey, RD; Saneja, A; Gupta, PK; Gupta, PN (10 October 2016). "Recent advances in drug delivery strategies for improved therapeutic efficacy of gemcitabine". European Journal of Pharmaceutical Sciences. 93: 147–62. doi:10.1016/j.ejps.2016.08.021. PMID 27531553.
- Pishvaian, MJ; Brody, JR (15 March 2017). "Therapeutic Implications of Molecular Subtyping for Pancreatic Cancer". Oncology (Williston Park, N.Y.). 31 (3): 159–66, 168. PMID 28299752. مؤرشف من الأصل في 03 يوليو 2017.
- Krown, SE (September 2011). "Treatment strategies for Kaposi sarcoma in sub-Saharan Africa: challenges and opportunities". Current Opinion in Oncology. 23 (5): 463–8. doi:10.1097/cco.0b013e328349428d. PMC . PMID 21681092.