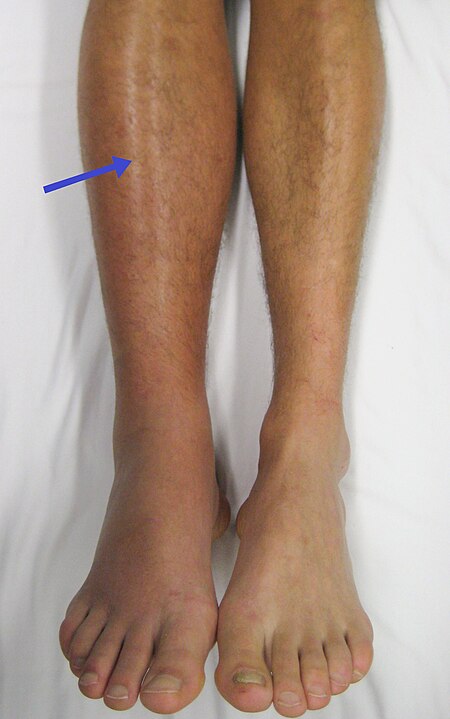
الخثار الوريدي العميق حالة مرضية تنتج عن تشكل خثرة بداخل وريد عميق. غالبا ما تحدث في الوريد الفخذي أو الوريد المأبضي بالساق، نتيجة لملازمة الفراش لفترات طويلة.
| خثار وريدي عميق | |
|---|---|
جلطة في الساق اليمنى. لاحظ الانتفاخ والاحمرار في الساق.
| |
| معلومات عامة | |
| الاختصاص | طب القلب |
| من أنواع | خثار وريدي |
في الطب، تجلط الأوردة العميقة - deep vein thrombosis (المعروف أيضًا باسم جلطة الساق أو التجلط الوريدي العميق ، والذي عادة ما يشار إليه بالاختصار DVT)، هو تكوّن جلطة دموية ("خثار") في وريد عميق. ويعد هذا المرض شكلاً من أشكال مرض التهاب الوريد الخثاري (التهاب وريد مع تكوّن جلطة).
ويؤثر تجلط الأوردة العميقة عادةً على أوردة الساق (مثل الوريد الفخذي أو الوريد المأبضي) أو الأوردة العميقة في الحوض. في بعض الأحيان، تصاب أوردة الذراع بهذا المرض (وإذا كانت الإصابة تلقائية، فإنها تعرف باسم مرض متلازمة باجيت-شروتر). ويمكن أن تحدث الإصابة بتجلط الأوردة العميقة دون ظهور أعراض، ولكن في العديد من الحالات، يكون هناك ألم وورم واحمرار وسخونة في الطرف المصاب، كما يمكن أن تكون الأوردة السطحية للطرف محتقنة. جدير بالذكر أن أخطر مضاعفات الإصابة بتجلط الأوردة العميقة هي إمكانية أن تتحرك الجلطة من مكانها وتنتقل إلى الرئتين، وهو ما يسمى انسداد الشريان الرئوي (PE). تجدر الإشارة إلى أن تجلط الأوردة العميقة يعتبر حالة طبية طارئة. وعندما يكون تجلط الأوردة العميقة في الطرف السفلي (الساق)، فإن هناك احتمالاً بنسبة %3 أن يحدث الانسداد الرئوي القادر على قتل المريض.[1] ومن المضاعفات المتأخرة لمرض تجلط الأوردة العميقة متلازمة ما بعد الجلطة والتي يمكن أن تؤدي إلى مرض الأوديما (تورم الأطراف) أو الشعور بألم أو عدم ارتياح ومشاكل جلدية.
وفقًا لما يسمى ثلاثي فيرشو، تحدث الإصابة بالتجلط الوريدي بسبب ثلاثة عوامل هي: انخفاض معدل تدفق الدم وحدوث تلف في جدار الوعاء الدموي وزيادة قابلية تجلط الدم (فرط تخثر الدم). ويمكن أن تؤدي العديد من الحالات المرضية إلى الإصابة بتجلط الأوردة العميقة، مثل انضغاط الأوردة والصدمات الجسدية الحادة والسرطان وأنواع العدوى المختلفة وأمراض التهابية معينة وحالات مرضية معينة، مثل السكتة الدماغية أو قصور القلب أو المتلازمة الكلائية (nephrotic syndrome). وهناك العديد من العوامل التي يمكن أن تزيد من احتمال إصابة الفرد بتجلط الأوردة العميقة، وتشمل الجراحة والإقامة في المستشفى وعدم الحركة لفترة طويلة (مثلاً عند تجبير العظام أو السفر بالطائرة لفترات طويلة وهو ما يؤدي إلى ما يعرف باسم متلازمة الدرجة السياحية) والتدخين والسمنة والشيخوخة وأدوية معينة (مثل العلاج بهرمون الإستروجين أو الإريثروبيوتين) والنزعة الوراثية لتكوّن الجلطات والمعروفة باسم الثرومبوفيليا (على سبيل المثال، لدى حاملي العامل خمسة لايدن). تواجه النساء احتمالاً متزايدًا للإصابة بهذا المرض خلال فترة الحمل وفترة ما بعد الولادة.
هذا ويعد أكثر الاختبارات المستخدمة في تشخيص الإصابة بتجلط الأوردة العميقة هو اختبار دم يسمى دي-دايمر وتحليل الموجات فوق الصوتية دوبلر للأوردة المصابة. في بعض الأحيان، يلزم إجراء المزيد من الاختبارات لمعرفة سبب الإصابة بتجلط الأوردة العميقة. وفي حالات محددة، يمكن محاولة إذابة الجلطة (باستخدام أدوية مذيبة للجلطات). ولمنع المزيد من ترسب الدم وتكوّن جلطات جديدة، مع احتمالية الإصابة بانسداد الشريان الرئوي، يُنصح باستخدام مضادات التجلط (الأدوية المسيلة للدم) (وإذا لم تكن متوفرة، يمكن استخدام فلتر الوريد الأجوف السفلي). ويوصى بمحاولة وقاية المرضى المقيمين في المستشفيات من أجل العديد من الأغراض العلاجية والجراحية من الإصابة بتجلط الأوردة العميقة باستخدام مضادات التجلط أو الجوارب الطبية ذات الضغط المتدرج (المعروفة أيضًا باسم جوارب ضد الجلطة) أو أجهزة الضغط المتقطع (IPC).
علامات وأعراض المرض
من أهم أعراض الخثار الوريدي العميق هو ألم شديد وتورم واحمرار العضو المصاب. بينما في نسبة حوالي 25% من الحالات، تكون الإصابة ساكنة إلى أن تحدث مضاعفات للخثار الوريدي العميق، مثل انصمام الشريان الرئوي. قد لا تكون هناك أي أعراض تشير إلى موضع جلطة الأوردة العميقة، ولكن الأعراض التقليدية لهذا المرض تتضمن الشعور بألم في الساق وتورمها واحمرارها وتمدد الأوردة السطحية. وقد تعاني نسبة تصل إلى %25 من إجمالي المرضى المقيمين لفترات طويلة في المستشفى من بعض أشكال مرض تجلط الأوردة العميقة، والذي غالبًا ما يظل غير ظاهر إكلينكيًا (ما لم يتطور ويسبب انسداد الشريان الرئوي).
توجد العديد من الأساليب أثناء فحص جسد المريض تساعد في زيادة احتمالات الكشف عن تجلط الأوردة العميقة، مثل قياس محيط الطرف المصاب والطرف المقابل له عند نقطة ثابتة (لمعرفة ما إذا كانت هناك حالة أوديما) وجس المسار الوريدي الذي كثيرًا ما يكون مؤلمًا عند لمسه. ولا يمكن الاعتماد على الفحص الجسماني للمريض في استبعاد تشخيص الإصابة بمرض تجلط الأوردة العميقة.
في حالة الإصابة بمرض التهاب الوريدالأبيض المؤلم، تكون الساق شاحبة اللون وباردة، مع انخفاض النبض في الشرايين بسبب نوبات التشنج العضلي. وعادةً ما ينتج هذا المرض من الانسداد الحاد في الأوردة الحرقفية والأوردة الفخذية بسبب الإصابة بتجلط الأوردة العميقة.
أما في حالة الإصابة بمرض التهاب الوريد الأزرق المؤلم، يكون هناك انسداد وريدي حاد في التدفق الدموي للطرف المصاب كله تقريبًا، بما في ذلك الأوردة الحرقفية والفخذية. وعادةً ما تكون الساق مؤلمة ومزرقة (بسبب نقص الأكسجين) ومتورمة (لأنها ممتلئة بسائل). وقد تصاب الساق بعد ذلك بالغرغرينا الوريدية.
ومن الأهمية بمكان إدراج احتمالية الإصابة بانسداد الشريان الرئوي في التاريخ المرضي، لأن هذا قد يستدعي المزيد من البحث والدراسة (انظر انسداد الشريان الرئوي).
يجب أخذ التاريخ المرضي بدقة، مع وضع عوامل الخطر في الاعتبار (أنظر أدناه)، بما في ذلك استخدام وسائل لمنع الحمل، مثل حبوب منع الحمل الهرمونية التي تحتوي على هرمون الإستروجين، والطيران لمسافات طويلة وتعاطي الأدوية التي تؤخذ عن طريق الوريد وأخذ التاريخ المرضي لحالات الإجهاض (وهي سمة تميز العديد من الاضطرابات التي يمكن أن تسبب أيضًا تجلط الدم). في حالة الطيران لمسافات طويلة، أثبتت الدراسات الحديثة أن خطر الإصابة بتجلط الأوردة العميقة يزداد عند المسافرين الذين يدخنون أو يعانون من السمنة أو يتعاطون حاليًا حبوب منع الحمل.[2] يمكن أن يكشف التاريخ المرضي للعائلة عن وجود عامل وراثي يؤدي إلى الإصابة بتجلط الأوردة العميقة. جدير بالذكر أن حوالي %35 من مرضى تجلط الأوردة العميقة يعانون من حالة ثرومبوفيليا وراثية واحدة على الأقل، بما في ذلك النقص في عوامل مضادة لتجلط الدم وهي بروتين C أو بروتين S أو مضاد الثرومبين أو طفرات في العامل الخامس وجينات البروثرومبين.[3]
أسباب المرض
- مقالة مفصلة: خثار
إن ثلاثي فيرشو عبارة عن مجموعة مكونة من ثلاثة عوامل معروفة بتأثيرها على تكوّن الجلطة، وهي معدل تدفق الدم وكثافة الدم وخصائص جدار الوعاء الدموي. وقد لاحظ فيرشو أن تجلط الأوردة العميقة يصيب الساق اليسرى أكثر من الساق اليمنى، وأشار إلى أن السبب الرئيسي في ذلك يرجع إلى الضغط الشديد من الوريد الحرقفي العام للساق اليمنى على الوريد الحرقفي العام للساق اليسرى (انظر متلازمة May-Thurner).[4]
إن من أكثر عوامل الخطر شيوعًا العمليات الجراحية الحديثة أو الإقامة في المستشفى.[5] هذا ولم يتلق %40 من هؤلاء المرضى العلاج الوقائي بدواء الهيبارين. في حين أن عوامل الخطر الأخرى تشمل السن المتقدم والسمنة والإصابة بعدوى وعدم الحركة واستخدام أشكال حبوب منع الهرمونية المركبة (المحتوية على هرمون الإستروجين) وتدخين السجائر والسفر جوًا ("متلازمة الدرجة السياحية"، وهي مزيج من عدم الحركة والجفاف النسبي)، وهذه العوامل من أكثر الأسباب المعروفة للإصابة بتجلط الأوردة العميقة.[6] كثيرًا ما تظهر الثرومبوفيليا (الميل إلى تكوّن الجلطات) في صورة جلطات متكررة.
وقد لوحظ أن الجلطة عادةً ما تتكون أولاً في أوردة ربلة الساق (السمانة) وتنمو في اتجاه تدفق الدم في الوريد. وتتسم جلطات الأوردة العميقة بأنها تكون إما أعلى الوريد المأبضي أو أسفله. ويمكن أن تمتد جلطات الأوردة العميقة واسعة الانتشار إلى الأوردة الحرقفية أو الوريد الأجوف السفلي. ويكون خطر الإصابة بانسداد الشريان الرئوي أعلى في حالة وجود جلطات أكثر انتشارًا.
التشخيص
إن معيار الذهب في تشخيص تجلط الأوردة العميقة هو تصوير الأوردة بالأشعة والذي يتضمن حقن الوريد المحيطي للطرف المصاب بإحدى مواد التباين وإجراء فحص باستخدام أشعة إكس لإظهار ما إذا كان قد حدث انسداد في التدفق الوريدي أم لا. ونظرًا لأن هذا النوع من الاختبارات التشخيصية يخترق جسم الإنسان، فإنه قلّما يتم إجراؤه.
فحص جسد المريض
- علامة هومانز: ثني القدم إلى الخلف يسبب ألمًا في ربلة الساق الخلفية.
- علامة برات: الضغط على ربلة الساق الخلفية يسبب ألمًا.
ومع ذلك، فإن هذه العلامات الطبية لا تشخص المرض بشكل جيد وغير مدرجة في قواعد التنبؤ الإكلينيكي التي تجمع بين أفضل النتائج التي تم التوصل إليها من أجل تشخيص الإصابة بمرض تجلط الأوردة العميقة.[7]
حساب احتمالات الإصابة بمرض تجلط الأوردة العميقة
في عام 2006، وضع سكارفيلاس وويلز مجموعة من قواعد التنبؤ الإكلينيكي لمرض تجلط الأوردة العميقة،[8] على غرار مجموعة المعايير الإكلينيكية التي يتم تطبيقها على نطاق واسع في تشخيص الإصابة بانسداد الشريان الرئوي.[9][10]
درجة أو معيار ويلز : (الدرجة المحتملة من 2- إلى 8)
- سرطان نشط (العلاج في غضون الستة شهور الأخيرة أو الحصول على علاج ملطف) -- نقطة واحدة
- تورم ربلة الساق أكثر من 3 سم مقارنةً بربلة الساق الأخرى (يتم قياسها عند 10 سم أسفل عظم الأحدوبة الظنبوبية) -- نقطة واحدة
- الأوردة السطحية الجانبية (غير مصابة بالدوالي) -- نقطة واحدة
- أوديما انطباعية (تقتصر على الساق التي تظهر عليها الأعراض) -- نقطة واحدة
- تورم الساق كلها—نقطة واحدة
- ألم موضعي على طول الجهاز الوريدي العميق— نقطة واحدة
- الشلل أو الخزل (الشلل الجزئي) أو عدم تحرك الأطراف السفلية مؤخرًا بسبب تجبيرها— نقطة واحدة
- طريح الفراش مؤخرًا منذ أكثر من ثلاثة أيام أو أجريت له عملية جراحية كبيرة تطلبت تخديرًا كليًا أو موضعيًا في الأربعة أسابيع الماضية— نقطة واحدة
- الإصابة بتجلط الأوردة العميقة سابقًا - نقطة واحدة
- تشخيص بديل يكون على الأقل محتملاً كالاحتمالات السابقة- يتم طرح نقطتين
التفسير :
- النتيجة نقطتان أو أكثر - من المحتمل الإصابة بتجلط الأوردة العميقة. ينبغي تصوير أوردة الساق.
- النتيجة أقل من نقطتين - من غير المحتمل الإصابة بتجلط الأوردة العميقة. ينبغي إجراء اختبار دم، مثل اختبار دي-دايمر، لاستبعاد احتمالات الإصابة بتجلط الأوردة العميقة.
اختبارات الدم
اختبار دي-دايمر
- مقالة مفصلة: ديمر-دي
عند انخفاض احتمالات الإصابة بتجلط الأوردة العميقة، يلجأ الطب الحديث إلى إجراء أبحاث وفحوصات من خلال تحليل مستويات المركب الكيميائي دي-دايمر في الدم. وهذا المركب - الذي يعتبر ناتج عملية هدم بروتين الفيبرين المترابط - هو إشارة على وجود جلطة في الدم وأن هذه الجلطة الدموية تتحلل بفعل بروتين البلازمين. وعندما يكون مستوى مركب دي-دايمر منخفضًا في الدم، يستدعي ذلك التفكير في طرق تشخيص أخرى (مثل تمزق كيسة بيكر، إذا كان الاحتمال الإكلينيكي لإصابة المريض بتجلط الأوردة العميقة منخفضًا بالقدر الكافي).[11][12]
اختبارات دم أخرى
عادةً ما تكون اختبارات الدم الأخرى التي يتم إجراؤها في هذه المرحلة هي:
- اختبار صورة الدم الكاملة
- دراسات تجلط الدم الأولية: قياس زمن البروثرومبين (PT) والثرمبوبلاستين النشط الجزئي (APTT) ومستوى الفيبرينوجين في الدم
- اختبارات إنزيمات الكبد
- اختبارات وظائف الكلى وكهارل الدم
تصوير أوردة الساق
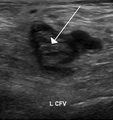
يمكن استخدام أساليب تخطيط معاوقة الامتلاء الدموي (Impedance plethysmography) وموجات دوبلر فوق الصوتية (Doppler ultrasonography) والمسح بالموجات فوق الصوتية الضاغطة لأوردة الساق، بالإضافة إلى الفحص بالدوبلكس (لتحديد مستوى تدفق الدم) للمساعدة في الكشف عن جلطة الدم وتحديد مكانها (أي إذا ما كانت أسفل الركبة أم أعلاها). وقد حل فحص دوبلكس بالموجات فوق الصوتية (Duplex Ultrasonography)، بسبب حساسيته ونوعيته وتكراريته العالية، محل تصوير الوريد بالأشعة وأصبح من أكثر طرق الاختبار المستخدمة في تقييم هذا المرض شيوعًا. ويتضمن هذا الاختبار كلاً من نظام التصوير ثنائي البعد B mode وموجات دوبلر لالتقاط صور لتدفق الدم.
طرق الوقاية
تتضمن الأدلة الإرشادية للممارسة الإكلينيكية التي وضعتها كلية أطباء الصدر الأمريكية (ACCP) بعض التوصيات حول طرق وقاية المرضى الذين يمكثون فترات طويلة في المستشفى من الإصابة بتجلط الأوردة العميقة[13].
إرشادات عامة للمرضى المحتجزين في المستشفيات
فيما يتعلق بالمرضى المحتجزين في المستشفيات، فإن الأدلة الإرشادية تنص على أن: "بالنسبة للمرضى الذين يعانون من آلام مبرحة وتم إدخالهم إلى المستشفى بسبب قصور القلب الاحتقاني أو أمراض خطيرة في الجهاز التنفسي أو المرضى طريحي الفراش الذين يعانون من عامل خطر إضافي واحد أو أكثر، بما في ذلك السرطان النشط أو إصابة سابقة بالانصمام الخثري الوريدي أو أحد أمراض الإنتان أو مرض عصبي حاد أو مرض التهاب الأمعاء، فإننا ننصح بالوقاية من الإصابة بتجلط الأوردة العميقة من خلال حصولهم على جرعة منخفضة من دواء الهيبارين غير المجزأ (من الدرجة 1A) أو دواء الهيبارين منخفض الوزن الجزيئي (من الدرجة 1A أيضًا)[13]." يمكن استخدام دواء الإنوكسبارين (الهيبارين منخفض الوزن الجزيئي) أو الهيبارين غير المجزأ.[14] مع العلم أن دواء الهيبارين منخفض الوزن الجزيئي قد يكون أكثر فاعليةً من دواء الهيبارين غير المجزأ. ولكن إذا تم استخدام الهيبارين غير المجزأ، فإن تعاطيه بجرعة 5000 وحدة ثلاث مرات يوميًا يمكن أن يكون أكثر فاعليةً.[15]
منذ نشر الأدلة الإرشادية العامة لكلية أطباء الصدر الأمريكية، تم نشر تجربة مراقبة عشوائية إضافية [16] وتحليل جمعي[17] شمل التجربة. وخلص التحليل الجمعي إلى أن: "الأدوية المضادة للتجلط فعالة في منع ظهور أعراض الانصمام الخثري الوريدي أثناء فترة تلقي المرضى المحتجزين في المستشفيات ممن هم عرضة لخطر الإصابة بمرض تجلط الأوردة العميقة هذه الأدوية المضادة للتجلط. وهناك حاجة إلى إجراء أبحاث إضافية لتحديد ما إذا كان هناك خطر قائم ممثل في احتمالية إصابة هؤلاء المرضى بالانصمام الخثري الوريدي بعد توقفهم عن تلقي العلاج الوقائي." وفيما يتعلق بأي من المرضى معرض لهذا الخطر، فإن معظم الدراسات المدرجة في التحليل الجمعي كانت تتناول مرضى قصور القلب من الفئة الثالثة والرابعة بناءً على التصنيف الوظيفي لجمعية أمراض القلب في نيويورك. أما المرضى الذين يقل احتمال تعرضهم لخطر الإصابة بتجلط الأوردة العميقة، فإن التجربة المذكورة آنفًا[16] وتجربة سابقة[18] هي تجارب مناسبة لحالتهم ولكنها غير حاسمة.
يمكن أن يزداد احتمال تعرض مرضى الفشل الكلوي المزمن الذين يخضعون للغسيل الكلوي لخطر الإصابة بمرض الانصمام التخثري[19]، ولكن التجارب المراقبة العشوائية لم تقم بتحليل المنافع المحتمل الحصول عليها من العلاج الوقائي في مقابل المخاطر المحتمل التعرض لها جراءه.
مرضى العمليات الجراحية
يحصل المرضى الذين خضعوا لعمليات جراحية على جرعات منتظمة من دواء الهيبارين منخفض الوزن الجزيئي لمنع الإصابة بتجلط الدم. ويمكن حاليًا إعطاء دواء الهيبارين منخفض الوزن الجزيئي فقط عن طريق الحقن تحت الجلد. وقد تكون الجرعات الوقائية للسيدات الحوامل اللاتي لديهن تاريخ من الجلطات مقتصرة على حقن من دواء الهيبارين منخفض الوزن الجزيئي أو ربما تكون غير ضرورية إذا كانت عوامل الخطر التي تهددهن مؤقتة إلى حدٍ كبير.
إن ممارسة رياضة المشي باكرًا وبانتظام تعتبر علاجًا يسبق مضادات التجلط وما زال معترفًا به ومستخدمًا حتى الآن. فالمشي ينشط مضخات العضلات في الجسم ويزيد من سرعة جريان الدم الوريدي ويمنع الركود الوريدي. وقد أثبتت أجهزة الضغط المتقطع فاعليتها مع المرضى الملازمين للفراش أو للكراسي المتحركة الذين يزداد احتمال تعرضهم لخطر الإصابة بمرض تجلط الأوردة العميقة أو لديهن موانع لاستعمال دواء الهيبارين. إن أجهزة الضغط المتقطع تستخدم أكياس هواء يتم لفها حول الفخذ و/أو ربلة الساق. تنتفخ أكياس الهواء وتنكمش بالتناوب؛ مما يضغط على العضلات ويزيد سرعة جريان الدم بنسبة تصل إلى %500. وقد ثبتت فاعلية أجهزة الضغط المتقطع بالنسبة للمرضى الذين خضعوا لعمليات جراحية في الركبة ومفصل الورك (مرضى معرضون لخطر الإصابة بتخثر الدم بنسبة %80 وليس هناك علاج وقائي لهم)؛ حيث تقيهم من الإصابة بتجلط الأوردة العميقة والانسداد الشرياني الرئوي. وبدلاً من ذلك، يمكن تناول ما بين 150-300 مللي جرام من الأسبرين.
فترة الحمل
- مقالة مفصلة: فرط الخثورية أثناء الحمل
يزيد احتمال التعرض لخطر الإصابة بتجلط الأوردة العميقة في فترة الحمل بسبب آلية التكيف الفسيولوجية الناتجة عن زيادة قابلية تجلط الدم لمنع نزيف ما بعد الولادة.[20] ومع ذلك، عندما يقترن الحمل بقابلية تجلط الدم داخل الأوعية الدموية، فإنه يزداد احتمال التعرض لخطر الإصابة بالتجلط أو انسداد الشريان الرئوي بشكل كبير.[20]
في الوقت الذي يوجد فيه إجماع في الآراء بين الأطباء على أن سلامة الأم قبل سلامة الجنين، فإنه يمكن إحداث تغييرات في نظام مضادات التجلط خلال فترة الحمل لتقليل المخاطر التي يتعرض لها الجنين، بينما تظل المستويات العلاجية المضادة لتجلط الدم كما هي عند الأم.
إن المشكلة الرئيسية مع مضادات التجلط في فترة الحمل هي أن دواء الوارفارين، الدواء المضاد للتجلط الأكثر استخدامًا في حالة تعاطي الدواء لفترة طويلة، معروف بأن له آثار ماسخة على الجنين إذا تم إعطاؤه للأم في بداية الحمل.[21][22]
المسافرون
- مقالة مفصلة: خثار وريدي عميق
هناك أدلة إكلينيكة تشير إلى أن ارتداء الجوارب الضاغطة أو الملابس الضاغطة أثناء السفر يقلل أيضًا من نسب الإصابة بتجلط الدم لدى الأشخاص الذين يسافرون في رحلات طيران طويلة. وقد قارنت دراسة عشوائية في عام 2001 بين مجموعتين من ركاب رحلة طيران طويلة؛ حيث ارتدت مجموعة جوارب ضاغطة بينما لم تفعل المجموعة الأخرى. وقد تم إجراء فحوصات واختبارات دم لجميع الركاب لتحديد ما إذا كانت هناك حالات إصابة بتجلط الأوردة العميقة. وقد أظهرت النتائج أن %10 من المسافرين الذين لم يرتدوا جوارب ضاغطة أصيبوا بتجلط الأوردة العميقة اللاعرضي. بينما لم تصب المجموعة التي ارتدت جوارب ضاغطة بتجلط الأوردة العميقة. وقد استنتج العلماء الذين أجروا الدراسة العشوائية أن ارتداء الجوارب الضاغطة المطاطية يقلل من معدل الإصابة بتجلط الأوردة العميقة لدى المسافرين في رحلات طيران طويلة.[23].
التدبير العلاجي
الإقامة في المستشفى
يعتبر العلاج في المنزل خيارًا متاحًا وفقًا للتحليل الجمعي الذي أجرته مجموعة كوشران العلمية التعاونية (Cochrane Collaboration) البريطانية.[24] ينبغي التفكير في خيار الإقامة في المستشفى في حالة المرضى الذين يعانون من أكثر من عاملين من عوامل الخطر التالية؛ حيث إن هؤلاء المرضى يحتمل أن يواجهوا خطر الإصابة بمزيد من المضاعفات أثناء العلاج[25]:
- تجلط الأوردة العميقة في الساقين
- قصور كلوي
- انخفاض وزن الجسم (أقل من 70 كيلو جرام/154 رطل)
- عدم القدرة على الحركة مؤخرًا
- قصور القلب المزمن
- السرطان
مضادات التجلط
- مقالة مفصلة: مضاد تخثر
إن مضادات التجلط هي العلاج المعتاد لمرض تجلط الأوردة العميقة. وبصفة عامة، يبدأ علاج المرضى من خلال برنامج علاجي قصير الأمد (أي أقل من أسبوع) من تعاطي دواء الهيبارين، بينما يحصلون على برنامج علاجي مدته من 3-6 شهور معتمد على دواء الوارفارين (أو أدوية أخرى من مثبطات فيتامين k). يفضل إعطاء المرضى دواء الهيبارين منخفض الوزن الجزيئي،[26] مع العلم أن دواء الهيبارين غير المجزأ يتم إعطاؤه للمرضى الذين لديهم موانع لاستعمال دواء الهيبارين منخفض الوزن الجزيئي (مثل مرضى الفشل الكلوى أو حاجة وشيكة لإجراء جراحي؛ أي إجراء يتم بإدخال أدوات جراحية داخل الجسم). أما بالنسبة للمرضى الذين عانوا من تجلط الأوردة العميقة المتكرر (مرتين أو أكثر)، فإنهم يتناولون مضادات التجلط "مدى الحياة". قامت مجموعة كوشران العلمية التعاونية بإجراء تحليل جمعي لمخاطر وفوائد تعاطي مضادات التجلط لفترات طويلة.[27] ومتى تم علاج تجلط الدم بعوامل تخفيف كريات الدم الحمراء، فإن الجزء المصاب تصبح أمامه فرصة جيدة لكي يرجع إلى حجمه الطبيعي. ومع ذلك، فإن عوامل التخفيف لا تقلل احتمالات الإصابة بانسداد الشريان الرئوي أو انسداد الشرايين التاجية. ومن ثم، فبينما تلاشت احتمالات إصابة الجزء المصاب بتجلط الأوردة العميقة بالتجلط (أي الساقين)، ما زالت احتمالات الإصابة بانسداد الشريان الرئوي واردة.
يمكن اعتبار النسب غير الطبيعية من مركب دي دايمر في الدم في نهاية العلاج على أنها إشارة إلى وجود حاجة إلى علاج مستمر للمرضى المصابين بتجلط الأوردة العميقة الدانية غير المستثارة للمرة الأولى.[28]
وعلى الرغم من حقيقة أنه ليس هناك من يشكك في ذلك، فإنه استنادًا إلى تحليل جمعي أجرته مجموعة كوشران العلمية التعاونية، فقد وُجدت تجربة عشوائية واحدة عن استخدام مضادات التجلط مقابل الدواء الوهمي في علاج مرض الانصمام الخثري الوريدي؛ حيث لم يكن هناك فرق كبير من الاثنين.[29]
تتضمن التوصيات الحالية للعلاج الأولي لتجلط الأوردة العميقة الحاد بدء العلاج بمضادات فيتامين K، إلى جانب دواء الهيبارين منخفض الوزن الجزيئي أو الهيبارين غير المجزأ في أول يوم للعلاج.[30] ويمكن التوقف عن إعطاء المريض دواء الهيبارين عندما يصبح مقياس مدى سيولة الدم (INR) مستقرًا وأعلى من 2.0. تتضمن توصيات مدة وطريقة علاج تجلط الأوردة العميقة الحاد في الساق ما يلي:
- بالنسبة للمرضى الذين يعانون لأول مرة من تجلط الأوردة العميقة بعد التعرض لعامل خطر مؤقت (قابل للانعكاس)، يتم إخضاعهم للعلاج طويل المدى بمضادات فيتامين K لمدة 3 شهور.
- بالنسبة للمرضى الذين يعانون لأول مرة من تجلط الأوردة العميقة مجهول السبب، يتم إخضاعهم للعلاج بمضادات فيتامين K لمدة لا تقل عن 6 أشهر - 12 شهرًا. ويتم تعديل جرعة مضادات فيتامين K للحفاظ على مقياس مدى سيولة الدم في نطاق يتراوح ما بين 2.0 إلى 3.0.
- للوقاية من متلازمة ما بعد الجلطة، يُنصح بارتداء جوارب ضاغطة مطاطية.
الأدوية المذيبة للجلطات
- مقالة مفصلة: انحلال الخثرة
يتم استخدام الأدوية المذيبة للجلطات بوجه عام من أجل إذابة الجلطات واسعة الانتشار، مثل جلطة الوريد الحرقفي الفخذي. وعلى الرغم من أن التحليل الجمعي لبعض التجارب المراقبة العشوائية الذي أجرته مجموعة كوشران العلمية التعاونية يظهر تحسن النتائج في حالة استخدام الأدوية المذيبة للجلطات،[31] فإنه ربما تكون هناك زيادة في المضاعفات الخطيرة، مثل النزيف. في يوليو 2008، نشرت كلية أطباء الصدر الأمريكية أدلة إرشادية إكلينيكية لعلاج مرض الانصمام الخثري الوريدي تعتمد على قرائن جديدة، وقد اقترح الأطباء ولأول مرة استخدام الطرق العلاجية الميكانيكية لإذابة الجلطات في علاج حالات معينة من تجلط الأوردة العميقة الحاد. يمكن تحميل الأدلة الإرشادية الكاملة لمرض الانصمام الخثري الوريدي من كلية أطباء الصدر الأمريكية الصادرة في عام 2008 بدون رسوم من الموقع الإليكتروني: TheNewGuidelines.org
إزالة الجلطة
يمكن إزالة الجلطة باستخدام جهاز ميكانيكي متخصص في استئصال الجلطات. وقد لاقى العلاج التوليفي الذي يستخدم طريقة ميكانيكية لإذابة الجلطة موضعيًا اهتمامًا بالغًا في الآونة الأخيرة كعلاج لتجلط الأوردة العميقة.
الجوارب الضاغطة
- مقالة مفصلة: جوارب ضاغطة
ينبغي ارتداء الجوارب الضاغطة المطاطية بانتظام "يفضل البدء في ارتدائها في خلال شهر من تاريخ تشخيص الإصابة بتجلط الأوردة العميقة الدانية والاستمرار في ارتدائها لمدة لا تقل عن سنة بعد التشخيص".[26] جدير بالذكر أن البدء في ارتدائها في غضون أسبوع من تشخيص المرض يمكن أن يكون أكثر فاعلية.[32] وقد كانت الجوارب في جميع التجارب تقريبًا أقوى من الجوارب العادية ضد الجلطات وتم تصنيعها إما بضغط 20-30 ملليمتر زئبق أو 30-40 مللي زئبق. مع العلم أن معظم التجارب استخدمت الجوارب التي تصل إلى الركبة. وقد أظهر التحليل الجمعي لعدد من التجارب المراقبة العشوائية الذي أجرته مجموعة كوشران العلمية التعاونية انخفاض معدلات الإصابة بمتلازمة ما بعد الجلطة.[33] وقد كان عدد المرضى اللازم علاجهم مرتفعًا نسبيًا، حيث كان يلزم علاج نحو 4 إلى 5 مرضى للحيلولة دون إصابة حالة واحدة فقط بمتلازمة ما بعد الجلطة.[34]
فلتر الوريد الأجوف السفلي
- مقالة مفصلة: مرشح الوريد الأجوف السفلي
يقلل فلتر الوريد الأجوف السفلي احتمالات الإصابة بانسداد الشريان الرئوي[35] ويعد خيارًا للمرضى الذين لديهم موانع لاستعمال الأدوية المضادة للجلطات (مثل نزيف المخ) أو هؤلاء المرضى القليلين للغاية الذين تكررت إصابتهم بانسداد الشريان الرئوي أثناء تعاطيهم أدوية مضادة للتجلط. ويمكن أن يمنع فلتر الوريد الأجوف السفلي (ويشار إليه أيضًا باسم فلتر Greenfield) الإصابة بانسداد الشريان الرئوي الناتج عن جلطة الساق. وعلى الرغم من أن هذه الفلاتر نفسها يمكن أن تؤدي إلى تجلط الدم،[36] فإنه يتم اعتبار فلتر الوريد الأجوف السفلي وسيلة مؤقتة لمنع الإصابة بانسداد الشريان الرئوي الذي يهدد الحياة.[37]
المردود العلاجي المتوقع
يصاب حوالي %15 من مرضى تجلط الأوردة العميقة بمتلازمة ما بعد الجلطة. وتأتي المتلازمة في صورة ورم في الساق وألم وتشنج عضلي أثناء النوم وعرج وريدي المنشأ وتصبغ الجلد والتهابه وتقرح الجلد (عادةً ما يكون على الجانب الأوسط من أسفل الساق).
معدلات انتشار المرض
يصاب حوالي شخص من كل 1000 شخص سنويًا بمرض تجلط الأوردة العميقة. وتشير التقديرات إلى أن نحو 350,000 إلى 600,000 أمريكي يصابون سنويًا بتجلط الأوردة العميقة وانسداد الشريان الرئوي، وأن 100.000 حالة وفاة على الأقل يمكن أن ترتبط بشكل مباشر أو غير مباشر بهذين المرضين.[38]
جدير بالذكر أن تجلط الأوردة العميقة أقل شيوعًا بين الأطفال. على أن حوالي شخص من كل 100.000 شخص تحت سن 18 عامًا يصاب بتجلط الأوردة العميقة، وربما يكون السبب في ذلك هو ارتفاع معدل ضربات القلب في الدقيقة لدى الطفل، كما أن أسلوب حياته نشط نسبيًا عند مقارنته بالبالغين، بالإضافة إلى احتمالات الإصابة بعدد أقل من الأمراض المصاحبة (مثل الأورام الخبيثة).
في النساء الحوامل، تكون احتمالات الإصابة به هي 0.5 إلى 7 حالات من كل 1.000 حالة حمل، ويعتبر تجلط الأوردة العميقة السبب الثاني الأكثر شيوعًا في حدوث وفيات الأمهات الحوامل في الدول المتقدمة بعد النزيف.[39]
معرض صور
مقالات ذات صلة
- صورة الوريد (طبي)
- قصور وريدي مزمن
المراجع
- by Alexander G.G. Turpie, MD (last modified March 2008). "Deep Venous Thrombosis - The Merck's Manuals Online Medical Library". مؤرشف من الأصل في 13 مارس 2020.
- Firkin, F and Nandurkar, H(2009). "Flying and thromboembolism". Australian Prescriber , 32:148-50. هذا المقال متاح على الموقع الإليكتروني: http://www.australianprescriber.com/magazine/32/6/148/50/
- Rosendall FR. (2005). "Venous Thrombosis: the role of genes, environment, and behavior". Hematology Am Soc Hematol Educ Program. 2005: 1–12. doi:10.1182/asheducation-2005.1.1. PMID 16304352.
- Virchow R. Ueber die Erweiterung kleinerer Gefäfse. Arch Pathol Anat Physiol Klin Med 1851;3:427-62.
- Spencer FA, Lessard D, Emery C, Reed G, Goldberg RJ (2007). "Venous thromboembolism in the outpatient setting". Arch. Intern. Med. 167 (14): 1471–5. doi:10.1001/archinte.167.14.1471. PMC . PMID 17646600.
- Tsai A, Cushman M, Rosamond W, Heckbert S, Polak J, Folsom A (2002). "Cardiovascular risk factors and venous thromboembolism incidence: the longitudinal investigation of thromboembolism etiology". Arch Intern Med. 162 (10): 1182–9. doi:10.1001/archinte.162.10.1182. PMID 12020191.
- Wells PS, Owen C, Doucette S, Fergusson D, Tran H (2006). "Does this patient have deep vein thrombosis?". JAMA. 295 (2): 199–207. doi:10.1001/jama.295.2.199. PMID 16403932.
- Scarvelis D, Wells P (2006). "Diagnosis and treatment of deep-vein thrombosis". CMAJ. 175 (9): 1087–92. doi:10.1503/cmaj.060366. PMC . PMID [http://www.cmaj.ca/cgi/content/full/175/9/1087 Free Full Text 17060659. [http://www.cmaj.ca/cgi/content/full/175/9/1087 Free Full Text]] .
- نشر الطبيب Neff MJ. بالكلية الأمريكية لأطباء الطوارئ نصائح إكلينيكية عن التقييم الطبي والتدبير العلاجي لانسداد الشريان الرئوي. في الجريدة الطبية American Family Physician. 2003; 68 (4):759-?. هذا المقال متاح على الموقع الإليكتروني: http://www.aafp.org/afp/20030815/practice.html. وصل إليه في: 8 ديسمبر 2006. نسخة محفوظة 15 مايو 2008 على موقع واي باك مشين.
- Wells P, Anderson D, Rodger M, Ginsberg J, Kearon C, Gent M, Turpie A, Bormanis J, Weitz J, Chamberlain M, Bowie D, Barnes D, Hirsh J (2000). "Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer". Thromb Haemost. 83 (3): 416–20. PMID 10744147.
- Wells PS, Anderson DR, Rodger M; et al. (2003). "Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis". N. Engl. J. Med. 349 (13): 1227–35. doi:10.1056/NEJMoa023153. PMID 14507948.
- Bates SM, Kearon C, Crowther M; et al. (2003). "A diagnostic strategy involving a quantitative latex D-dimer assay reliably excludes deep venous thrombosis". Ann. Intern. Med. 138 (10): 787–94. PMID 12755550.
- Geerts WH, Pineo GF, Heit JA; et al. (2004). "Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy". Chest. 126 (3 Suppl): 338S–400S. doi:10.1378/chest.126.3_suppl.338S. PMID 15383478.
- King CS, Holley AB, Jackson JL, Shorr AF, Moores LK (2007). "Twice vs three times daily heparin dosing for thromboembolism prophylaxis in the general medical population: A metaanalysis". Chest. 131 (2): 507–16. doi:10.1378/chest.06-1861. PMID 17296655.
- Wein L, Wein S, Haas SJ, Shaw J, Krum H (2007). "Pharmacological Venous Thromboembolism Prophylaxis in Hospitalized Medical Patients: A Meta-analysis of Randomized Controlled Trials". Archives of Internal Medicine. 167 (14): 1476–1486. doi:10.1001/archinte.167.14.1476. PMID 17646601.
- Lederle FA, Sacks JM, Fiore L; et al. (2006). "The prophylaxis of medical patients for thromboembolism pilot study". Am. J. Med. 119 (1): 54–9. doi:10.1016/j.amjmed.2005.03.049. PMID 16431185.
- Dentali F, Douketis JD, Gianni M, Lim W, Crowther MA (2007). "Meta-analysis: anticoagulant prophylaxis to prevent symptomatic venous thromboembolism in hospitalized medical patients". Ann. Intern. Med. 146 (4): 278–88. PMID 17310052. مؤرشف من الأصل في 1 يونيو 2009.
- Gärdlund B (1996). "Randomised, controlled trial of low-dose heparin for prevention of fatal pulmonary embolism in patients with infectious diseases. The Heparin Prophylaxis Study Group". Lancet. 347 (9012): 1357–61. doi:10.1016/S0140-6736(96)91009-0. PMID 8637340.
- Tveit DP, Hypolite IO, Hshieh P; et al. (2002). "Chronic dialysis patients have high risk for pulmonary embolism". Am. J. Kidney Dis. 39 (5): 1011–7. doi:10.1053/ajkd.2002.32774. PMID 11979344.
- صفحة 264 في: Gresele, Paolo (2008). Platelets in hematologic and cardiovascular disorders: a clinical handbook. Cambridge, UK: Cambridge University Press. .
- Sathienkijkanchai A, Wasant P. (2005). "Fetal warfarin syndrome". J Med Assoc Thai. 88 (Suppl 8): S246–50. PMID 16856447.
- Schaefer C, Hannemann D, Meister R, Eléfant E, Paulus W, Vial T, Reuvers M, Robert-Gnansia E, Arnon J, De Santis M, Clementi M, Rodriguez-Pinilla E, Dolivo A, Merlob P. (2006). "Vitamin K antagonists and pregnancy outcome. A multi-centre prospective study". Thromb Haemost. 95 (6): 949–57. doi:10.1160/TH06-02-0108. PMID 16732373.
- Scurr JH, Machin SJ, Bailey-King S, Mackie IJ, McDonald S, Smith PD (2001). "Frequency and prevention of symptomless deep-vein thrombosis in long-haul flights: a randomised trial". Lancet. 357 (9267): 1485–9. doi:10.1016/S0140-6736(00)04645-6. PMID 11377600.
- Othieno R, Abu Affan M, Okpo E (2007). "Home versus in-patient treatment for deep vein thrombosis". Cochrane database of systematic reviews (Online) (3): CD003076. doi:10.1002/14651858.CD003076.pub2. PMID 17636714.
- Trujillo-Santos J, Herrera S, Page MA; et al. (2006). "Predicting adverse outcome in outpatients with acute deep vein thrombosis. findings from the RIETE Registry". J. Vasc. Surg. 44 (4): 789–93. doi:10.1016/j.jvs.2006.06.032. PMID 16926081.
- Snow V, Qaseem A, Barry P; et al. (2007). "Management of venous thromboembolism: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians". Ann. Intern. Med. 146 (3): 204–10. PMID 17261857. مؤرشف من الأصل في 9 مارس 2009.
- Hutten BA, Prins MH (2006). "Duration of treatment with vitamin K antagonists in symptomatic venous thromboembolism". Cochrane database of systematic reviews (Online) (1): CD001367. doi:10.1002/14651858.CD001367.pub2. PMID 16437432.
- Palareti G, Cosmi B, Legnani C; et al. (2006). "D-dimer testing to determine the duration of anticoagulation therapy". N. Engl. J. Med. 355 (17): 1780–9. doi:10.1056/NEJMoa054444. PMID 17065639.
- Cundiff DK, Manyemba J, Pezzullo JC (2006). "Anticoagulants versus non-steroidal anti-inflammatories or placebo for treatment of venous thromboembolism". Cochrane Database Syst Rev (1): CD003746. doi:10.1002/14651858.CD003746.pub2. PMID 16437461.
- Harry R. Büller, Giancarlo Agnelli, Russel D. Hull, Thomas M. Hyers, Martin H. Prins, and Gary E. Raskob (سبتمبر 2004). "Antithrombotic Therapy for Venous Thromboembolic Disease: The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy". Chest. 126 (3): 401S–428S. doi:10.1378/chest.126.3_suppl.401S. PMID 1538347912 أغسطس 2010.
- Watson L, Armon M (2004). "Thrombolysis for acute deep vein thrombosis". Cochrane Database Syst Rev (4): CD002783. doi:10.1002/14651858.CD002783.pub2. PMID 15495034.
- Prandoni P, Lensing AW, Prins MH; et al. (2004). "Below-knee elastic compression stockings to prevent the post-thrombotic syndrome: a randomized, controlled trial". Ann. Intern. Med. 141 (4): 249–56. PMID 15313740.
- Kolbach D, Sandbrink M, Hamulyak K, Neumann H, Prins M (2003). "Non-pharmaceutical measures for prevention of post-thrombotic syndrome". Cochrane Database Syst Rev (1): CD004174. doi:10.1002/14651858.CD004174.pub2. PMID 14974060.
- Kakkos S, Daskalopoulou S, Daskalopoulos M, Nicolaides A, Geroulakos G (2006). "Review on the value of graduated elastic compression stockings after deep vein thrombosis". Thromb Haemost. 96 (4): 441–5. PMID 17003920.
- Decousus H, Leizorovicz A, Parent F, Page Y, Tardy B, Girard P, Laporte S, Faivre R, Charbonnier B, Barral F, Huet Y, Simonneau G (1998). "A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d'Embolie Pulmonaire par Interruption Cave Study Group". N Engl J Med. 338 (7): 409–15. doi:10.1056/NEJM199802123380701. PMID 9459643.
- Prepic Study, Group (2005). "Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study". Circulation. 112 (3): 416–22. doi:10.1161/CIRCULATIONAHA.104.512834. PMID 16009794.
- Young T, Aukes J, Hughes R, Tang H (2007). "Vena caval filters for the prevention of pulmonary embolism". Cochrane database of systematic reviews (Online) (3): CD006212. doi:10.1002/14651858.CD006212.pub2. PMID 17636834.
- "The Surgeon General's Call to Action to Prevent Deep Vein Thrombosis and Pulmonary Embolism 2008" ( كتاب إلكتروني PDF ). مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 26 فبراير 201213 أكتوبر 2008.
- الانصمام الخثري الوريدي (VTE) - أدلة إرشادية لطرق العلاج في بعض الدول، مثل تشيلي والصين والكاميرون. Bengt Wahlström، قسم الطوارئ، مستشفى أوبسالا الأكاديمي. يناير 2008
وصلات خارجية
- North American Thrombosis Forum: Patients and Health Professionals working together to enhance prevention, diagnosis and treatment of thrombosis and cardiovascular diseases.
- American College of Chest Physicians 2008 Clinical Evidence-based Guidelines for (Venous Thromboembolic Disease (VTE
- International Society on Thrombosis and Haemostasis
- Ongoing campaign to change Scottish doctors and hospitals procedures regarding DVT
- DVT patient information
- A Lighter Vein.com - DVT Prevention & Compression Hosiery