تجلط الدم ( Coagulation أو Clotting) هو عملية معقدة يقوم خلالها الدم بتكوين جلطات الدم وهي تجمعات دموية متماسكة تمنع نزيف الدم. كما أنه يعد أحد العوامل المهمة في عملية الإرقاء (وهي وقف نزيف وفقدان الدم من الأوعية الدموية المصابة)، حيث من خلاله تتم تغطية الموضع المصاب من جدار الوعاء الدموي بواسطة صفيحة دموية وتكوين جلطة دموية تحتوي على بروتين الفبرين لوقف نزيف الدم وترميم الوعاء الدموي المصاب وإصلاحه. كذلك، يمكن أن تؤدي اضطرابات تجلط الدم إما إلى زيادة احتمالية حدوث النزيف الدموي أو الجلطة الانسدادية (thrombosis).[1]
هذا، ويعتبر تجلط الدم من الموضوعات التي تناولها علم الأحياء بالدراسة العميقة؛ حيث تعد العمليات الحيوية كفيلة بأن تحفظ استمرار عملية تجلط الدم. ففي جميع الثدييات، تحدث عملية تجلط الدم من خلال عاملين؛ العامل الخلوي (الصفائح الدموية) والبروتين (عامل التجلط).[2] ولقد خضعت عملية تجلط الدم التي تحدث في جسم الإنسان إلى أبحاث كثيرة، ولذلك تم فهمها بشكل أفضل.[3]
وتبدأ عملية تجلط الدم على الفور تقريبًا بعدما تؤدي إصابة الوعاء الدموي إلى تلف طبقة الإندوثيليوم (الغشاء المبطن لجدار الوعاء الدموي). ومع تعرض الدم لبعض البروتينات، مثل العامل النسيجي، تحدث بعض التغيرات في الصفائح الدموية وأحد بروتينات البلازما وهو "الفيبرينوجين"، الذي يمثل أحد عوامل تجلط الدم. وبعد ذلك على الفور تعمل الصفائح الدموية على تكوين سدادة صفيحية على منطقة الإصابة بالوعاء الدموي؛ وهذا ما يُطلق عليه الإرقاء الأولي. بعدها يحدث مباشرةً الإرقاء الثانوي ؛ حيث تستجيب البروتينات الموجودة في بلازما الدم، التي تُعرف باسم عوامل التجلط أو عوامل التخثر، وتتفاعل في صورة شلال معقد لتشكل خيوط الفبرين التي تقوي السدادة التي كونتها الصفائح الدموية من قبل.[4]
المراحل الفسيولوجية لتجلط الدم
تنشيط الصفائح الدموية
يؤدي التلف الذي يصيب جدران الأوعية الدموية إلى تعرض البروتينات الموجودة أسفل الطبقة المبطنة للوعاء الدموي للخطر، وعلى الأخص عامل فون ويلبراند الذي يقع تحت طبقة الإندوثيليوم. ويعتبر عامل فون ويلبراند بروتينًا سكريًا تفرزه طبقة الإندوثيليوم السليمة، مما يؤدي إلى تكوين طبقة تقع بين الإندوثيليوم والغشاء القاعدي الموجود أسفلها. فعندما تحدث إصابة في طبقة الإندوثيليوم المبطنة للأوعية الدموية، يتعرض الدم لعامل فون ويلبراند الموجود منفصلاً بطبيعته حاملاً العامل VIII والكولاجين وعوامل تجلط الدم الأخرى. وتلتصق الصفائح الدموية بهذا الكولاجين من خلال مستقبلات البروتين السكري la وlla السطحية المرتبطة بالكولاجين. جدير بالذكر أن هناك بروتينات أخرى في الدم تساهم في تعزيز هذا الالتصاق وذلك بواسطة عامل فون ويلبراند الذي يكوِّن روابط إضافية تربط بين البروتينات السكرية الموجودة في الصفائح الدموية، ومنها بروتين Ib والعاملين IX وV، من جانب وألياف الكولاجين من الجانب الآخر. وبذلك يعمل هذا الالتصاق على تنشيط الصفائح الدموية.[5]
تقوم الصفائح الدموية النشطة بإخراج محتوياتها المختزنة في صورة حبيبات إلى بلازما الدم. وتشمل هذه الحبيبات مركب الأدينوسين ثنائي الفوسفات (ADP) والسيروتونين والعامل المنشط للصفائح الدموية (PAF) وعامل فون ويلبراند والعامل الصفيحي الرابع والثرومبوكسان A2 - واختصاره TXA2؛ حيث تجتمع كل هذه العناصر لتقوم بدورها بتنشيط المزيد من الصفائح الدموية الأخرى. هذا، وتعمل محتويات هذه الحبيبات على تفعيل مجموعة المستقبلات المرتبطة بالبروتين Gq، الأمر الذي يؤدي إلى زيادة تركيز الكالسيوم في العصارة الخلوية الموجودة في الصفائح الدموية. كما يساهم الكالسيوم في تفعيل بروتين كيناز C، الذي يساعد بدوره في تنشيط مركب الفوسفوليباز A2 - واختصاره PLA2. ثم بعد ذلك يعمل مركب الفوسفوليباز A2 على تغيير بروتينات IIb وIIIa السكرية الغشائية التي تنتمي لمجموعة بروتينات الإنتجرين (integrin)، مما يزيد من قدرتها على الالتصاق مع الفبرينوجين. كما يتحول شكل الصفائح الدموية المُفَعَّلة من الشكل المكور إلى الشكل النجمي، ومن ثم يساعد التصاق الفبرينوجين بالبروتينات السكرية IIb وIIIa في تجمع الصفائح الدموية المتجاورة مع بعضها.[6]
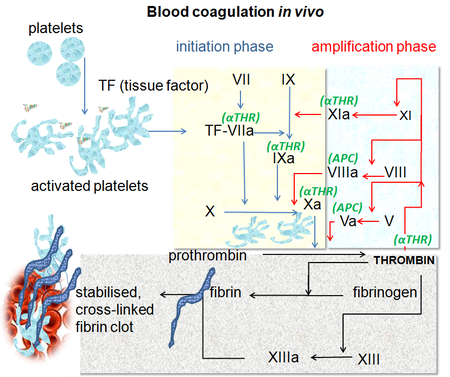
شلال التخثر (تجلط الدم)

يشتمل شلال التخثر الذي يتم من خلال عملية الإرقاء الثانوي على مسارين يؤديان إلى تكوُّن الفبرين. وهذان المساران هما مسار التفعيل بالتَمَاسّ في عملية التجلط (الذي عُرف من قبل باسم المسار الداخلي) ومسار العامل النسيجي (الذي عُرف من قبل باسم المسار الخارجي). ولقد اعتقد البعض من قبل أن شلال التخثر في عملية تجلط الدم يتكون من مسارين يتمتعان بالأهمية نفسها ومتصلين بمسار مشترك أخير. لكن من المعروف الآن أن المسار الرئيسي لبدء عملية تجلط الدم هو مسار العامل النسيجي. وعلاوةً على ذلك، يتكون هذان المساران نتيجةً لسلسلة من التفاعلات يتم فيها تنشيط الزيموجين (مولد الإنزيمات غير النشطة) الخاص بأحد إنزيمات السيرين بروتياز وعاملها المساعد من البروتين السكري، مما ينتج عنه تكوين العناصر النشطة التي ستحفز بعد ذلك التفاعل التالي في الشلال، الأمر الذي يؤدي في النهاية إلى تكوُّن خيوط الفبرين المتشابكة. وبوجه عام، تتم الإشارة إلى عوامل تجلط الدم باستخدام أرقام رومانية مذيلة بحرف a للإشارة إلى أنها في حالتها النشطة.[7]
وبصفة عامة، تنتمي عوامل تجلط الدم إلى عائلة السيرين بروتياز (مجموعة إنزيمات). لكن هناك بعض الاستثناءات. على سبيل المثال، ينتمي العاملين VIII وV إلى البروتينات السكرية، بينما ينتمي العامل XIII إلى عائلة إنزيم الترانسجلوتامينيز.[7] ويتمثل عمل عائلة السيرين بروتياز في شطر بعض أنواع البروتينات الأخرى في أمكان محددة. وتنتشر عوامل التجلط في الدم في صورة مجموعة من الزيموجينات غير النشطة. وتجدر الإشارة إلى أن شلال التخثر ينقسم إلى ثلاثة مسارات. ذلك، حيث يقوم كل من مسار العامل النسيجي ومسار التفعيل بالتَمَاسّ بتنشيط "المسار المشترك النهائي" للعامل X والثرومبين والفبرين.[8]
مسار العامل النسيجي (المسار الخارجي)
يتمثل الدور الرئيسي لمسار العامل النسيجي في تحفيز حدوث عملية "تدفق الثرومبين"؛ تلك العملية التي يتم من خلالها على الفور إفراز إنزيم الثرومبين الذي يعد أهم عناصر شلال التخثر من حيث الأدوار التي يلعبها في تنشيط التفاعلات في عملية تجلط الدم. ينتشر العامل VIIa في صورته النشطة بكميات أكبر من أي عامل نشط من عوامل التجلط الأخرى. وتشمل العملية الخطوات التالية:[7]
- بعد إصابة أحد الأوعية الدموية، ينفصل العامل VII عن مسار الدورة الدموية ويتحد مع العامل النسيجي الذي تحمله وتنقله الخلايا الحاملة للعامل النسيجي (الخلايا الليفية السدوية وخلايا الدم البيضاء) مكونًا مركبًا معقدًا منشطًا (يتألف من العامل النسيجي والعامل VIIa النشط واختصاره TF-FVIIa).
- يقوم مركب TF-FVIIa بتنشيط العاملين IX وX.
- يتم تنشيط العامل VII نفسه بفعل الثرومبين والعامل XIa النشط والعامل XII والعامل Xa النشط.
- يقوم غالبًا مثبط مسار العامل النسيجي (TFPI) على الفور بتثبيط نشاط العامل Xa النشط بفعل مركب TF-FVIIa.
- يقوم كل من العامل Xa النشط والعامل المساعد له، المتمثل في العامل Va النشط، بتكوين إنزيم البروثرومبينيز الذي يعمل على تنشيط بروتين البروثرومبين وتحويله إلى الثرومبين.
- بعد ذلك، يقوم الثرومبين بتنشيط العناصر الأخرى الموجودة في شلال التخثر، بما في ذلك العاملين V وVIII (الذين يعملان على تنشيط العامل XI الذي يقوم بدوره بتنشيط العامل IX)، وكذلك يقوم الثرومبين بتنشيط العامل VIII وتحريره من التصاقه بعامل فون ويلبراند.
- يعد العامل VIIIa النشط هو العامل المساعد للعامل IXa النشط، حيث يتحدان معًا ليكونا المركب الإنزيمي الذي يقوم بدوره بتنشيط العامل X. وهكذا تستمر دورة عملية تجلط الدم. (يعتبر مصطلح "tenase" دمج لمقطع "ten" ومقطع "-ase" المستخدم للإشارة إلى عائلة الإنزيمات).
مسار التفعيل بالتَمَاسّ (المسار الداخلي)
إن مسار التفعيل بالتَمَاسّ يبدأ بتكوين مركب أولي على الكولاجين عن طريق الكينينوجين عالي الوزن الجزيئي (مولد الكينين ذي الوزن الجزيئي المرتفع - HMWK) والبريكاليكرين (طليعة الكاليكرين) والعامل XII (عامل هاجمان). ومن ثم، يتحول البريكاليكرين إلى الكاليكرين، وكذلك يصير العامل XII عاملاً نشطًا بعد تفعيله. وبالتالي، يقوم العامل XIIa النشط بدوره بتفعيل العامل XI ليصبح عاملاً نشطًا. بعد ذلك، يقوم العامل XIa الفعال بتنشيط العامل IX الذي يعمل مع العامل VIIIa النشط، وهو عامله المساعد، على تكوين المركب الإنزيمي الذي يقوم بدوره بتنشيط العامل FX ليصبح عاملاً فعالاً. ويتضح الدور الثانوي الذي يلعبه مسار التفعيل بالتَمَاسّ في بدء عملية تكوين الجلطات الدموية من خلال عدم تعرض المرضى الذي يعانون من نقص حاد في معدلات العامل XII ومولد الكينين عالي الوزن الجزيئي والبريكاليكرين للمعاناة من أمراض النزيف الدموي. وبدلاً من ذلك، يبدو أن لمسار التفعيل بالتماس دور كبير في الإصابة بالالتهابات. وعلى الرغم من ذلك، فإن التداخل مع المسار قد يمنح الحماية ضد تجلط الدم دون خطر نزيف كبير.[9]
المسار المشترك النهائي
يؤدي الثرومبين العديد من المهام والأدوار في هذا المسار. ذلك، حيث يتمثل دوره الرئيسي في تحويل الفبرينوجين إلى الفبرين الذي يمثل العنصر الأساسي في تكوين السدادة لوقف نزيف الدم. وإضافةً إلى ذلك، يقوم الثرومبين بتنشيط العاملين VIII وV وبروتين C المثبط لهما (في وجود مادة مرتبطة بالغشاء المخاطي المبطن للأوعية الدموية يُطلق عليها الترومبوموديولين - thrombomodulin؛ وهي عبارة عن بروتين موجود في خلايا الأوعية الدموية)، كما يعمل على تنشيط العامل XIII الذي يُكوِّن روابط تساهمية مع بوليمرات الفبرين الثابتة التي تتكون من وحدات أحادية منشطة.[7]
وبعد حدوث عملية التنشيط سواء عن طريق مسار التفعيل بالتَمَاسّ أو مسار العامل النسيجي، يظل شلال التخثر في حالة تزيد معها احتمالية تكوُّن الجلطات الانسدادية من خلال التنشيط المستمر للعاملين VIII وIX لتكوين المركب الإنزيمي، حتى يتم خفض تلك الاحتمالية بفعل موانع ومضادات التجلط.[7]
العوامل المساعدة في عملية التجلط
نورد فيما يلي العديد من المواد التي تعد ضرورية للمساعدة في تفعيل شلال التخثر وإتمام دورته بشكل ملائم:
- يتعين وجود عنصر الكالسيوم ومركب الفوسفوليبيد (أحد مكونات غشاء الصفيحة الدموية) لكي يؤدي كل من المركب الإنزيمي وإنزيم البروثرومبينيز عملهما. ذلك، حيث يساهم الكالسيوم في الربط بين المركبات من خلال رواسب جاما كربوكسي الموجودة على العاملين Xa وIXa النشطين من ناحية وأسطح جزيئات الفوسفوليبيد المحمولة على الصفائح الدموية من ناحية أخرى، بالإضافة إلى الجزيئات الدقيقة أو الحويصلات المجهرية الداعمة للتجلط المتوفرة من خلالها. كذلك يعد وجود الكالسيوم ضروريًا لقيامه بدور مهم في تفعيل عوامل أخرى في شلال التخثر.
- يعتبر فيتامين K عاملاً أساسيًا بالنسبة لإنزيم جاما جلوتاميل كربوكسيليز الذي يفرزه الكبد والذي يضيف مجموعة كربوكسيل إلى رواسب حمض الجلوتاميك الموجودة على العوامل II وVII وIX وX، هذا بالإضافة إلى عدد من البروتينات مثل بروتين S وبروتين C وبروتين Z. وأثناء إضافة مجموعة جاما كربوكسيل لرواسب الجلوتامات الموجودة على عوامل التجلط غير النشطة، فإن فيتامين K نفسه يتأكسد. وهناك إنزيم آخر يسمى إنزيم الإيبوكسيد المختزل لفيتامين K (واختصاره VKORC) يقوم بإعادة فيتامين K إلى حالته النشطة. يعتبر إنزيم الإيبوكسيد المختزل لفيتامين K مهمًا في صناعة الأدوية باعتباره أحد المكونات الأساسية لمختلف أنواع دواء الوارفارين المضاد لتجلط الدم وما شابهه من مشتقات الكومارين، مثل الأسنوكومرول والفنبروكومون والدايكيومارول. وتسبب هذه الأدوية نقص كمية فيتامين K المختزل من خلال منع إفراز إنزيم الإيبوكسيد المختزل لفيتامين K، وبذلك يتم تثبيط نشاط عوامل التجلط. كذلك تؤدي الصور الأخرى لنقص فيتامين K (مثل سوء امتصاص فيتامين K) أو الحالات المرضية له (مثل سرطان خلايا الكبد) إلى إضعاف نشاط هذا الإنزيم وتكوين مجموعة بروتينات PIVKAs (مجموعة بروتينات تتكون في غياب فيتامين K)؛ وهذا يؤدي إلى عدم إتمام عملية إضافة الكربوكسيل إلى جلوتامات جاما أو إتمامها جزئيًا، وبالتالي يؤثر هذا على قدرة عوامل التجلط على الارتباط بجزيئات الفوسفوليبيد المحمولة.
آليات عملية تجلط الدم
هناك خمس آليات تعمل على الحفاظ على تنشيط الصفائح الدموية وتفعيل شلال التخثر بطريقة منظمة. أما حدوث خلل أو اضطراب في ذلك فيمكن أن يؤدي إلى زيادة احتمالية الإصابة بالجلطة الانسدادية:
- يعتبر بروتين C أحد العناصر الفسيولوجية الرئيسية المضادة لتجلط الدم. هذا، حيث يتم تنشيط إنزيم السيرين بروتياز الذي يعتمد على فيتامين K بواسطة الثرومبين وتحويله إلى بروتين C المنشط (APC). وتتم عملية تنشيط بروتين C من خلال سلسلة تبدأ بارتباط كل من بروتين C والثرومبين ببروتين الترومبوموديولين الموجود في غشاء الخلايا المبطنة للأوعية الدموية. ومن ثم، يربط الترومبوموديولين بين هذه البروتينات بصورة تعمل على تنشيط بروتين C. ويساهم هذا البروتين المنشط، إلى جانب بروتين S وجزيئات الفوسفوليبيد باعتبارهما من العوامل المساعدة في عملية التجلط، بدوره في تثبيط العاملين Va وVIIIa النشطين. قد يؤدي وجود نقص في المستوى الكمي أو النوعي لأي من هذه العناصر اللازمة لمنع التجلط إلى التعرض للإصابة بمرض الثرومبوفيليا (استعداد للإصابة بالجلطة الانسدادية). وقد يؤدي أيضًا ضعف تأثير بروتين C (مقاومة بروتين C النشط)، على سبيل المثال من خلال التعرض لمتغير العامل V "لايدن" أو ارتفاع مستويات العامل VIII، إلى احتمالية التعرض لخطر الإصابة بالجلطة الانسدادية.
- مضاد الثرومبين هو مثبط لإنزيم السيرين بروتياز(السربين) الذي يعمل على إضعاف تأثير عناصر عائلة السيرين بروتياز والمتمثلة في الثرومبين والعوامل IXa وXa وXIa وXIIa النشطة. ذلك، حيث إنه دائمًا يكون نشطًا، لكن ارتباطه بهذه العوامل يزيد بوجود كبريتات الهيبارين (جليكوز أمينوجليكان) أو تناول أنواع الهيبارين (تزيد الأنواع المختلفة من الهيبارين - هيبارينويد - من الارتباط بالعامل Xa النشط والثرومبين أو كليهما). ويؤدي وجود نقص في المستوى الكمي أو النوعي لمضاد الثرومبين (سواء كان يرجع ذلك لأسباب وراثية أو مكتسبة، مثل حالات الإصابة بمرض فقدان البروتين في البول) إلى الإصابة بمرض الثرومبوفيليا.
- يقوم مثبط مسار العامل النسيجي (TFPI) بالحد من تأثير العامل النسيجي. كما أنه يثبط أيضًا عملية التفعيل الزائد لكل من العاملين IX وX والتي يقوم فيها العامل النسيجي بدوره كوسيط.
- يتم إنتاج البلازمين من خلال التحلل البروتيني للبلازمينوجين؛ وهو أحد بروتينات البلازما الذي يتكون في الكبد. ويتم تحفيز هذا التحلل عن طريق منشط بلازمينوجين النسيجي (t-PA)، الذي يتكون في طبقة الإندوثيليوم الطلائية الداخلية التي تقوم أيضًا بإفرازه بعد ذلك. ويقوم البلازمين بتحليل الفبرين إلى نواتج تحلل الفبرين التي تثبط تكوّن كميات إضافية من الفبرين.
- تفرز طبقة الإندوثيليوم مادة البروستاسيلين (PGI2) التي تقوم بتنشيط المستقبلات المرتبطة ببروتين GS والموجودة على سطح الصفائح الدموية. وهذا، بدوره، يقوم بتنشيط الأدنيليل سيكلاز (الحلقي) الذي يقوم بتكوين الأدينوسين أحادى الفوسفات الحلقي cAMP، الذي يقوم بتثبيط نشاط الصفائح الدموية من خلال خفض مستويات الكالسيوم، وبالتالي يثبط إفراز الحبيبات التي من شأنها تنشيط المزيد من الصفائح الدموية وتفعيل شلال التخثر.[10]
انحلال الفبرين
- مقالة مفصلة: انحلال الفبرين
في النهاية، تتم إعادة ترتيب الجلطات الدموية وإعادة ذوبانها مجددًا من خلال عملية يُطلق عليها انحلال الفبرين. ويعتبر الإنزيم الرئيسي المسئول عن إتمام تلك العملية هو البلازمين الذي يتم تنظيم نشاطه بفعل مجموعة مختلفة من المنشطات والمثبطات.[10]
دور تجلط الدم بالنسبة للجهاز المناعي للإنسان
ثمة تداخل موجود بين عملية تجلط الدم وجهاز المناعة بالجسم. ويتمثل ذلك التداخل في القدرة الطبيعية لعملية التجلط على وقف الميكروبات التي تهاجم جسم الإنسان واحتباسها في الجلطات الدموية وذلك عند إصابته بجرح أو ما شابه ذلك. وعلاوةً على ذلك، يمكن لبعض العناصر الناتجة عن عملية تجلط الدم أن تساهم في تقوية الجهاز المناعي الفطري من خلال قدرتها على تعزيز إمكانية النفاذ للأوعية الدموية وكونها تمثل عوامل جذب الخلايا المناعية، كما توجه الخلايا البلعمية نحو مكان تواجد الميكروبات الغازية للجسم. وبالإضافة إلى ذلك، هناك بعض المواد التي تنتج خلال عملية تجلط الدم بالجسم وتعد في حد ذاتها مضادة للميكروبات. على سبيل المثال، يمكن أن يسبب بيتا لايسين؛ وهو بروتين تنتجه الصفائح الدموية خلال عملية تجلط الدم، تحلل عدد كبير من البكتيريا موجبة الجرام باعتباره محلولاً كاتيونيًا مطهرًا.[11] كما تتضمن عملية تجلط الدم العديد من بروتينات المرحلة الحادة التي تزداد مستوياتها في الدم أثناء المعاناة من الالتهابات. وإضافةً إلى ذلك، قد تفرز البكتيريا الممرضة بعض المواد التي تغيِّر من عملية تجلط الدم مثل إنزيم التجلط وإنزيم الستربتوكيناز.
اختبارات تجلط الدم
تُستخدم العديد من الاختبارات لتقييم مستوى أداء جهاز تجلط الدم وقياس معدل التجلط في الجسم:[12]
- اختبارات عامة: اختبار زمن الثرمبوبلاستين الجزئي الفعال (aPTT) واختبار زمن البروثرومبين (PT) (ويستخدم أيضًا لتحديد نسبة المعايرة الدولية لمعرفة مقياس مدى سيولة الدم - INR) واختبار قياس تركيز الفيبرينوجين (غالبًا يتم إجراؤه بواسطة طريقة Clauss) واختبار الكشف عن عدد الصفائح الدموية واختبار وظائف الصفائح الدموية (غالبًا يتم إجراؤه باستخدام جهاز محلل تماسك صفائح الدم - 100).
- اختبارات أخرى: اختبار زمن التجلط (وهو اختبار زمن الثرومبين - TCT) واختبار زمن النزف واختبار المزج (الذي يتم إجراؤه لفحص ما إذا كان سيستعيد دم المريض قدرته ويمكن تصحيح أي خلل أو اضطراب به في حالة مزج بلازما دم هذا المريض مع بلازما دم شخص طبيعي أم لا) واختبارات عوامل التجلط واختبارات أضداد الفوسفوليبيد واختبار D-dimer واختبارات الدم الجينية (مثل العامل V لايدن وطفرة البروثرومبين الوراثية G20210A) واختبار dilute Russell's viper venom time (dRVVT) المعتمد على استخدام سم أفعى راسيل، هذا إلى جانب اختبارات أخرى متنوعة لقياس وظائف الصفائح الدموية وتخطيط مرونة التجلط (TEG أو Sonoclot) واختبار زمن انحلال الجلوبولين الحقيقي (ELT).
هذا، ويبدأ مسار التفعيل بالتَمَاسّ (المسار الداخلي) بتنشيط "عوامل التَمَاسّ" الموجودة في بلازما الدم، كما يمكن فحصه من خلال اختبار زمن الثرومبوبلاستين الجزئي الفعال (aPTT).
بينما يبدأ مسار العامل النسيجي (المسار الخارجي) بإفراز العامل النسيجي (وهو بروتين دهني - ليبوبروتين - موجود في خلايا معينة)، كما يمكن فحصه من خلال اختبار زمن البروثرومبين (PT). وفي أغلب الأحيان، تظهر نتائج هذا الاختبار في صورة نسبة (تشير إلى قيمة مقياس مدى سيولة الدم - INR) بهدف حساب الجرعة المقرر تناولها من مضادات التجلط عن طريق الفم مثل دواء الوارفارين.
ويتم قياس مستوى الفبرينوجين من حيث الكم والنوع من خلال إجراء اختبار لقياس زمن تجلط الثرومبين. وعلاوةً على ذلك، يتم قياس كمية الفبرينوجين الفعلية الموجودة في الدم من خلال طريقة Clauss المستخدمة في اختبار قياس تركيز الفبرينوجين. كما يستطيع العديد من المحللين قياس مستوى "الفبرينوجين المشتق" من خلال مخطط زمن البروثرومبين المستخدم في معرفة الوقت المستغرق لتكوين الجلطة الدموية.
إذا كان عامل تجلط الدم يُمثل جزءًا من مسار التفعيل بالتَمَاسّ أو مسار العامل النسيجي، فسوف يؤثر حدوث نقص في هذا العامل في الدم على نتيجة اختبار واحد فحسب من تلك الاختبارات: هكذا سيؤدي مرض الهيموفيليا A؛ وهو نقص العامل الثامن الذي يعتبر جزءًا من مسار التفعيل بالتَمَاسّ، إلى اضطراب نتائج اختبار زمن الثرومبوبلاستين الجزئي الفعال على المدى الطويل، بينما ستظهر نتائج اختبار زمن البروثرومبين في صورة طبيعية. وهناك بعض الاستثناءات التي تتمثل في البروثرومبين والفبرينوجين وعدد من متغيرات العامل X التي يمكن فحصها فقط إما بواسطة اختبار زمن البروثرومبين الجزئي الفعال أو اختبار زمن البروثرومبين. وإذا كانت نتائج أي من الاختبارين غير طبيعية، فسوف يتم إجراء المزيد من الاختبارات لتحديد أي العوامل (إذا وجدت) كانت نسب تركيزه في الدم غير طبيعية.
وسوف يؤثر نقص مستوى الفبرينوجين (سواء من حيث الكم أو النوع) في الدم على نتائج جميع اختبارات التقصي.
تجلط الدم والإصابة بالأمراض
قد يؤدي حدوث مشكلات تعوق إتمام عملية تجلط الدم بنجاح إلى التعرض للإصابة ببعض أمراض الدم، مثل نزيف الدم والجلطة الانسدادية، وفي بعض الأحيان، تحدث الإصابة بكليهما، وهذا يتوقف على طبيعة المرض والأسباب المؤدية إليه.[13]
اضطرابات وظائف صفائح الدم
قد تكون حالات اضطراب وظائف الصفائح الدموية وراثية أو مكتسبة. وهناك عدة أنواع من اضطراب صفائح الدم الوراثي؛ منها مرض جلانزمان ومتلازمة بيرنارد سولير (وجود خلل في مستقبلات البروتين السكري Ib-IX-V الموجودة في غشاء الصفائح الدموية) ومتلازمة الصفائح السنجابية (نقص حبيبات ألفا في الصفائح الدموية) ونقص حبيبات دلتا المختزنة في الصفائح الدموية (نقص الحبيبات الكثيفة). ويعتبر معظم تلك الحالات المرضية نادرة الحدوث. وتؤدي معظم اضطرابات الصفائح الدموية الوراثية إلى حدوث النزيف الدموي. ويرجع السبب في حدوث مرض فون ويلبراند إلى نقص عامل فون ويلبراند في الدم أو وجود خلل به، كما أنه يؤدي إلى درجة أخرى من النزيف الذي تشيع حالات الإصابة البسيطة به إلى حد ما بين الأفراد.
وجدير بالذكر أنه قد يرجع انخفاض عدد الصفائح الدموية إلى أسباب عديدة، منها عدم إنتاجها بأعداد كافية (كما في متلازمة خلل التنسج النقوي أو غيرها من أمراض النخاع العظمي) أو تكسيرها عن طريق جهاز المناعة (فرفرية نقص الصفائح الدموية المناعي - ITP) وكذلك استهلاكها لأسباب كثيرة (كما في حالات فرفرية نقص خلايا التجلط - TTP - ومتلازمة التحلل الدموي البولي - HUS - وبيلة خضاب الدم الانتيابية الليلية - PNH - وهي ظهور الدم في البول، وتجلط الدم المنتشر بالأوعية الدموية - DIC - ونقص خلايا التجلط بفعل الهيبارين - HIT). تؤدي معظم حالات استهلاك الصفائح الدموية إلى تنشيط الصفائح، كما يرتبط بعضها بالإصابة بالجلطة الانسدادية.
الدور الإكلينيكي للجلطة الانسدادية والإصابة بالمرض
يعتبر مرض الهيموفيليا (نزف الدم الوراثي) بمختلف صوره من أشهر حالات اضطراب عوامل تجلط الدم. وتتمثل أشكاله الثلاثة الرئيسية في: الهيموفيليا A (الناتج عن نقص عامل تجلط الدم VIII) والهيموفيليا B (الناتج عن نقص العامل IX أو "مرض كريسماس") والهيموفيليا C (الناتج عن نقص العامل XI الذي يؤدي إلى حالات بسيطة من نزف الدم). ويعتبر كل من الهيموفيليا A وB من الاضطرابات الوراثية المتنحية المرتبطة بالصبغيات الجنسية-X؛ أي أن الإصابة تكون نسبتها أعلى في الذكور، بينما ينتقل مرض الهيموفيليا c عن طريق الوراثة المتنحية حيث إنه يعد من الاضطرابات الوراثية التي تصيب الجنسين ولكنه نادر الحدوث، إلا أنه يشيع كثيرًا بين يهود الأشكناز.
هذا، ويعد مرض فون ويلبراند (الذي يشبه إلى حد كبير اضطراب الصفائح الدموية باستثناء الحالات الشديدة منه) هو اضطراب نزيف الدم الوراثي الأكثر شيوعًا. وباعتباره مرضًا وراثيًا، فإنه إما يكون متنحيًا أو سائدًا. ويرجع سبب الإصابة بهذا المرض إلى وجود خلل في عامل فون ويلبراند الذي يعد بمثابة وسيط يربط بين البروتين السكري Ib والكولاجين. ذلك، حيث إن هذا العامل من خلال دوره كوسيط في هذا الترابط يساعد في تنشيط الصفائح الدموية وتكوين الإرقاء الأولي.
أما متلازمة برنارد سولير، فيرجع سبب الإصابة بها إلى وجود خلل في البروتين السكري Ib أو نقصه في الدم. ذلك، حيث من الممكن أن يوجد خلل في هذا البروتين السكري lb؛ وهو مستقبل عامل فون ويلبراند، مما يؤدي إلى عدم تكون الجلطة الأولية (الإرقاء الأولي) وزيادة احتمالية استمرار نزيف الدم. وبذلك فإنها تعد اضطرابًا وراثيًا متنحيًا.
من ناحية أخرى، يعد مرض ضعف الصفائح الدموية المنسوب لكل من جلانزمان وناجيلي (مرض جلانزمان) من أمراض الدم نادرة الحدوث للغاية. ومن خصائص هذا المرض وجود خلل في نشاط مستقبلات الفبرينوجين GPIIb/IIIa. عندما يوجد هذا الخلل، لا يستطيع الفبرينوجين الارتباط بالصفائح الدموية، الأمر الذي يؤدي بدوره إلى تثبيط عملية الإرقاء الأولي. وهذا يعد اضطرابًا وراثيًا متنحيًا.
أما في حالات فشل الكبد (الحالات الحادة والمزمنة على حد سواء)، لا يقوم الكبد بإنتاج عوامل تجلط الدم بشكل كافٍ، مما يؤدي إلى زيادة احتمال حدوث نزيف.
بجانب هذا، قد يؤدي نقص فيتامين K إلى اضطرابات نزفية نتيجةً لأن نشاط عوامل تجلط الدم يعتمد على وجود فيتامين K.
هذا، وتعد الجلطة الانسدادية هي الحالة المرضية الناتجة عن تكوّن جلطات الدم. قد تتحرر هذه الجلطات وتتحرك مع مجرى الدم لأماكن مختلفة بالجسم مكونةً سدادة دموية أو يكبر حجمها حتى تسبب انسداد الوعاء الدموي الذي تمر به. وقد تم التوصل إلى أن الانسداد الدموي يحدث عندما تتحرك الجلطة الدموية في صورة سدادة دموية تنتقل لمكان آخر بالجسم عبر مجرى الدم نحو أي عضو آخر، ومن ثم تعوق وظيفته مسببةً انسداد الوعاء الدموي الذي توجد به. هذا، ويؤدي وجود انسداد في الأوعية الدموية إلى الإسكيميا (قصور في الإمداد الدموي) وغالبًا ما يتسبب ذلك في الموت الموضعي لأنسجة معينة بسبب عدم تدفق كميات كافية من الدم إليها. وترجع معظم حالات الإصابة بالجلطة الانسدادية إلى مشكلات خارجية مكتسبة (مثل، أن تكون بسبب عملية جراحية أو الإصابة بمرض السرطان أو انعدام الحركة والنشاط أو المعاناة من السمنة أو متلازمة الدرجة السياحية)، لكن هناك نسبة صغيرة من الأفراد يكون لديهم قابلية أكثر للإصابة بمرض الثرومبوفيليا الوراثي؛ وهو زيادة التجلط الخلقي في الدم (كما في حالات متلازمة أضداد الفوسفوليبيد والعامل V لايدن وغيرها من أمراض الدم الوراثية الأخرى نادرة الحدوث).
ويرافق الطفرات الوراثية التي توجد في العامل XII طول فترات زمن التجلط لأسباب غير واضحة، ومن المحتمل أن يكون هناك استعداد للإصابة بمرض التهاب الوريد التجلطي. كما يرتبط العديد من الطفرات الأخرى بنوع نادر من الأوديما الوعائية الوراثية (النوع الثالث منها).
آثار الأدوية على عملية التجلط
مساعدات التجلط
تستخدم المواد الكيميائية الممتزة، مثل مركبات الزيوليت وغيرها من الأدوية المساعدة على تجلط الدم، أيضًا في وقف نزيف الجروح الخطيرة وتضميدها بسرعة (بدءًا من حالات نزيف الجروح الثانوية وانتهاءً بنزيف الجروح الناتجة عن الإصابة بطلق ناري). وكذلك يستخدم صمغ الثرومبين والفبرين في العمليات الجراحية لعلاج النزيف وإيقافه وتكوين أمهات الدم المساعدة في حدوث عملية التجلط الدموي.
وعلاوةً على ذلك، يُستخدم دواء الدزموبريسين في تحسين وظائف الصفائح الدموية من خلال تنشيط مستقبل الأرجينين فازوبريسين 1A.
وتستخدم نسب تركيز عوامل تجلط الدم في علاج مرض الهيموفيليا وإبطال تأثير مضادات التجلط وعلاج نزيف الدم لدى المرضى الذين يعانون من ضعف تكوين عوامل تجلط الدم أو من الاستهلاك المتزايد للصفائح الدموية. ويعد مركب البروثرومبين المركز وعامل التجلط المركز المصنع (المترسب بالتبريد) والبلازما الطازجة المجمدة من منتجات عوامل تجلط الدم شائعة الاستخدام. كما يشيع استخدام العامل VII البشري النشط المأشوب بصورة متزايدة في علاج حالات النزيف الشديد.
وعلاوةً على ذلك، يعمل حمض الترانيكساميك وحمض الأمينوكابرويك على تثبيط عملية انحلال الفبرين، كما أنهما يؤديان إلى خفض نزيف الدم فعليًا. وقبل سحب دواء الأبروتينين من السوق، كان يتم استخدامه في بعض الجراحات الكبيرة لخفض احتمالية التعرض لحدوث نزيف الدم وتقليل الحاجة إلى إمداد المريض بالمزيد من منتجات الدم.

مضادات التجلط
- مقالات مفصلة: مضاد الصفيحات
- مضاد تخثر
تعد مضادات التجلط والأدوية المضادة للصفائح الدموية من الأدوية الأكثر شيوعًا من حيث استخدامها. هذا، وتشمل الأدوية المضادة للصفائح الدموية الأسبرين والكلوبيدوجريل والديبيريدامول والتيكلوبيدين؛ حيث إنها تعد من مثبطات البروتين السكري IIb/IIIa التي تؤخذ عن طريق الحقن ويتم استخدامها في أثناء إجراء جراحات تقويم الأوعية الدموية.
يعد الوارفارين (وباقي مشتقات الكومارين) والهيبارين من مضادات التجلط الأكثر شيوعًا. ذلك، حيث يؤثر استخدام دواء الوارفارين على عوامل تجلط الدم التي تعتمد على فيتامين K (المتمثلة في العامل II وVII وIX وX)، بينما يعمل دواء الهيبارين وما شابهه من مركبات دوائية أخرى على زيادة تأثير مضاد الثرومبين على الثرومبين والعامل Xa النشط. وهناك مجموعة من الأدوية التي تم التوصل إليها حديثًا وتتمثل في مثبطات الثرومبين المباشرة، ولكنها ما زالت في مرحلة البحث والتطوير؛ حيث يخضع بعضها بالفعل إلى الاستخدام الإكلينيكي (مثل دواء الليبيرودين). وهناك أيضًا مجموعة أخرى من المركبات الجزيئية الصغيرة التي ما زالت قيد البحث والتطوير، حيث تعمل تلك المركبات مباشرةً على تثبيط التأثير الإنزيمي لعدد معين من عوامل تجلط الدم (مثل دواء ريفاروكسيبان).[14]
عوامل تجلط الدم
| رقم العامل و/أو اسمه | دوره في عملية تجلط الدم | الاضطرابات الوراثية المرتبطة |
|---|---|---|
| العامل I (الفبرينوجين) | تكوين الجلطة (الفبرين) | داء نشواني عائلي، فقد فيبرينوجين الدم الخلقي |
| العامل II (البروثرومبين) | يقوم العامل IIa النشط بتفعيل مجموعة من عوامل تجلط الدم ألا وهي؛ I وV وVII وVIII وXI وXIII وبروتين C والصفائح الدموية. | أهبة التخثر |
| العامل النسيجي | يعد عاملاً مساعدًا للعامل VIIa النشط (وكان يُعرف سابقًا باسم العامل III). | |
| الكالسيوم | يعد وجوده ضروريًا بالنسبة لعوامل تجلط الدم لكي يحدث الارتباط بالفوسفوليبيد (وكان يُعرف سابقًا باسم العامل IV). | |
| العامل V (طليعة الأكسيليرين، وهو عامل غير مستقر) | يعد عاملًا مساعدًا للعامل X الذي يشترك معه في تكوين مركب البروثرومبينيز. | مقاومة بروتين C المنشط |
| العامل VI | غير معروف دوره - الاسم السابق للعامل Va النشط | |
| العامل VII (عامل مستقر) | عامل دعم التحويل - يقوم بتنشيط العاملين IX وX. | نقص العامل السابع الخلقي |
| العامل VIII (العامل A المضاد للهيموفيليا) | عامل مساعد للعامل IX الذي يشترك معه في تكوين المركب الإنزيمي. | الهيموفيليا A |
| العامل IX (العامل B المضاد للهيموفيليا أو عامل كريسماس) | ينشط العامل X: حيث يشترك مع العامل VIII في تكوين المركب الإنزيمي. | الهيموفيليا B |
| العامل X (عامل ستيوارت براور) | ينشط العامل II: حيث يشترك مع العامل V في تكوين مركب البروثرومبينيز. | نقص العامل العاشر الخلقي |
| العامل XI (الاسم السابق عامل ثرومبوبلاستين البلازما) | ينشط العامل IX. | الهيموفيليا C |
| العامل XII (عامل هاجمان) | ينشط العاملين XI وVII والبريكاليكرين. | وذمة وعائية وراثية من النوع الثالث |
| العامل XIII (عامل تثبيت الفبرين) | يعمل على ترابط خيوط الفبرين ببعضها. | نقص العامل XIIIa/b الخلقي |
| عامل فون ويلبراند | يرتبط بالعامل VIII ويساهم بدوره كوسيط في تعزيز حدوث التصاق بين الصفائح الدموية. | مرض فون ويلبراند |
| البريكاليكرين (عامل فليتشر) | ينشط العامل XII والبريكاليكرين ويعمل على انحلال الكينينوجين عالي الوزن الجزيئي (HMWK). | نقص العامل بريكاليكرين |
| الكينينوجين عالي الوزن الجزيئي (عامل فيتزجيرالد) | يدعم التنشيط المتبادل بين العاملين XII وXI والبريكاليكرين. | نقص الكينينوجين |
| الفبرونكتين | يقوم بلصق الخلايا ببعضها. | اعتلال كبيبات الكلى مع ترسب الفبرونكتين |
| مضاد الثرومبين الثالث | يقوم بتثبيط العاملين IIa وXa النشطين والعديد من عائلة إنزيمات البروتياز الأخرى. | نقص مضاد الثرومبين الثالث |
| العامل II المساعد للهيبارين | يقوم بتثبيط العامل IIa النشط والعامل المساعد للهيبارين وكبريتات الديرماتان ("مضاد الثرومبين الثانوي"). | نقص العامل II المساعد للهيبارين |
| بروتين C | يثبط العاملين Va وVIIIa النشطين. | نقص بروتين سي |
| بروتين S | يعد العامل المساعد لبروتين C المنشط (APC) الذي يصبح غير فعال عندما يرتبط بالبروتين المكمل C4b. | نقص بروتين إس |
| بروتين Z | يعمل كوسيط يساعد في التصاق الثرومبين بجزيئات الفوسفوليبيد ويحفز على تثبيط نشاط العامل X بفعل مثبط إنزيم البروتياز المرتبط ببروتين Z (واختصاره ZPI). | بروتين Z |
| مثبط البروتياز المرتبط ببروتين Z | يثبط نشاط العامل X (في وجود بروتين Z) والعامل XI (منفردًا). | |
| البلازمينوجين | يتحول إلى البلازمين ويحلل الفبرين وغيره من البروتينات الأخرى. | نقص البلازمينوجين من النوع الأول |
| مضاد البلازمين ألفا 2 (مثبط البلازمين a2) | يثبط البلازمين. | نقص مضاد البلازمين |
| منشط بلازمينوجين النسيجي (t-PA) | يُفَعِّل البلازمينوجين. | فرط تحلل الفيبرين العائلي وأهبة التخثر |
| إنزيم اليوروكيناز | ينشط البلازمينوجين. | اضطراب الصفائح الدموية كيبيك |
| مثبط منشط البلازمينوجين-1 (PAI1) | يثبط تأثير منشط البلازمينوجين النسيجي وإنزيم اليوروكيناز (مثبط منشط البلازمينوجين الذي تفرزه الخلايا البطانية في الدم). | نقص مثبط منشط البلازمينوجين-1 |
| مثبط منشط البلازمينوجين-2 (PAI2) | يُبطل تأثير منشط البلازمينوجين النسيجي وإنزيم اليوروكيناز (مثبط منشط البلازمينوجين تفرزه المشيمة). | |
| مساعدات التجلط المسببة للسرطان | منشط العامل X المرضي المرتبط بالجلطة الانسدادية في حالة الإصابة بمرض السرطان |
الخلفية التاريخية لدراسة عملية تجلط الدم
الاكتشافات الأولى في هذا الصدد
لقد كان هناك العديد من النظريات التي ناقشت عملية تجلط الدم منذ زمن بعيد. ذلك، حيث قدَّم عالِم الفسيولوجيا جوهانس مولر (1801 - 1858) وصفًا للفبرين؛ وهو المادة الأساسية المكونة لأية جلطة دموية. بعد ذلك، قام العالِم رودولف فيركو (1821 - 1902) بإطلاق اسم الفبرينوجين على المادة القابلة للانحلال والسابقة لتكوُّن الفبرين، ثم قام بفصله كيميائيًا العالِم بروسبر سيلفان دنيس (1799 - 1863). وكذلك أشار العالِم ألكسندر شميدت إلى أن عملية تحوُّل الفبرينوجين إلى الفبرين تعد ناتجة عن عملية إنزيمية، وافترض أن هناك دور في هذه العملية لإنزيم أسماه "الثرومبين" والصورة السابقة المكوِّنة له "البروثرومبين".[15][16] وفي عام 1890، اكتشف العالِم أرثس أن الكالسيوم يعد عنصرًا أساسيًا لحدوث عملية تجلط الدم.[17][18] وفي عام 1865، تم اكتشاف الصفائح الدموية، وأوضح العالِم جوليو بيزوزيرو وظيفتها في عام 1882.[19]
بعد ذلك وضع العالِم بول مورويتز في عام 1905 النظرية التي تفترض أن إفراز الثرومبين يرجع إلى وجود العامل النسيجي.[20] في هذه المرحلة، تم اكتشاف أن الأنسجة التالفة تقوم بإفراز الثرومبوكيناز/ الثرومبوبلاستين (العامل III)، وذلك بالتفاعل مع البروثرومبين (العامل II) الذي يشترك مع الكالسيوم (العامل IV) في تكوين الثرومبين الذي بدوره يقوم بتحويل الفبرينوجين إلى الفبرين (العامل I).[21]
اكتشاف عوامل تجلط الدم
بصفة عامة، تم اكتشاف باقي العوامل الكيميائية الحيوية التي تساهم في حدوث عملية تجلط الدم في القرن العشرين.
لقد كان أول دليل لفك لغز جهاز تجلط الدم هو اكتشاف العالِم بول أورن (1905 - 1990) لما يُعرف باسم طليعة الأكسيليرين (وهذا ما يُشار إليه منذ البداية وحتى الآن بالعامل V). كما افترض أن دوره يتمثل في توليد الأكسيليرين (العامل VI) الذي تحَوَّل فيما بعد ليصبح العامل Va النشط. ومن ثم، لم يعد الآن يُشار إليه باعتباره العامل VI.[21]
كما تم اكتشاف العامل VII (الذي يُعرف أيضًا باسم عامل إسراع تحويل بروثرومبين الدم أو عامل دعم التحويل والذي يقوم بدوره بفعل تأثير كبريتات الباريوم) على يد مجموعة متنوعة من الباحثين من خلال مريضة شابة في الفترة ما بين 1949 و1951.
بعد ذلك، اتضح أنه يوجد نقص في مستوى العامل VIII في الحالات المصابة بمرض الهيموفيليا A التي تم التعرف عليها إكلينيكيًا ولكنها ما زالت مجهولة الأسباب؛ حيث تم التوصل إليه وتحديده في فترة الخمسينيات من القرن العشرين، وقد تم تغيير اسمه إلى الجلوبولين المضاد للهيموفيليا وهذا يرجع لمدى قدرته على علاج مرض الهيموفيليا A ومدى فاعليته في ذلك.[21]
وفي عام 1952، تم اكتشاف العامل IX في مريض شاب يُدعى ستيفين كريسماس (1947 - 1993) كان يعاني من مرض الهيموفيليا B. ذلك، حيث قام الدكتور روزماري بيجز والبروفيسور أر. جي. ماك فارلين في أوكسفورد بالمملكة المتحدة بوصف ماهية نقص مستوى هذا العامل في الجسم. ومن ثم، تمت تسمية هذا العامل باسم "عامل كريسماس" نسبةً إليه. عاش "كريسماس" في كندا ونظَّم حملات تدعو إلى ضمان السلامة أثناء عملية نقل الدم حتى وافته المنية عن عمر يناهز 46 عامًا إثر معاناته من مرض الإيدز الذي أصيب به أثناء إحدى عمليات نقل الدم الذي كان يتلقاه. كما أطلقت مجموعة مستقلة من الباحثين في كاليفورنيا اسمًا بديلاً لذلك العامل وهو عامل ثرومبوبلاستين البلازما.[21]
وفي عام 1955، تم اكتشاف عامل هاجمان، الذي يُعرف الآن باسم العامل XII، من خلال مريض يُدعى "جون هاجمان" وكان يعاني من طول فترات زمن نزيف الدم مجهول السبب ولم تَبدُ عليه أية أعراض. ثم تبع ذلك اكتشاف العامل X، أو عامل ستيوارت براور، في عام 1956. ذلك، حيث تم اكتشاف هذا البروتين لدى السيدة "أودري براور" من مدينة لندن والتي كانت تعاني من استعدادها بدرجة كبيرة للتعرض للنزيف الدموي على مدار حياتها. وفي عام 1957، اكتشفت مجموعة من الباحثين الأمريكيين العامل نفسه في السيد "روفس ستيوارت". بعد ذلك، تم اكتشاف العاملين XI وXIII في عامي 1953 و1961 على التوالي.[21]
هذا، وفي الوقت نفسه أعلن "ماك فارلين"[22] في المملكة المتحدة و"دافي" و"راتنوف"[23] في الولايات المتحدة الأمريكية على التوالي وجهة النظر التي تقر بأن عملية تجلط الدم هي عبارة عن سلسلة من المراحل والعوامل التي قد تبدو في صورة شلال تخثر الدم.
مبادئ تسمية عوامل تجلط الدم
لقد اتفق علماء الطب خلال المؤتمرات السنوية التي كان يحضرها خبراء متخصصون في عملية الإرقاء ووقف النزيف (بدايةً من عام 1955) على استخدام الأرقام الرومانية في تسمية عوامل تجلط الدم بدلاً من تسميتها نسبةً إلى المرض أو إلى أحد الأشخاص وكذلك بدلاً من استخدام الأسماء النظامية. وفي عام 1962، تم الإجماع على استخدام الأرقام الرومانية للدلالة على عوامل تجلط الدم بدايةً من العامل I وحتى العامل XII.[24] وقد تطورت هذه اللجنة حتى أصبحت اللجنة الدولية لأمراض التجلط والسيولة (ICTH). وفي عام 1963، تم التوقف عن استخدام الأرقام الرومانية في الإشارة إلى باقي عوامل تجلط الدم وذلك بعد تسمية العامل XIII. ذلك، حيث تم إطلاق مصطلحي عامل فليتشر وعامل فيتزجيرالد على نوعين آخرين من البروتينات المرتبطة بعملية تجلط الدم، هما على وجه التحديد البريكاليكرين والكينينوجين عالي الوزن الجزيئي على التوالي.[21]
ولم يتم تحديد العاملين III وVI؛ لأنه لم يكن قد تم اكتشاف الثرومبوبلاستين، حيث اتضح فعليًا فيما بعد تكوُّنه من عشرة عوامل أخرى، كما تم التوصل إلى أن الأكسيليرين هو العامل الخامس V النشط.
آلية عملية تجلط الدم في الكائنات الأخرى
تتشابه جميع الثدييات تقريبًا في آلية عملية تجلط الدم التي تتم بها إلى حد كبير، وذلك من خلال العملية المشتركة التي تُجرى بين الخلايا وعائلة إنزيمات السيرين بروتياز. في الواقع، من الممكن أن يقوم أي عامل من عوامل تجلط الدم الموجودة في أي كائن ثديي بتكسير العامل المكافئ له في أي كائن ثديي آخر. ويعد الحيوان الوحيد غير الثديي المعروف أنه تتم به عملية تجلط الدم من خلال عائلة إنزيمات السيرين بروتياز هو حيوان بحري يشبه حدوة الحصان في الشكل يسمى سرطان حدوة الحصان.[25]
المراجع
- David Lillicrap; Nigel Key; Michael Makris; Denise O'Shaughnessy (2009). Practical Hemostasis and Thrombosis. Wiley-Blackwell. صفحات 1–5. .
- Alan D. Michelson (26 October 2006). Platelets. Academic Press. صفحات 3–5. . مؤرشف من الأصل في 16 يناير 202018 أكتوبر 2012.
- Schmaier, Alvin H.; Lazarus, Hillard M. (2011). Concise guide to hematology. Chichester, West Sussex, UK: Wiley-Blackwell. صفحة 91. .
- Furie B, Furie BC (2005). "Thrombus formation in vivo". J. Clin. Invest. 115 (12): 3355–62. doi:10.1172/JCI26987. PMC . PMID 16322780. مؤرشف من الأصل في 13 مايو 2012. ببمد سنترال 1297262
- Nigel Key; Michael Makris; et al. (2009). Practical Hemostasis and Thrombosis. Wiley-Blackwell. صفحة 2. .
- Pallister CJ, Watson MS (2010). Haematology. Scion Publishing. صفحات 334–336. .
- Pallister CJ, Watson MS (2010). Haematology. Scion Publishing. صفحات 336–347. .
- Hoffbrand, A. V. (2002). Essential haematology. Oxford: Blackwell Science. صفحات 241–243. .
- Long, Andrew T.; Kenne, Ellinor; Jung, Roman; Fuchs, Tobias A.; Renné, Thomas (2015). "Contact system revisited: An interface between inflammation, coagulation, and innate immunity". Journal of Thrombosis and Haemostasis. 14: 427–437. doi:10.1111/jth.13235.
- Hoffbrand, A. V. (2002). Essential haematology. Oxford: Blackwell Science. صفحات 243–245. .
- IMMUNOLOGY - CHAPTER ONE> INNATE (NON-SPECIFIC) IMMUNITY Gene Mayer, Ph.D. Immunology Section of Microbiology and Immunology On-line. University of South Carolina نسخة محفوظة 21 أكتوبر 2014 على موقع واي باك مشين.
- David Lillicrap; Nigel Key; Michael Makris; Denise O'Shaughnessy (2009). Practical Hemostasis and Thrombosis. Wiley-Blackwell. صفحات 7–16. .
- Hatton, Chris (2008). Haematology (Lecture Notes). Cambridge, MA: Blackwell Publishers. صفحات 145–166. .
- Soff GA (569–74). "A new generation of oral direct anticoagulants". Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3): March 2012. doi:10.1161/ATVBAHA.111.242834. PMID 22345595.
- Schmidt A (1872). "Neue Untersuchungen ueber die Fasserstoffesgerinnung". Pflüger's Archiv für die gesamte Physiologie. 6: 413–538. doi:10.1007/BF01612263.
- Schmidt A. Zur Blutlehre. Leipzig: Vogel, 1892.
- Arthus M, Pagès C (1890). "Nouvelle theorie chimique de la coagulation du sang". Arch Physiol Norm Pathol. 5: 739–46.
- Shapiro SS (2003). "Treating thrombosis in the 21st century". N. Engl. J. Med. 349 (18): 1762–4. doi:10.1056/NEJMe038152. PMID 14585945.
- Brewer DB (2006). "Max Schultze (1865), G. Bizzozero (1882) and the discovery of the platelet". Br. J. Haematol. 133 (3): 251–8. doi:10.1111/j.1365-2141.2006.06036.x. PMID 16643426.
- Morawitz P (1905). "Die Chemie der Blutgerinnung". Ergebn Physiol. 4: 307–422.
- Giangrande PL (2003). "Six characters in search of an author: the history of the nomenclature of coagulation factors". Br. J. Haematol. 121 (5): 703–12. doi:10.1046/j.1365-2141.2003.04333.x. PMID 12780784.
- MacFarlane RG (1964). "An enzyme cascade in the blood clotting mechanism, and its function as a biochemical amplifier". Nature. 202: 498–9. doi:10.1038/202498a0. PMID 14167839.
- Davie EW, Ratnoff OD (1964). "Waterfall sequence for intrinsic blood clotting". Science. 145: 1310–2. doi:10.1126/science.145.3638.1310. PMID 14173416.
- Wright IS (1962). "The nomenclature of blood clotting factors". Can Med Assoc J. 86: 373–4. PMC . PMID 14008442. ببمد سنترال 1848865
- Osaki T, Kawabata S (June 2004). "Structure and function of coagulogen, a clottable protein in horseshoe crabs". Cellular and Molecular Life Sciences : CMLS. 61 (11): 1257–65. doi:10.1007/s00018-004-3396-5. PMID 15170505.
وصلات خارجية
بِنى ثلاثية الأبعاد
- قاعدة بيانات توجهات البروتينات في الأغشية families/superfamily-97 - اتجاهات المركبات المعدودة التي تحتوي على نطاقات جاما كربوكسي جلوتاميك أسيد (GLA domains) وتوجد في الغشاء الخلوي
- قاعدة بيانات توجهات البروتينات في الأغشية families/superfamily-48 - النطاقات قرصية الشكل الخاصة بعوامل تجلط الدم