| Acide oléique | ||
| ||
 | ||
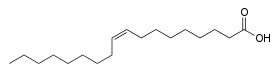
| Structure de l'acide oléique | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Acide cis-octadéc-9-énoïque | |
| No CAS | ||
| No ECHA | 100.003.643 | |
| No CE | 204-007-1 | |
| PubChem | ||
| FEMA | 2815 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, devient jaune à brun lors d'exposition à l'air[1] | |
| Propriétés chimiques | ||
| Formule | C18H34O2 [Isomères] |
|
| Masse molaire[2] | 282,461 4 ± 0,017 4 g/mol C 76,54 %, H 12,13 %, O 11,33 %, 282.26 g/mol |
|
| pKa | 5,02[3] | |
| Propriétés physiques | ||
| T° fusion | 13,4 °C[1] | |
| T° ébullition | 360 °C 194 à 195 °C (1,2 mmHg) 286 °C (100 mmHg) |
|
| Solubilité | dans l'eau : nulle[1]. Soluble dans l'éthanol, le benzène, le chloroforme, l'éther |
|
| Masse volumique | 0,898 g·cm-3[4] | |
| T° d'auto-inflammation | 363 °C[1] | |
| Point d’éclair | 189 °C (coupelle fermée)[1] | |
| Pression de vapeur saturante | 1 mmHg à 176 °C | |
| Thermochimie | ||
| Cp | ||
| Propriétés optiques | ||
| Indice de réfraction | 1,458 2[4] | |
| Précautions | ||
| SIMDUT[6] | ||
Produit non contrôlé |
||
| Directive 67/548/EEC | ||
 Xi |
||
| Écotoxicologie | ||
| DL50 | 230 ± 18 mg·kg-1 (souris, intra-veineuse) |
|
| Composés apparentés | ||
| Isomère(s) | Acide élaïdique | |
| Unités du SI et CNTP, sauf indication contraire. | ||
L'acide oléique est un acide gras mono-insaturé à 18 atomes de carbone, son nom vient du latin oleum qui signifie « huile ». C'est le plus abondant des acides gras dans la nature. Il est le plus abondant dans le tissu adipeux humain et le plasma.
Sa formule chimique brute est C18H34O2 (ou CH3(CH2)7CH=CH(CH2)7COOH). Son nom IUPAC est Acide cis-9-octadécamonoénoïque, et son nom court de lipide est 18:1 cis-9. La forme saturée de cet acide est l'acide stéarique.
Structure
On le symbolise par les nombres 18:1 pour indiquer qu'il possède 18 atomes de carbone et une liaison éthylénique. Pour montrer la position de la double liaison, on préfère indiquer le nombre de carbones entre le dernier carbone (n° 18) et le carbone où commence la double liaison (n° 9), d'où 18 - 9, qu'on écrit n - 9, en désignant par n le nombre de carbones de la chaîne. L'acide oléique est donc un acide gras insaturé, plus précisément mono-insaturé.
Aspect physique
La double liaison agit sur la forme de la molécule et des triglycérides qu’elle forme avec le glycérol. Comme la molécule ne peut pas pivoter autour de C = C, la chaîne est beaucoup moins flexible que l’acide stéarique et ne peut pas former de boule. Les molécules des esters de cet acide sont beaucoup moins compactes que la tristéarine : ce sont des huiles.
À la température de notre corps, c'est un liquide (huile) qui ne se solidifie qu'à 13,4 °C.
Données
- Aspect : Liquide jaune pâle ou jaune brunâtre à forte odeur de lard.
- Solubilité : insoluble dans l'eau.
- Point de fusion : 13,4 °C
- Point d'ébullition : 360 °C
- Densité : 0,9 g·cm-3
Origine
Son nom vient de l'huile d'olive dont il constitue 55 % à 80 %, mais il est abondant dans toutes les huiles animales ou végétales, par exemple dans l'huile de pépins de raisin (15 % à 20 %) ou le beurre de karité (40 % à 60 %)[7].
C'est un excellent aliment énergétique. Il est utilisé pour la fabrication des savonnettes. Il est l'un des composants de l'huile de Lorenzo.
| Pourcentage massique | |
|---|---|
| Huile de noisette | 77,800 |
| Huile d'olive | 72,294 |
| Huile d'avocat | 67,889 |
| Huile de colza | 56,100 |
| Huile d'arachide | 44,800 |
| Graisse de canard | 44,200 |
| Saindoux | 41,200 |
| Huile de sésame | 39,300 |
| Graisse de mouton | 37,600 |
| Huile de palme | 36,600 |
| Graisse de bœuf | 36,000 |
| Beurre de cacao | 34,00 |
| Huile de maïs | 27,333 |
| Huile de soja | 22,800 |
| Huile de noix | 22,200 |
| Beurre doux | 19,961 |
| Huile de tournesol | 19,500 |
| Huile de lin | 18,115 |
| Huile de pépins de raisins | 15,800 |
| Huile de germe de blé | 14,600 |
| Beurre allégé doux | 13,867 |
| Huile de palmiste | 11,400 |
| Huile de noix de coco | 5,800 |
Réactivité chimique
La réactivité chimique de l'acide oléique est celle de sa double liaison C=C et de sa fonction acide carboxylique.
Réactivité de la double liaison C=C
La double liaison est une insaturation qui peut être réduite par l'action du dihydrogène en présence d'un catalyseur. Il se forme alors l'acide stéarique.
Les dihalogènes comme le dibrome ou le dichlore réagissent également avec cette double liaison en se fixant. La réaction avec le diiode est utilisée pour la mesure de l'indice d'iode.
Réactivité de la fonction carboxylique
La fonction carboxylique -COOH possède une hydrogène acide (hydrogène mobile) qui peut réagir avec une base comme la soude. Il se forme alors un ion carboxylate -COO−. La présence de ce groupe augmente la solubilité dans l'eau de cette espèce chimique. Pour autant, la propriété essentielle de l'oléate de sodium est d'être un tensioactif. Le mélange biphasique d'acide oléique et d'eau avec de la soude donne un système laiteux (blanc) qui mousse quand il est agité.
Références
- 1 2 3 4 5 ACIDE OLEIQUE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Riddick, J.A., W.B. Bunger, Sakano T.K. Techniques of Chemistry 4th ed., Volume II. Organic Solvents. New York, NY: John Wiley and Sons., 1985., p. 379
- 1 2 (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-859-4)
- ↑ « Acide oléique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Davrieux, F., Allal, F., Piombo, G., Kelly, B., Okulo, J.B., Thiam, M., Diallo, O.B. & Bouvet, J.-M. (2010) Near Infrared Spectroscopy for High-Throughput Characterization of Shea Tree (Vitellaria paradoxa) Nut Fat Profiles. Journal of Agricultural and Food Chemistry, 58, 7811-7819.



