Cochenilles
Heslop-Harrison, 1952
Handlirsch, 1903

Les cochenilles (Coccoidea) forment une super-famille d'insectes hémiptères du sous-ordre des Sternorrhyncha.
On en compte près de 8 500 espèces[1],[2] réunies en 21 à 24 familles. Elles vivent dans une grande variété d'habitats ; des toundras (environ 2 000 espèces connues en écozone paléarctique[2]) jusqu'à l'équateur. Ces insectes étaient autrefois nommés « poux des plantes » en raison de leurs pièces buccales transformées en rostre piqueur leur permettant d'aspirer la sève, soit de la sève élaborée pour certains groupes, aspirée dans le phloème, soit de la sève brute prélevée dans le xylème, alors que quelques espèces aspirent les liquides des parenchymes cellulaires[2]. Celles qui vivent en zones tropicales chaudes sont plus grandes que celles des zones tempérées. Les femelles produisent généralement une grande quantité de sécrétions tégumentaires (cires ou laques) qui les protègent et parfois les recouvrent complètement[2].
Les Coccoidea se nourrissent d'une large variété de plantes, si bien que la plupart d'entre eux sont considérés comme des nuisibles.
Les cochenilles sont des insectes communs, ou devenus communs, voire localement envahissantes, mais dont l'écologie reste mal connue.
Description






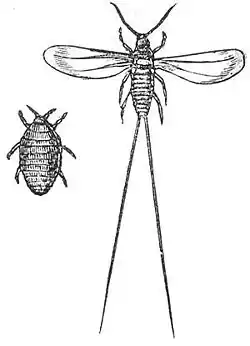
Les cochenilles sont toutes des parasites des végétaux, à fort dimorphisme sexuel. Le mâle adulte est un insecte ailé ne possédant qu'une paire d'ailes antérieures. Ses ailes postérieures sont réduites à des structures nommées hamulohaltères, des antennes et des pattes (tarses uni-articulés) développées. Il n'a pas de pièces buccales et ne vit qu'un à deux jours, le temps de se reproduire. Chez la plupart des familles de cochenilles, la femelle est aptère, à l'aspect néoténique et peut avoir des antennes et pattes réduites (beaucoup vivent fixées sur des végétaux). La femelle ressemble à une Larve en forme d'écaille, de galle ou couverte de cire[3], alors que d'autres familles comme les Diaspididae peuvent avoir une disparition totale des pattes chez la femelle adulte, qui reste complètement fixée sur la plante.
En zone tempérée, elles ne mesurent au mieux que quelques mm, mais des espèces du genre Callipappus atteignent 40 mm de long. En Afrique, Aspidoproctus maximus (Lounsbury, 1908) mesure jusqu'à 35 mm de long et 20 mm de largeur[4].
Certaines cochenilles sécrètent une matière d'apparence cotonneuse, constituée de fins filaments cireux ou d'écailles cireuses. Certaines espèces ont une salive toxique : lorsque la plante est parasitée par un nombre important de cochenilles, on peut voir apparaitre sur les feuilles des taches noires correspondant aux toxines qui s'accumulent jusqu'à créer une petite lésion. La feuille finit par tomber, se recroqueviller, jaunir ou se nécroser, selon les espèces.
Pour certaines espèces très petites (difficiles à observer et à remarquer sur la plante), on peut déceler leur présence au niveau des jeunes feuilles : les cochenilles se fixent sur la jeune feuille en émergence, profitant d'une arrivée constante de sève, et d'un matériel plus tendre, donc plus facile à percer. La conséquence est un sous-développement de la nouvelle feuille au niveau de la piqûre. Tout autour de celle-ci, la feuille est beaucoup moins développée et peut apparaitre légèrement difforme, à cause de la dissymétrie engendrée par le manque local de sève. On peut vérifier s'il s'agit bien de cochenilles en laissant la feuille sur la plante, durant quelques jours ou quelques semaines, selon la vitesse de développement de la plante : l'insecte va se nourrir de manière quasi-continue, produisant son bouclier de cire : cela se traduira par une fine couche (en général brun clair) présente tout autour de l'encoche. En grattant doucement, on décolle en un seul coup l'intégralité de cette petite plaque fine à moins qu'il y en ait deux toutes proches l'une de l'autre. Avec une très bonne loupe ou un petit microscope amateur, en observant la partie de la plaque collée à la feuille, on trouve près de son centre les membres de l'insecte qui lui permettaient de rester fermement attaché à la plante.
Reproduction et cycle de vie
Le système de reproduction au sein de ce groupe est très hétérogène.
Les cochenilles sont presque toujours ovipares mais certaines espèces sont ovovivipares (les œufs pondus sont déjà embryonnés), et d'autres sont vivipares[2].
L'hermaphrodisme est possible, par exemple chez certaines espèces du genre Icerya (Monophlebidés) : chez ces espèces, dont la Cochenille australienne, chaque individu porte à la fois des organes reproducteurs mâles et femelles. L'œuf fécondé produit un hermaphrodite, et celui qui échapperait à l'autofécondation (phénomène rare) produira par parthénogenèse arrhénotoque un mâle ailé[2]. On connait aussi au moins sept formes de parthénogenèse chez les cochenilles[5]. Plusieurs de ces modes de reproduction peuvent coexister au sein d'une même espèce, produisant alors à la fois des lignées parthénogénétiques et bisexuées. C'est le cas en France par exemple pour la Lécanine du cornouiller, la Lécanine de la vigne, le Pou des Hespérides ou le Cochenille virgule du pommier[2].
La parthénogenèse consiste en développement d'œuf non fécondés ; elle peut être de trois types[2]:
- type thélytoque : les œufs non fécondés ne produisent que des femelles ; c'est toujours le cas chez quelques Diaspididés et Margarodidés ;
- type facultatif : les œufs non fécondés produisent des femelles, mais la reproduction bisexuée donne des individus des deux sexes ;
- type arrhénotoque : de l'œuf non fécondé ne sortent que des mâles.
La fécondation : à l'émergence, les mâles sexuellement mûrs partent à la recherche des femelles, guidés par leurs phéromones. Ils s'accouplent en quelques minutes — plusieurs mâles peuvent être observés sur une même femelle, s'accouplant les uns après les autres[2] —.
Les cochenilles connaissent trois principaux stades de développement[2] :
- l'œuf ;
- la larve femelle est mobile, éruciforme, avec trois ou quatre stades larvaires : L1, L2 et L3 et éventuellement L4 ; la femelle a un développement post-embryonnaire dit paramétabolique : sans métamorphose, avec des larves ressemblant plus ou moins à des adultes miniatures, pour leur forme autant que pour leur mode de vie ;
- le mâle passe par cinq stades ; 1er et 2e stades larvaires, puis stades « prénymphe », « nymphe » et adulte. Au contraire de la femelle, le mâle connait un développement post-embryonnaire holométabole ;
- l'adulte : la femelle, le plus souvent fixée, pond de nombreux œufs très petits, déposés sous ou derrière elle, dans un coussinet de cire blanche.
Le nombre de générations par an varie selon l'espèce et le climat. L'espèce est dite univoltine quand elle ne produit qu'une génération par an et bi-, tri- ou poly-voltine quand elle en produit plusieurs.
La fécondité[2] diffère selon les espèces et les contextes, notamment selon le taux de parasitisme ;
- Les Parlatoria (diaspididés) ne pondent que 15 à 20 œufs par femelle.
- Au contraire, les Eulecanium et Saissetia (comme la Cochenille noire de l'olivier) pondent jusqu'à 2 000 œufs par femelle, mais les Aspidoproctus (monophlebidés) peuvent en pondre 3 fois plus (jusqu'à environ 6 000).
Mobilité
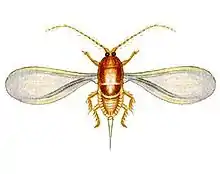
Le mâle est ailé et vole. À l'état adulte, la femelle n'est pas mobile, sauf chez les Pseudococcidae, et se nourrit en se fixant sur les tiges ou les feuilles de certaines plantes dont elle suce la sève. Certaines familles peuvent avoir des cochenilles femelles avec des appendices développés tels que chez les Ortheziidae[3], alors que d'autres familles comme les diaspididae peuvent avoir une disparition totale des pattes chez la femelle adulte, pour rester complètement fixée sur la plante.
C'est au stade de nymphe que cet animal se disperse et colonise de nouveaux arbres, d'autres plantes ou de nouvelles parties de sa plante hôte. Certaines larves au 1er stade se déplacent activement (c'est le cas par exemple pour la Cochenille blanche du palmier-dattier (Parlatoria blanchardi Targioni Tozzetti, 1868). Certaines se laissent emporter par le vent ou sont transportées par des fourmis qui les approchent de leur colonies pour récolter leur miellat. Au second stade, dans certaines familles comme les Coccidae et les Kermesidés, les larves se fixent définitivement, jusqu'à leur mort par exemple pour les diaspididés femelles, ou jusqu'à la mue imaginale pour le mâle. Beaucoup d'espèces sont encore mobiles au second stade. Dans quelques familles comme les pseudococcidés ou les ortheziidés), la femelle reste mobile toute sa vie.
Mécanismes d'adaptation, défense et protection

Ils sont nombreux, et probablement encore imparfaitement compris[2] :
- Certaines espèces ont développé des symbioses avec les fourmis qui les défendent en échange de leur miellat.
- Les boucliers, jouant parfois un rôle de camouflage, et les protections cireuses les protègent de certains prédateurs et de la déshydradation
- Les femelles se positionnent sur des parties des plantes où elles sont mieux cachées, ou là où elles peuvent profiter du ruissellement des eaux de pluies.
- Quelques genres (Kuwania, Xylococcus, Matsucoccus dont la Cochenille du pin maritime) se protègent dans la plante (sous les écorces, dans les gaines foliaires ou dans les nœuds de graminées ou sur des racines non visibles.
- Les Eriococcidés se protègent dans un sac qu'elles construisent au fur et à mesure de leur croissance. Les cochenilles Diaspines recyclent leurs exuvies dans leur bouclier protecteur, élaboré à partir de sécrétions cimentées par le liquide anal.
- Les larves de certaines espèces hypogées (de la famille des Margarodidés) peuvent en cas de stress hydrique retarder leur mue imaginale, se protéger sous un test étanche qu'elles élaborent au moyen de leurs sécrétions, pour y survivre le temps que les conditions extérieures redeviennent plus clémentes.
- Des stratégies variées de protection des œufs et jeunes larves existent. Ce sont les ovisac solides et structurés de la Cochenille australienne ou des Pulvinaria, ou des tapis de filaments cireux enchevêtrés par la femelle Porphyrophora. Chez les Ortheziidés, les femelles mobiles transportent leur ovisac. Les femelles d'autres espèces (Kermesidés et beaucoup de Coccidae) protègent leurs œufs sous leur bouclier ou sous leurs corps. En Australie, les femelles du genre Callipappus génèrent une poche « marsupiale » en invaginant leurs segments abdominaux postérieurs et y pondent directement. Les jeunes larves y grandiront. Le genre Apiomorpha crée des galles sur les eucalyptus (tumeurs creuse de la plante provoquées en particulier par l'injection de salive) et les larves s'y développent protégées de leurs prédateurs.
Parasitisme
Ce sont des parasites qui tuent rarement leurs hôtes, mais qui peuvent les affaiblir et poser problème en agriculture, horticulture, sylviculture et dans les vergers. En France, environ 110 espèces sont occasionnellement nuisibles et quelques espèces sont considérées comme ravageuses (ce sont surtout des diaspididés, coccidés, pseudococcidés ou margarodidés).
- Certaines infestations d'arbres, rameaux et feuilles par des cochenilles sont en train de devenir caractéristiques des milieux urbains ou très anthropisés. On les trouve aussi parfois sur ou sous des objets adjacents (ex. : les colliers qui lient l'arbre aux tuteurs).
- Quand ils sont nombreux sur les feuilles ou tiges, ces insectes peuvent faire des ravages sur les arbres fruitiers et en particulier les pommiers.
- La Cochenille du pin maritime a peut-être été favorisée par les monocultures de pins et le recul de ses prédateurs (ex : la punaise Elatophilus nigricornis Zetterstedt est un anthocoridé prédateur spécialiste de cette espèce, utilisé en lutte intégrée). Elle a tué les pins maritimes sur environ 120 000 ha dans le Var et les Alpes-Maritimes et elle colonise la Corse[6],[7].
- Le Pou de San José polyphage affaiblit les arbres et arbustes fruitiers.
- La cochenille du mûrier s'attaque aux pêchers de vergers et aux cassissiers[8]. On peut la combattre par la lutte biologique avec un de ses prédateurs (Hyménoptère endoparasite), Encarsia berlesei (Howard)[9], ainsi que par l'hyménoptère ectoparasite Aphytis proclia (Walker)[10] ou une petite coccinelle Rhizobius satelles (Blaisdell)[11].
- Antonina graminis s'attaque aux herbacées graminées, et peut produire des taches jaunes dans le gazon de golf[12].
- Une dizaine d'espèces sont observées sur la vigne, quelques espèces devenant parfois localement et momentanément nuisibles : cochenille floconneuse de la vigne (Pulvinaria vitis L.), floconneuse de l'érable (Neopulvinaria innumerabilis (Rathvon), lécanine du cornouiller, (Parthenolecanium corni, Bouché), cochenille farineuse du citronnier (Planococcus citri, Risso), avec en cas de larges pullulations des pertes importantes. Elles peuvent transmettre des maladies dont les « virus de l'enroulement » de la vigne (transmis selon l'INRA par la cochenille bohémienne (Heliococcus bohemicus), la cochenille du platane (Phenacoccus aceris) et la lécanine du cornouiller (Parthenolecanium corni, Bouché).
Pour les infestations très locales, des alternatives[13] aux pesticides toxiques sont le nettoyage à l'eau sous pression, la pulvérisation d'une solution de savon noir avec 1 % d'alcool à brûler ou un peu d'huile de soja. Favoriser la présence et la survie de coccinelles sauvages, de syrphes et de leurs larves, ainsi que d'une grande richesse en insectes et oiseaux — en particulier ceux qui mangent les fourmis qui protègent les pucerons et cochenilles — permet aussi d'éviter les pullulations.
Répartition
Les introductions par l'homme et la mondialisation des échanges de plantes a bouleversé la répartition de certaines espèces. On en a par exemple dénombré 159 espèces en Sicile dont près de la moitié au moins sont des parasites des cultures récemment introduits. On en compte 343 en Italie. Les mieux connues sont celles qui parasitent les espèces cultivées.
Ils sont réputés peu mobiles et donc à faible risque de dissémination. Ils sont pourtant en Europe en pleine expansion, notamment sur les arbres urbains stressés par la pollution ou le contexte urbain et peut-être via les transports de plants parasités. Les petites larves semblent pouvoir être transportées par le vent.
Pullulations
Les pullulations de cochenilles hors de leur milieu naturel, en climat urbain et périurbain notamment, sont de plus en plus fréquentes, sur tous les continents, et elles sont mal comprises. Plusieurs facteurs semblent pouvoir les favoriser, allant d'une moindre défense de l'arbre ou de la plante parasitée à la suite d'un manque d'eau, l'exposition à certains polluants urbains ou la présence d'un couple thermohygrométrique anormal. Une explication essentielle semble être la régression ou disparition de leurs prédateurs naturels (notamment en ville) ; avec en particulier :
- certaines espèces de coccinelles et leurs larves,
- les larves de Syrphidés,
- les chenilles de Pyralidés,
- les microhyménoptères (Chalcidiens et Braconidés) qui parasitent et contrôlent les cochenilles dans la nature.
Ces prédateurs naturels des cochenilles semblent fortement régresser et ont souvent localement disparu. L'augmentation générale du taux de pesticides et de certains polluants dans l'air, les pluies, les brumes ou rosées pourraient être en partie responsables de la disparition de ces prédateurs.
Ennemis naturels
Leurs principaux ennemis (voir ci-dessus), dont certaines espèces de coccinelles prédatrices et de microhyménoptères parasites semblent en voie de forte régression.
Certaines espèces de guêpes ou de fourmis sont réputées pour les épargner et consommer leur miellat, mais divers hyménoptères dont Metaphycus helvolus ou Metaphycus lounsburyi parasitent les stades larvaires ou à l'adulte. La mouche Diversinervus elegans parasite l'adulte ou la larve[14]. Quelques prédateurs de cet insecte ont été utilisés en lutte biologique, dont Chilicorus renipustulatus et Chilicorus nigritus, deux petites coccinelles qui se nourrissent de diverses espèces de cochenilles (diaspines et lécanines).
Pathogénicité

Comme tous les insectes piqueurs-suceurs, ces espèces (notamment introduites) sont potentiellement dangereuses pour les plantes, à cause de leur ponction de sève, du rejet de miellat qui peut provoquer des fumagines, et du fait des virus[15] qu'elles peuvent contribuer à introduire dans la sève ou les tissus qu'elles perforent, mais aussi en raison de l'absence de prédateur spécifique dans le pays d'accueil.
Les larves ou œufs ou individus adultes sont supposés fréquemment introduits ailleurs que dans leur zone d'origine avec les transports à longue distance de plantes vertes, plantes en pots, arbres de pépinières, fruits et légumes. Par exemple, une Cochenille jusqu'ici inconnue en Europe, Ripersiella hibisci, a été identifiée dans des plants de Callistemon en pot provenant d'Italie, vendus en Suisse au printemps 2021[16].
Traitements horticoles
Le bouclier ou les fibres cireuses qui protègent ces insectes et leurs œufs les rendent moins vulnérables aux pesticides externes. Les solutions aqueuses leur glissent dessus si l'on n'y ajoute pas d'agents mouillants (savon noir, liquide vaisselle...).
On évitera les huiles insecticides (huile blanche) en traitement d'hiver.
Autre moyen à éviter car favorisant l'apparition de formes résistantes, est l'utilisation de pesticides systémiques (substances pénétrant la plante et empoisonnant l'insecte suceur via la sève, dans toutes les parties de la plante, y compris racines) . Du fait des œufs, il faut retraiter une semaine à dix jours après contre larves écloses dans l'intervalle. L'inconvénient de cette solution est qu'elle peut également empoisonner les prédateurs naturels des cochenilles.
Il faut traiter toutes les plantes concernées et en cas de récidive examiner d'éventuelles sources de recontamination dont certaines plantes adventices.
En jardinage, selon la gravité, les espèces à protéger et les types de cochenilles, différentes méthodes peuvent être utilisées[17].
Intérêt économique ou culinaire


Certaines espèces ont joué un rôle économique, qui a décliné depuis l'invention des substances de synthèse.
Des cochenilles peuvent être utilisées pour produire :
- des laques, comme le shellac issu de l'espèce Kerria lacca qui parasite le jujubier (Zizyphus mauritiana), le kussam (Schleichera oleosa), le palas (Butea monosperma), le ghont (Zizyphus xyloporus) ou le figuier des pagodes (Ficus religiosa). Son extrait est utilisé pour fabriquer des dragées pharmaceutiques, l'enrobage de certains chocolats « qui ne fondent pas dans la main » et autrefois parmi les premières matières plastiques (premiers disques 78 tours)[7] ;
- du carmin ou rouge écarlate produit depuis l'antiquité[18],[7] à partir de cochenille Kermes vermilio dite Kermès des teinturiers ou « graines écarlates », vivant sur le chêne kermès en Espagne et autour de la Méditerranée. La matière colorante est constituée d'acide kermésique (pigment du type anthraquinone, et d'acide laccaïque qu'on a détecté sur des momies égyptiennes et même dans certaines peintures préhistoriques. Ce colorant a été utilisé comme remède jusqu'au XVIIIe siècle (astringent pour les plaies, décongestionnant pour les yeux). Fillipo Silvestri estime même que l'extrait de cette cochenille a été la Confectio Alkermes, le médicament le plus prescrit aux VIIIe et IXe siècles. L'Alkermes est une boisson italienne encore fabriquée avec cette cochenille.
- En Amérique centrale et du sud (Mexique, Pérou), on tire de Dactylopius coccus (Costa, 1835), nourri sur le figuier de Barbarie (Opuntia ficus-indica), un carmin rouge cramoisi constitué d'acide carminique pur (anthraquinone résistante au lavage). 70 000 cochenilles produisent 500 gr de carmin.
Il a été utilisé pour teindre les tissus, la peau, des poteries ou comme colorant alimentaire, depuis au moins Les envahisseurs espagnols ont élevé en secret ces cochenilles, entre autres à Malaga, et dès 1626 aux îles Canaries dans des « nopaleries ». La cochenille de Pologne et la cochenille d'Arménie produisent aussi un colorant rouge.
Les colorants chimiques de synthèse ont concurrencé cette production à partir des années 1850, mais elle se poursuit au Pérou comme colorant alimentaire ou pour l'histologie (« carmin n° 40 pour histologie »)[7]. - Les Aztèques, Incas et Mayas extrayaient un rouge carmin et l'aje à partir de grosses cochenilles de 2 cm de long. L'aje est une sécrétion jaune, graisseuse et imperméabilisante produite par Llaveia axin (Llave). Il servait aussi de base aux peintures (dont sur le visage). Poteries, bateaux, bois ou gourdes étaient imperméabilisés par de l'aje. Enfin, l'aje était aussi un remède contre la diarrhée et un analgésique contre la goutte. En altitude, il protégeait la peau des engelures et gerçures[7].
- La manne, évoquée dans la Bible, qui aurait nourri les Hébreux lors de leur traversée du désert pourrait avoir été le miellat cristallisé d'une cochenille, pouvant être Trabutina mannipara (Hemprich & Ehrenberg, 1829), une pseudococcine vivant sur le tamaris (Tamarix sp.) dans les montagnes du Sinaï — il pourrait aussi s'agir de colonies de bactéries de type nostoc —. La cochenille, étant un insecte, n'est pas un aliment autorisé dans le judaïsme selon la Bible[19], mais le miellat est une production animale et non de la chair, comme pour le miel qui lui est casher.
- Les Aborigènes d'Australie mangent les galles d'eucalyptus et les apiomorphas qu'elles contiennent, comme friandises. En Asie du sud-est ce sont les Monophlébines (grosses cochenilles) qui sont consommées[7].
Evolution
Histoire évolutive
Dans l'histoire de l'évolution, les cochenilles semblent apparaître vers le milieu du Mésozoïque (il y a 140 millions d'années). Elles faisaient probablement partie de la faune de la litière et on suppose qu'elles mangeaient des mycéliums. Certains groupes de margarodidés (insectes de 10 à 15 mm) étaient déjà diversifiés au Crétacé inférieur (−100 millions d'années). Les cochenilles seraient devenues parasites des plantes à fleur en coévoluant avec certaines d'entre elles. Souvent, les cochenilles ont développé des relations de mutualisme avec des fourmis, ainsi qu'avec des microorganismes devenus leurs symbiontes et produisant pour elles des substances azotées indispensables. Les inclusions d'ambre du Tertiaire (Eocène, Oligocène et Miocène) (−55 millions d'années) ont conservé des représentants de presque tous les groupes existant aujourd'hui[2].
Classification externe
La super-famille des cochenilles (Coccoidea), regroupe des hémiptères du sous-ordre des Sternorrhyncha. C'est un groupe monophylétique, l'un des 4 groupes frères des Sternorrhynches (les 3 autres étant les pucerons (Aphidoidea), les Aleurodes (Aleyrodoidea) et les psylles (Psylloidea)[2].
La phylogénie des groupes existants de Sternorrhyncha, déduite de l'analyse de l'ARN ribosomique de la petite sous-unité (18S), est indiquée dans le cladogramme suivant[20].
| Sternorrhyncha |
| ||||||||||||||||||||||||
Liste des familles
- Aclerididae
- Asterolecaniidae
- Beesoniidae
- Carayonemidae
- Cerococcidae
- Coccidae
- Conchaspididae
- Dactylopiidae
- Diaspididae
- Electrococcidae
- Eriococcidae
- Grimaldiellidae
- Halimococcidae
- Inkaidae
- Jersicoccidae
- Kermesidae
- Kerriidae
- Kukaspididae
- Labiococcidae
- Lecanodiaspididae
- Margarodidae
- Micrococcidae
- Ortheziidae
- Phenacoleachiidae
- Phoenicococcidae
- Pseudococcidae
- Putoidae
- Stictococcidae
Phylogénie
La diversification phylogénétique au sein des Coccomorphes a été analysée par la taxonomiste Isabelle Vea et l'entomologiste David Grimaldi en 2016, combinant l'ADN (3 régions géniques) et 174 caractères morphologiques (pour permettre l'incorporation de preuves fossiles). Toutes les familles étaient monophylétiques à l'exception des Eriococcidae. Les Coccomorpha sont divisés en deux clades les "Archaeococcoids" et "Neococcoids". Les familles archéococcoïdes ont des mâles adultes avec des yeux composés ou une rangée d'yeux unicornéens et ont des spiracles abdominaux chez les femelles. Chez les néoccoïdes, les femelles n'ont pas de stigmates abdominaux[21]. Dans le cladogramme ci-dessous, le genre Pityococcus est déplacé vers les "Neococcoids". Un cladogramme montrant les principales familles utilisant cette méthodologie est présenté ci-dessous[22].
| Coccomorpha |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Trois grands types de cochenilles
- Celles qui ont un corps mou, sans bouclier protecteur.
Elles se protègent sous des filaments cireux. - Pseudococcidés et Margarodidés :
- Exemples :
- Cochenille farineuse des serres (Pseudococcus adonidum)
- Cochenille australienne (Icerya purchasi)
- Celles qui ont un corps durci par imprégnation de cire ou de laque (lécanines ou lécanies, de la famille des Lécanidés, autrefois). Maintenant les cochenilles de cette famille s'appellent les Coccidés.
- Exemples :
- Cochenille du cornouiller (Parthenolecanium corni)
- Cochenille du pêcher (Eulecanium persicae)
- Cochenille des serres (Saissetia hemisphaerica)
- Cochenille de l'olivier (Saissetia oleae)
- Cochenille floconneuse de la vigne (Pulvinaria vitis)
- Lécanie du chêne (Parthenolecanium quercifex)
- Lécanie de Fletcher (Parthenolecanium fletcheri)
- Lécanie de la vigne (Parthenolecanium corni)
- Celles qui ont un corps mou, couvert d'un boulier protecteur cireux (Diaspididés) dont la forme rappellerait une minuscule coquille d'huître.
- Exemples :
- Pou de san José (Diaspidiotus perniciosus)
- Cochenille des arbres fruitiers à pépins (Diaspidiotus piri et D. ostraeiformis)
- Cochenille virgule du pommier (Lepidosaphes ulmi)
- Cochenille du poirier (Epidiaspis leperii)
- Pou de l'oranger (Chrysomphalus aonidum et C. dictyospermi)
- Cochenille noire des agrumes (Parlatoria zizyphii), Cochenilles serpette des agrumes (Lepidosaphes citricola et L. gloweri)
- Cochenille du mûrier (Pseudaulascaspis pentagona)
Exemples d'espèces
- Famille des Ortheziidae
- Orthezia urticae (Linnaeus, 1758)
- Famille des Margarodidae
- Guerriniella serratulae (Fabricius, 1775)
- Icerya purchasi (Maskell, 1879)
- Matsucoccus pini (Green, 1925)
- Neomargarodes europaeus (Goidanich, 1969)
- Porphyrophora italica (Goidanich, 1963)
- Famille des Pseudococcidae
- Asphodelococcus asphodeli (Bodenheimer, 1927)
- Balanococcus santilongoi (Mazzeo, 1996)
- Chaetococcus phragmitis (Marchal, 1909)
- Delottococcus euphorbiae (Ezzat & McConnell, 1956)
- Dysmicoccus brevipes (Cockerell, 1893)
- Dysmicoccus neobrevipes (Beardsley, 1959)
- Dysmicoccus pietroi (Marotta, 1992)
- Euripersia tomlini (Newstead, 1892)
- Hypogeococcus pungens (Granara de Willink, 1981)
- Nipaecoccus nipae (Maskell, 1893)
- Peliococcus cycliger (Leonardi, 1908)
- Peliococcus vivarensis Tranfaglia, 1981
- Phenacoccus aceris (Signoret, 1875)
- Phenacoccus graminicola (Leonardi, 1908)
- Phenacoccus interruptus (Green, 1923 )
- Phenacoccus madeirensis (Green, 1923 )
- Phenacoccus mespili (Signoret, 1875)
- Phenacoccus neohordei (Marotta, 1992)
- Phenacoccus silvanae (Longo & Russo, 1989 )
- Phenacoccus yerushalmi (Ben-Dov, 1985 )
- Planococcus citri (Risso, 1813)
- Planococcus ficus (Signoret, 1875)
- Pseudococcus affinis (Maskell, 1894)
- Pseudococcus calceolariae (Maskell, 1878)
- Pseudococcus longispinus (Targioni Tozzetti, 1867)
- Puto palinuri (Marotta e Tranfaglia, 1993)
- Puto superbus (Leonardi, 1907)
- Puto tauricus (Borchsenius, 1948)
- Rhizoecus cacticans (Hambleton, 1946)
- Rhizoecus falcifer (Kunckel d'Herculais, 1878)
- Rhizoecus lelloi (Mazzeo, 1996 )
- Spilococcus mammillariae (Bouché, 1844 )
- Spinococcus multispinus (Siraiwa, 1939)
- Trionymus perrisii (Signoret, 1875)
- Trionymus tomlini (Green, 1925 )
- Vryburgia rimariae (Tranfaglia, 1981)
- Famille des Eriococcidae
- Acanthococcus araucariae (Maskell, 1879)
- Acanthococcus cactearum (Leonardi, 1908)
- Acanthococcus coccineus (Cockerell, 1894)
- Acanthococcus cynodontis (Kiritchenko, 1940)
- Acanthococcus devoniensis (Green, 1896)
- Acanthococcus rosannae (Tranfaglia & Esposito, 1985)
- Ovaticoccus agavium (Douglass, 1888)
- Rhizococcus insignis (Newstead, 1891)
- Famille des Cryptococcidae
- Cryptococcus fagisuga Lindinger, 1936
- Famille des Micrococcidae
- Micrococcus silvestrii Leonardi, 1907
- Famille des Kermesidae
- Kermes bacciformis (Leonardi, 1908)
- Kermes gibbosus (Signoret, 1875)
- Kermes roboris (Fourcroy, 1785)
- Kermes vermilio (Planchon, 1864)
- Nidularia pulvinata (Planchon, 1864)
- Famille des Cerococcidae
- Pollinia pollini (Costa, 1857)
- Famille des Coccidae
- Ceroplastes rusci (Linnaeus, 1758)
- Ceroplastes sinensis (Del Guercio, 1900 )
- Coccus hesperidum (Linnaeus, 1758)
- Coccus pseudomagnoliarum (Kuwana, 1914)
- Eucalymnatus tessellatus (Signoret, 1873)
- Eulecanium tiliae (Linnaeus, 1758)
- Filippia follicularis (Targioni Tozzetti, 1867)
- Lecanopsis formicarum (Newstead, 1893)
- Lichtensia viburni (Signoret, 1873)
- Nemolecanium graniformis (Wünn, 1921)
- Parthenolecanium corni (Bouché, 1844)
- Parthenolecanium persicae (Fabricius, 1776)
- Parthenolecanium rufulum (Cockerell, 1903)
- Pulvinara mesembryanthemi (Vallot, 1830)
- Pulvinaria floccifera (Westwood, 1870)
- Pulvinaria vitis (Linnaeus, 1758)
- Rhizopulvinaria grassei (Balachowsky, 1936)
- Saissetia coffeae (Walker, 1852)
- Saissetia oleae (Olivier, 1791)
- Scythia aetnensis Russo & Longo, 1990
- Famille des Aclerididae
- Aclerda berlesei (Buffa, 1897 )
- Famille des Asterolecaniidae
- Asterodiaspis bella (Russell, 1941)
- Asterodiaspis ilicicola (Targioni Tozzetti, 1888)
- Asterodiaspis roboris (Russell, 1941)
- Bambusaspis bambusae (Boisduval, 1869)
- Planchonia zanthenes (Russell, 1941)
- Famille des Phoenicococcidae
- Phoenicococcus marlatti Cockerell, 1899
- Famille des Diaspididae
- Abgrallaspis cyanophylli (Signoret, 1869)
- Acanthomytilus intermittens (Hall, 1924)
- Acanthomytilus sacchari (Hall, 1923)
- Aonidia lauri (Bouché, 1833)
- Aonidiella aurantii (Maskell, 1879)
- Aonidiella taxus (Leonardi, 1906)
- Aspidiotus hedericola (Leonardi, 1920 )
- Aspidiotus nerii (Bouché, 1933)
- Aspidiotus spinosus (Comstock, 1883 )
- Aulacaspis rosae (Bouché, 1833)
- Carulaspis carueli (Signoret, 1869)
- Carulaspis juniperi (Bouché, 1851)
- Carulaspis silvestrii Lupo, 1966
- Carulaspis visci (Schrank, 1781)
- Chionaspis pinifoliae (Fitch…)
- Chionaspis salicis (Linnaeus, 1758)
- Chrysomphalus aonidum (Linnaeus, 1758)
- Chrysomphalus dictyospermi (Morgan, 1889)
- Diaspidiotus distinctus (Leonardi, 1900)
- Diaspidiotus osborni (Newell & Cockerell, 1898)
- Diaspidiotus viticola (Leonardi, 1913)
- Diaspis boisduvalii (Signoret, 1869)
- Diaspis bromeliae (Kerner, 1778)
- Diaspis coccois (Lichtenstein, 1882 )
- Diaspis echinocacti (Bouché, 1833)
- Duplachionaspis berlesei (Leonardi, 1898)
- Duplachionaspis sicula (Lupo, 1938)
- Dynaspidiotus britannicus (Newstead, 1898)
- Epidiaspis gennadii (Leonardi, 1898)
- Epidiaspis leperii (Signoret, 1869)
- Evallaspis ampelodesmae (Newstead, 1897)
- Fiorinia fioriniae (Targioni Tozzetti, 1867)
- Furchadaspis zamiae (Morgan, 1890)
- Gonaspidiotus minimus (Leonardi, 1896)
- Hemiberlesia lataniae (Signoret, 1869)
- Hemiberlesia rapax (Comstock, 1881)
- Howardia biclavis (Comstock, 1883)
- Ischnaspis longirostris (Signoret, 1882)
- Lepidosaphes beckii (Newmann, 1869)
- Lepidosaphes conchiformis (Gmelin, 1789)
- Lepidosaphes destefanii (Leonardi, 1907 )
- Lepidosaphes gloverii (Packard, 1869)
- Lepidosaphes granati Koronéos, 1934
- Lepidosaphes newsteadi (Sulc, 1895)
- Lepidosaphes pinnaeformis (Bouché, 1851)
- Lepidosaphes ulmi (Linnaeus, 1758)
- Leucaspis loewi (Colvée, 1882 )
- Leucaspis pini (Hartig, 1839)
- Leucaspis pusilla( Loew, 1883)
- Leucaspis riccae Targioni Tozzetti, 1881
- Lindingaspis rossi (Maskell, 1891)
- Melanaspis inopinata (Leonardi, 1913)
- Mercetaspis sphaerocarpae Gomez Menor, 1927
- Nuculaspis abietis (Schrank, 1776)
- Pallulaspis retamae (Hall, 1926)
- Parlatoria camelliae (Comstock, 1883 )
- Parlatoria oleae (Colvée, 1880)
- Parlatoria pergandii (Comstock, 1881 )
- Parlatoria ziziphi (Lucas, 1853)
- Pinnaspis aspidistrae (Signoret, 1869)
- Pinnaspis strachani (Cooley, 1899)
- Pseudaulacaspis cockerelli (Cooley, 1897)
- Pseudaulacaspis pentagona (Targioni Tozzetti, 1886)
- Quadraspidiotus cecconii (Leonardi, 1908)
- Quadraspidiotus lenticularis (Lindinger, 1912)
- Quadraspidiotus ostraeformis (Curtis, 1843)
- Diaspidiotus perniciosus (Comstock, 1881)
- Quadraspidiotus zonatus (Frauenfeld, 1868)
- Rungaspis capparidis (Bodenheimer, 1929)
- Saharaspis ceardi (Balachowsky, 1928)
- Suturaspis archangelskyae (Lindinger, 1929)
- Targionia nigra (Signoret, 1870)
- Targionia vitis (Signoret, 1876)
- Unaspis euonymi (Comstock, 1881)
Notes et références
- ↑ (en) « ScaleNet: Scale Insects (Coccoidea) Database », sur www.sel.barc.usda.gov (consulté le ).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Imre Foldi, « Les cochenilles : 1re partie », Insectes, vol. 2, no 129, (lire en ligne [PDF]).
- 1 2 « Scale families », sur www.sel.barc.usda.gov (consulté le ).
- ↑ décrit par Charles P. Lounsbury (en), 1908.
- ↑ (en) Uzi Nur, « Parthenogenesis in Coccids (Homoptera) », American Zoologist, vol. 11, no 2, , p. 301–308 (ISSN 0003-1569, DOI 10.1093/icb/11.2.301, lire en ligne, consulté le )
- ↑ Hervé Jactel, Pierre Menassieu, Alain Ceria, C. Burban, Jacques Regad, S. Normand et Emmanuel Carcreff, « Une pullulation de la cochenille Matsucoccus feytaudi provoque un début de dépérissement du Pin maritime en Corse », Revue forestière française, vol. L, no n°1, , p. 33-45 (DOI 10.4267/2042/5510, lire en ligne).
- 1 2 3 4 5 6 Imre Foldi, « Les cochenilles : 2e partie », Insectes, vol. 3, no 130, , p. 29 (lire en ligne [PDF]).
- ↑ Philippe Kreiter, C. Coquelet et Marcel Thaon, « La cochenille blanche du mûrier, principal ravageur des cassissiers en Région Rhône-Alpes », Publications de la Société Linnéenne de Lyon, vol. 71, no 6, , p. 251–252 (DOI 10.3406/linly.2002.13399, lire en ligne, consulté le ).
- ↑ décrit par Leland Ossian Howard, 1906.
- ↑ décrit par Francis Walker, 1839, (en) Francis Walker, Monographia Chalciditum, vol. 1, Londres, Balliere, .
- ↑ P. Kreiter et L. Dijoux, « La cochenille blanche du mûrier en verger de pêcher : Un exemple de lutte dans les Alpes-Maritimes », La Défense des Végétaux, no 501, , p. 36-40.
- ↑ (en-US) « Antonina graminis : huji.ac.il », sur Plant Pests of the Middle East, (consulté le ).
- ↑ J. Jourdheuil, P. Grison et A. Fraval, « La lutte biologique : un aperçu historique », Courrier de la Cellule Environnement de l'INRA, no 15, , p. 37-60 (lire en ligne [PDF]).
- ↑ (en) « Chalcidoidea », sur Natural History Museum (consulté le ).
- ↑ « CHAPTER 11: Virus Transmission by Mealybugs and Soft Scales (Hemiptera: Coccoidea) », dans Vector-Mediated Transmission of Plant Pathogens, The American Phytopathological Society, (lire en ligne), p. 147–161
- ↑ Office fédéral de l'agriculture, « Organisme nuisible dangereux introduit involontairement en Suisse avec des plantes ornementales », sur www.admin.ch (consulté le )
- ↑ Jardiner Autrement, « La lutte contre les cochenilles - Jardiner Autrement », (consulté le ).
- ↑ Dominique Cardon et Gaëtan du Chatenet, Guide des teintures naturelles, Plantes-Lichens, Champignons, Mollusques et Insectes, Delachaux et Niestlé, , 400 p. (ISBN 2603007327).
- ↑ Hélène Hadas-Lebel, Judaïsme : pratiques, fêtes et symboles, , 118 p. (ISBN 978-2-7509-0645-0, lire en ligne), p. 33.
- ↑ « Phylogeny of Insects », What-When-How (consulté le )
- ↑ D. J. Williams, P. J. Gullan, D. R. Miller, D. Matile-Ferrero et Sarah I. Han, « A study of the scale insect genera Puto Signoret (Hemiptera: Sternorrhyncha: Coccoidea: Putoidae) and Ceroputo Šulc (Pseudococcidae) with a comparison to Phenacoccus Cockerell (Pseudococcidae) », Zootaxa, vol. 2802, no 1, , p. 1 (DOI 10.11646/zootaxa.2802.1.1, hdl 1885/63136
 , lire en ligne)
, lire en ligne) - ↑ Isabelle M. Vea et David A. Grimaldi, « Putting scales into evolutionary time: the divergence of major scale insect lineages (Hemiptera) predates the radiation of modern angiosperm hosts », Scientific Reports, vol. 6, no 1, , p. 23487 (ISSN 2045-2322, PMID 27000526, PMCID 4802209, DOI 10.1038/srep23487, Bibcode 2016NatSR...623487V)
Voir aussi
Articles connexes
- Les maladies des bonsaïs
- Phytopathologie
- Espèces invasives
Liens externes
- (en) « ScaleNet: Scale Insects (Coccoidea) Database », sur www.sel.barc.usda.gov (consulté le ).,
- Imre Foldi, « Les cochenilles : 1re partie », Insectes, vol. 2, no 129, (lire en ligne [PDF]).
- Imre Foldi, « Les cochenilles : 2e partie », Insectes, vol. 3, no 130, , p. 29 (lire en ligne [PDF]).
- « Hypp : encyclopédie en protection des plantes - Les ravageurs des cultures et leurs dégâts - HYPPZ », sur ephytia.inra.fr (consulté le )
- « Caribfruits - Cochenilles à bouclier / Protection raisonnée des vergers (maladies, ravageurs et auxiliaires) / Production Fruitière Intégrée », sur caribfruits.cirad.fr (consulté le )
Bibliographie
- Foldi I., « Les Cochenilles : des insectes mal connus mais passionnants », Insectes, vol. 70, , p. 4-7 (lire en ligne)
- (en) Foldi I., « The wax glands in scale insects : comparative ultrastructure, secretion, function and evolution (Homoptera: Coccoidea) », Annales de la Société Entomologique de France (N.S.), vol. 27, no 2, , p. 163-188
- (en) Foldi I., « Defense strategies in scale insects: phylogenetic inference and volutionary scenarios (Hemiptera : Coccoidea) », The Origin of Biodiversity in Insects : Phylogenetic Tests of Evolutionary Scenarios. Mémoires du Muséum national d'Histoire naturelle, vol. 173, , p. 203-230
- Foldi I., « Liste des Cochenilles de France (Hemiptera, Coccoidea) », Bulletin de la Société entomologique de France, vol. 106, , p. 303-308
- (en) Gullan P.J. & Kosztarab M., « Adaptation in Scale Insects », Annual Reviews of Entomology, vol. 42, , p. 23-50 (PMID 15012306, DOI 10.1146/annurev.ento.42.1.23, lire en ligne)
- Georges Roque, La Cochenille, de la teinture à la peinture. Une histoire matérielle de la couleur, Gallimard, (ISBN 2072852315).





