| Graphite Catégorie I : Éléments natifs[1] | |
 Graphite natif | |
| Général | |
|---|---|
| Numéro CAS | |
| Classe de Strunz | 1.CB.05a
|
| Classe de Dana | 1.3.6.2
|
| Formule chimique | C |
| Identification | |
| Masse formulaire[2] | 12,0107 ± 0,0008 uma C 100 %, |
| Couleur | gris métallique; gris foncé; noir |
| Système cristallin | hexagonal |
| Classe cristalline et groupe d'espace | dihexagonale dipyramidale ; P 63/mmc |
| Réseau de Bravais | primitif P |
| Macle | sur {1121} |
| Clivage | parfait sur {0001} |
| Cassure | Minéral sectile, conchoïdale, irrégulière |
| Habitus | massif, très rares cristaux |
| Faciès | cristaux hexagonaux |
| Échelle de Mohs | de 1,00 à 2,00 |
| Trait | gris acier; noir |
| Éclat | métallique; mat |
| Propriétés optiques | |
| Indice de réfraction | w=1,93-2,07 |
| Biréfringence | Uniaxial (-) |
| Fluorescence ultraviolet | aucune |
| Transparence | opaque |
| Propriétés chimiques | |
| Masse volumique | 2,09-2,23[3] g/cm3 |
| Température de fusion | Point de sublimation[3] : 3 652 °C |
| Solubilité | dans l'eau : insoluble[3] |
| Propriétés physiques | |
| Magnétisme | aucun |
| Radioactivité | aucune |
| Précautions | |
| SIMDUT[4] | |
 D2A, |
|
| Unités du SI & CNTP, sauf indication contraire. | |
Le graphite est une espèce minérale qui est, avec le diamant, la lonsdaléite et la chaoite, l'un des allotropes naturels du carbone.
Sa formule chimique est « C » mais les formes natives permettent de retrouver des traces d'hydrogène (« H »), d'azote (« N »), d'oxygène (« O »), de silicium (« Si »), d'aluminium (« Al »), de fer (« Fe ») ou encore d'argile.
Inventeur et étymologie
- Les gisements historiques sont les mines britanniques de Seathwaite (en) exploitées pour confectionner les mines de crayon dès le XVIIe siècle. Comme ce minéral ressemble au plomb que l'on utilise alors pour dessiner ou écrire, il reçoit le nom de plombagine[5]. La plombagine remplace progressivement la mine de plomb dans les crayons. Ce n'est qu'en 1779 que le chimiste suédois Carl Wilhelm Scheele analyse la plombagine (qu'il utilise pour écrire) et prouve qu'elle est composée de carbone pur et non de plomb, montrant que ce minerai est une forme cristalline particulière du carbone[6].
- C'est le minéralogiste allemand Abraham Gottlob Werner qui a inventé[7] le terme « graphite » en 1789, s'inspirant du grec γράφω / gráphô, « écrire ».
Gîtologie
C'est un élément natif dont les gîtes se sont formés aux dépens de roches carbonées (roches riches en carbone, du type charbon). Constitué de carbone pur, il correspond au degré ultime de houillification[8] atteint dans des conditions de métamorphisme régional ou de contact (pegmatites ou gîtes hydrothermaux dans l'auréole de contact de certains granites)[9]. Il peut aussi se former par réduction des carbonates. Il se présente dans les gîtes « sous forme de masses lamellaires micacées, foliacées, compactes ou pulvérulentes ; rarement en lamelles hexagonales ; souvent en paillettes irrégulières disséminées. Il offre un toucher gras, tache les doigts et laisse sur le papier une trace noirâtre[9] ».
Il est aussi présent dans les météorites.
Au XVIIIe siècle, la prospection de gisements riches en charbon conduit à interpréter à tort les roches graphiteuses (schistes, quartzites), de teinte noirâtre, comme étant charbonneuses[10].
Cristallographie
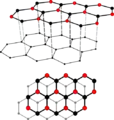 Structure du graphite.
Structure du graphite.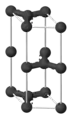 Maille élémentaire.
Maille élémentaire.
La structure du graphite est constituée de feuillets hexagonaux non compacts, nommés graphènes, séparés d'environ 0,336 nm le long de la direction de leur normale. Dans chaque feuillet, chaque atome de carbone est fortement lié par des liaisons covalentes de type sigma pour ses 3 électrons sp2, et des liaisons covalentes de type π pour son autre électron p, Ces liaisons π sont des liaisons conjuguées avec les trois atomes voisins, les électrons y sont très mobiles ce qui explique la grande conductivité électrique et thermique ainsi que la couleur noire du graphite. Entre les feuillets les liaisons sont faibles et seraient de type Liaison de van der Waals, ce qui expliquerait le clivage et la faible dureté. Par contre ceci est mis en doute dans des travaux récents.[11].
Propriétés physiques
Le graphite est la forme stable du carbone à température et à pressions ordinaires.
L'apparence du graphite est celle d'un solide noir à l'éclat submétallique ; sa dureté est faible, entre 1 et 2 sur l'échelle de Mohs.
En raison de sa structure en feuillets, toutes les propriétés physiques du graphite sont anisotropes. En particulier, la conductivité électrique est très différente dans le plan des feuillets et dans la direction perpendiculaire.
Polytypisme
Le graphite existe en deux polytypes :
- graphite-2H, système cristallin hexagonal, classe cristalline dihexagonale-bipyramidale, groupe d'espace P 63/mmc, empilement de type ABAB où le plan B est translaté de par rapport au plan A. Bien que sa structure soit analogue à celle des métaux qui cristallisent avec empilement hexagonal compact, le graphite est un non-métal. Il possède une certaine conductivité électrique, sa résistivité est de 50 µΩ.m, soit 2900 fois celle du cuivre.
- graphite-3R, trigonal à réseau rhomboédrique, empilement de type ABCABC. La structure rhomboédrique est instable : elle se produit par moulage et disparaît lors d'un recuit. On ne la trouve jamais comme forme pure, mais seulement comme tendance à l’empilement ABC dans les cristaux hexagonaux primaires.
Le charbon existe dans tous les états intermédiaires entre charbon amorphe et graphite hexagonal. On parle de graphite « lubricostratique » (du latin lubricare, « rendre glissant ») quand les couches sont déplacées parallèlement au hasard, et de graphite « turbostratique » (du latin turbo, « tourbillon ») si elles sont aussi tournées au hasard.
Synonymie
Variété
Utilisations

Le graphite a de nombreuses applications industrielles, sous diverses formes naturelles ou synthétiques :
- construction mécanique : pièces de frottement, joints d'étanchéité, produits lubrifiants ;
- construction électrique : balais de moteurs ;
- comme réducteur, notamment en sidérurgie (coke des hauts-fourneaux) ;
- comme électrode, par exemple en sidérurgie (acier électrique) ;
- comme cathode, par exemple dans l'industrie d'électrolyse de l'aluminium ;
- comme cathode dans la galvanoplastie et particulièrement la galvanotypie ;
- comme modérateur dans des réacteurs nucléaires ;
- comme adsorbant, dans les filtres à « charbon actif » ;
- comme conducteur électrique (pencil mod, bombe au graphite) ;
- comme échangeur de chaleur pour le traitement d'acide chlorhydrique (fabrication pigment de peinture) ;
- comme matériau principal de la fibre de carbone ;
- comme matériau principal des raquettes de badminton dans la tige et le cadre.
Il est également utilisé en médecine comme absorbant en cas d'intoxication par voie orale et en usage militaire pour endommager les centrales électriques comme bombe au graphite.
Dans les arts plastiques, il est utilisé pour le dessin. Il sert en particulier à fabriquer des crayons, souvent sous l'appellation incorrecte de « mine de plomb ».
L'utilisation domestique la plus courante est le crayon.
Il peut aussi être utilisé comme composite d'alliage (avec le Titane ou Fibre de verre) dans la fabrication des cadres de raquettes de tennis (existe en Aluminium aussi).
Une forme pyrolytique du graphite est utilisée dans la fabrication de grilles pour les tétrodes de très grande puissance dans le domaine de la radiodiffusion. On peut citer par exemple la tétrode TH539 qui a été utilisée jusqu'en sur l'un des deux blocs émetteurs ondes longues d'Allouis de 1 000 kW.
Production
Le graphite synthétique est généralement élaboré par le procédé Acheson : les principaux producteurs sont, en 2020, Showa Denko Carbon, SGL Carbon, Schunk Kohlenstofftechnik (Allemagne), Imerys (France), Tōkai Carbon (Japon) et Morgan Advanced Materials (Grande-Bretagne).
En 2019, l'agence australienne d'énergie renouvelable (ARENA) a annoncé 9,41 millions de dollars australiens d'aides pour un projet du Groupe Hazer (compagnie d'énergie renouvelable australienne) de conversion du biogaz (ici issu de méthanisation de boues d’épuration) en graphite et en hydrogène (usine démonstratrice de $10,72 millions USD à Munster, Australie de l'Ouest)[17].
Notes et références
- ↑ La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 GRAPHITE (NATUREL), Fiches internationales de sécurité chimique
- ↑ « Graphite naturel » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Jean-Claude Boulliard, Les Minéraux, CNRS Editions, , p. 81.
- ↑ Francis Ribemont, Au-delà de l'image: les techniques du dessin révélées par la science, Musée des beaux-arts de Rennes, , p. 121.
- ↑ Cf. C.A.S. Hoffmann et Alexander Wilhelm Köhler (dir.), « Mineralsystem des Herrn Inspektor Werners », Bergmännisches Journal, Freyberg, Crazische Buchhandlung, vol. 1, , p. 369–386 (lire en ligne).
- ↑ Alain Foucault, Jean-François Raoult, Dictionnaire de Géologie, Dunod, , p. 67.
- 1 2 Louis Chauris, « Propos sur le graphite en Bretagne », Penn ar Bed, no 207, , p. 42.
- ↑ Louis Chauris, « Propos sur le graphite en Bretagne », Penn ar Bed, no 207, , p. 43.
- ↑ Y. J. Dappe, M. A. Basanta, F. Flores et J. Ortega, « Weak chemical interaction and van der Waals forces between graphene layers: A combined density functional and intermolecular perturbation theory approach », Physical Review B, vol. 74, , p. 205434 (DOI 10.1103/PhysRevB.74.205434, lire en ligne, consulté le )
- ↑ Pierre-Joseph Buc'hoz - Dictionnaire mineralogique et hydrologique de la France, Volume 3 1774 p.590
- ↑ Albert Auguste Cochon de Lapparent - Cours de minéralogie 1908 p.737
- ↑ Auguste Drapiez - Dictionnaire classique des sciences naturelles 1840 p.330
- ↑ Charles S. Sonnini - Nouveau dictionnaire d'histoire naturelle Volume 20 1818 - p.505
- ↑ Louis Jacques Thenard - Traité de chimie élémentaire, théorique et pratique, Volume 1 1817 p.378
- ↑ Liz Gyekye (2019) [ https://biomarketinsights.com/australia-backs-tech-that-converts-biogas-into-hydrogen-and-graphite/ « Australia backs tech that converts biogas into hydrogen and graphite »], Biomarketing sights ; 4 sept 2019
