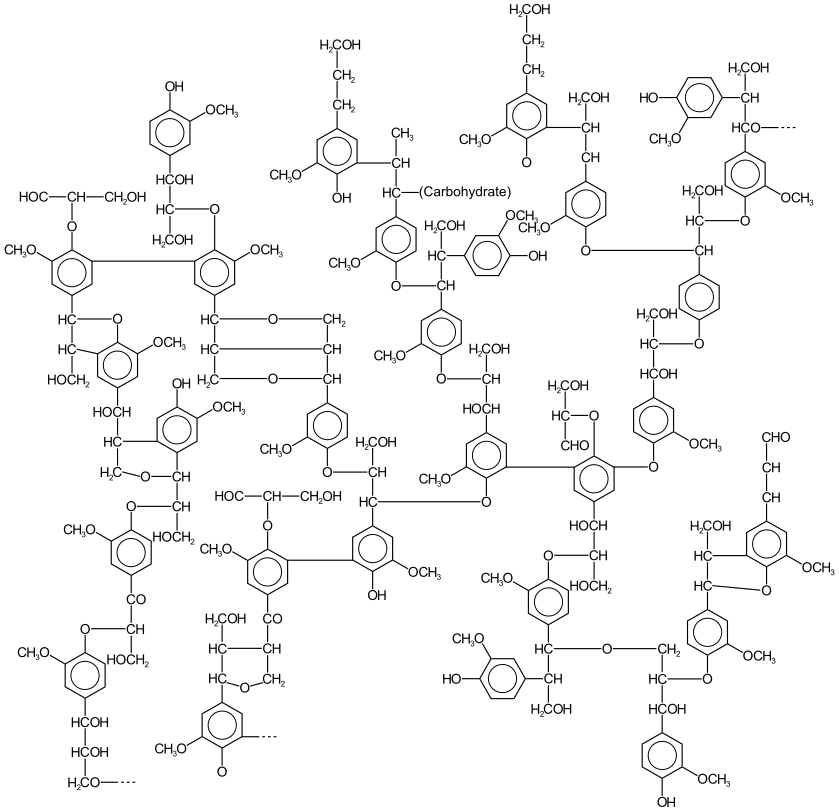


La lignine (du latin lignum qui signifie bois) est une biomolécule, plus précisément une famille de macromolécules polyphénoliques, qui est un des principaux composants du bois avec la cellulose et les hémicelluloses. Ce biopolymère est présent principalement dans les plantes vasculaires et dans quelques algues rouges coralligènes, ce qui suggère une convergence évolutive de la biosynthèse des lignines entre ces algues et les trachéophytes[5]. Ses principales fonctions sont de conférer de la rigidité et de la résistance mécanique aux parois cellulaires[6], ainsi que d'apporter une imperméabilité à l'eau et une résistance à la décomposition.
Bien qu'elle puisse être présente en quantité importante au sein de certaines plantes herbacées, la lignine est en moyenne beaucoup plus abondante chez les plantes ligneuses. Ainsi, la teneur en lignine est de 14 à 34 % dans le bois dur des arbres angiospermes, et de 21 à 37 % dans le bois tendre des arbres gymnospermes[7]. La lignine est principalement localisée dans les lamelles moyennes, c'est-à-dire entre les cellules, mais est également présente à l'intérieur même de celles-ci[8]. Réseau tridimensionnel hydrophobe complexe, les unités structurales de la lignine sont des unités phénylpropanes.
Après la cellulose (constituant 35 à 50 % de la biomasse végétale terrestre) et l'hémicellulose (30 à 45 %), la lignine forme la troisième famille de composés par ordre d’abondance dans les plantes et dans les écosystèmes terrestres où domine la biomasse végétale morte ou vive[9]. Son abondance explique qu'elle fasse l'objet de recherches en vue de valorisations autres que ses utilisations actuelles en bois d'œuvre et en combustible.
Voie de biosynthèse
La lignine est une biomolécule appartenant au groupe des phénylpropanoïdes, qui dérivent d'un précurseur, la phénylalanine, après élimination de la partie contenant de l'azote[10]. Cet acide aminé subit une cascade de réactions faisant intervenir une dizaine de familles d'enzymes différentes afin de former des monolignols. Ces enzymes sont : phénylalanine ammonia-lyase (PAL) responsable de la désamination oxydative, cinnamate 4-hydroxylase (C4H), 4-coumarate-CoA ligase (4CL), hydroxycinnamoyl-CoA shikimate/quinate hydroxycinnamoyl transférase (HCT), p-coumarate 3-hydroxylase (C3H), cafféoyl-CoA o-méthyltransférase (CCoAOMT), cinnamoyl-CoA réductase (CCR), ferrulate 5-hydroxylase (F5H), Acide cafféique O-méthyltransférase (COMT) et cinnamyl alcool deshydrogénase (CAD). Dans un certain nombre de cas, des aldéhydes peuvent également être incorporés dans le polymère[11].
Apparition
La lignine est apparue il y a 380 millions d'années, au Dévonien, avec les premières plantes vasculaires que sont les Fougères (Ptéridophytes) et presque simultanément les premiers arbres (Archaeopteris)[12]. La biosynthèse de la lignine nécessite de l'oxygène et est probablement apparue à cette époque lorsque la concentration en oxygène atmosphérique a atteint un niveau suffisant[13].
Historique
En 1813, le botaniste suisse Augustin Pyramus de Candolle décrit brièvement la lignine en page 417 de son ouvrage Théorie élémentaire de la botanique; ou, Exposition des principes de la classification naturelle et de l'art de décrire et d'étudier les végétaux. Il en énumère plusieurs caractéristiques : « fibreuse, insipide, insoluble dans l'eau et l'alcool ; soluble dans les lessives alcalines faibles ; précipitée par les acides[14]. »
En 1839, le chimiste français Anselme Payen parle d'une « matière incrustante » ayant un lien exclusivement mécanique avec la cellulose[15].
C'est en 1856 que le terme lignine fait son apparition pour la première fois en littérature scientifique dans une publication du chimiste Franz Ferdinand Schulze (1815–1873)[16].
Le caractère aromatique de la lignine a été mis en évidence pour la première fois en 1868[17], et en 1897 le scientifique suédois P. Klasen décrira la lignine comme non cellulosique et confirmera sa nature aromatique. Après la Première Guerre mondiale, plusieurs travaux permettront d'attester le phénol comme étant un constituant de la lignine[18],[19], mais il faudra attendre jusqu'en 1927 avant que sa structure phénylpropane et ses dérivés soient clairement établis[20].
Structure chimique
On ne s'accorde toujours pas sur une définition unique et précise de la lignine du fait de sa grande variabilité et cela au sein même d'une espèce donnée, car sa formation dépend de l'environnement physico-chimique dans lequel le végétal croît. La lignine est donc un nom générique regroupant des molécules aux structures très diverses.
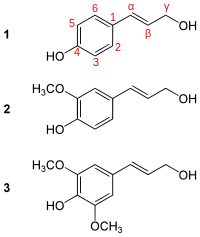
1 : alcool paracoumarylique.
2 : alcool coniférylique.
3 : alcool sinapylique.
La lignine est un polymère biosynthétisé à partir de trois monolignols, ses monomères. Ceux-ci ne diffèrent que par le nombre de groupe méthoxy -OCH3 sur le noyau aromatique :
- l'alcool paracoumarylique, appelé unité H (hydroxyphényle), sans groupe méthoxy ;
- l'alcool coniférylique, appelé unité G (guaïacyle), ayant un groupe méthoxy ;
- l'alcool sinapylique, appelé unité S (syringyle), ayant deux groupes méthoxy.
Outre des groupes éther et méthoxy, la lignine contient, dans l’ordre décroissant d’abondance, des alcools aliphatiques, des phénols, des carbonyles et des carboxyles[21],[22].
La fraction de chaque monomère varie de façon importante en fonction de :
- la lignée végétale (gymnosperme, angiosperme monocotylédone, angiosperme dicotylédone) ;
- l’espèce ;
- l’organe ;
- le tissu.
La lignine du bois des gymnospermes est constituée à 95 % d’unités G, tandis que celle du bois des angiospermes contient des proportions équivalentes (environ 50 %) d’unités S et G[23],[24],[22]. La lignine des plantes herbacées, quant à elle, contient les trois unités G, S et H, avec en particulier une grande proportion d'unités G[22]. Ainsi, toutes les plantes vasculaires, ligneuses et herbacées, synthétisent de la lignine où est toujours présente l'unité G (relative à l'alcool coniférylique), dont l'oxydation donne l'acide férulique.
Les molécules de lignine de gymnospermes sont homogènes. Le bois de ces essences, dit homoxylé, est constitué à 95 % de trachéides et à 5 % de différents types de parenchymes. Le bois de résineux contient une lignine dont la structure est « condensée » (nombreuses liaison carbone-carbone entre les unités constitutives).
Les angiospermes, évolutivement beaucoup plus jeunes, ont diversifié leurs tissus pour le transport des sèves par des éléments de vaisseaux en plus des trachéides (alors que chez les gymnospermes, les fonctions de transport des sèves et de support mécanique sont assurées exclusivement par les trachéides). On trouve ainsi une diversité énorme des bois de feuillus, dits hétéroxylés, dont certains sont plus poreux (riches en vaisseaux, comme les chênes) et les autres plus « fibreux » (comme les bouleaux). La lignine devient elle aussi plus diversifiée et elle varie entre les cellules des fibres et les cellules des vaisseaux.
Propriétés et lignification
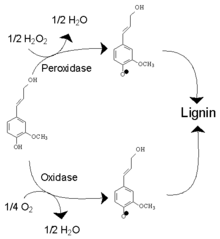
La lignification est un processus fondamental de l’évolution des plantes terrestres végétaux ligneuses. Elle assure une rigidité, une imperméabilité à l'eau, une résistance à l'implosion[Note 3] des cellules conductrices de sève brute[25] et une grande résistance à la décomposition. Cette capacité a permis d'avoir un port dressé favorisant la réception de l'énergie lumineuse. L'ensemble de ces acquisitions étant un préalable à la conquête du milieu terrestre. La capacité de formation de lignine par les végétaux s'est mise en place au début du Paléozoïque (avec un fort développement à partir du Dévonien) et caractérise les trachéophytes (voir flore de Rhynie).
La lignine se dépose tout d'abord dans la lamelle moyenne, la paroi primaire et la couche S1 de la paroi secondaire de certaines cellules végétales, puis imprègne les couches S2 et S3. La paroi aura ainsi une meilleure solidité, car la lignine est très résistante à la compression. De plus, la lignine possède un pouvoir d’imperméabilisation des cellules, du fait de son caractère hydrophobe.
On trouve ainsi des parois imprégnées de lignine (lignifiées) dans les cellules de tissus servant au soutien de la plante (sclérenchyme) ou au transport de l’eau et des sels minéraux (xylème). En règle générale, les cellules lignifiées, devenues imperméables, ont perdu leur cytoplasme et n’acquièrent leur rôle dans le végétal qu’une fois mortes.
Intérêt biologique

La lignine, qui est donc caractéristique des plantes vasculaires terrestres, offre également une barrière de protection contre l'attaque microbienne du végétal. En effet, Sa nature chimique la rend extrêmement résistante à divers agents chimiques et à la dégradation biologique, ce qui explique la qualité biologique médiocre des fourrages hautement lignifiés.
Selon une hypothèse de A.C Neish et C. Hébant, la lignine serait une forme de stockage des excréments de la plante[26]. Sachant que la lignine est constituée de composés phénoliques qui sont toxiques pour la plante sous forme libre, cette dernière aurait trouvé une façon de les neutraliser en les stockant sous forme de lignine dans des cellules vasculaires mortes.
Dégradation biologique de la lignine
Certains micro-organismes, en particulier les champignons dits de la pourriture blanche du bois, sont capables de digérer entièrement le complexe lignine - hémicellulose - cellulose (ligninolyse) et ainsi d'améliorer la valeur nutritive des matériaux lignocellulosiques.
Voie de dégradation : la lignolyse fongique

Macromolécule très stable, la lignine n'est décomposée de manière significative que par des champignons saprotrophes à haut pouvoir de lyse fongique, principalement des basidiomycètes (agents de « pourriture blanche » de la litière, agents de pourriture du bois qui ont un équipement enzymatique spécifique : cellulases et hémicellulases, peroxydases et polyphénol-oxydases extracellulaires et intracellulaires attaquant les fragments de cellulose, hémicellulose et lignine importés dans la cellule fongique) responsables de la lyse de ces composés et de l'humification[27].

L'activité lignolytique est appelée lignolyse fongique (dégradation de la matière ligneuse du bois de manière significative sans nécessairement s'attaquer à la lignine, les champignons lignolytiques se répartissant en espèces cellulolytiques et en espèces ligninolytiques) et l'activité ligninolytique, ligninolyse fongique (dégradation de la lignine de manière significative)[29],[30].
Une croyance encore répandue fait apparaître les champignons lignivores (dits aussi xylophages) il y a 280 millions d'années, stoppant l'accumulation des débris végétaux qui avait permis jusqu'alors la formation du charbon par fossilisation pendant la période géologique appelée Carbonifère[31],[32]. Pourtant, une étude de 2016 a montré que les micro-organismes détritivores (notamment champignons) sont plus anciens et que le charbon est principalement constitué de tissus non ligneux, comme démontré par les fossiles qu'il contient[33].
Enjeux économiques
- La lignine présente une structure chimique lui permettant d'être intégrée à de nombreuses applications actuellement pétro-sourcées. Le potentiel de marché de la lignine est estimé à plus de 240 milliards de dollars[34].
- La lignine est recherchée dans le bois de chauffage pour son pouvoir calorifique important.
- Lorsqu’elle est présente dans la pâte à papier, la lignine induit un jaunissement important du papier avec le temps[35]. Cela est dû à la photo-oxydation de la lignine qui aboutit à la formation de groupes quinoïdes chromophores[36], menant progressivement au jaunissement et au brunissement de la pâte. Pour éliminer la lignine et aboutir à une pâte à papier qui restera davantage blanche avec le temps, l'industrie papetière exploite des procédés chimiques de traitement de la pâte et des étapes de blanchiment. Dans la mesure où les papiers étaient autrefois fabriqués à partir de chiffons de fibres végétales (notamment, lin, chanvre ou coton), qui ne contiennent que peu voire pas de lignine, les papiers produits industriellement entre le XIXe et le XXe siècles avec de la pâte de bois non délignifiée sont très généralement plus jaunes que les papiers plus anciens[35].
- Lors de sa dégradation, la lignine libère de nombreux composés aromatiques, comme la vanilline, l'eugénol, ou encore le guaiacol[37],[38]. Cette source d'arômes est exploitée dans le traitement des fûts en bois destinés au stockage des alcools. Ainsi, lors de la fabrication des tonneaux, l'étape de bousinage (ou de toastage) consiste à "griller" l'intérieur du récipient afin de libérer des produits de dégradation de la lignine et des tanins. Les propriétés organoleptiques des alcools dépendent en grande partie de la production de ces composés aromatiques et du temps pendant lequel ces derniers y seront immergés.
- Peu digestes, la lignine est peu recherchée dans la culture de plantes fourragères, mais néanmoins utilisée comme liant dans l'alimentation animale industrielle[39].
- La lignine, qui a des propriétés tensioactives, est aussi utilisée comme stabilisateur ou émulsifiant de ciments[40], dans des bétons de lignine-bois avec un liant de laitier alcalin (dès les années 1980 en Russie[41]).
Recherche/Prospective
Des recherches sont en cours pour trouver de nouveaux usages à la lignine (par exemple, le bois liquide produit à partir de lignine désoufrée[39]) ; l'industrie tente, essentiellement par transformation génétique, de créer des végétaux pauvres en lignine pour les papeteries, ou au contraire plus riches en lignine, comme bois de chauffage.
La production du complexe lignine-hémicellulose-cellulose est importante sur la planète, et environ 25 % de cette ressource renouvelable serait accessible à des procédés de conversion biotechnologiques. Les champignons xylophages, dont le champignon de la pourriture blanche, sont très étudiés pour leur intérêt dans les domaines suivants :
- amélioration et humification des sols (en utilisation directe via le bois raméal fragmenté) ;
- procédés propres et économiques de traitement de la lignine de l'industrie papetière ;
- bioconversion et production de molécules à haute valeur ajoutée (bois liquide, et polymères) ou produits d'intérêts agro-alimentaire et pharmaceutique à partir de matériaux lignocellulosiques ;
- biotraitement et valorisation des matériaux lignocellulosiques (notamment pour l'alimentation ou le paillage du bétail).
L'université de Tokushima (Japon) a réussi en 2009 à séparer, à haute température et haute pression, la lignine des autres composants du bois, permettant de produire avec cette lignine à faible masse moléculaire l'équivalent d'une résine époxy résistante à la température et non conductrice de l'électricité, comparable selon ses inventeurs aux résines actuellement utilisées[42]. Des résines à bases de lignine sont déjà utilisées comme agent de charge et liant pour agglomérer les particules des panneaux de bois[40], renforcer des caoutchoucs[40] ou la charge adhésive dans les colles à froid à base d'aminoplaste[40] et de phénoplastes[40].
Un processus catalytique par réduction de l'oxygène de la lignine a été proposé, permettant la production de biocarburant pour l'aviation[43],[44].
Notes et références
Notes
- ↑ La fonction de protection avant celle de rigidification, par les lignines, est suggérée par la découverte de phénylpropanoïdes solubles chez des bryophytes[1].
- ↑ Quantitativement, la teneur en lignine est de 3 à 5 % dans les feuilles, 10 à 14 % dans les tiges des plantes herbacées, 15 à 35 % dans les tiges des plantes ligneuses. Les botanistes considèrent les palmiers (dessinés sur le schéma de sortie des eaux ci-dessus) comme des plantes herbacées géantes et non des plantes ligneuses car il ne possèdent pas de cambium qui met en place le xylème secondaire ou bois contenant 15 à 35 % de lignine[3].
- ↑ Cette implosion (collapse) est l'effondrement sous l'effet d'une pression négative (tension), surtout en cas de sécheresse et de forte évaporation.
- ↑ Appelées aussi pourritures blanches de l'humus, elles se distinguent de la pourriture blanche du bois et de la pourriture brune sous l'action desquelles le bois acquiert une texture cubique puis se transforme progressivement en une masse pulvérulente brune.
Références
- ↑ (en) Brian Lowry, David Lee and Charles Hébant, « The Origin of Land Plants: A New Look at an Old Problem », Taxon, vol. 29, nos 2/3, , p. 183-197 (DOI 10.2307/1220280).
- ↑ (en) Hugues Renault, Annette Alber, Nelly A. Horst, Alexandra Basilio Lopes, Eric A. Fich, Lucie Kriegshauser, Gertrud Wiedemann, Pascaline Ullmann, Laurence Herrgott, Mathieu Erhardt, Emmanuelle Pineau, Jürgen Ehlting, Martine Schmitt, Jocelyn K. C. Rose, Ralf Reski & Danièle Werck-Reichhart, « A phenol-enriched cuticle is ancestral to lignin evolution in land plants », Nature Communications, vol. 8, no 14713, (DOI 10.1038/ncomms14713).
- ↑ André Granier, Les arbres grandissent-ils toute leur vie ?, Quæ, , p. 11-12.
- ↑ Jean-Jacques Macheix, Annie Fleuriet, Christian Jay-Allemand, Les composés phénoliques des végétaux, :Presses polytechniques et universitaires romandes, , p. 101.
- ↑ (en) Patrick T.Martone et al, « Discovery of Lignin in Seaweed Reveals Convergent Evolution of Cell-Wall Architecture », Current Biology, vol. 19, no 2, , p. 169-175 (DOI 10.1016/j.cub.2008.12.031).
- ↑ (en) Paulo Henrique Fernandes Pereira, Morsyleide de Freitas Rosa, Maria Odila Hilário Cioffi et Kelly Cristina Coelho de Carvalho Benini, « Vegetal fibers in polymeric composites: a review », Polímeros, vol. 25, 2015-jan-feb, p. 9–22 (ISSN 0104-1428 et 1678-5169, DOI 10.1590/0104-1428.1722, lire en ligne, consulté le ).
- ↑ (en) M. Jawaid et H. P. S. Abdul Khalil, « Cellulosic/synthetic fibre reinforced polymer hybrid composites: A review », Carbohydrate Polymers, vol. 86, no 1, , p. 1–18 (ISSN 0144-8617, DOI 10.1016/j.carbpol.2011.04.043, lire en ligne, consulté le ).
- ↑ Hongzhang Chen, « Chemical Composition and Structure of Natural Lignocellulose », dans Biotechnology of Lignocellulose, Springer Netherlands, (ISBN 978-94-007-6897-0, lire en ligne), p. 25–71.
- ↑ (en) Commission of the European Communities, Biomass for energy, UK Section of the International Solar Energy Society, , p. 73.
- ↑ Marc-André Selosse, Les Goûts et les couleurs du monde. Une histoire naturelle des tanins, de l'écologie à la santé, actes sud, p. 87.
- ↑ (en) J. Ralph et al., « Lignins: Natural polymers from oxidative coupling of 4-hydroxyphenylpropanoids », Phytochem. Rev., vol. 3, no 1, , p. 29–60.
- ↑ B. Meyer-Berthaud, S. E. Scheckler, J. Wendt, Archaeopteris is the earliest known modern tree, Nature, 446, 904-907,1999
- ↑ (en) J. A. Raven, J. D. Lawson, « Comparative physiology of plant and arthropod land adaptation », Philos. Trans. R. Soc. Lond. B, vol. 309, no 1138, (DOI 10.1098/rstb.1985.0087).
- ↑ Augustin Pyramus de Candolle, Théorie élémentaire de la botanique ; ou, Exposition des principes de la classification naturelle et de l'art de décrire et d'étudier les végétaux, Paris, Déterville, (lire en ligne).
- ↑ Comptes rendus de l’Académie des Sciences (C.r.), 8 (1939) 51.
- ↑ Hägglund, E.; Chemistry of Wood. [Academic press Inc., New York, 1952].
- ↑ Bente F., Über die Konstitution des Tannen- und Pappelholzes. Chem. Ber., 8 (1868) 476–479.
- ↑ Klason, P.; Ber. dt. chem. Ges. (B.), 53(1920) 1864.
- ↑ Fuchs, W.; Berichte der Deutschen Chemischen Gesellschaft (B.), 54 (1921) 484.
- ↑ Freudenberg, K.; Zur Konstitution des Lignins. II. Mittl., B., 60 (1927) 581.
- ↑ (en) Erich Adler, « Lignin chemistry—past, present and future », Wood Science and Technology, vol. 11, no 3, , p. 169–218 (ISSN 1432-5225, DOI 10.1007/BF00365615, lire en ligne, consulté le ).
- 1 2 3 Gösta Brunow et Knut Lundquist, « Functional Groups and Bonding Patterns in Lignin (Including the Lignin-Carbohydrate Complexes) », dans Lignin and Lignans, CRC Press, (lire en ligne), p. 267–299.
- ↑ K. K. Pandey, « A study of chemical structure of soft and hardwood and wood polymers by FTIR spectroscopy », Journal of Applied Polymer Science, vol. 71, no 12, , p. 1969–1975 (ISSN 0021-8995 et 1097-4628, DOI 10.1002/(sici)1097-4628(19990321)71:12<1969::aid-app6>3.0.co;2-d, <1969::aid-app6>3.0.co;2-d lire en ligne, consulté le ).
- ↑ Edwin Dorrestijn, Lucas J.J. Laarhoven, Isabel W.C.E. Arends et Peter Mulder, « The occurrence and reactivity of phenoxyl linkages in lignin and low rank coal », Journal of Analytical and Applied Pyrolysis, vol. 54, nos 1-2, , p. 153–192 (ISSN 0165-2370, DOI 10.1016/s0165-2370(99)00082-0, lire en ligne, consulté le ).
- ↑ Marie-Christine Trouy, Anatomie du bois. Formation, fonctions et identification, Éditions Quae, , p. 13.
- ↑ Les arbres ont-ils des excréments ?, Interview de Francis Hallé, Le Monde, (consulté le 22 février 2021).
- ↑ (en) Martínez AT, Speranza M, Ruiz-Dueñas FJ, Ferreira P, Camarero S, Guillén F, et al., « Biodegradation of lignocellulosics: microbial, chemical, and enzymatic aspects of the fungal attack of lignin », Int Microbiol J Span Soc Microbiol., vol. 8, no 3, , p. 195–204 (DOI 10.1093/femsre/fux049).
- ↑ Guy Durrieu, Écologie des champignons, Masson, , p. 45.
- ↑ Jean-Michel Gobat, Michel Aragno, Willy Matthey, Le sol vivant : bases de pédologie, biologie des sols, PPUR Presses polytechniques, (lire en ligne), p. 304-305.
- ↑ (en) Pierre-Emmanuel Courty, Marc Buee, Abdala Gamby Diedhiou, Pascale Frey-Klett, Francois Le Tacon, Francois Rineau, Marie-Pierre Turpault, Stephane Uroz, Jean Garbaye, « The role of ectomycorrhizal communities in forest ecosystem processes: New perspectives and emerging concepts », Soil Biology & Biochemistry, vol. 42, no 5, , p. 679-698.
- ↑ (en) D. Floudas et al., « The Paleozoic origin of enzymatic lignin decomposition reconstructed from 31 fungal genomes », Science, vol. 336, no 6089, , p. 1715-1719 (DOI 10.1126/science.1221748).
- ↑ David Garon, Jean-Christophe Guéguen, Biodiversité et évolution du monde végétal, EDP Sciences, , p. 166.
- ↑ (en) Matthew P. Nelsen, William A. DiMichele, Shanan E. Peters et C. Kevin Boyce, « Delayed fungal evolution did not cause the Paleozoic peak in coal production », Proceedings of the National Academy of Sciences, vol. 113, no 9, , p. 2442–2447 (ISSN 0027-8424 et 1091-6490, PMID 26787881, PMCID PMC4780611, DOI 10.1073/pnas.1517943113, lire en ligne, consulté le )
- ↑ Finding Untapped Value: Converting Lignin to Higher Value Chemicals -Lux Research (juin 2014)
- 1 2 Biasi, Pierre-Marc de., Le papier : une aventure au quotidien, Gallimard, (ISBN 2-07-053445-6 et 978-2-07-053445-6, OCLC 469460196, lire en ligne).
- ↑ Cyril Heitner, « The Photochemistry of Lignin », dans Lignin and Lignans, CRC Press, (lire en ligne), p. 555–584.
- ↑ (en) Nathan Ferrandin-Schoffel, Mohamed Haouas, Charlotte Martineau-Corcos et Odile Fichet, « Modeling the Reactivity of Aged Paper with Aminoalkylalkoxysilanes as Strengthening and Deacidification Agents », ACS Applied Polymer Materials, vol. 2, no 5, , p. 1943–1953 (ISSN 2637-6105 et 2637-6105, DOI 10.1021/acsapm.0c00132, lire en ligne, consulté le ).
- ↑ David N.S. Hon et Nobuo Shiraishi, Wood and Cellulosic Chemistry, Revised, and Expanded, CRC Press, (ISBN 978-0-429-17533-6, lire en ligne).
- 1 2 Le « bois liquide », nouveau composant pour l'industrie du jouet, L'Usine nouvelle, 20/01/2009.
- 1 2 3 4 5 « Valorisation des déchets de papeteries », mis en ligne par l'ENSEEIHT, consulté le .
- ↑ Khrulev V. M. ; Tinnikov A. A. ; Selivanov V. M. ; Étude des propriétés du béton de lignine-bois (article écrit en russe) ; « Izvestiâ vysših ucebnyh zavedenij ». Stroitel'stvo i arhitektura, 1984, no 3, p. 53-57 (2 ref.) ; (ISSN 0536-1052) ; Résumé Inist/CNRS.
- ↑ BE Japon numéro 514 (18/09/2009) - Ambassade de France au Japon / ADIT, intitulé Hitachi développe une nouvelle résine époxyde à base de lignine.
- ↑ (en) « News Release: Catalytic Process With Lignin Could Enable 100% Sustainable Aviation Fuel », sur www.nrel.gov (consulté le )
- ↑ (en) Michael L. Stone, Matthew S. Webber, William P. Mounfield et David C. Bell, « Continuous hydrodeoxygenation of lignin to jet-range aromatic hydrocarbons », Joule, (ISSN 2542-4351, DOI 10.1016/j.joule.2022.08.005, lire en ligne, consulté le )
Voir aussi
Bibliographie
Articles connexes
- Plante ligneuse
- Bois
- Filière bois
- Bois raméal fragmenté
Liens externes