Houiller
| Notation chronostratigraphique | C |
|---|---|
| Notation française | h |
| Notation RGF | h |
| Niveau | Période / Système |
| Érathème / Ère - Éonothème / Éon |
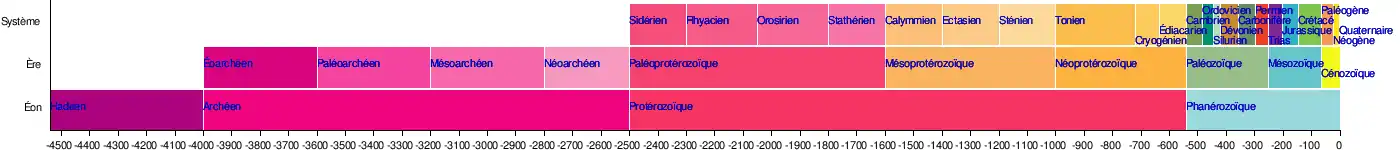
Paléozoïque Phanérozoïque |
Stratigraphie
| Lithologies notables | couches carbonifères |
|---|
- Pennsylvanien (≃Silésien)
- Mississippien (≃Dinantien)
Paléogéographie et climat

| Taux de O2 atmosphérique |
env. 25 %vol[1] (125 % de l'actuel) |
|---|---|
| Taux de CO2 atmosphérique |
env. 450 ppm[2] (2 fois le niveau d'avant la révolution industrielle) |
| Température moyenne |
15 °C[3] (+1 °C par rapport à l'actuel) |
Contexte géodynamique
- 345–230 Ma : orogenèse hercynienne
Faune et flore

- 350 Ma : filicophytes (fougères)
- 330 Ma : tétrapodes (vertébrés) exclusivement terrestres
- 330 Ma : myxinoïdés (animaux des grands fonds)
- 320 Ma : explosion des plantes à graines
- 315–310 Ma : œuf amniotique
- 310 Ma : pinophytes (conifères)
- 300 Ma : coléoptères
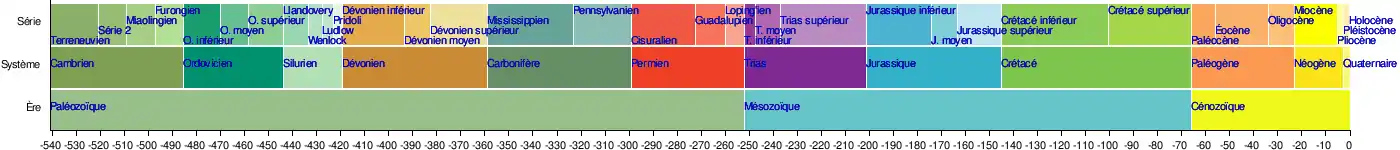
Le Carbonifère est une période géologique du Paléozoïque. Elle s'étend de −358,9 ± 0,4 à −298,9 ± 0,2 millions d'années (Ma). Le Carbonifère suit le Dévonien et précède le Permien. Carbonifère signifie « porteur de carbone », faisant référence aux importantes quantités de carbone qui ont été emprisonnées sous forme de charbon, formant ainsi d'abondants dépôts houillers.
La Pangée continue sa formation durant le Carbonifère, la température moyenne, stable pendant la première partie du Carbonifère diminue par la suite. La partie sud du Gondwana est recouverte d’un glacier continental, mais aux latitudes plus basses un environnement propice et riche en vie prédomine.
Cette période est caractérisée par la présence des premiers grands arbres en abondance. Dans le nord-est de l'Amérique, les lys de mer deviennent moins communs et sont presque inexistants vers la fin de cette période. La vie marine est riche en crinoïdes et autres espèces d’échinodermes. Les brachiopodes sont abondants. Les trilobites se sont raréfiés. Sur les terres, une population variée de plantes existe. Les vertébrés terrestres incluent de grands amphibiens et les premiers reptiles.
Dans certains des textes anciens en français, une autre appellation (désormais obsolète) a été parfois utilisée : Carboniférien.
La seconde moitié de la période a connu des glaciations, un niveau de la mer bas, et la formation de montagnes à mesure que les continents entraient en collision pour former la Pangée. Un événement mineur d'extinction marine et terrestre, l'effondrement de la forêt du Carbonifère, s'est produit à la fin de la période, provoqué par les changements climatiques[4].
Subdivisions
Au niveau mondial, la Commission internationale de stratigraphie divise le Carbonifère en deux sous-systèmes (ou sous-périodes) : le Pennsylvanien et le Mississippien, subdivisés chacun en trois séries : inférieur, moyen et supérieur, comprenant chacune un ou deux étages[5]. Les datations des subdivisions correspondent à celle de l'échelle des temps géologiques publiée en 2012 (Geologic Time Scale 2012, GTS2012)[6],[7].
| Pennsylvanien | |
| Pennsylvanien supérieur : | |
| Gzhélien | (303,7 ± 0,1 - 298,9 ± 0,2 Ma) |
| Kasimovien | (307,0 ± 0,1 - 303,7 ± 0,1 Ma) |
| Pennsylvanien moyen : | |
| Moscovien | (315,2 ± 0,2 - 307,0 ± 0,1 Ma) |
| Pennsylvanien inférieur : | |
| Bashkirien | (323,2 ± 0,4 - 315,2 ± 0,2 Ma) |
| Mississippien | |
| Mississippien supérieur : | |
| Serpukhovien | (330,9 ± 0,2 - 323,2 ± 0,4 Ma) |
| Mississippien moyen : | |
| Viséen | (346,7 ± 0,4 - 330,9 ± 0,2 Ma) |
| Mississippien inférieur : | |
| Tournaisien | (358,9 ± 0,4 - 346,7 ± 0,4 Ma) |
En Europe on utilise également les notions de Silésien et de Dinantien, ces époques correspondent au Pennsylvanien et au Mississippien à l’exception du Serpukhovien qui est placé dans le Silésien. Le Stéphanien, étage régional pour l'Europe du Nord-Ouest, couvre une partie du Gzhélien et du Kasimovien[8].
Paléogéographie
La baisse globale du niveau de la mer de la fin du Dévonien s’inverse au début du Carbonifère. Cette hausse du niveau de la mer crée des mers épicontinentales et les dépôts de carbonate du Mississippien. Une chute des températures se produit au pôle Sud et le sud du Gondwana est gelé. On ignore si les glaciers de ce continent étaient nouveaux, ou s'ils existaient déjà durant le Dévonien. Ces conditions plus froides ont peu d’effet aux plus basses latitudes, où des marécages luxuriants sont communs[9].
Le niveau de la mer s'abaisse vers le milieu du Carbonifère. De nombreuses espèces marines sont touchées et s’éteignent, particulièrement les crinoïdes et les ammonites. Cet épisode marque la limite entre le Mississippien et le Pennsylvanien[9].
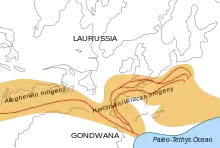
Le Carbonifère est une période d’orogenèse active: la Pangée est en cours de formation. Les continents de l’hémisphère sud restent liés dans Gondwana, tandis que ce supercontinent entre en collision avec la Laurussia le long de ce qui est actuellement la côte est de l’Amérique du Nord (voir l'article orogenèse alléghanienne). La chaîne hercynienne en Europe et les Appalaches en Amérique du Nord se forment lors de cette collision[9]. La plaque eurasienne se soude à l’Europe de l'Ouest au niveau de l’Oural. La plus grande partie de la Pangée est alors assemblée à l’exception de la Chine du nord et de l’Asie du Sud-Est. La forme de la Pangée à la fin du Carbonifère est celle d'un C quasi-fermé, au bord gauche épais ; presque celle d’un D.
Il existe deux océans majeurs au Carbonifère, Panthalassa et Paléotéthys, à l’intérieur du C formé par la Pangée du Carbonifère récent.
D’autres océans mineurs existent :
- la Prototéthys, fermé par la collision du microcontinent de Chine du Nord et Sibéria/Kazakhstania ;
- l’océan Rhéique, fermé par la collision de l’Amérique du Nord et de l’Amérique du Sud ;
- le petit et peu profond océan de l'Oural, fermé par la collision de Baltica et Sibéria.
Climat
Après le refroidissement amorcé durant le Dévonien, la température reste tiède (malgré un taux de CO2 estimé entre 0.06 % et 0,09 %[10], soit deux à trois fois celui du XIXe siècle), et stable durant la première partie du Carbonifère. Pendant la seconde partie du Carbonifère, le climat se refroidit à nouveau. Le Gondwana, dans les latitudes hautes de l’hémisphère sud, est en partie couvert de glace, glaciation qui se poursuit au début du Permien. Laurussia est situé à des latitudes peu élevées et n'est guère touché par le refroidissement.
Les niveaux mondiaux de dioxyde de carbone atmosphérique étaient d'environ 1 500 parties par million, ce qui est une valeur très élevée par rapport aux valeurs contemporaines[11] qui sont autour de 400 ppm en volume en 2021. Les niveaux de dioxyde de carbone ont ensuite diminué à environ 350 parties par million au milieu du Carbonifère[11]. L'émergence des forêts, il y a environ 385 millions d'années, est généralement rendue responsable de cette diminution des niveaux de CO2 atmosphérique et du refroidissement climatique associé[12]. Cependant, les concentrations de CO2 atmosphérique avant l'avènement des forêts présentent des incertitudes importantes[13].
Le taux d'oxygène était de 35 % pendant le Carbonifère, il y a environ 300 millions d'années. À mesure que le climat a refroidit et que les plantes terrestres ont disparu, l'oxygène est tombé jusque 12 % au début du Trias[14].
Géologie


Les couches rocheuses datant du Carbonifère en Europe et en Amérique du Nord consistent souvent en des séquences répétées de calcaire, grès, schiste et charbon. En Amérique du Nord, les dépôts de calcaire sont largement d’origine marine. Les dépôts de charbon du Carbonifère ont fourni une grande part des ressources énergétiques nécessaires à la révolution industrielle. Ils restent encore de nos jours la source d'énergie la plus utilisée dans le monde pour produire de l'électricité et leur exploitation est la principale cause du réchauffement climatique d'origine anthropique.
L'importance des dépôts de charbon est due à deux facteurs :
- l’apparition d’arbres à écorces et en particulier ceux à écorces ligneuses ;
- le niveau des mers, peu élevé, comparé à celui du Dévonien, qui a permis l’extension de vastes marécages et forêts en Amérique du Nord et en Eurasie.
Le taux de CO2 de l'atmosphère (deux à trois fois celui du XIXe siècle) a certainement favorisé la croissance de la végétation.

%252C_Llewellyn_Formation%252C_St._Clair%252C_Schuykill_County%252C_Pennsylvania%252C_USA_-_Houston_Museum_of_Natural_Science_-_DSC01757.JPG.webp)
On a émis l’hypothèse que l’enfouissement de grandes quantités de bois est dû au fait que les bactéries et les animaux n’étaient pas encore assez évolués pour être capables de digérer et de décomposer les nouveaux ligneux. La lignine est en effet difficile à décomposer. De plus les plantes ligneuses de cette période comportaient un ratio écorce/bois bien plus important que de nos jours, 8 pour 1 à 20 pour 1, contre 1 pour 4 de nos jours. Les écorces devaient comporter entre 38 et 58 % de lignine. La lignine n’est pas soluble, elle peut rester dans le sol pendant des centaines d’années et inhiber la décomposition d’autres substances végétales[15].
L’enfouissement massif de carbone a pu conduire à un surplus d’oxygène dans l’air allant jusqu’à 35 %[16] mais des modèles révisés considèrent ce chiffre comme irréaliste et estiment que le pourcentage d’oxygène dans l’air devait se situer entre 15 et 25 %[17].
Faune et flore
Flore
La forêt du Carbonifère subsiste aujourd'hui sous la forme de gisements de houille, qui en sont les dépôts fossilisés. Elle était composée de grandes lycophytes arborescentes comme Lépidodendron, de Calamites, arbres d'une hauteur de 10 mètres, semblables aux prêles actuelles, et les fougères arborescentes[18]. Si la forêt du Carbonifère était pour une grande part une forêt de Ptéridophytes (plantes ne produisant ni fleurs ni graines, dont font partie les lycophytes, les calamites et les fougères), y figuraient aussi, en moindre nombre, les premiers conifères archaïques (les Cordaitales), ainsi qu'un groupe aujourd'hui éteint, les Ptéridospermales (« fougères à graines »)[18].
Faune
Le Carbonifère voit l'apparition de l'œuf amniotique et par conséquent des amniotes. Le groupe apparait vers 340 Ma, les synapsides s'en différencient vers 320 Ma et les saurospides 5 Ma plus tard. À la fin du Carbonifère, les deux clades seront en place et bien diversifiés.
Le gigantisme (à nos yeux) affiché par les arthropodes (myriapode géant, Arthropleura, libellule géante Meganeura) et les amphibiens du Carbonifère s'expliquerait par un fort taux de dioxygène contenu dans l'air (proche de 35 % au lieu des 21 % actuels), la quasi-absence de prédateurs, et une nourriture abondante[19],[20].
 Bivalves marins Aviculopecten et Syringothyris.
Bivalves marins Aviculopecten et Syringothyris. Helenodora inopinata, un proche parent de nos onychophores.
Helenodora inopinata, un proche parent de nos onychophores. Arthropleura pouvait atteindre 2 m de longueur.
Arthropleura pouvait atteindre 2 m de longueur. L'arachnide trigonotarbide Maiocercus.
L'arachnide trigonotarbide Maiocercus. Pulmonoscorpius atteignait 70 cm.
Pulmonoscorpius atteignait 70 cm. Megarachne, un euryptéride aquatique de 60 cm.
Megarachne, un euryptéride aquatique de 60 cm. Le paléodictyoptère Mazothairos avait le thorax segmenté et une troisième paire d'ailes résiduelle sur le premier segment.
Le paléodictyoptère Mazothairos avait le thorax segmenté et une troisième paire d'ailes résiduelle sur le premier segment. Meganeura monyi, un méganisoptère de 75 cm d'envergure.
Meganeura monyi, un méganisoptère de 75 cm d'envergure. Une blatte de 20 cm.
Une blatte de 20 cm. Akmonistion est un holocéphale de l'ordre des Symmoriida.
Akmonistion est un holocéphale de l'ordre des Symmoriida. Falcatus, autre holocéphale, présentait un dimorphisme sexuel.
Falcatus, autre holocéphale, présentait un dimorphisme sexuel. Dracopristis, un elasmobranche ctenacanthiforme.
Dracopristis, un elasmobranche ctenacanthiforme. Ornithoprion, un petit holocéphale eugeneodonte.
Ornithoprion, un petit holocéphale eugeneodonte._(cropped).jpg.webp) Allenypterus, un sarcoptérygien.
Allenypterus, un sarcoptérygien._(Bear_Gulch_Limestone%252C_Upper_Mississippian%253B_Montana%252C_USA)_(33784748875).jpg.webp) Echinochimaera, autre poisson carbonifère.
Echinochimaera, autre poisson carbonifère. Phanerosteon, un ostéichtyen de l'ordre des palaeonisciformes.
Phanerosteon, un ostéichtyen de l'ordre des palaeonisciformes. Rhizodus, poisson d'eau douce sarcoptérygién.
Rhizodus, poisson d'eau douce sarcoptérygién. Squatinactis, un élasmobranche.
Squatinactis, un élasmobranche. Bandringa, autre élasmobranche, à rostre.
Bandringa, autre élasmobranche, à rostre.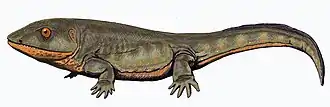 Le pré-amphibien Pederpes, un des premiers tétrapodes.
Le pré-amphibien Pederpes, un des premiers tétrapodes..jpg.webp) Crassigyrinus, autre amphibien.
Crassigyrinus, autre amphibien. Ophiderpeton, un amphibien aïstopode.
Ophiderpeton, un amphibien aïstopode. Microbrachis, un amphibien lépospondyle.
Microbrachis, un amphibien lépospondyle. Amphibamus, un dissorophoïde temnospondyle.
Amphibamus, un dissorophoïde temnospondyle. Hylonomus, un des premiers sauropsides (reptiles).
Hylonomus, un des premiers sauropsides (reptiles). Petrolacosaurus, le plus ancien diapside connu (entre autres, les crocodiles, les dinosaures et donc les oiseaux en descendent).
Petrolacosaurus, le plus ancien diapside connu (entre autres, les crocodiles, les dinosaures et donc les oiseaux en descendent). Archaeothyris, le plus ancien synapside connu (entre autres, les mammifères en descendent).
Archaeothyris, le plus ancien synapside connu (entre autres, les mammifères en descendent).
Extinctions
Lacune de Romer
Les 15 premiers millions d'années du Carbonifère sont marqués par la pauvreté des fossiles terrestres dans les couches géologiques. Cette lacune dans le registre fossile est appelée lacune de Romer, en hommage au paléontologue américain Alfred Romer[21]. Cette lacune a fait l'objet d'un long débat (résultat d'un déficit dans la fossilisation ou conséquence d'un événement), jusqu'à une étude publiée en 2006 qui montre que la période a connu une baisse du niveau d'oxygène, ce qui indique une sorte d'effondrement écologique[22]. Cette période a vu la disparition de tétrapodes basaux du Dévonien, tel Ichthyostega, et l'essor des temnospondyles plus avancés et des reptiliomorphes, caractérisant la faune des vertébrés terrestres du Carbonifère.
Effondrement de la forêt tropicale du Carbonifère
Avant la fin de la période carbonifère, il y a environ 305 millions d'années, une extinction de masse a eu lieu, qui a concerné principalement les plantes, appelée effondrement de la forêt tropicale du Carbonifère[23] (en anglais CRC, Carboniferous Rainforest Collapse). De vastes forêts humides se sont effondrées soudainement alors que le climat, chaud et humide, devenait frais et sec, probablement à cause d'une glaciation intense et de la baisse du niveau de la mer consécutive[24]. Les forêts ont vu leur espace se rétrécir et leur flore a perdu une grande part de sa diversité (les Lycophytes notamment ont été les grandes victimes de cet effondrement).
Les amphibiens, qui étaient les vertébrés dominants à l'époque, ont été pour une grande partie d'entre eux anéantis ; les reptiles, en revanche, ont continué à se diversifier en raison d'adaptations décisives qui leur ont permis de survivre dans un habitat plus sec, en particulier l'œuf à coquille dure, et les écailles, qui retiennent mieux l'humidité que ne le fait la peau des amphibiens[23].
Cause de la fin du Carbonifère
Le charbon a arrêté de se former il y a près de 290 millions d'années (fin du Carbonifère). Selon une étude ayant comparé l'horloge moléculaire et le génome de 31 espèces de basidiomycètes (agaricomycetes : « pourriture blanche », groupe qui contient aussi des champignons ne dégradant pas la lignine — pourriture brune — et des espèces ectomycorrhiziennes), cet arrêt de formation du charbon semble pouvoir être expliqué par l'apparition de nouvelles espèces de champignons lignivores (dits aussi xylophages) capables de dégrader la totalité de la lignine grâce à des enzymes (les lignine peroxydases)[25],[26].
Notes et références
- ↑ (de) teneur en oxygène dans l'atmosphère au Phanérozoïque
- ↑ (en) dioxyde de carbone au Phanérozoïque
- ↑ (en) température de la Terre
- ↑ Sarda Sahney, Michael J. Benton et Howard J. Falcon-Lang, « Rainforest collapse triggered Carboniferous tetrapod diversification in Euramerica », Geology, vol. 38, no 12, , p. 1079–1082 (ISSN 1943-2682 et 0091-7613, DOI 10.1130/g31182.1, lire en ligne, consulté le )
- ↑ Gradstein et al. 2012, p. 603-651.
- ↑ Gradstein et al. 2012.
- ↑ (en) « International chronostratigraphic chart (2012) » [PDF], sur stratigraphy.org.
- ↑ Gradstein, Ogg et Smith 2005, p. 227.
- 1 2 3 (en) Steven M. Stanley, Earth System History. (New York: W. H. Freeman and Company, 1999), 414-426.
- ↑ « Historique du taux de CO2 »
- 1 2 (en-GB) « The Carboniferous Period », sur Darwin's Door, (consulté le )
- ↑ Georg Feulner, « Formation of most of our coal brought Earth close to global glaciation », Proceedings of the National Academy of Sciences, vol. 114, no 43, , p. 11333–11337 (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.1712062114, lire en ligne, consulté le )
- ↑ Georg Feulner et Tais W. Dahl, « New proxy estimates reveal low atmospheric CO2 levels before the emergence of forested ecosystems », sur dx.doi.org, (consulté le )
- ↑ « How does Earth maintain a constant level of oxygen? », sur www.sciencefocus.com (consulté le )
- ↑ (en) Jennifer M. Robinson, « Lignin, land plants, and fungi: Biological evolution affecting Phanerozoic oxygen balance », Geology, vol. 18, no 7, , p. 607-610 (DOI 10.1130/0091-7613(1990)018<0607:LLPAFB>2.3.CO;2, résumé).
- ↑ (en) Robert A. Berner, « Atmospheric oxygen over Phanerozoic time », PNAS, vol. 96, no 20, , p. 10955-10957 (lire en ligne).
- ↑ (en) Timothy M. Lenton, « The role of land plants, phosphorus weathering and fire in the rise and regulation of atmospheric oxygen », Global Change Biology (en), vol. 7, no 6, , p. 613-629 (DOI 10.1046/j.1354-1013.2001.00429.x).
- 1 2 Marcel Bournérias et Christian Bock, Le génie des végétaux. Des conquérants fragiles, Humensis, (ISBN 978-2-7011-8702-0, lire en ligne), p. 135.
- ↑ (en) N. J. Butterfield, « Oxygen, animals and oceanic ventilation: An alternative view », Geobiology (en), vol. 7, no 1, , p. 1–7 (PMID 19200141, DOI 10.1111/j.1472-4669.2009.00188.x).
- ↑ (en) Martin Lockley et Christian Meyer, Dinosaur Tracks and Other Fossil Footprints of Europe, Columbia University Press, , p. 32.
- ↑ (en) Michael I. Coates et Jennifer A. Clack, « Romer's gap: tetrapods orings and terrestriality », Bulletin du Muséum National d'Histoire Naturelle (es), 4e série, vol. 17, nos 1-4, , p. 373-388 (résumé).
- ↑ (en) Peter Waerd, Conrad Labandeira, Michel Laurin et Robert A. Berner, « Confirmation of Romer’s Gap as a low oxygen interval constraining the timing of initial arthropod and vertebrate terrestrialization », PNAS, vol. 103, no 45, , p. 16818-16822 (DOI 10.1073/pnas.060782410).
- 1 2 Sahney, S., Benton, M.J. et Falcon-Lang, H.J., « Rainforest collapse triggered Pennsylvanian tetrapod diversification in Euramerica », Geology, vol. 38, no 12, , p. 1079–1082 (DOI 10.1130/G31182.1, Bibcode 2010Geo....38.1079S).
- ↑ Heckel, P.H., « Pennsylvanian cyclothems in Midcontinent North America as far-field effects of waxing and waning of Gondwana ice sheets », Resolving the Late Paleozoic Ice Age in Time and Space: Geological Society of America Special Paper, vol. 441, , p. 275–289 (ISBN 978-0-8137-2441-6, DOI 10.1130/2008.2441(19)).
- ↑ (en) Floudas D. et al. (2012). The Paleozoic Origin of Enzymatic Lignin Decomposition Reconstructed from 31 Fungal Genomes Science, 336, 1715, (résumé).
- ↑ David Garon et Jean-Christophe Guéguen, Biodiversité et évolution du monde végétal, EDP Sciences, , p. 166.
Bibliographie
- (en) F.M. Gradstein, J.G Ogg, M. Schmitz et G. Ogg, The Geologic Time Scale 2012, Elsevier, , 1176 p. (ISBN 978-0-444-59448-8, lire en ligne).
- (en) Felix M. Gradstein, James G. Ogg et Alan G. Smith, A Geologic Time Scale 2004, Cambridge, Cambridge University Press, , 610 p. (ISBN 0-521-78142-6).
Voir aussi
Articles connexes
- Échelle des temps géologiques
- Point stratotypique mondial (PSM)
- Paléobotanique
Liens externes
- (en) GeoWhen Database