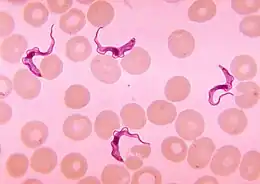
| Causes | Trypanosoma brucei, Trypanosoma gambiense (d) ou Trypanosoma brucei rhodesiense (d) |
|---|---|
| Transmission | Transmission vectorielle (d) |
| Incubation min | 7 j |
| Incubation max | 22 j |
| Symptômes | Signe de Winterbottom (en), fièvre périodique (d), céphalée, malaise, anémie, arthralgie, trouble du sommeil, étourdissement, foyer d'infection primaire (d), tachycardie, tuméfaction, cachexie et sopor (en) |
| Médicament | (RS)-éflornithine, Nifurtimox, suramine, pentamidine et Mélarsoprol |
|---|---|
| Spécialité | Infectiologie |
| CIM-10 | B56 |
|---|---|
| CIM-9 | 086.5 |
| DiseasesDB | 29277 13400 |
| MedlinePlus | 001362 |
| eMedicine | 228613 |
| MeSH | D014353 |
| Patient UK | African-trypanosomiasis |
![]() Mise en garde médicale
Mise en garde médicale
La trypanosomiase africaine, couramment appelée maladie du sommeil, est une forme de trypanosomiase, une maladie parasitaire provoquée par un trypanosome (protozoaire flagellé), qui est transmis par la piqûre de la mouche tsé-tsé ou glossine et qui affecte les animaux et les humains. Deux sous-espèces d'un trypanosome (Trypanosoma brucei) engendrent chez l'humain des pathologies différentes : Trypanosoma brucei ssp. gambiense (Afrique de l'Ouest) et Trypanosoma brucei ssp. rhodensiense (Afrique de l'Est).
La maladie est endémique dans certaines régions de l’Afrique subsaharienne, couvrant environ 36 pays et menaçant 60 millions de personnes. Il est estimé que 50 000 à 70 000 individus sont actuellement infectés par an, le nombre ayant diminué légèrement ces dernières années.
Trois épidémies majeures se sont produites ces cent dernières années, une en 1896-1906 (qui aurait tué environ un million de personnes dans le bassin du Congo[1]) et les deux autres en 1920 et 1970. La trypanosomiase du bétail est appelée nagana (« être déprimé » ou « faiblesse » en zoulou)[2].
Caractéristiques cliniques

En plus de la piqûre par la mouche tsé-tsé, la maladie peut se contracter de la manière suivante :
- de la mère à l'enfant : le trypanosome peut traverser la barrière placentaire et infecter le fœtus, avec un risque de mort périnatale ;
- en laboratoire : infections accidentelles, par exemple, au cours de la manipulation du sang d’une personne infectée ou par une transplantation d'organe, bien que ce soit rare ;
- sexuellement : avoir des rapports non protégés avec une personne atteinte pourrait la transmettre mais les cas avérés sont anecdotiques[3].
Les symptômes commencent par de la fièvre, typiquement intermittente, des maux de tête, et des douleurs articulaires. Un chancre (tuméfaction au niveau du point d'inoculation) se voit dans un cas sur cinq dans la forme rhodésienne mais est exceptionnel dans la forme gambienne[4]. Comme les parasites pénètrent dans l’organisme à la fois par le sang et par le système lymphatique, les ganglions lymphatiques gonflent souvent et atteignent des tailles énormes. Le signe de Winterbottom (en), adénopathies cervicales postérieures (ganglions derrière le cou) peut apparaître. En l’absence de traitement, la maladie déborde progressivement les défenses de la personne infectée, et de nouveaux symptômes apparaissent, notamment l’anémie, les troubles endocriniens, cardiaques, et rénaux. La maladie entre alors dans sa phase de troubles neurologiques quand le parasite traverse la barrière hématoencéphalique. Les symptômes de cette deuxième phase donnent son nom à la maladie ; en plus de la confusion mentale et des troubles de la coordination, le cycle du sommeil est perturbé, ce qui entraîne des accès de fatigue alternant avec des périodes d’agitation maniaque apparaissant le jour avec un assoupissement et la nuit avec l'insomnie. Sans traitement, la maladie est mortelle, avec une détérioration mentale progressive aboutissant au coma et à la mort. Les dommages causés dans la phase neurologique peuvent être irréversibles.
La durée de la maladie varie selon le parasite en cause. L'évolution est plus rapide dans le cas du Trypanosomia rhodesiense (sur quelques semaines à quelques mois)[5]. Elle peut atteindre plusieurs années dans le cas du Trypanosomia gambiense[6].
Une atteinte cardiaque peut se voir dans la forme gambienne, essentiellement à type d'anomalie sur l'électrocardiogramme sans conséquence. Cette atteinte reste au second plan, contrairement à la forme américaine de la trypanosomiase (maladie de Chagas)[7]. La forme gambienne peut être également totalement asymptomatique[4].
Distribution géographique et épidémiologique
La maladie se rencontre sous deux formes, selon le parasite en cause, Trypanosoma brucei gambiense ou Trypanosoma brucei rhodesiense . T.B.gambiense se trouve en Afrique centrale et occidentale; il provoque une atteinte chronique qui peut se prolonger sous une forme passive pendant des mois ou des années avant que les symptômes apparaissent. Le T.B. rhodesiense, est à l’origine d’une forme aiguë de la maladie mais il entraîne des effets beaucoup plus limités. Il est trouvé en Afrique méridionale et orientale ; l’infection débute en quelques semaines, est plus virulente et se développe plus rapidement. Selon des estimations récentes, la maladie du sommeil est responsable d’une perte d’espérance de vie (de 9 à 10 ans) pour 2 millions de personnes[9]. Les évaluations récentes indiquent que plus de 60 millions de personnes réparties dans 250 foyers environ sont en danger de contracter la maladie, et il y a environ 300.000 nouveaux cas tous les ans[10]. En 2011, un rapport du CDC prévoit qu'au rythme du réchauffement climatique actuel, certaines régions tempérées pourraient devenir des zones à risque de contamination ; si actuellement 75 millions de personnes sont exposées, ils évaluent qu'en 2090, ce sont 40 à 77 millions d'individus en plus qui seront exposés au risque de transmission de la maladie[11].
La maladie a été constatée dans 36 pays, tous en Afrique subsaharienne. Les humains sont le réservoir principal pour Trypanosoma brucei gambiense, mais d’autres espèces peuvent également être retrouvées chez les porcs et d'autres animaux. Les animaux sauvages et le bétail sont le réservoir principal de T.B. rhodesiense .
Les Taons (Tabanidae) et Stomoxydinae peuvent probablement jouer un rôle dans la transmission passive (dans des situations spéciales) non seulement pour la Nagana (la forme animale de la maladie du sommeil) mais également de la forme humaine de la maladie[12].
Cycle parasitaire
.GIF)
La mouche tsé-tsé est grande, brune et furtive. La piqûre est ressentie comme une aiguille chaude enfoncée dans la chair. Pendant un repas de sang sur le mammifère hôte, une mouche tsé-tsé infectée (du genre Glossina) injecte les trypomastigotes métacycliques dans le tissu cutané. Les parasites entrent dans le système lymphatique et passent dans la circulation sanguine (1). À l'intérieur de l’hôte, ils se transforment en trypomastigotes circulants dans le sang (2) et sont transportés à d'autres emplacements dans tout le corps, atteignent d'autres fluides biologiques (par exemple, lymphe, liquide cérébrospinal), et continuent de se répliquer par scissiparité (3). Le cycle parasitaire du Trypanosome africain est représenté par des étapes extracellulaires. Une mouche tsé-tsé s’infecte par des trypomastigotes circulants en prenant un repas de sang sur un mammifère infecté hôte (4)(5). Dans l’intestin de la mouche, les parasites se transforment en trypomastigotes procycliques, se multiplient par scissiparité (6), quittent l’intestin, et se transforment en épimastigotes (7). Les épimastigotes atteignent les glandes salivaires de la mouche et continuent leur multiplication par scissiparité (8). Le cycle dans la mouche dure approximativement 3 semaines.
Diagnostic de laboratoire
Le diagnostic repose sur la mise en évidence des trypanosomes par l'examen au microscope du fluide d’un chancre, du liquide de ponction d’un ganglion, de sang, de moelle osseuse, ou, aux dernières étapes de l'infection, du liquide cérébrospinal prélevé par ponction lombaire. Les trypanosomes mobiles sont recherchés sur une préparation humide et en outre une préparation est fixée et colorée avec la méthode de Giemsa. Des techniques de concentration peuvent être utilisées avant l'examen au microscope. Pour des échantillons de sang, la centrifugation est utilisée, pour d'autres échantillons, tels que le liquide cérébrospinal, les techniques de concentration comprennent la centrifugation suivie de l'examen du sédiment. L'isolement du parasite par l'inoculation au rat ou à la souris est une méthode sensible, mais son utilisation est limitée au T.B. rhodesiense. La détection d'anticorps a une sensibilité et une spécificité qui sont trop variables pour en tirer des conclusions cliniques. En outre, dans les infections avec le T.B. rhodesiense, la séroconversion se produit après le début des symptômes cliniques et présente donc un intérêt limité.
Trois tests sérologiques semblables sont disponibles pour la détection du parasite gambien : le micro-CATT, le wb-CATT, et le wb-LATEX. Le premier utilise le sang coagulé tandis que les autres utilisent des échantillons de sang entier. Ces tests consistent à faire réagir une goutte de sang sur un réactif sur carte. Ils sont simples à mettre en œuvre et constituent un moyen de dépistage efficace[13]. La sérologie est, par contre, peu utile dans les formes rhodésiennes, le diagnostic parasitologique devant être privilégié et étant plus facile, du fait d'une plus grande concentration en parasites[4].
Dans les formes neurologiques, la ponction lombaire montre, outre le parasite, une augmentation du taux de protéines ainsi que la présence de globules blancs.
Traitement
.jpg.webp)
Le traitement standard courant pour la première étape de la maladie est la pentamidine en intraveineuse (pour le T.b. gambiense ) ou en intramusculaire, sur une semaine[4], les effets secondaires principaux étant l'hypoglycémie et la douleur au point d'injection ; suivie de la suramine en intraveineuse (pour le T.b.rhodesiense ) sur une durée plus prolongée.
Le traitement standard courant pour la deuxième étape de la maladie (phase neurologique) est le mélarsoprol en intraveineuse de 2.2 mg/kg et par jour pendant 10 jours consécutifs[14].
La première ligne de thérapies alternative inclut le mélarsoprol en intraveineuse 0,6 mg/kg le jour 1, le mélarsoprol IV 1,2 mg/kg sur le jour 2, et 1.2/jour IV combiné avec 7,5 mg/kg par voie orale de nifurtimox deux fois par jour les jours 3 à 10[15] ou l'éflornithine en intraveineuse 50 mg/kg toutes les six heures pendant 14 jours[16].
Dans les zones résistant au mélarsoprol ou chez les patients qui ont rechuté après la monothérapie au mélarsoprol, le traitement devrait être du mélarsoprol et du nifurtimox, ou de l’éflornithine.
Les protocoles traditionnels suivants ne devraient plus être employés :
- Ancien « schéma » thérapeutique de 26 jours de mélarsoprol (3 séries de 3,6 mg/kg/j en intraveineuse pendant 3 jours, avec une interruption de sept jours entre les séries) (ce protocole est moins facile et les patients sont moins volontaires pour accomplir le traitement complet)[17];
- Traitement à doses progressives de mélarsoprol : traitement de dix jours de mélarsoprol (0,6 mg/kg IV le jour 1, 1,2 mg/kg IV le jour 2, et 1,8 mg/kg les jours 3 à 10). Ce protocole était censé réduire le risque d'encéphalopathie induite par le traitement, mais maintenant on sait qu’il est associé à un plus grand risque de rechute et à une incidence plus élevée de l'encéphalopathie[15],[17];
Tous les patients devraient être suivis pendant deux années avec des ponctions lombaires semestrielles pour détecter les rechutes.
En 2022, le développement de l'acoziborole laisse espérer une maitrise de la maladie[18].
Histoire du traitement
Dès le début du XXe siècle, l'Institut Pasteur de Paris entame des démarches afin de comprendre le développement de la maladie mortelle. Pour cela, le centre de recherche envoie des spécialistes médicaux au sein des colonies françaises afin d'effectuer une évaluation de la maladie. Le biologiste Émile Roubaud, faisant partie de ces déploiements, mène ses recherches sur le territoire colonial français. Le scientifique effectue notamment des recherches sur la cause de transmission, soit les glossines, plus connus sous le nom de mouche tsé-tsé[19].
Dans le rapport de la mision d'étude de la maladie du sommeil du Congo français 1906-1908, les médecins tentent de comprendre le développement de la maladie dès les premiers symptômes. Ils débutent donc par effectuer des travaux sur le sang des victimes[20].
En 1910, l’année même de la découverte de Bruce, est introduit le premier médicament actif contre la maladie du sommeil, le Salvarsan (arsphénamine), mis au point par Paul Ehrlich et Sahachiro Hata[21]. Cependant, l’emploi de ce dérivé de l’arsenic présente des risques graves, dont la cécité. Jointe à une toxicité qui le rend peu maniable, l’efficacité du Salvarsan incite à poursuivre les recherches en direction des dérivés de l’arsenic, et d'autres molécules seront obtenues par dérivation de l'acide aminophénolarsinieux : la tryparsamide (it) et le mélarsen, acides arsiniques, à noyau d'arsenic pentavalent ; l'arséno-phénylglycine, le melarsen-oxyde et le melarsoprol, oxydes d'acides arsiniques, à noyau trivalent.
Il faut pourtant attendre jusqu’en 1919 pour qu’aboutissent les travaux de Walter Jacobs et Michael Heidelberger, qui permettront à Wade Brown et Louise Pearce d’introduire la tryparsamide[22]. Dès lors, trois trypanocides apparus au cours des années 1920, la suramine (non-arsenical), l’orsanine et la tryparsamide, sont employés dans de vastes campagnes de dépistage et de traitement de masse. La suramine (Bayer 205), synthétisée en 1917, mais dont la formule, tenue secrète, n'est élucidée par Ernest Fourneau qu'en 1924 à l'Institut Pasteur, est introduite dès 1920. Elle est utilisée au premier stade de la maladie ou en cas d'arséno-résistance. Son administration par voie intraveineuse et à des doses élevées[23] en limite l’emploi. Cependant, et malgré son importante toxicité, elle est encore en usage en 2001 dans la phase lymphatico-sanguine. La tryparsamide (it), dérivée de l'atoxyl, est introduite en 1921 et commercialisée en 1930 sous le nom de Tryponarsil. C’est le premier médicament actif sur la phase cérébrospinale. Cependant, même réduite par une posologie progressive, sa toxicité oculaire touche 2 % des malades traités au cours de la campagne menée par Jean Laigret en République du Congo au milieu des années 1920, et 4,4 % de ceux traités par Eugène Jamot au Cameroun à la même époque. Et chez les patients administrés à un stade avancé, le taux de létalité iatrogène s’élève à 6,6 %[24]. Dans l'ouvrage Essaie de traitement de la maladie du sommeil, au Cameroun, par le Bayer 205 rédigée par Jamot lui-même explique : " [n]ous nous basions, en l'absence de données exactes, sur l'âge que nous étions obligés d'évaluer approximativement d'après l'aspect général. C'est ainsi qu'un garçon de 12 ans, bien développé, a reçu 3 grammes en tout, comme un adulte et n'en a été, en aucune façon, incommodé[25]." Les doses administrées sont donc parfois trop concentrées pour l'âge ou pour le sexe du malade, la cause de l'aveuglement de plusieurs camerounais. Au total, environ 700 camerounais sont atteints de cécité à la suite d'une vaccination[26]. L'orsanine sodique (Fourneau 270) est employée à partir de 1925 et pendant une quinzaine d'années[27],[28],[29], soit seule chez les patients « en période douteuse », soit en association avec la tryparsamide chez les malades au stade second[30].
Dès le début des années 1930, au Congo belge, apparaissent les premiers cas d’arséno-résistance et, à partir de 1934, la tryparsamide est associée à d'autres molécules, dont la suramine et l'orsanine sodique[31].
L’orsanine est abandonnée à la découverte, en 1939, de la pentamidine, molécule très efficace dans la première phase de la maladie, couramment employée en Afrique occidentale comme agent prophylactique, et qui permet pendant les années 1950 une diminution des taux d'infection si importante qu'on croit possible l'éradication de la maladie. La suramine quant à elle, généralement associée à la tryparsamide, reste le médicament le plus employé dans le traitement de la maladie du sommeil jusqu’à la fin des années 1960, progressivement remplacée à partir de 1949 par le mélarsoprol, mis au point par Friedheim[32] et qui présente une toxicité moins élevée que tous les arsenicaux employés jusqu’alors.
L’éflornithine enfin (difluoromethylornithine ou DFMO), le traitement le plus moderne, a été mise au point dans les années 1970 par Albert Sjoerdsmanot et elle a fait l’objet d’essais cliniques dans les années 1980[33]. La molécule a été autorisée aux États-Unis par la Food and Drug Administration en 1990, mais Aventis, le laboratoire pharmaceutique responsable de sa fabrication, a cessé la production en 1999. En 2001, cependant, Aventis, en association avec Médecins sans frontières et l'Organisation mondiale de la santé, a signé un accord à long terme pour fabriquer et distribuer le médicament. Son efficacité est démontrée, sa tolérance est meilleure que celle du mélarsoprol. Il existe cependant, des rechutes sous ce traitement, dans un peu moins de 10 % de cas, mais le plus souvent mortelles[34]. Le fexinidazole pourrait constituer une alternative à ce traitement[35].
Des traitements combinés pourraient réduire ce risque de rechute, parmi lesquels l'association eflornithine - nifurtimox semble particulièrement prometteuse[36].
Le Megazol, molécule biologiquement active avec une activité trypanocide, a fait l'objet il y a quelques années d'études scientifiques[37]. En effet cette molécule, active sous forme de pilule (voie orale) permet d'éliminer 100 % du parasite en deux jours (tests in vitro et in vivo chez le chimpanzé et le cochon). Cette molécule est cependant suspectée d'être cancérigène et son développement a été arrêté.
Perspectives et voies de recherche
Le génome du parasite a été décodé et plusieurs protéines ont été identifiées comme cibles potentielles pour un traitement médicamenteux. Le décodage de l'ADN a également permis de comprendre pourquoi la production d'un vaccin pour cette maladie a été si difficile. T brucei a plus de 800 gènes qui fabriquent des protéines qu’il utilise pour éviter la détection par le système immunitaire. (Berriman, et autres. , 2005)
Une équipe de recherche internationale travaillant en République démocratique du Congo, au Soudan et en Angola impliquant Immtech international et l’université de la Caroline du Nord à Chapel Hill a mené les essais cliniques en phase I et commencé un essai en phase III en 2005 pour tester l'efficacité du premier traitement par voie orale de la maladie de sommeil, connu pour le moment sous le nom de « DB289 »[38],[39].
Des résultats récents indiquent que le parasite ne peut pas survivre dans la circulation sanguine sans son flagelle. Cette découverte donne aux chercheurs un nouvel angle d’attaque pour éliminer le parasite[40].
Des chercheurs[41] ont trouvé un mécanisme immunitaire qu'ils pensent utiliser pour créer de nouveaux traitements. Une protéine Hpr (haptoglobinrelated protein) découverte en 2006 et liée à des lipides du système sanguin peut capturer l'hémoglobine et la transporter vers le corps gras auxquels elles sont liées, qui contient une toxine fatale au trypanosome. Ce mécanisme pourrait être une solution immunitaire utilisant la dépendance des trypanosomes à l'hémoglobine. Lorsque cette dernière a préalablement été capturée par une protéine Hpr, les trypanosomes s'y fixent aussi à la particule graisseuse qui empoisonne alors le parasite[42].
Prévention et contrôle
Il n'existe pas de vaccin ni de prévention médicamenteuse. La prévention et le contrôle se focalisent, là où c’est possible, sur l'extirpation de l'hôte parasite, la mouche tsé-tsé. Deux stratégies ont été employées alternativement dans les tentatives pour réduire les trypanosomiases africaines. L'une des tactiques est principalement médicale ou vétérinaire et vise directement la maladie en utilisant la prophylaxie, le traitement, et la surveillance pour réduire le nombre d'organismes porteurs de la maladie. La deuxième stratégie est généralement entomologique et prévoit de perturber le cycle de transmission en réduisant le nombre de mouches.
Il existe des exemples de réduction de la maladie du sommeil par l'utilisation de techniques de stérilisation des insectes. La surveillance active régulière, impliquant la détection et le traitement des cas, en plus du contrôle des mouches de tsé-tsé, est l'épine dorsale de la stratégie pour le contrôle de la maladie du sommeil. Le dépistage systématique dans les communautés où des foyers ont été identifiés est la meilleure approche, car le dépistage au cas par cas n'est pas possible en pratique dans les zones de forte endémie. Le dépistage systématique peut se faire sous forme de cliniques mobiles ou de centres fixes de dépistages où les équipes voyagent quotidiennement dans les foyers. La nature de la maladie de gambiense est telle que les patients ne cherchent pas à se faire soigner assez tôt parce que les symptômes à cette phase ne sont pas évidents ou assez sérieux pour justifier une consultation médicale, en raison de l'éloignement des quelques secteurs affectés. En outre, le diagnostic de la maladie est difficile et la plupart des personnels sanitaires ne sont pas capable de la détecter. Le dépistage systématique permet à la maladie débutante d'être détectée et traitée avant que la maladie progresse, et diminue le réservoir humain[43].
Pour le voyageur, le port de vêtements couvrants ainsi que de répulsifs contre la mouche responsable est conseillé[4].
Histoire et épidémiologie
En Afrique, la présence de la maladie du sommeil est attestée depuis le XIVe siècle.
Ce n'est pourtant qu'au début du XXe siècle, en 1901 et 1903, que Sir David Bruce découvre et confirme l’agent parasitaire de cette affection, auquel il laisse son nom : le trypanosome de Bruce (Trypanosoma brucei)[44], et en 1910 qu'il identifie avec précision son insecte vecteur, la mouche Glossina palpalis[45]
Il y a eu trois épidémies graves en Afrique au cours du dernier siècle. La première, entre 1896 et 1906, atteint surtout l’Ouganda et le bassin du Congo.
Une épidémie majeure a lieu après le début de la colonisation au passage du XXe siècle, tuant probablement environ un million de personnes dans le bassin du Congo, contribuant à dépeupler les pays du bassin d'Afrique ; il est d'ailleurs probable que les déplacements accrus et souvent forcés dans ce bassin, la promiscuité entre enfants rassemblés dans les écoles, entre les porteurs de tribus et horizons différentes, volontaires ou recrutés de force. Une Assistance médicale indigène[46] et des groupes sanitaires mobiles sont mis en place par l'administration coloniale pour toutes ses colonies, dont au Maroc[47],[48] et en Algérie[49], en Afrique-Occidentale française[50] dont au Cameroun, rapidement confiée aux médecins militaires.
Une deuxième épidémie sévit à partir de 1920 dans plusieurs pays africains. Elle est arrêtée par des équipes mobiles qui examinent systématiquement des millions de personnes en danger. La maladie ayant presque disparu entre 1960 et 1965, le dépistage et la surveillance se relâchent après le départ des autorités coloniales et, en 1970, éclate la troisième grande épidémie.
Depuis, la maladie n'a cessé de progresser sous forme endémique dans plusieurs foyers[51].
Divers
De 1951 à 1953, alors que d'importants progrès sont faits par la pharmacologie et dans la connaissance des psychoses, le professeur Pierre Gallais, responsable du service de psychiatrie de l'hôpital Lévy à Marseille, expérimente une méthode thérapeutique inspirée de la malariathérapie, qu'il nomme trypanothérapie[52], et fait des essais pharmacologiques directement chez 12 patients durant deux ans, estimant que « la phase nerveuse de la maladie pourrait être un moment salutaire pour les patients psychotiques et schizophrènes, en échec thérapeutique, accueillis dans son service »[53]
La molécule sécrétée par le parasite responsable des retentissements symptomatiques sur l'état de veille est le tryptophol[54].
Notes et références
- ↑ Documentaire Les médecins militaires au temps des colonies, Arté France, 2011,réalisé par Farnçois Caillat & Silvia Radelli.
- ↑ Futura Sciences
- ↑ (en) G. Rocha, A. Martins, G. Gama, F. Brandão et J. Atouguia, « Possible cases of sexual and congenital transmission of sleeping sickness », Lancet, vol. 363, , p. 247 (PMID 14738812, lire en ligne [PDF])
- 1 2 3 4 5 (en) R. Brun, J. Blum J, F. Chappuis et C. Burri, « Human african trypanosomiasis », Lancet, vol. 375, , p. 148-159 (lire en ligne)
- ↑ (en) Odiit M, Kansiime F, Enyaru JC, « Duration of symptoms and case fatality of sleeping sickness caused by Trypanosoma brucei rhodesiense in Tororo, Uganda », East Afr Med J, vol. 74, no 12, , p. 792-5. (PMID 9557424)
- ↑ (en) Checchi F, Filipe JA, Haydon DT, Chandramohan D, Chappuis F, « Estimates of the duration of the early and late stage of gambiense sleeping sickness », BMC Infect Dis, vol. 8, , p. 16. (PMID 18261232, PMCID PMC2259357, DOI 10.1186/1471-2334-8-16, lire en ligne [html])
- ↑ (en) Blum JA, Zellweger MZ, Burri C, Hatz C, « Cardiac involvement in African and American trypanosomiasis », Lancet Infect Dis, vol. 8, no 10, , p. 631–41. (PMID 18922485, DOI 10.1016/S1473-3099(08)70230-5, résumé)
- ↑ WHO mortality and health data and statistics, accessed Feb 10, 2009.
- ↑ (en) World Health Organization (Geneva), World Health Report 2000: Health Systems Improving Performance, (lire en ligne)
- ↑ (en) WHO Expert Committee on Control and Surveillance of African trypanosomiasis (Geneva), WHO Technical Report Series,No.881, (lire en ligne)
- ↑ (en) Sean Moore, Sourya Shrestha, Kyle W. Tomlinson and Holly Vuong, Predicting the effect of climate change on African trypanosomiasis : integrating epidemiology with parasite and vector biology . lire en ligne
- ↑ (en) T. Cherenet, R.A. Sani, J.M. Panandam, S. Nadzr, N. Speybroeck et Pé van den Bossche, « Seasonal prevalence of bovine trypanosomosis in a tsetse-infested zone and a tsetse-free zone of the Amhara Region, north-west Ethiopia », The Onderstepoort journal of veterinary research, vol. 71, no 4, , p. 307–312 (lire en ligne)
- ↑ Lutumba P, Robays J, Miaka C et Als. Efficience de différentes stratégies de détection de la Trypanosomiase Humaine Africaine àT. b. gambiense, Trop Med Int Health, 2005;10:347–356
- ↑ (en) C. Burri, S. Nkunku, A. Merolle et al., « Efficacy of new, concise schedule for mélarsoprol in treatment of sleeping sickness caused by Trypanosoma brucei gambiense: a randomised trial », Lancet, vol. 355, no 9213, , p. 1419–25 (PMID 10791526)
- 1 2 (en) Sylvie Bisser, François-Xavier N'Siesi, Veerle Lejon et al., « Equivalence Trial of Melarsoprol and Nifurtimox Monotherapy and Combination Therapy for the Treatment of Second-Stage Trypanosoma brucei gambiense Sleeping Sickness », The Journal of Infectious Diseases, vol. 195, , p. 322–29 (lire en ligne).
- ↑ (en) S. van Nieuwenhove, P.J. Schechter, J. Declercq et al., « Treatment of gambiense sleeping sickness in the Sudan with oral DFMO (DL-alfa-difluoromethyl ornithine) an inhibitor of ornithine decarboxylase: first field trial », Trans R Soc Trop Med Hyg, vol. 79, no 5, , p. 692–8.
- 1 2 (en) J. Pepin et B. Mpia, « Randomized controlled trial of three regimens of melarsoprol in the treatment of Trypanosoma brucei gambiense trypanosomiasis », Trans R Soc Trop Med Hyg, vol. 100, , p. 437–41 (PMID 16483622).
- ↑ Olivier Monod, « Un nouveau traitement prometteur contre la maladie du sommeil », sur Libération, .
- ↑ Jean-Pierre Dozon, Quand les Pastoriens traquaient la maladie du sommeil, , 56 p. (lire en ligne), p. 27-56
- ↑ Pierre Nicolas Alexis Leboeuf, Gustave Martin et Émile Roubaud, Rapport de la mission d'étude de la maladie du sommeil au Congo français, Paris, Masson, , 721 p., p. 10
- ↑ Le 19 avril 1910, au Congrès de médecine interne de Wiesbaden, Ehrlich et Hata font un rapport sur la découverte de l’arsphénamine et sur les résultats encourageants des premiers essais cliniques.
- ↑ « Chemotherapy of Trypanosome and Spirochete Infections. Chemistry of N-Phenylglycineamide-p-Arsonic Acid », Journal of Experimental Medicine, vol. 30, no 5, 1er novembre 1919, p. 411 ; L. Pearce and W. H. Brown, « Therapeutic Action in Experimental Trypanosomiasis of Mice, Rats and Guinea-Pigs », ibid., p. 437 ; « Toxic Action », ibid., p. 417 ; « Therapeutic Action in Experimental Trypanosomiasis of Rabbits », ibid., p. 455 ; « Action on Spirochete Infections », ibid., p. 483.
- ↑ H. Jonchère « Chimioprophylaxie de la trypanosomiase humaine en A.O.F. », dans Bulletin de la Société de pathologie exotique, 44 (1951), 83-93.
- ↑ S. Abbatucci, « À propos du traitement de la maladie du sommeil par la tryparsamide », dans Bulletin de la Société de pathologie exotique, 19 (1926), 271-279.
- ↑ L. Tanon et E. Jamot, « Essai de traitement de la maladie du sommeil, au Cameroun, par le Bayer 205 - Action sur les parasites. Action sur les reins et le foie », Annales de Parasitologie Humaine et Comparée, vol. 2, no 4, , p. 327–334 (ISSN 0003-4150 et 2772-4042, DOI 10.1051/parasite/1924024327, lire en ligne, consulté le )
- ↑ Josiane Tantchou Yakam, « Eugène Jamot : historiographie et hagiographie d'un médecin colonial », Outre-Mers. Revue d'histoire, vol. 95, no 360, , p. 169–189 (DOI 10.3406/outre.2008.4358, lire en ligne, consulté le )
- ↑ Ernest Fourneau, « Sur l'emploi de l'acide oxyaminophénylarsinique et des acides arylarsiniques en général dans le traitement des spirilloses et des trypanosomiases », Annales de l'Institut Pasteur, vol. 35, , p. 571-574.
- ↑ Ernest Fourneau, Jacques et Thérèse Tréfouël et Yvonne de Lestrange-Trévise, « Les Dérivés de l’acide phénylarsénique (As pentavalent) dans le traitement des trypanosomiases. II », Ann. Inst. Pasteur, vol. 40, , p. 933.
- ↑ Ernest Fourneau, Jacques et Thérèse Tréfouël et Germaine Benoit, « Sur les isomères de l'acide para-oxy-3-amino-phényl-arsinique et de son dérivé acétylé (stovarsol) », Bulletin de la Société chimique de France, 4e série, vol. 41, , p. 499-514.
- ↑ J. Dutertre et R. Labusquière, « La thérapeutique de la trypanosomiase », dans Médecine tropicale, 26 (1966), 342-356.
- ↑ J. Burke, « Historique de la lutte contre la maladie du sommeil au Congo », dans Annales de la Société belge de médecine tropicale, 51(1971), 465-477.
- ↑ E. A. H.Friedheim, « Mel B in the treatment of human trypanosomiasis », Am. J. Trop. Med. Hyg., 29 (1949) 173-180.
- ↑ J. Hardenberg, N. Claverie, G. P. Tell, « Eflornithine (Ornidyl) treatment of Trypanosoma brucei gambiense sleeping sickness: report of 711 patients treated up to March 1991 », 21e Réunion du Conseil scientifique international pour la recherche et la lutte contre les trypanosomoses (CSILRT), Yamoussoukro, Côte d'Ivoire, 1991 ;
F. J. Louis, J. Keiser, P. P. Simarro, C. Schmid, J. Jannin, « L’eflornithine dans le traitement de la maladie du sommeil », Med. Trop., 63 (2003), 559-563. - ↑ Priotto G., Pinoges L., Fursa I.B. et al., « Safety and effectiveness of first line eflornithine for Trypanosoma brucei gambiense sleeping sickness in Sudan: cohort study », BMJ, 2008, 336, 705-708.
- ↑ Kande Betu Ku Mesu V, Mutombo Kalonji W, Bardonneau C et al. Oral fexinidazole for late-stage African Trypanosoma brucei gambiense trypanosomiasis: a pivotal multicentre, randomised, non-inferiority trial, Lancet, 2018;391:144–154
- ↑ Priotto G., Kasparian S., Ngouama D. et al., « Nifurtimox-eflornithine combination therapy for second-stage Trypanosoma brucei gambiense sleeping sickness: a randomized clinical trial in Congo », Clin. Infect. Dis., 2007, 45, 1435-42.
- ↑ Gérard Chauvière, Bernard Bouteille, Bertin Enanga, Cristina de Albuquerque, Simon L. Croft, Michel Dumas, Jacques Périe, Journal of medicinal chemistry, vol. 46, no 3, 2003, p. 427-440.
- ↑ (en) David Williamson, « Compound might defeat African sleeping sickness, clinical trial beginning this month », University of North Carolina News Service, (lire en ligne)
- ↑ (en) Staff, « Clinical Trials Update », Genetic Engineering News, , p. 5
- ↑ « African Sleeping Sickness Breakthrough » (consulté le )
- ↑ équipe de l'Université d'Aarhus et de l'Université Libre de Bruxelles, étude parue dans la revue Science en mi-2008
- ↑ B. Vanhollebeke et al., « A haptoglobin-hemoglobin receptor conveys innate immunity to Trypanosoma brucei in humans », Science, vol. 320, (résumé)
- ↑ « Strategic Direction for African Trypanosomiasis Research »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Special Programme for Research and Training in Tropical Diseases (consulté le )
- ↑ D. Bruce, « Note on the discovery of a New Trypanosoma », Proceedings of the Royal Physical Society of Edinburgh, IXIX, 1902, p. 496 ;
« The Etiology of Sleeping Sickness (with special plate). The Trypanosome and its insect carrier », compte rendu de la conférence prononcée par le colonel D. Bruce devant la Société biologique de Liverpool sur la maladie du sommeil en Uganda, British Medical Journal, 21 novembre 1903, p. 1343-1350. - ↑ D. Bruce, A. E. Hamerton, H. R. Bateman, F. P. Mackie, « The natural food of Glossina palpalis », Proceedings of the Royal Society of London, Série B (publications à caractère biologique), 15 juin 1910.
- ↑ Vassal J.(1923).Aperçu général sur l'assistance médicale indigène en Afrique. Rev. méd. Angola, 1, 205-206.
- ↑ Chatinières P (1919) Dans le Grand Atlas marocain: extraits du carnet de route d'un Médecin d'assistance médicale indigène 1912-1916. Plon-Nourrit.
- ↑ Cilleuls, J. D. (1959). La participation des Médecins des groupes sanitaires mobiles a l’Assistance Médicale Indigène et à la conquête du Maroc. Histoire Médicale, 9, 5-39.
- ↑ Raynaud L, Soulié H & Picard P (1932) Hygiène et pathologie nord-africaines: L'assistance médicale des Européens en Algérie, par P. Picard. L'assistance médicale des indigènes en Algérie, par H. Soulié. Considérations générales sur l'organisation et le fonctionnement des services d'assistance et d'hygiène de la colonie, par H. Soulié, L. Raynaud, P. Picard (Vol. 2). Masson.
- ↑ Heckenroth F.(1923). L'œuvre d'assistance médicale indigène en Afrique Occidentale Française. Rev. méd. Angola, 1, 207-219
- ↑ (en) WHO Media centre, Fact sheet No 259: African trypanosomiasis or sleeping sickness, (lire en ligne)
- ↑ http://www.chs-savoie.fr/france/MENU5/news/index.html/quand-1317420000 voir aussi : Souvenirs (JDTR)
- ↑ Blanc F (2012) Trypanothérapie, contribution à l’histoire de la psychiatrie biologique ; PSN 2012/1 (Volume 10) ; Éditions Matériologiques ; (ISBN 9782919694150) p. 77 à 94.
- ↑ (en) E.M. Cornford, W.D. Bocash, L.D. Braun, P.D. Crane, W.H. Oldendorf et A.J. MacInnis. « Rapid distribution of tryptophol (3-indole ethanol) to the brain and other tissues » J Clin Invest. 1979;63(6):1241-8.
Annexes
Bibliographie
- Gaëlle Ollivier et Dominique Legros, « Historique de la trypanosomiase humaine africaine », Tropical Medecine International Health, vol. 6, no 11, , p. 855-863 (lire en ligne)
- (en) M.P. Barrett et al., « The trypanosomiases », Lancet, vol. 362, no 9394, , p. 1469-80 (PMID 14602444, lire en ligne)
- (en) M. Berriman et al., « The genome of the African trypanosome Trypanosoma brucei », Science, vol. 309, no 5733, , p. 416–22 (PMID 16020726, lire en ligne)
Articles connexes
- Mouche tsé-tsé
- Liste des maladies infectieuses
- Maladie de Chagas, autre maladie humaine provoquée par le Trypanosome
- DNDi (Drugs for Neglected Diseases Initiative)
- Épidémie de maladie du sommeil dans le bassin du Congo
Liens externes
- Doctors Without Borders/Medecins Sans Frontieres Sleeping sickness information page
- Institut de recherche pour le développement
- OMS "Trypanosomiase humaine africaine (maladie du sommeil)" dernière mise à jour , http://www.who.int/mediacentre/factsheets/fs259/fr/
