
يمتدُ تاريخُ أبحاثِ التصلب الحَدَبِي إلى أقلِ من 200 عام. التصلب الحَدَبي (Tuberous Sclerosis) ويُدعى اختصارًا TSC، هوَ اضطرابٌ جينيٌ نادرٌ مٌتعددُ الأجهزة، ويُمكنُ أن يؤدي إلى نمو أورامٍ حميدة في الدماغ أو في الأعضاءِ الحيوية الأخرى مثل الكلية، والقلب، والعين، والرئة، والجلد. يَترافقُ التصلب الحَدَبي مع مجموعةٍ من الأعراض والتي تتضمن نوباتٍ صرعية، وتأخرٍ نمائي، واضطراباتٍ سلوكية، وتشوهاتٍ جلدية، بالإضافة إلى أمراضٍ في الرئة والكلية. يحدثُ التصلب الحَدبي بسبب طفراتٍ في واحدٍ من الجينين، TSC1 وTSC2، واللذان على الترتيب يُشفران بروتيني همراتن وتوبرين، حيثُ تعمل هذه البروتينات كابتاتٍ للنمو الورمي ومنظماتٍ لتمايُزِ وتكاثرُ الخلايا.[1] سابقًا كان التَصلب الحَدَبي يُعتبر مرضًا نادرًا لافتًا للنظر، ولكنهُ الآن أصبح محورًا مُهمًا للبحثِ حول تكونِ الأورام وكبتها.
عادةً ما يُقسم تاريخُ البُحوث المتعلقة بالتصلب الحَدبَي إلى أربعِ فترات.[2] في أواخرٍ القرن التاسع عشر، وصفَ أطباءٌ بارزون يعلمون في المستشفياتِ التعليمية الأوروبية أولًا المظاهر الطبية القشرية والجلدية، وقد كرمَ هؤلاء الباحثون الأوائل بتسمياتٍ للتصلب الحَدبي مرُتبطةٍ بأسمائهم مثل "مرض برنفيل"[3] و"ورم برينغل الغدي الزهمي".[4] في بدايةِ القرن العشرين، حُددت هذه الأعراض بأنها مرتبطةٌ بحالةٍ طبيةٍ واحدة، واكتُشف أنَّ المرض يُصيب أعضاء أُخرى، وأنَّ المرض مُتباينٌ في شدته وتختلفُ مظاهره من حالةٍ إلى أُخرى. شهدت أواخر القرن العشرين تحسُناتٍ كبيرة في تقنيات التصوير القحفي، وأيضًا اكتُشف الجينين المُرتبطان بالمرض. أخيرًا، شهدت بدايةُ القرن الحادي والعشرين بدايةً في الفهم الجزيئي للمرض، بالإضافة إلى جوانب علاجية غير جراحية مُحتملة.
القرن التاسع عشر
- 1835
- نَشر طبيب الجلد الفَرنسي بيير فرانسوا أوليف راير أطلسًا لأمراضِ الجلد، يحتوي على 22 لوحة ملونة كبيرة مع 400 شَكل، مَعروضة بترتيبٍ جهازي. الشَكل الأول في الصفحة 20، يُعتبر أول رسم يَصف مرض التَصلب الحَدَبي،[5] وعُنونَ باسم "végétations vasculaires" (تَعني الناميات الوعائية)، حيثُ لاحظ راير أنَّ هُناك "أوعية دموية صغيرة، ذات مظهر حطاطي، تنمو سريعًا وتنتشر على الأنف وحول الفم".[6] لم يذكُر أيَّ حالةٍ طبية مُرتبطة بهذا الاضطراب الجلدي.
- 1850
- وَصف طبيبا الجلد الإنجليزيين توماس أديسون والسير ويليام غول، في تقارير مستشفى غاي، حالة فتاة في الرابعة من عُمرها ولديها "طفح غريب يمتد عبر الأنف ويؤثر بشكلٍ طفيف على كلا الخدين"، وأطلقا عليه اسم "vitiligoidea tuberosa" (تَعني تخطيط بهاقي حَدَبي).[7]
- 1862
- قامَ الطبيب الألماني فريدرش دانيل فون ركلينغهاوزن، والذي كان يعمل مساعدًا لرودلف فيرخوف في معهد التشريح المرضي في برلين،[8] بتقديم حالة لجمعية التوليد في المدينة،[9] حيثُ كانَ قلب الرضيع الذي تُوفي بعد التقاطه لبضعة أنفاسٍ فسحب مُصابًا بعدة أورام، فأطلق على هذه الأورام تسمية "أورام عضلية" (myomata)، كان واحدٌ منها بحجم بيضة الحمام.[7] كما لاحظَ أنَّ الدماغ يحتوي على عددٍ كبيرٍ من التصلبات،[5] وكان شبه مؤكد أنها ورم عضلي مُخطط قلبي وحدبات قشرية دماغية لمرض التصلب الحدبي، ولكنه فشلَ في التعرض على المرض المُميز، واعتبرهُ صفةً تشريحيةً مرضيةً غَريبة.[10] بدلًا من ذلك، أصبح اسم فون ركلينغهاوزن مرتبطًا بالورام الليفي العصبي، وذلك بعد نشره بحثًا تقليديًا عام 1881.[8]
- 1864
- نشر أخصائي علم الأمراض الألماني رودلف فيرخوف عملاً مكوناً من ثلاثة مجلداتٍ عن الأورام، والتي وصفت الطفل المُصاب بالتصلب الحدبي الدماغي والورم العضلي المخطط القلبي. يُعتبر وصف رودلف أول إشارةً إلى أنَّ هذا المرض قد يكون مرضًا وراثيًا، حيثُ أنَّ أُخت الطفل تُوفيت بسبب ورمٍ دماغي.[11]
- 1880
- حَصل طبيب الأعصاب الفرنسي ديزري-ماغلوار بورنفيل على فرصةٍ للتعامل مع المَرض الذي يحملُ اسمه (التَصلب الحدبي يُسمى أيضًا مرض بورنفيل)، وكانَ يعمل مساعدًا غيرَ رسميٍ لجان مارتن شاركو في مستشفى بيتي سالبترير.[10] بينما كانَ ديزري يحلَ محلَّ أستاذه لويس ديلاسيوف،[12] ذهبَ إلى ماري، وهي فتاة تبلغُ من العُمر 15 عامًا وتعاني من تَأخُرٍ حركيٍ نفسي، وصرع، وطفحٍ حطاطي حويصلي متمادٍ في الأنف والخدين والجبين، وَلديها تاريخ من النوبات منذُ مرحلة الرضاعة، وكانت قد نُقلت إلى مستشفى الأطفال وهي في الثالثةِ من عمرها، وحددت كحالةٍ ميؤوسٍ منها. كانت تُعاني أيضًا من صعوباتٍ في التعلم، ولم يكن بإمكانها المشي أو التحدث؛ وبينما كانت تحتَ رعاية بورنفيل، ازداد عندها عدد النوبات، والتي جاءت على شكل مجموعات. عُولجت بالكينا، وبروميد الكافور، ونتريت الأميل، وباستعمال العلقيات خلف الأذن. تُوفيت ماري في المُستشفى بتاريخ 7 مايو 1879. أظهر تشريح الجثة بعد الوفاة وجود حدباتٍ صلبةٍ كثيفةٍ في تلافيف الدماغ، وأطلقَ بورنفيل عليها اسم "Sclérose tubéreuse des circonvolutions cérébrales" (التصلب الحَدبي لتلافيف المخ)، كما خَلصَ بورنفيل إلى أنَّ هذه الحدبات كانت مصدرَ النوبات، بالإضافة لذلك، عُثرَ في الكليتين على كتلٍ صلبةٍ بيضاء، بحجمِ حبة الجوز.[13]
- 1881
- وصفَ الطبيب الألماني هارتغين حالةً لطفلٍ عُمره يومين تُوفي في حالة صرعية، وكشفَ الفحص بعد الوفاة عن وجودِ أورامٍ صغيرة في البطينات الجانبية للدماغ مع تصلباتٍ قشرية، وأطلقَ عليه اسم "glioma gangliocellulare cerebri congenitum" (ورم دبقي عقدي الخلايا دماغي خلقي).[14][15]
- 1881
- قام بورنفيل وإدوارد بريسو بفحص طفلٍ يبلغ من العمر 4 سنوات في مستشفى بيسيتر، ومثل السابق، كان لدى المريض حدباتٌ قشرية وصرع وصعوبات في التعلم، إضافة لوجود لغط في القلب. وأظهر الفحص بعد الوفاة أنَّ لديه أورام صلبة صغيرة في جدران البطين في الدماغ (عقيدات تحت البطانة العصبية)، بالإضافة لوجود أورامٍ صغيرة في الكليتين (أورام شحمية عضلية وعائية).[16]
- 1885
- وثقَ الطبيبان الفرنسيان فيليكس بالزر وبيير يوجين مينتري حالةً مُصابة بورمٍ غدّي في الغدد الدهنية الموجودة في الوجه وفروة الرأس (adénomes sébacés de la face et du cuir)،[17]، ومنذُ ذلك الوقت ثبتَ أنَّ المُصطلح المُستعمل غير صحيح؛ لأنها ليست أورامًا غدية وليست خارجةً من الغدد الدهنية، وأصبح الطفح الجلدي يُعرف منذئذٍ باسم "ورم وعائي ليفي وجهي".[18]
- 1885
- نشرَ طبيبا الجلد فرانسوا هنري هالوبو وإيميلي ليريددي عن حالةٍ مُصابة بورم غدي زهمي ذي طبيعةٍ ليفية صلبة. وقد وصفا أولًا اللويحات الحرشاء ثُم وصفا لاحقًا وجود ارتباطٍ بين الطفح الوجهي والصرع.[7][19]
- 1890
- وصف طبيب الجلد الإسكتلندي جون جيمس برينغل، والذي كان يعمل في لندن، حالة امرأة تبلغُ من العمر 25 عامًا، تُعاني من تدني الذكاء عن المُعدل الطبيعي، إضافة لوجود آفاتٍ خشنة على ذراعيها وساقيها وطفحٍ حطاطي في الوجه. لَفَت جون برينغل الانتباه إلى خمسةِ تقاريرَ سابقة، منها اثنان لم ينشرا.[20] أصبح مُصطلح ورم برينغل الغدي الدهني شائِعًا لوصف الطفح الوجهي.
بداية القرن العشرين
- 1901
- درسَ الطبيب الإيطالي جي بي بليتسي مرضيات الآفات الدماغية، حيثُ أشارَ إلى طبيعتها المُتعلقة بخلل التنسج، والتوضع القشري المغاير، والميالين المعيب. قام بليتسي بتصنيف الحدبات إلى النوع الأول (سطح أملس) والنوع الثاني (مع انخفاضاتٍ مركزية).[21][22]
- 1903
- وصفَ الطبيب الألماني ريتشارد كوثي أورامًا ليفية مُحيطةً بالظفر، والتي أُعيد اكتشافها مرةً أُخرى على يد الطبيب الهولندي يوهانس كوينين عام 1932، وتعرف باسم أورام كوينين.[23]
- 1906
- اعتبرَ طبيب الأعصاب الأسترالي ألفريد والتر كامبل، والذي كان يعمل آنذاك في إنجلترا، أنَّ الآفات الموجودة في الدماغ والجلد والقلب والكلى يسببها مرضٌ واحد، كما وصف المَرض الظاهر بالعين لأول مرة. ساعدتهُ مراجعته لعشرين حالةٍ موثقة على اقتراح تشخيصٍ ثلاثي الأعراض والذي يُنسب بشكلٍ أكبر إلى فوغت.[24]
- 1908
- وضعَ طبيب الأطفال والأعصاب الألماني هاينريش فوغت معاييرَ تشخيص التصلب الحدبي، وأكدَ على العلاقة بين الطفح الوجهي والآثار العصبية في الحدبات القشرية.[25][26] استمر ثالوث فوغت من الصرع والعته والورم الغدي الدهني لمدة 60 عامًا، حتى اكتشف مانويل غوميز أنَّ أقل من ثلث مرضى التصلب الحدبي كان لديهم الأعراض الثلاثة.[5]
- 1910
- يُعتبر ج. كيربكزنيك أول من حددَ أنَّ التصلب الحدبي هو حالة وراثية، حيثُ وصف حالاتٍ لتوائم متطابقة إخوة، وأيضًا لعائلةٍ واحدة فيها ثلاثة أجيال مُتعاقبة مُتأثرة بالتصلب الحدبي.[27]
- 1911
- وثّق إدوارد شيرلوك، وهو محامٍ ومُحاضر في علم الأحياء، تسعَ حالاتٍ في كتابه عن "ضُعف العقل"، وصاغَ إدوارد مُصطلحَ "epiloia" (تصلب معجر)، وهو لفظ منحوت من "epilepsy" (الصرع) و"anoia" (الغَباء).[28] لم يعد هذا المُصطلح مستعملًا كثيرًا كمرادفٍ للتصلب الحدبي. في عام 1981، اقترحَ عالم الوراثة روبرت جيمس غورلين بأنَّ هذا المصطلح قد يكون اختصارًا مُفيدًا لِلصرع (epilepsy) وانخفاض الذكاء (low intelligence) والورم الغدي الدهني (adenoma sebaceum).[29]
- 1913
- يُنسب الفضل إلى هـ. بيرغ في تدوينه لأول مرة أنَّ التصلب الحدبي هو اضطرابٌ وراثي، مُشيرًا أنَّ انتقاله يكون عبر جيلين أو ثلاثة أجيال.[30]
- 1914
- وصفَ ب. شوستر مريضًا مع ورمٍ غدي دهني وصرع ولكن ذكاءه طبيعي،[7] ويُسمى هذا التعبير الظاهري المُخفف للتصلب الحدبي باسم "forme fruste" (أي، شَكْل مُسْدَف، وهو شكل خفيف ولانموذجي من المرض)[31].[32]
- 1918
- نشرَ الطبيب الفرنسي رينيه لوتيمباغير أول تقريرٍ لحدوث داء الرئة الكيسي في مريضٍ بالتصلب الحدبي، بعدما توفيت مرأة بالغة من العمر 36 عامًا بسبب استرواح الصدر ثنائي الجانب. يعتقدُ رينيه لوتيمباغير أنَّ الكيسات والعقيدات قد تكون منتقلة من الساركومة الليفية الكلوية. هذه المُضاعفة تُصيب النساء فقط، وتُعرف باسم الورام العضلي الأملس الوعائي اللمفي.[33][34]
- 1920
- وصف طبيب العيون الهولندي جان فان دير هوف ورمًا عابيًا شبكيًا (ورم أعدس)، وقامَ بجمع التصلب الحدبي والورام الليفي العصبي معًا باسم "المتلازمة العدسية" (أصبحت تُدعى لاحقًا المتلازمات العصبية الجلدية).[35]
- 1924
- أشار هـ. ماركوس أنَّ السمات المميزة للتصلب الحدبي مثل التكلسات داخل القحف تكون مرئية عبر الأشعة السينية.[36]
منتصف القرن العشرين
- 1932
- درسَ ماكدونالد كريتشيلي وشارلز ج. س. إيرل 29 مريضًا بالتصلب اللوحي والموجودين في مستشفيات الأمراض العقلية، حيثُ وصفوا حركاتٍ سلوكية-غير طبيعية في اليد ومواقف غريبة وحركاتٍ متكررة (نمطية)، والتي تُشابه طيف التوحد، ولكن على الرغم من ذلك، كان هذا الوصف قبل 11 عامًا من اقتراح ليو كانر لمصطلح "autism" (التوحد). لاحظوا أثناء الدراسة وجود بقعٍ بيضاء على الجلد (بقع ناقصة الملانين).[37]
- 1934
- بيّنَ ن. جا. بيركويتز ول. جي. راجلر احتمال تشخيص التصلب الحدبي باستعمال تصوير الدماغ المحقون بالغاز لإظهار العقيدات تحت البطانة العصبية غير المُتكلسة، والتي تُشبه الشمع المتساقط في الشمعة المُشتعلة على البطينات الجانبية.[38]
- 1942
- اقترح سيلفان إي. مولتن مُركب التصلب الحدبي (the tuberous sclerosis complex)، والذي أصبح الاسم المُفضل حاليًا، حيثُ فسرَ الطبيعة الجهازية المُتعددة لهذا المرض. قدم مولتن ثلاث كلماتٍ لوصف المرض وفقًا لعلم الأمراض: الآفة الأساسية هي عيبية، تُصبح بدورها شبيهة بالورم (ورم عابي) أو ورم حقيقي (ورم أرومي عابي).[39]
- 1954
- هجّنَ عالم الأمراض النرويجي ريدار إيكر نسلًا من جرذان ويستار لديها قابليةٌ لحدوث ورم غدي كلوي. أصبحت جرذات إيكر نموذجًا مهمًا للسرطان المُوَرث سياديًا.[40]
- 1966
- قادَ فانور بيرو وبريس وير عمليات التدخل الجراحي للصرع في التصلب الحدبي، ومن المرضى السبعة الذين خضعوا لاستئصال الحدبة القشرية، أصبح اثنان منهم خاليين من النوبات الصرعية. قبل هذا، عُولج أربعة مرضى فقط جراحًيا لعلاج النوبات الصرعية المُرافقة للتصلب الحدبي.[41]
- 1967
- استعرضَ جا.سي. لاغوس ومانويل رودريغيز غوميز 71 حالةً مُصابةً بالتصلب الحدبي، ووجدوا أنَّ 38% من المرضى يكون معدل الذكاء لديهم طبيعيًا.[14][42]
- 1971
- طورَ عالم الوراثة الأمريكي ألفريد ندسون فرضية ندسون لتفسير تكون ورم أرومة الشبكية في الأطفال والبالغين. كان لدى الأطفال طفرة جنسية خلقية والتي اتحدت مع طفرة جسدية عمرية مُبكرة مؤديةً إلى الورم. ينطبق هذا النموذج على العديد من الحالات التي تتضمن جيناتٍ كابتة للورم مثل التصلب الحدبي.[43] في ثمانينيات القرن العشرين، عززت دراسات كنودسن على جرذان إيكر من هذه الفرضية.[44]
- 1975
- أشارَ جيوسبي بامبيغليون وإي. بيغ، في رسالةٍ إلى مجلة ذا لانسيت، أنَّ حوالي 69% من المرضى تَعرضوا لتشجناتٍ صرعية.[45]
- 1975
- استخدمَ ريمان تخطيط الصدى الطبي لأور مرةٍ لفحص الكلى المصابة بالتصلب الحدبي في حالةٍ لامرأة تبلغ من العمر 35 عامًا تُعاني من فشلٍ كلويٍ مزمن.[46]
أواخر القرن العشرين
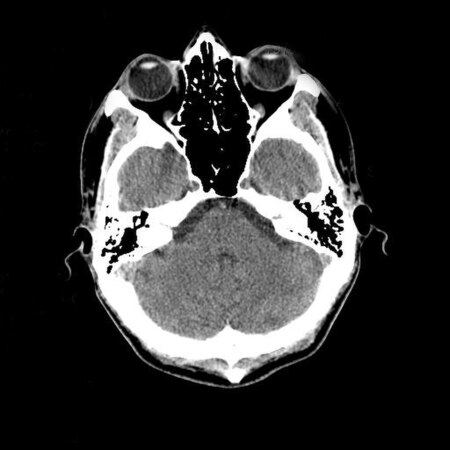
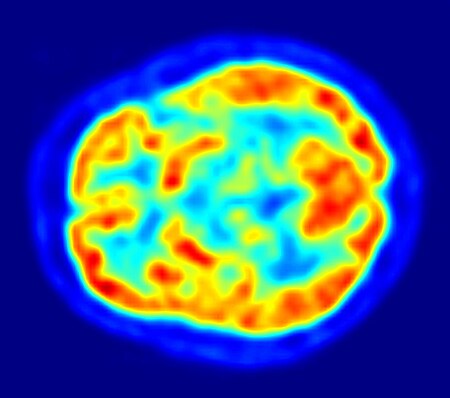
- 1976
- أَثبتَ التصوير المقطعي المُحوسب (اخترع عام 1972) أنهُ أداةٌ ممتازة لتشخيص الأورام الدماغية في الأطفال، بما يتضمن الأورام الموجودة في التَصلب الحَدَبي.[47]
- 1979
- نشر مانويل غوميز أفرودةً بعنوان "Tuberous Sclerosis" (التصلب الحدبي)، والذي ظلَ الكتاب المرجعي لثلاث طبعاتٍ على مدى عقدين، حيثُ يصف الكتاب لأول مرة الطيف السريري الكامل لمرض التصلب الحدبي، كما يصف مجموعةً جديدةً من المعايير التشخيصية لتحل محل ثالوث فوغت.[14][48]
- 1982
- نجحَ كينيث أرندت بعلاج ورم وعائي ليفي وجهي باستعمال ليزر الأرغون.[49]
- 1983
- قُورنَ التصوير المقطعي بالإصدار البوزيتروني (PET، اخترع عام 1981) بالتصوير المقطعي المحوسب (CT) وتخطيط أمواج الدماغ (EEG)، حيثُ وجدَ أنهُ قادرٌ على تحديد تموضع الحدبات القشرية المخية المحدثة للصرع والتي قد لا تلاحظ من دونه.[50]
- 1984
- اكتُشفت مجموعةٌ من التشنجات الطِفلِية في التصلب الحدبي والتي تُسبق بتفريغٍ بؤري عبر تخطيط أمواج الدماغ.[51]
- 1985
- استُخدمَ التصوير بالرنين المغناطيسي (MRI، اختُرع عام 1980) لأول مرة في التصلب الحدبي لتحديد المناطق المتأثرة في دماغ فتاةٍ مُصابة بالتصلب الحدبي.[52]
- 1987
- تقررَ أنَّ التصوير بالرنين المغناطيسي مُفضل على التصوير المقطعي المُحوسب في الحساسية والنوعية. في دراسةٍ شملت 15 مريضًا، حيثُ حُدِدَت عقيدات تحت البطانة العصبية مُوجهة نحو البطينات الجانبية في 12 مريضًا، وانفتال في الهيكل القشري الطبيعي في 10 مرضى (تناظر الحدبات القشرية)، وأيضًا حُددت بطينات متوسعة في 5 مرضى، كما لُوحظَ وجو ورم نجمي معروف من العقيدات الحميدة تحت البطانة العصبية في مريضٍ واحد.[53]
- 1987
- وُجدَ أنَّ التصوير بالرنين المغناطيسي قادرٌ على توقع الشدة السريرية للمرض (النوبات الصرعية والتأخير النمائي)، حيثُ أُجريت دراسة على 25 مريضًا، وُجدَ فيها علاقةٌ مع عدد الحدبات القشرية المُحددة، وعلى النقيض من ذلك، فإنَّ التصوير المقطعي المُحوسب لم يكن مُفيدًا في التوقع، ولكنه تفوقَ في تحديد الآفات المُتكلسة.[54]
- 1987
- حدد تحليل الارتباط الجيني في 19 عائلة مُصابة بالتصلب الحدبي، جينًا على الكروموسوم 9.[55]
- 1988
- في دراسةٍ على 6 أطفال مُصابين بالتصلب الحدبي، استُخدِمَ التصوير بالرنين المغناطيسي، حيثُ وَجدَ حدباتٍ قشرية تُقابل بالضبط موقع بُؤر تخطيط الدماغ الكهربائي، وخصيصًا الحدبات القشرية الأمامية التي ترتبط مع نوباتٍ أكثرُ تعقيدًا.[56]
- 1990
- وُجدَ أنَّ مُضاد الصرع فيغاباترين فعالٌ جدًا في علاجِ التشجنات الرضيعية، خاصةً في الأطفال المصابين بالتصلب الحدبي.[57] في عام 1997 اكتُشف أنه من الآثار الجانبية المُحتملة للفيغاباترين إحداثُ تضيقٍ مستمرٍ شديد في المجال البصري، لذلك أصبحت المعالجة الأحادية بالفيغاباترين مُقيدةٌ إلى حدٍ كبير في مجموعةٍ من المرضى.[58]
- 1992
- حدد تحليل الارتباط الجيني موقع جينٍ ثانٍ على الكرومسوم 16p13.3، على مقربةٍ من جين النوع الأول من مرض الكلى المتعدد الكيسات (PKD1).[59]
- 1994
- اكتُشفَ أنَّ جرذان إيكر عبارةٌ عن نموذج حي على التصلب الحدبي، لامتلاكها طفرة على الجين الجرذي المُناظر لجين TSC2.[61]
- 1995
- وُثقَ أنَّ متواليات التصوير بالرنين المغناطيسي مع استعادة السائل الموهن بالانقلاب (FLAIR) أفضل بِكثير في تحديدِ الحدبات الصغيرة من تقنية الصور في الزمن الثاني الموزون (T2-weighted images)، وخاصةً الحدبات تحت القشرة.[62][63]
- 1997
- اكتُشف أنَّ جين PKD1، والذي يؤدي إلى مرض الكلى متعدد الكيسات الجسدي السائد، وجين TSC2 مُتقاربين على الكرموسوم 16p13.3. قام فريق في معهد علم الوراثة الطبية في ويلز بدراسةٍ على 27 مريضًا لا علاقةً لهم بمرض التصلب الحدبي والمرض الكيسي الكلوي، حيثُ توصلوا أنَّ مرض الكلية الشديد في مرضى التصلب الحدبي غالبًا يحدثُ بسبب حذفٍ جيني مُجاور في TSC2 وPKD1، كما لاحظوا أيضًا أنَّ المرض يختلف (يحدث بوقت مُبكر وأكثر شدة) عن المرضى المُصابين بمرض الكلى متعدد الكيسات الجسدي السائد، وأنَّ مرضى TSC1 لا يعانون من مرضٍ كيسيٍ كبير.[65]
- 1997
- قامَ كلٌ مِن باتريك بولتون وبول غريفيث بفحصِ 18 مريضًا مُصابين بالتصلب الحدبي، وكان نِصفهم مُصابًا بنوعٍ من التوحد، كما وجدوا رابطًا قويًا بين مرضى التوحد والحدبات في الفصوص الصدغية.[66]
- 1998
- أصدرَ مؤتمر إجماع التصلب الحدبي معاييرًا تشخيصية مُنقحة، وهي المعايير الحالية للمرض.[67]
- 1998
- قام فريقٌ إيطالي باستخدام تخطيط الدماغ المغناطيسي (MEG) لدراسة 3 مرضى يُعانون من التصلب الحدبي والصرع الجزئي. بالاشتراك مع استخدام التصوير بالرنين المغناطيسي، استطاعَ الفريق دراسةَ الارتباط بين المناطق الحدبية في الدماغ والخلل الوظيفي العصبي والمناطق المُولدة للصرع.[68] ستؤكد دراسات لاحقة أنَّ تخطيط الدماغ المغناطيسي يَتفوق على تخطيط أمواج الدماغ في تحديد الحدبات المولدة للصرع، والتي قد تكون قابلةً للاستئصال الجراحي.[69]
القرن الواحد والعشرين
- 2001
- إجراء دراسة تعرض على مجموعةٍ متعددة من المراكز، حيثُ شملت العينة 224 مريضًا، وقد تم فحصهم بالنسبة للطفرات وشدة المرضي. المرضى المُصابون بـ TSC1 كانوا أقلَ شدةٍ من أولئك المُصابين بـ TSC2، حيثُ كان لديهم نوبات تشنجية وضعف ذهني أقل، كما كانت بعض أعراض التصلب الحدبي نادرة أو غير موجودة لديهم. كان الاستنتاج بأنه "يظهر بأنَّ طفرات الخط الإنتاشي والطفرات الجسدية أقل شيوعًا في TSC1 من TSC2".[70]
- 2002
- عملت العديد من المجموعات البحثية على التحقق من كيفية عمل المُنتجات الجينية TSC1 وTSC2 (همراتن وتوبرين) معًا على تثبيط هدف الثدييات من الراباميسين (mTOR)-يتوسط إرسال الإشارات مع التيار. يُنظم هذا المسار المهم تكاثر الخلايا وتثبيط الأورام.[71]
- 2002
- وجد أنَّ العلاج بالراباميسين (سيروليموس) يُقلص الأورام في نماذج التصلب الحدبي من جرذان إيكر (TSC2)[72] وفأر (TSC1)[73].
- 2006
- أظهرت التجارب الصغيرة نتائجًا مُبشرة في استخدام الراباميسين لتقليص الورم الشحمي العضلي الوعائي[74] والأورام النجمية.[75] بدأت العديد من التجارب السريرية الكبيرة مُتعددة المراكز بعلاج الورام العضلي الأملس الوعائي اللمفي[76] والورم الشحمي العضلي الوعائي الكلوي[77] بالراباميسين، كما أنَّ أورام النجميات العملاقة عُولجت بالإيفيروليموس المُشتق من الراباميسين.[78]
المراجع
- "Tuberous Sclerosis Fact Sheet". NINDS. 11 April 2006. مؤرشف من الأصل في 21 يناير 200709 يناير 2007.
- Rott (2005), page 2 - Introduction.
- Enersen, Ole Daniel. "Désiré-Magloire Bourneville". من سمى هذا؟?. مؤرشف من الأصل في 11 نوفمبر 201830 أبريل 2007.
- Enersen, Ole Daniel. "John James Pringle". Who Named It?. مؤرشف من الأصل في 11 نوفمبر 201830 أبريل 2007.
- Curatolo (2003), chapter: "Historical Background".
- Rayer, Pierre François (1835). Traité des maladies de la peau / atlas (باللغة الفرنسية). Paris: J.B. Baillière. صفحة 20. مؤرشف من الأصل في 6 فبراير 20129 ديسمبر 2006.
- Jay V (2004). "Historical contributions to pediatric pathology: Tuberous Sclerosis". Pediatric and Developmental Pathology. 2 (2): 197–8. doi:10.1007/s100249900110. PMID 9949228.
- Enersen, Ole Daniel. "Friedrich Daniel von Recklinghausen". Who Named It?. مؤرشف من الأصل في 16 نوفمبر 201810 ديسمبر 2006.
- von Recklinghausen, F (1862). "Ein Herz von einem Neugeborene welches mehrere theils nach aussen, theils nach den Höhlen prominirende Tumoren (Myomen) trug". Monatschr Geburtsheilkd (باللغة الألمانية). 20: 1–2. (As cited in Curatolo (2003))
- "Tuberous sclerosis complex and its founders". Journal of Neurology, Neurosurgery, and Psychiatry. 75 (5): 770. 2004. doi:10.1136/jnnp.2003.027524. PMC . PMID 15090576. مؤرشف من الأصل في 22 فبراير 2008.
- Virchow R (1863–7). Die Krankhaften Geschwülste. Vol II. Berlin: August Hirschwald. صفحة 148. (كما ذكر في أسييرنو (Acierno) (1994))
- Wilkins, Robert H (ed); Brody, Irwin A (ed) (1997). "XXXI Tuberous Sclerosis". Neurological Classics. American Association of Neurological Surgeons. صفحات 149–52. . (يحتوي على ترجمة مختصرة لورقة بورنفيل 1880)
- Bourneville D (1880). "Sclérose tubéreuse des circonvolutions cérébrales: Idiotie et épilepsie hemiplégique". Archives de neurologie (باللغة الفرنسية). 1: 81–9l. مؤرشف من الأصل في 25 فبراير 201222 أغسطس 2009.
- Sancak, Özgür (2005). Tuberous Sclerosis Complex: Mutations, Functions and Phenotypes. Stichting Tubereuze Sclerose Nederland. صفحات 11–2. .
- Hartdegen A (فبراير 1881). "Ein Fall von multipler Verhärtung des Grosshirns nebst histologisch eigenartigen harten Geschwülsten der Seitenventrikel ("Glioma gangliocellulare") bei einem Neugeborenen". European Archives of Psychiatry and Clinical Neuroscience. 11 (1): 117–31. doi:10.1007/BF02054825.
- "Encéphalite ou sclérose tubéreuse des circonvolutions cérébrales". Archives de neurologie. 1: 390–412. 1881. (كما ذكر في كيوريتلو (Curatolo) (2003))
- "Étude sur un cas d'adénomes sébacés de la face et du cuir". Archives de Physiologie Normale et Pathologique. 6: 564–76. 1885. (كما ذكر في كيوريتلو (Curatolo) (2003))
- "Adenoma sebaceum of Pringle: a clinicopathologic review, with a discussion of related pathologic entities". Journal of Cutaneous Pathology. 8 (6): 395–403. 1981. doi:10.1111/j.1600-0560.1981.tb01028.x. PMID 6278000.
- Hallopeau F; Leredde É (1885). "Sur un cas d'adenomes sébacés à forme sclereuse". Ann Dermatol Syph. 6: 473–9. (كما ذكر في كيوريتلو (Curatolo) (2003))
- Pringle, JJ (1890). "A case of congenital adenoma sebaceum". British Journal of Dermatology. 2: 1–14. مؤرشف من الأصل في 24 أبريل 202022 أغسطس 2009.
- Pellizzi GB (1901). "Contributo allo studio dell'idiozia: rivisita sperimentale di freniatria e medicina legale delle alienazioni mentali". Riv Sper Freniat. 27: 265–9. (كما ذكر في كيوريتلو (2003))
- "MR imaging of tuberous sclerosis: pathogenesis of this phakomatosis, use of gadopentetate dimeglumine, and literature review". Radiology. 183 (1): 227–38. April 1, 1992. doi:10.1148/radiology.183.1.1549677. PMID 1549677.
- Kothe R (1903). "Zur Lehre der Talgdrüsengeschwülste". Archiv für Dermatologie und Syphilis (باللغة الألمانية). 68: 273–8. doi:10.1007/BF01829939. (كما ذكر في روت (2005))
- Campbell, AW (1906). "Cerebral sclerosis". Brain. 28 (3–4): 382–96. doi:10.1093/brain/28.3-4.367.
- Enersen, Ole Daniel. "Heinrich Vogt". Who Named It?. مؤرشف من الأصل في 30 نوفمبر 201811 ديسمبر 2006.
- Vogt H (1908). "Zur Diagnostik der tuberösen Sklerose". Zeitschrift für die Erforschung und Behandlung des jugendlichen Schwachsinns auf wissenschaftlicher Grundlage, Jena. 2: 1–16. (كما ذُكر في كيوريتلو (2003) واستشهد به بالكامل من قبل Who Named It؟)
- Kirpicznik J (1910). "Ein Fall von Tuberoser Sklerose und gleichzeitigen multiplen Nierengeschwùlsten". Virchows Archiv für pathologische Anatomie und Physiologie und für klinische Medicin (باللغة الألمانية). 202 (3): 258. doi:10.1007/BF01993975. (كما ذكر في كيوريتلو (2003))
- Sherlock, Edward Birchall (1911). The Feeble-minded, A Guide to Study and Practice. Macmillan & Co. (كما ذكر في جاي (2004))
- الوراثة المندلية البشرية عبر الإنترنت (OMIM) Tuberous Sclerosis -191100
- Berg H (1913). "Vererbung der tuberösen Sklerose durch zwei bzw. drei Generationen". Z ges Neurol Psychiatr (باللغة الألمانية). 19: 528–39. doi:10.1007/BF02909909. (كما ذكر في كيوريتلو (2003))
- "ترجمة و معنى forme fruste بالعربي في قاموس المعاني". www.almaany.com. مؤرشف من الأصل في 01 ديسمبر 20181 ديسمبر 2018.
- Schuster P (1914). "Beiträge zur Klinik der tuberösen Sklerose des Gehirns". Dtsch Z Nervenheilkd (باللغة الألمانية). 50: 96–133. (كما ذكر في كيوريتلو (2003))
- Lutembacher R (1918). "Dysembryomes métatypique des reins. Carcinose submiliaire aigue du poumon avec emphysème généralisé et double pneumothorax". Annals of Medicine (باللغة الفرنسية). 5: 435–50. (كما ذكر في كيوريتلو (2003))
- Abbott GF; Rosado-de-Christenson ML; Frazier AA; Franks TJ; Pugatch RD; Galvin JR. (2005). "From the archives of the AFIP: lymphangioleiomyomatosis: radiologic-pathologic correlation". Radiographics. 25 (3): 803–28. doi:10.1148/rg.253055006. PMID 15888627. مؤرشف من الأصل في 14 فبراير 2012.
- Van der Hoeve J (1920). "Eye symptoms in tuberous sclerosis of the brain". Trans Ophthalmol Soc UK. 40: 329–34. (كما ذكر في كيوريتلو (2003))
- Marcus H (1924). Svenska Làk Sallsk Forth. (كما ذكر في Dickerson WW (1945). "Characteristic roentgenographic changes associated with tuberous sclerosis". Archives of Neurology and Psychiatry. 53: 199–204. doi:10.1001/archneurpsyc.1945.02300030036005. ، كما ذكر في كيوريتلو (2003) وغوميز (1995))
- "Tuberose sclerosis and allied conditions". Brain. 55 (3): 311–46. 1932. doi:10.1093/brain/55.3.311.
- "Tuberous sclerosis diagnosed with cerebral pneumography". Archives of Neurology and Psychiatry. 35: 833–8. 1934. (كما ورد في غوميز (1995))
- Moolten SE (1942). "Hamartial nature of tuberous sclerosis complex and its bearings on the tumor problem: report of a case with tumor anomaly of the kidney and adenoma sebaceum". Arch Intern Med. 69: 589–623. doi:10.1001/archinte.1942.00200160040005.
- Eker R (1954). "Familial renal adenomas in Wistar rats; a preliminary report". Acta Pathologica et Microbiologica Scandinavica. 34 (6): 554–62. doi:10.1111/j.1699-0463.1954.tb00301.x. PMID 13206757. (كما ورد في يونغ (1994))
- "Tuberous sclerosis. Surgical therapy for seizures". Archives of Neurology. 15 (5): 498–506. 1966. doi:10.1001/archneur.1966.00470170052005. PMID 5955139. (كما ورد في "Surgical treatment for epilepsy in cerebral tuberous sclerosis". Epilepsia. 34 (4): 651–7. 1993. doi:10.1111/j.1528-1157.1993.tb00442.x. PMID 8330575. )
- "Tuberous sclerosis: reappraisal of a clinical entity". Mayo Clinic Proceedings. 42 (1): 26–49. 1967. PMID 5297238. (كما ورد في كيوريتلو (2003))
- Knudson AG (أبريل 1971). "Mutation and Cancer: Statistical Study of Retinoblastoma". Proc. Natl. Acad. Sci. U.S.A. 68 (4): 820–3. doi:10.1073/pnas.68.4.820. PMC . PMID 5279523. (As cited in Rott (2005))
- Yeung R (2004). "Lessons from the Eker rat model: from cage to bedside". Current Molecular Medicine. 4 (8): 799–806. doi:10.2174/1566524043359791. PMID 15579026.
- "Letter: Infantile spasms and subsequent appearance of tuberous sclerosis syndrome". Lancet. 2 (7943): 1046. 1975. doi:10.1016/S0140-6736(75)90343-8. PMID 53537.
- "Chronische Niereninsuffizienz bei Morbus Bourneville-Pringle (Chronic renal failure in bourneville-pringle's disease)". Medizinische Klinik (باللغة الألمانية). 70 (26): 1128–32. 1975. PMID 1223616. (As cited in Rott (2005))
- "Computed tomography in infants and children: intracranial neoplasms". American Journal of Roentgenology. 127 (1): 129–37. 1976. doi:10.2214/ajr.127.1.129. PMID 180824.
- Gómez, Manuel R (1979). Tuberous Sclerosis (الطبعة 1st). New York: Raven Press. . (As cited in Özgür (2005))
- Arndt KA (1982). "Adenoma sebaceum: successful treatment with the argon laser". Plastic and Reconstructive Surgery. 70 (1): 91–3. doi:10.1097/00006534-198207000-00021. PMID 7089113. (As cited in Rott (2005))
- "Hypometabolic cortical lesions in tuberous sclerosis with epilepsy: demonstration by positron emission tomography". Journal of Computer Assisted Tomography. 7 (6): 946–53. 1983. doi:10.1097/00004728-198312000-00002. PMID 6415136. (As cited in Rott (2005))
- "The Bourneville syndrome: clinical and EEG features of epilepsy in the first year of life". Boll Lega Ital Epil. 45/46: 39–42. 1984. (As cited in Curatolo (2003))
- "Tuberous sclerosis with cardiogenic cerebral embolism: magnetic resonance imaging". Neurology. 35 (8): 1223–5. 1985. doi:10.1212/wnl.35.8.1223. PMID 4022361. (As cited in Rott (2005))
- McMurdo SK Jr; Moore SG; et al. (1987). "MR imaging of intracranial tuberous sclerosis". AJR Am J Roentgenol. 148 (4): 791–6. doi:10.2214/ajr.148.4.791. PMID 3493666.
- "Magnetic resonance imaging in tuberous sclerosis". Arch Neurol. 44 (3): 301–3. 1987. doi:10.1001/archneur.1987.00520150047020. PMID 3827681. (As cited in Curatolo (2003))
- "Evidence that the gene for tuberous sclerosis is on chromosome 9". Lancet. 1 (8534): 659–61. 1987. doi:10.1016/S0140-6736(87)90416-8. PMID 2882085.
- "Imagerie par résonance magnétique nucléaire dans la maladie de Bourneville: relation avec les données électroencéphalographiques (Magnetic resonance imaging in the Bourneville syndrome: relations with EEG)". Neurophysiologie clinique (باللغة الفرنسية). 18 (5): 459–67. 1988. doi:10.1016/s0987-7053(88)80056-x. PMID 3185465. (As cited in Curatolo (2003))
- "Vigabatrin in infantile spasms". Lancet. 335 (8685): 363–4. 1990. doi:10.1016/0140-6736(90)90660-W. PMID 1967808.
- Vigabatrin Paediatric Advisory Group (مايو 2000). "Guideline for prescribing vigabatrin in children has been revised". BMJ. 320 (7246): 1404–5. doi:10.1136/bmj.320.7246.1404. PMC . PMID 10858057.
- Kandt RS, Haines JL, Smith M, et al. (1992). "Linkage of an important gene locus for tuberous sclerosis to a chromosome 16 marker for polycystic kidney disease". Nature Genetics. 2 (1): 37–41. doi:10.1038/ng0992-37. PMID 1303246. مؤرشف من الأصل في 31 ديسمبر 2018.
- European Chromosome 16 Tuberous Sclerosis Consortium (1993). "Identification and characterization of the tuberous sclerosis gene on chromosome 16". Cell. 75 (7): 1305–15. doi:10.1016/0092-8674(93)90618-Z. PMID 8269512. (As cited in Rott (2005))
- Yeung R; Xiao G; Jin F; et all (نوفمبر 1994). "Predisposition to renal carcinoma in the Eker rat is determined by germ-line mutation of the tuberous sclerosis 2 (TSC2) gene". Proc Natl Acad Sci USA. 91 (24): 11413–6. Bibcode:1994PNAS...9111413Y. doi:10.1073/pnas.91.24.11413. PMC . PMID 7972075.
- "Cortical and subcortical tubers in tuberous sclerosis and FLAIR sequence". Journal of Computer Assisted Tomography. 19 (4): 660–1. 1995. doi:10.1097/00004728-199507000-00033. PMID 7622707.
- "MR evaluation of tuberous sclerosis: increased sensitivity with fluid-attenuated inversion recovery and relation to severity of seizures and mental retardation". AJNR American Journal of Neuroradiology. 16 (9): 1923–8. October 1, 1995. PMID 8693996. مؤرشف من الأصل في 27 سبتمبر 2011.
- "Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34". Science. 277 (5327): 805–8. 1997. doi:10.1126/science.277.5327.805. PMID 9242607.
- "Renal cystic disease in tuberous sclerosis: role of the polycystic kidney disease 1 gene". American Journal of Human Genetics. 61 (4): 843–51. أكتوبر 1997. doi:10.1086/514888. PMC . PMID 9382094. مؤرشف من الأصل في 04 يناير 2019.
- "Association of tuberous sclerosis of temporal lobes with autism and atypical autism". Lancet. 349 (9049): 392–5. 1997. doi:10.1016/S0140-6736(97)80012-8. PMID 9033466.
- "Tuberous sclerosis complex consensus conference: revised clinical diagnostic criteria". Journal of Child Neurology. 13 (12): 624–8. 1998. doi:10.1177/088307389801301206. PMID 9881533.
- "Magnetic source imaging and reactivity to rhythmical stimulation in tuberous sclerosis". Brain Dev. 20 (7): 512–8. 1998. doi:10.1016/S0387-7604(98)00034-5. PMID 9840671.
- "Identification of the epileptogenic tuber in patients with tuberous sclerosis: a comparison of high-resolution EEG and MEG". Epilepsia. 47 (1): 108–14. 2006. doi:10.1111/j.1528-1167.2006.00373.x. PMID 16417538. مؤرشف من الأصل في 24 أبريل 2020.
- "Mutational Analysis in a Cohort of 224 Tuberous Sclerosis Patients Indicates Increased Severity of TSC2, Compared with TSC1, Disease in Multiple Organs". The American Journal of Human Genetics. 68 (1): 64–80. يناير 2001. doi:10.1086/316951. PMC . PMID 11112665. مؤرشف من الأصل في 27 ديسمبر 2018.
- "Tuberous sclerosis complex-1 and -2 gene products function together to inhibit mammalian target of rapamycin (mTOR)-mediated downstream signaling". Proc Natl Acad Sci USA. 99 (21): 13571–6. 15 أكتوبر 2005. doi:10.1073/pnas.202476899. PMC . PMID 12271141. مؤرشف من الأصل في 28 ديسمبر 2018.
- "Activated mammalian target of rapamycin pathway in the pathogenesis of tuberous sclerosis complex renal tumors". Cancer Res. 62 (20): 5645–50. October 15, 2002. PMID 12384518. مؤرشف من الأصل في 5 يوليو 2008.
- "A mouse model of TSC1 reveals sex-dependent lethality from liver hemangiomas, and up-regulation of p70S6 kinase activity in Tsc1 null cells". Hum Mol Genet. 11 (5): 525–34. 2002. doi:10.1093/hmg/11.5.525. PMID 11875047. مؤرشف من الأصل في 13 فبراير 2006.
- "Antitumoral activity of rapamycin in renal angiomyolipoma associated with tuberous sclerosis complex". American Journal of Kidney Diseases. 48 (3): e27–9. سبتمبر 2006. doi:10.1053/j.ajkd.2006.05.018. PMID 16931204.
- "Rapamycin causes regression of astrocytomas in tuberous sclerosis complex". Annals of Neurology. 59 (3): 490–8. 2006. doi:10.1002/ana.20784. PMID 16453317. مؤرشف من الأصل في 24 أبريل 2020.
- "Multicenter International Lymphangioleiomyomatosis Efficacy of Sirolimus Trial (The MILES Trial)". ClinicalTrials.gov (NIH). 6 يناير 2007. مؤرشف من الأصل في 04 يناير 201910 يناير 2007.
- "Sirolimus in Treating Patients With Angiomyolipoma of the Kidney". ClinicalTrials.gov (NIH). 21 نوفمبر 2006. مؤرشف من الأصل في 04 يناير 201910 يناير 2007.
- "Everolimus (RAD001) Therapy of Giant Cell Astrocytoma in Patients With Tuberous Sclerosis Complex". ClinicalTrials.gov (NIH). 13 ديسمبر 2006. مؤرشف من الأصل في 04 يناير 201910 يناير 2007.
مراجع إضافية
- Acierno, Louis J (1994). The History of Cardiology. Taylor & Francis. صفحة 427. .
- Curatolo, Paolo (Editor) (2003). Tuberous Sclerosis Complex : From Basic Science to Clinical Phenotypes. MacKeith Press. .
- Gómez MR (1995). "History of the tuberous sclerosis complex". Brain & Development. 17 (suppl): 55–7. doi:10.1016/0387-7604(94)00130-8. PMID 8882573.
- "Zur Geschichte der Tuberösen Sklerose (The History of Tuberous Sclerosis)" ( كتاب إلكتروني PDF ) (باللغة الألمانية). Tuberöse Sklerose Deutschland e.V. 2005. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 15 مارس 20078 يناير 2007.





