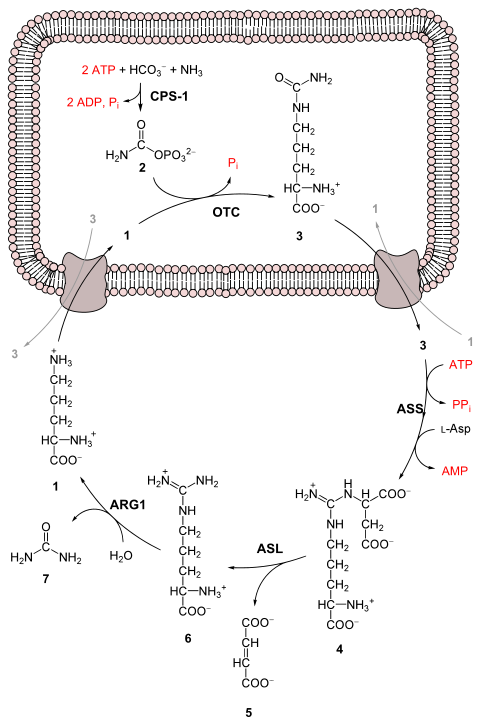
دورة اليوريا أو دورة الأورنثين هي دورة تفاعلات حيوكيميائية تحدث في الكثير من الحيوانات حيث تنتج اليوريا (نهــ2) 2كربونأكسجين من الأمونيا (NH3).هذه الدورة تحدث عند الكائنات الحية المنتجة لليوريا. دورة اليوريا تقوم بتحويل الأمونيا شديدة السّميّة إلى اليوريا للتخلص منها.[1][2] دورة اليوريا هي أول دورة استقلابية مكتشفة، واكتشفت بواسطة كريبس وكورت هنسيلت في عام 1932، خمس سنوات قبل اكتشاف دورة حمض الستريك (Citric acid cycle). تحدث دورة اليوريا في المقام الأول في الكبد، وبدرجة أقل في الكلى.
الوظيفة
يؤدي هدم الأحماض الأمينية إلى إنتاج الأمونيا كناتج خارجي. جميع الحيوانات بحاجة إلى طريقة للتخلص من هذا الناتج. معظم الكائنات المائية، أو الكائنات مفرغات الأمونيا، تتخلص من الأمونيا بدون الحاجة إلى تحويلها إلى مركب آخر.[1] تعتبرالأمونيا مركب سام، ولكن عند التخلص منها في الكائنات المائية، يتم تخفيفها بالماء خارج جسم الكائن الحي. الكائنات الحية التي لا تستطيع التخلص من النايتروجين على شكل أمونيا بشكل سهل وآمن، تلجأ لتحويلها إلى مركبات أقل سمية مثل اليوريا و اليوريك أسيد . تحدث دورة اليوريا بشكل رئيسي في الكبد . تفرزاليوريا المنتجة من قبل الكبد بعد ذلك إلى مجرى الدم، وتذهب بعد ذلك إلى الكلى ثم تخرج في نهاية المطاف في البول. في الأنواع بما فيها الطيور ومعظم الحشرت، الأمونيا تتحول إلى حمض اليوريك أو ملح اليوريت، الذي يفرز على شكل صلب. بذلك تلجأ الكائنات التي لا تستطيع التخلص من الأمونيا إلى تحويلها إلى مواد أخرى يسهل التخلص منها مثل اليوريا أو حمض اليوريك لأن هذه المواد أقل سميه من الأمونيا وأيضا لأن الأمونيا أقل ذوبانيه فتترسب في الدماغ مما يسبب الإغماء ثم الموت فضعف دورة اليوريا يكون نتاج الأمراض الوراثية والفشل الكبدي.
التفاعلات
العملية كلها تتم بتحويل مجموعتين من الأمين واحدة من +NH4 و الأخرى من حمض الأسباراتيك بالإضافة إلى ذرة كربون من HCO3- ، إلى ناتج إفراز غير سام نسبيا وهو اليوريا ، و يتم ذلك باستهلاك 4 روابط فوسفاتية ذات طاقة عالية (3ATP تحلل إلى 2ADP و 1 AMP ) .
تتم عملية تحويل الامونيا إلى يوريا بخمسة خطوات رئيسية، الخطوة الأولى ضرورية لدخول الأمونيا إلى الدورة، أما الخطوات الأربعة الأخرى فهي جزء من دورة اليوريا نفسها .
لدخول الدورة، يتم تحويل الأمونيا إلى كاربامويل فوسفات (carbamoyl phosphate ) . تتكون دورة اليوريا من 4 تفاعلات انزيمية : واحد يحدث في الميتوكندريا و الثلاثة الأخرى تحدث في السيتوسول .[3]
| تفاعلات دورة اليوريا | ||||
| الخطوة | المتفاعلات | النواتج | تُحَفَّز بواسطة | الموقع |
| 1 | NH3 + HCO3− + 2ATP | (فوسفات) carbamoyl phosphate + 2ADP + Pi | CPS1 | الميتوكندريا |
| 2 | carbamoyl phosphate + أورنيثين | citrulline + Pi | OTC(اورنيثين ناقل الكربامويل),
الزنك، البيوتين |
المايتوكندريا |
| 3 | citrulline + aspartate + ATP | argininosuccinate + AMP + PPi | ASS | السيتوسول |
| 4 | argininosuccinate | Arg + fumarate | ASL | السيتوسول |
| 5 | Arg + H2O | اورنيثين + urea | ARG1,
المنغنيز |
السيتوسول |
التفاعل الأول : الدخول في دورة اليوريا
قبل بدء دورة اليوريا يتم تحويل الأمونيا إلى كاربامويل فوسفات (carbamoyl phosphate) . يتم تحفيز التفاعل بواسطة (carbamoyl phosphate synthetase I) و يتطلب ذلك استخدام جزيئين أدينوسين ثلاثي الفوسفات
( 2ATP ).[3] مما ينتج عنه دخول الكاربومويل فوسفات (carbamoyl phosphate) إلى دورة اليوريا.
خطوات دورة اليوريا
1) تحويل الكاربومويل فوسفات إلى سيترولين(Citrulline) .
بتحفيز من أورنيثين ناقل الكاربامويل (ornithine transcarbamoylase) ، يتم التبرع بمجموعة الكاربومويل فوسفات إلى الاورنيثين و تحرير مجموعة فوسفات .[3]
2) تفاعل التكاثف الذي يحدث بين مجموعة الأمين الخاصة بالأسبارتام و مجموعة الكاربونيل الموجودة في السيترولين لتكوين الارجينينوساكسيليت ( argininosuccinate) . يحتاج حدوث هذا التفاعل إلى ATP ، و يتم تحفيزه عن طريق الانزيم argininosuccinate synthetase.[3]
3) يتم تفكيك الارجينينوساكسيليت (Argininosuccinate) عن طريق الانزيم argininosuccinase إلى ارجينين (arginine) و حمض الفوماريك (fumarate) .[3]
4) يتم تفكيك الارجنين عن طريق انزيم الارجينيز (arginase) لتكوين اليوريا و الاورنيثين. بعد ذلك يتم نقل الاورنيثين رجوعا إلى الميتوكندريا لتبدأ دورة اليوريا مرة أخرى .[3]
معادلة التفاعل الكلي
في التفاعل الأول، NH4+ + HCO3− تعادل NH3 + CO2 + H2O
بالتالي، فإن المعادلة الشاملة لدورة اليوريا هي:
NH3 + CO2 + aspartate + 3 ATP + 2 H2O → urea + fumarate + 2 ADP + 2 Pi + AMP + PPi
و بما أنه يتم الحصول على الفيومارات عن طريق ازالة ال NH3 من الاسبارتات ( عن طريق التفاعلين 3 و 4) و التفاعل
(PPi + H2O → 2 Pi ) , و يمكن تبسيط المعادلة كالآتي :
2NH3 + CO2 + 3 ATP + H2O → urea + 2 ADP + 4 Pi + AMP
نلاحظ أن التفاعلات المتعلقة بدورة اليوريا أيضا تؤدي إلى إنتاج 2 NADH ، لذلك ينتج التفاعل الكلي طاقة أكثر بقليل مما يستهلك . يتم انتاج جزيء ال NADH بطريقتين :
- جزيء NADH يتم انتاجه عن طريق انزيم glutamate dehydrogenase أثناء تحويل الجلوتامات إلى أمونيوم و حمض الفا كيتوجلوتاريك (α-ketoglutarate) . الجلوتامات هو الناقل غير السام للمجموعات الأمين. وهذا يوفر أيون الأمونيوم المستخدم في التكوين الأولي لفوسفات الكربامويل.
- الفيومارات الذي يطلف إلى السيتوسول يتحد مع الماء لينتج مركب المالات أو حمض التفاح (Malate) و يحدث ذلك عن طريق انزيم السيتوسوليك فيوميريز (cytosolic fumarase) . بعد ذلك يتأكسد المالات إلى حمض الاكسالواسيتيك عن طريق انزيم مالات ديهيدروجيناز (cytosolic malate dehydrogenase) ، مما يؤدي إلى توليد جزيء NADH مختزل في السيتسول.
حمض أوكسالواسيتيك هو أحد الأحماض الكيتونية التي يفضلها ناقل ألأمين (الترانساميناسات) ، وسيتم إعادة تدويره إلى حمض الأسبارتيك مما يحافظ على تدفق النيتروجين في دورة اليوريا .
يمكننا تلخيص ذلك من خلال دمج التفاعلات :
· CO2 + glutamate + aspartate + 3 ATP + 2 NAD++ 3 H2O → urea + α-ketoglutarate + oxalacetate + 2 ADP + 2 Pi + AMP + PPi + 2 NADH
يمكن لجزيائان الNADH المنتجان تزويد الطاقة من أجل انتاج 5 جزيئات ATP ( جزيء NADH المتواجد في العصارة الخلوية – السايتوسول- يقوم بانتاج 2.5 جزيء ATP بالإضافة إلى ناقل المالات اسبارتات
malate-aspartate shuttle في خلايا الكبد البشرية ) ، بالتالي يكون الناتج النهائي لهذه العملية هو رابطتين فوسفات عالية الطاقة لدورة اليوريا.
مع ذلك، إذا كانت عملية استحداث السكر(gluconeogenesis) جاريًا في العصارة الخلوية، يتم استخدام نظيره المختزل لتحريك العملية العكسية لانتاج الGAPDH بدلا من انتاج الATP .
مصير الاوكسالواسيتيت هو إما إنتاج الأسبارتات عن طريق النقل أو يتم تحويله إلى فوسفوإينول حمض البيروفيك (Phosphoenolpyruvate) ، وهو المادة المتفاعلة في عملية استحداث أو تكوين الجلوكوز .
تفاعلات دورة اليوريا
1- إل-أورثنين
2- فوسفات الكربامويل
3- إل-سيترولين
4- أرجينينوسكسينات
5- فومارات
6- إل-أرجينين
7- يوريا.
L-Asp L-aspartate
CPS-1 carbamoyl phosphate synthetase I
OTC Ornithine transcarbamoylase
ASS argininosuccinate synthetase
ASL argininosuccinate lyase
ARG1 arginase 1
- Shambaugh, G. E. (1977-12-01). "Urea biosynthesis I. The urea cycle and relationships to the citric acid cycle". The American Journal of Clinical Nutrition. 30 (12): 2083–2087. ISSN 0002-9165. PMID 337792. مؤرشف من الأصل في 13 أغسطس 2019.
- M., Cox, Michael (2013-01-01). Lehninger principles of biochemistry. Freeman. . OCLC 901647690. مؤرشف من الأصل في 26 مايو 2020.
- Nelson, D. L., & Cox, M. M. (2013). Lehninger principles of biochemistry. New York - Basingstoke: Freeman - Macmillan.
التنظيم
حمض N-Acetylglutamic
يعتمد تخليق (أو تركيب) فوسفات الكاربامويل ودورة اليوريا على وجود حامض ال N-Acetylglutamic "NAcGlu" الذي ينشط بالتبعية CPS1. NAcGlu وهو منشط متلازم من فوسفات جلوتامين . تركيب كل من NAcGlu بواسطة N-acetylglutamate جلوتامات بواسطة كل من Arg, ، ومحفز Allosteric ل NAGS ، Glu ، وهو منتج في تفاعلات النقل واحد ركائز NAGS، وكلاهما يرتفع عندما تكون الاحماض الامينية الحرة مرتفعة. لذلك فإن ال Glu ليس مجرد ركيزة لNAGS فحسب، بل يعمل ايضا كمنشط لدورة اليوريا.
تراكيز المادة المتفاعلة
يتم التحكم في الانزيمات المتبقية من الدورة من تركيزات المواد المتفاعلة منها وبالتالي فإن العيوب الموروثة في انزيمات الدورة ما عدا ال Arg1، لا تؤدي إلى انخفاض كبير في انتاج اليوريا (إذا كان أي انزيم في الدورة مفقود كليا يحدث الموت بعد الولادة بوقت قصير). بدلا من ذلك يتم بناء ركيزة الإنزيم الناقصة، مما يزيد من معدل العودة للوضع الطبيعي .
إن تراكم الركيزة الشاذة لا يمر دون تكلفة ولكن تصبح تركيزات الركيزة مرتفعة طوال الطريق حتى تصل الدورة إلى الرقم NH4+، مما يؤدي إلى فرط ( انحلال ) امونيا الدم (NH4+]P). وعلى الرغم من أن السبب الجذري لسمية ال [NH4+] غير مفهومة تماما إلا أن ارتفاعها يضع ضغطا هائلا على نظام إزالة [NH4+] خاصة في الدماغ ( أعراض نقص إنزيم دورة اليوريا تشمل الإعاقة الذهنية والخمول).
يتضمن نظام المقاصة GLUD1 and GLUL، مما يؤدي إلى تقليل تجمعات 2-oxogutarate ( 2OG) و Glu
إن الدماغ هو الأكثر حساسية لاستنزاف هذه التجمعات يؤدي استنفاد (2OG) إلى خفض معدل دورة حمض الستريك، في حين أن Glu هو ناقل عصبي ومن تبعات ال GABA.
ارتباطها مع دورة حمض الستريك
دورة اليوريا و دورة حمض السيتريك هما دورتين مستقلتين ولكنهما مرتبطتين . يتم الحصول على واحدة من النتروجينات في دورة اليوريا من انتقال الأوكسالاسيتايت إلى الأسبارتات.[1] الفوميتات التي يتم إنتاجها في الخطوة الثالثة هي أيضا وسيطة في دورة حمض الستريك وتعود إلى تلك الدورة.[1]
اضطرابات دورة اليوريا
يمكن أن تحدث عيوب وراثية في الإنزيمات المشاركة في الدورة. تؤدي الطفرات إلى قصور في مختلف الإنزيمات والناقلات المشاركة في دورة اليوريا وتسبب اضطرابات دورة اليوريا.[2] إذا كان الأفراد الذين يعانون من عيب في أي من الإنزيمات المستخدمة في دورة اليوريا يتناولون الأحماض الأمينية بشكل يتجاوز ما هو ضروري للحد الأدنى من المتطلبات اليومية فإن الأمونيا المنتجة لا يمكن تحويلها إلى اليوريا. يمكن أن يعاني هؤلاء الأفراد من فرط أمونيا الدم (فرط أمونيا الدم) أو تراكم العامل الوسيط للدورة .
أنواعها:
- نقص إنزيم (N-Acetylglutamate synthase) .
- نقص إنزيم (Carbamoyl phosphate synthetase).
- نقص إنزيم (Ornithine transcarbamoylase).
- سيترولينيميا (Citrullinemia)نقص في إنزيم ( argininosuccinic acid synthase).
- Argininosuccinic aciduria نقص في إنزيم ( argininosuccinic acid lyase).
- Argininemia نقص في إنزيم (arginase) آرجينينميا.
- فرط بورنيثين الدم(Hyperornithinemia) ، فرط أمونيا الدم(فرط أمونيا الدم) ، متلازمة homocitrullinuria (نقص ناقلة الأنتينيثاز الميتوكوندريا).
ترتبط معظم اضطرابات دورة اليوريا مع فرط أمونيا الدم، ولكن لا توجد argininemia وبعض أشكال acidurucceneic aciduria مع الأمونيا المرتفعة.