ثنائي أكسيد الكربون (أو كما يعرف بالاسم الشائع ثاني أكسيد الكربون) هو مركّب كيميائي من الأكسجين والكربون له الصيغة الكيميائيّة CO2. عند ظروف الضغط والحرارة القياسيّتين يكون ثنائي أكسيد الكربون على شكل غاز عديم اللون والرائحة، وهو غير قابل للاشتعال، وله صفة حمضية، كما أنه سهل الانحلال في الماء.
| ثنائي أكسيد الكربون | |
|---|---|
| المعرفات | |
| رقم CAS | 124-38-9 |
| بوب كيم (PubChem) | 280 |
| الخواص | |
| صيغة كيميائية | CO2 |
| كتلة مولية | 44.01 غ.مول−1 |
| المظهر | غاز عديم اللون |
| الرائحة | عديم الرائحة |
| الكثافة | 1562 كغ/م3 (صلب عند 1 ض.ج. و −78.5 °س) 770 كغ/م3 (سائل عند 56 ض.ج. و 20 °س) 1.977 كغ/م3 (غاز عند 1 ض.ج. و 0 °س) |
| نقطة الانصهار | -78 °س، 194.7 °ك، -109 °ف (تسامي) |
| نقطة الغليان | -57 °س، 216.6 °ك، -70 °ف (عند 5.185 بار) |
| الذوبانية في الماء | 1.45 غ/ل عند 25 °س, 100 كيلوباسكال |
| ضغط البخار | 5.73 ميغا باسكال (20 °س) |
| معامل الانكسار (nD) | 1.1120 |
| اللزوجة | 0.07 سنتيبواز عند −78.5 °س |
| عزم جزيئي ثنائي القطب | 0 D |
| البنية | |
| البنية الجزيئية | خطية |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−393.5 كيلوجول·مول−1 |
| إنتروبيا مولية قياسية S |
214 جول·مول−1·كلفن−1 |
| الحرارة النوعية، C | 37.135 جول·مول−1·كلفن−1 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يشكّل غاز CO2 ما متوسّطه 0.040 % حجماً من الغلاف الجوّي، أي ما يعادل 400 جزء في المليون (سنة 2014).[2][3] كجزء من دورة الكربون، تستخدم النباتات والطحالب والزراقم طاقة الضوء لتقوم بالتمثيل الضوئي للسكريّات من ثنائي أكسيد الكربون والماء، وينتج عن ذلك تكوّن أكسجين كناتج للعملية.[4] بالمقابل، فإن عملية التمثيل الضوئي لا تتمّ في الظلام، وتقوم النباتات بإنتاج ثنائي أكسيد الكربون ليلاً أثناء عملية التنفس الخلوي.[5] بالإضافة إلى ذلك، فإنّ ثنائي أكسيد الكربون ينتج خلال زفير البشر وسائر الكائنات الهوائية. كما ينتج ثنائي أكسيد الكربون خلال عمليات تحلّل المواد العضويّة، وأثناء تخمّر السكريّات، وكناتج لاحتراق الخشب والسكريّات ومعظم الوقود الأحفوري الغنيّ بالكربون والهيدروكربون، كالفحم والخثّ والنفط والغاز الطبيعي. ينبعث CO2 أيضاً من البراكين والحمم والعيون الحمئة (السخّانات)، كما يتحرّر من صخور الكربونات عند إذابتها في الأحماض، بالإضافة إلى تواجده أيضاً في البحيرات، وفي أعماق البحار ممتزجاً مع ترسّبات النفط والغاز.[6]
تثير التأثيرات البيئيّة لثنائي أكسيد الكربون اهتمامات واسعة، حيث يُعدّ وجوده في الغلاف الجويّ عنصراً أوليّاً في استمرار الحياة على الأرض كمصدر للكربون، وهو بالمقابل، أحد غازات الدفيئة الهامّة. كانت عملية التمثيل الضوئي أساساً لتنظيم تركيز ثنائي أكسيد الكربون في عصر ما قبل الكمبري، وحتّى عصر ما قبل الثورة الصناعيّة. مع زيادة عمليّة احتراق الوقود الكربوني منذ الثورة الصناعيّة، زادت تراكيز ثنائي أكسيد الكربون بسرعة كبيرة، ممّا أدّى إلى الاحترار العالمي. من جهة أخرى، يعدّ ثنائي أكسيد الكربون مصدراً رئيسيّاً لعملية تحمّض المحيطات، نظراً لذوبانه في الماء مكوّناً حمض الكربونيك.[7]
هناك العديد من التطبيقات لغاز ثنائي أكسيد الكربون، وذلك في الصناعات الغذائيّة، والصناعات النفطيّة والصناعات الكيميائيّة.[8] على سبيل المثال، يستخدم CO2 في إنتاج اليوريا، كما يستخدم في الصناعات الغذائيّة من أجل صناعة المشروبات الغازيّة والروحيّة. بالإضافة إلى ذلك، فإنّ ثنائي أكسيد الكربون فوق الحرج يستخدم كمذيب وكوسيلة للاستخلاص في الكيمياء، أمّا الثلج الجاف، وهو ثنائي أكسيد الكربون في الحالة الصلبة، فيستخدم مادّةً للتبريد.
التاريخ
يعدّ ثنائي أكسيد الكربون أحد أوائل الغازات التي يتمّ وصفها كمادّة منفصلة عن الهواء، ففي القرن السابع عشر الميلادي، لاحظ الكيميائي يان بابتست فان هيلمونت أنّه عند حرق الفحم النباتي في وعاء مغلق، فإنّ وزن الرماد أقلّ بكثير من وزن الفحم النباتي الأصلي. اعتقد فان هيلمونت أن بقيّة الفحم النباتي تتحوّل إلى مادّة غير مرئية، وصفها بمصطلح «الروح الشاذّة» (spiritus sylvestre).[9]
درس الفيزيائي جوزيف بلاك خواص ثنائي أكسيد الكربون بشكل أكبر خلال خمسينات القرن الثامن عشر الميلادي، فوجد أنّ الحجر الجيري (كربونات الكالسيوم) يمكن تسخينه أو معالجته بالأحماض لإنتاج غاز سمّاه «الهواء المُثَبَّت»، والذي وجد أنّه أكثر كثافةً من الهواء، ولا يساعد على الاشتعال، كما أنّه لا يؤمّن استمرارية حياة الحيوانات. لاحظ بلاك أيضاً أنّه عند قرقرة فقاعات من غاز ثنائي أكسيد الكربون في محلول من الجير المطفأ (محلول مائي مُشبّع من هيدروكسيد الكالسيوم)، فسيترسّب مركّب كربونات الكالسيوم. استخدم بلاك هذه الظاهرة ليوضّح أنّ ثنائي أكسيد الكربون ينتج عن تنفّس الحيوانات وعن التخمّر البكتيري، كما استطاع أن يبيّن أنّ الغازات يمكن لها أن تشارك في التفاعلات الكيميائيّة، ممّا أدّى لاحقاً إلى سقوط نظرية الفلوجستون.[10]
في سنة 1772 م، نشر الكيميائي جوزيف بريستلي ورقة بحثية بعنوان «إشباع الماء بالهواء المُثَبّت»، والتي وصف فيها عملية إسقاط قطرات من حمض الكبريتيك على الطباشير من أجل إنتاج غاز ثنائي أكسيد الكربون، ومن ثمّ إجبار الغاز على الذوبان عن طريق هزّ أو خضّ إناء يحوي على الماء، وذلك بتماس مباشر مع الغاز.[11]
سُيّل ثنائي أكسيد الكربون للمرة الأولى (تحت ضغوط عالية) بواسطة العالم همفري ديفي سنة 1823 م.[12] أمّا أقدم وصف لثنائي أكسيد الكربون الصلب فقد كان على يد أدريان-جان-بيير تيلورييه سنة 1835 م، والذي وجد أنّ تبريد وعاء ضغط يحتوي على ثنائي أكسيد الكربون السائل يؤدّي إلى الحصول على ثلج من CO2 الصلب.[13]
الوفرة
- مقالة مفصلة: دورة الكربون
يتوفّر ثنائي أكسيد الكربون في الطبيعة في كل من غلاف الأرض الجوي وغلاف الأرض المائي وغلاف الأرض الصخري وغلاف الأرض الحيوي. إنّ عنصر الكربون المهمّ لوجود الحياة على سطح الأرض يكون في حالة تبادل بين أغلفة الأرض المذكورة فيما يعرف باسم دورة الكربون. يوجد في الغلاف الجوي ما يقدّر بحوالي 800 غيغاطن من ثنائي أكسيد الكربون، أمّا الغلاف المائي فيحوي 38,000 غيغاطن، وذلك على شكل غاز منحلّ بشكل فيزيائي في الماء وعلى شكل بيكربونات وكربونات، في حين أنّ ثنائي أكسيد الكربون في الغلاف الصخري يكون مرتبطاً بشكل كيميائي في صخور الكربونات مثل الكالسيت والدولوميت، والتي تحوي ما يقدّر بستين ألف تيرّاطن من ثنائي أكسيد الكربون.[14]
في الغلاف الجوي
يعدّ غاز ثنائي أكسيد الكربون أحد الغازات النزرة في تركيب غلاف الأرض الجوي، حيث أنّ تركيزه يبلغ ما متوسّطه 400 جزء في المليون حجماً، وذلك حسب قياسات الإدارة الوطنية للمحيطات والغلاف الجوي الأمريكية NOAA على جزيرة مونا لوا في هاواي.[2][15] يتفاوت تركيز غاز CO2 وذلك بين المناطق القريبة من سطح الأرض والمناطق المرتفعة، كما يختلف تركيزه على أساس محلّي بين المدن والأرياف، وبين الدول الصناعيّة عن الدول غير الصناعيّة. بالإضافة إلى ذلك، فإنّ هناك اختلافاً في تركيز ثنائي أكسيد الكربون حسب شهور السنة، ففي نصف الأرض الشمالي يكون تركيز CO2 في قمّته في فصل الربيع، ويكون في أدنى مستواه في فصل الخريف، وذلك في دورة سنويّة متكرّرة.[16]
قبل حدوث ارتفاع في تركيز ثنائي أكسيد الكربون في الغلاف الجوي الأرضي نتيجة التأثير البشري، كانت تراكيز هذا الغاز في العصور الجيولوجية الماضية ترتفع مع ارتفاع درجات الحرارة العالميّة، وذلك على شكل تغذية راجعة إيجابيّة للتغيّرات الناجمة عن عمليات أخرى مثل تأثيرات مَيَلان محور الأرض كما فسّرها ميلانكوفيتش.[17] كان تركيز غاز CO2 في الجوّ قبل خمسمئة مليون سنة أكبر بحوالي 20 مرّة ممّا هو عليه الآن،[18] والذي تناقص إلى حوالي 4 إلى 5 مرات ممّا هو عليه الآن خلال العصر الجوراسي، ثمّ تناقص تدريجيّاً نتيجة حادثة أزولا قبل حوالي 49 مليون سنة مضت.[19][20] كان مستوى تركيز ثنائي أكسيد الكربون قبل 650 ألف سنة دائماً دون 280 جزء في المليون (ppm)، وبقي ثابتاً كذلك حتّى العشر آلاف سنة الأخيرة.[21]
يُطلق غاز ثنائي أكسيد الكربون بشكل مستمر إلى الغلاف الجوي من مصادر طبيعيّة. إنّ حوالي 40% من الغاز الذي ينبعث من البراكين خلال الثوران هو من ثنائي أكسيد الكربون.[22] يقدّر بأنّ البراكين تطلق ما يتراوح بين 130 إلى 230 مليون طن من CO2 إلى الغلاف الجوي كلّ سنة. على الرغم من ذلك، فإن غاز CO2 المنبعث من النشاطات البشريّة أكبر بحوالي 135 مرّة من الكمّيّات الصادرة عن البراكين.[23] كما ينتج ثنائي أكسيد الكربون من الينابيع الساخنة مثل الموجودة في موقع بوسوليتو Bossoleto، وذلك بالقرب من رابولانو تيرمي في توسكانا في إيطاليا، حيث أنّ تراكيز CO2 يمكن أن ترتفع بنسبة 75% ليلاً.[24]
أدّى النشاط البشري مثل قطع أشجار الغابات واستخدام الوقود الأحفوري كمصدر من مصادر الطاقة إلى ازدياد تركيز ثنائي أكسيد الكربون في الجوّ بحوالي 35% وذلك منذ بداية الثورة الصناعيّة.[25] في الفترة الزمنيّة بين سنتي 1960 و 2005 ازدادت نسبة غاز ثنائي أكسيد الكربون في الجوّ بمعدّل 1.4 جزء في المليون سنويّاً.[26] تعدّ صناعة الأسمنت أحد ثلاثة مصادر رئيسيّة لانبعاث ثنائي أكسيد الكربون في الجوّ وذلك بالإضافة إلى إنتاج الطاقة والمواصلات، حيث أنّه في سنة 2011 ساهمت صناعة الأسمنت عالمياً في حوالي 7% من انبعاثات CO2 البشريّة.[27] إنّ القيمة الحاليّة من تركيز ثنائي أكسيد الكربون هي أعلى قيمة منذ 15 إلى 20 مليون سنة.[28]

إنّ ما ينتجه البشر من غاز ثنائي أكسيد الكربون يبلغ سنوياً حوالي 36.3 غيغاطن،[26] وهو جزء صغير بالمقارنة مع المصادر الطبيعيّة، حيث ينتج منها سنويّاً 550 غيغاطن.[29] ولكن بالمقابل، فإنّ تصريف الكربون الطبيعي يستهلك قسماً كبيراً من الإنتاج الطبيعي في دورة الكربون الطبيعيّة، لذلك فإنّ التركيز قبل الثورة الصناعيّة كان ثابتاً. إنّ كمّيّة ثنائي أكسيد الكربون الفائضة يُستهلك حوالي نصفها في غلاف الأرض الحيوي والمحيطات، والتي كانت في السابق في حالة توازن بين الإنتاج والاستهلاك، ولكن الازدياد في تركيز CO2 أدّى إلى كونها في الوقت الحالي تستهلك أكثر مما تنتج.[30] أمّا النصف الثاني، فتبقى في الغلاف الجوي، وهي التي تؤدّي إلى ازدياد قيمة التركيز، والتي بدأ العالم تشارلز كيلينغ في إظهارها في ما يعرف باسم منحنى كيلنغ بدءاً من ستّينات القرن العشرين.
إنّ المسبّب الرئيسي للاحترار العالمي الحالي هو من تأثير بشري (أنتروبوجيني) على البيئة، وذلك بسبب توسّع ظاهرة الاحتباس الحراري،[31] والتي تنتج عندما يقوم الغلاف الجوّي الأرضي باحتباس الإشعاع الحراري الصادر عن الأرض تجاه الفضاء.[32] يكون غاز ثنائي أكسيد الكربون شفّافاً تجاه أشعّة الضوء القادمة من الشمس، حيث لا يمتصّ في مجال الأشعّة فوق البنفسجيّة، لكنّه يمتصّ الأشعّة تحت الحمراء الصادرة عن الأرض، بالتالي فإنّ غاز ثنائي أكسيد الكربون هو أحد الغازات الدفيئة، وهو يشكّل حوالي 60% من الغازات المؤثّرة على الاحتباس الحراري.[33][34] إنّ الطاقة الممتصّة تتحوّل في مجال هذه الأشعّة إلى حركات اهتزازيّة، ممّا يؤدّي لاحقاً إلى حدوث تصادمات على المستوى الجزيئي، والذي يؤدّي في النهاية إلى رفع درجة حرارة الغلاف الجوي.[35] تشير العديد من الدراسات إلى ارتفاع درجة حرارة سطح الأرض بمقدار 0.3-0.6°م منذ أواخر القرن التاسع عشر، بسبب ازدياد تركيز غاز ثنائي أكسيد الكربون، ممّا أدّى بذلك إلى ارتفاع منسوب البحر بمعدّل 10-25 سم خلال المئة سنة الأخيرة نتيجة ذوبان الجليد القطبي ، ولوحظ أيضاً ارتفاع طفيف في متوسّط الهطول المطري العالمي في القرن العشرين، وازدياد نسبة الأجزاء من العالم التي تتعرّض لموجات من الجفاف أو الفيضانات منذ عام 1970.[36] إنّ تبعات الاحترار العالمي هذه يمكن الحدّ منها عن طريق اتّباع سياسات حماية المناخ في الدول المعنيّة.[37]
في الغلاف المائي
في المحيطات
تحوي مياه المحيطات على ثنائي أكسيد الكربون بالشكل المنحلّ (فيزيائياً)، كما تحويه على شكل حمض الكربونيك والذي يكون في حالة توازن كيميائي مع البيكربونات والكربونات. تتغيّر الكمّيّة المنحلّة مع تغيّر فصول السنة، إذ أنّها تتعلّق بدرجة حرارة المياه وبكمّيّة الأملاح المنحلّة، حيث أنّ الماء البارد له القدرة على حلّ كمّيّة أكبر من ثنائي أكسيد الكربون. بما أنّ للماء البارد كثافة أكبر من الماء الدافئ، بالتالي فإنّ الماء غنيّ المحتوى بثنائي أكسيد الكربون يتركّز في الطبقات السفلى. تتناقص مقدرة مياه المحيطات على استقبال كمّيّات من CO2 مع ارتفاع درجة الحرارة، وهذا ما يحصل حتّى عند ضغوط مرتفعة في أعماق المحيطات وذلك بالقرب من الأنابيب البركانيّة.[38]
يوجد في المحيطات كمّيّات من ثنائي أكسيد الكربون تفوق التي هي موجودة في الغلاف الجوّي للأرض بحوالي 50 مرّة. بناءً على هذا الأمر، فإنّ المحيطات تعدّ أكبر مصرّف للكربون، حيث يستقبل حوالي ثلث الكمّيّة المنتجة بشريّاً من غاز CO2.[39][40] إنّ ازدياد الكمّيّة المنحلّة من ثنائي أكسيد الكربون في مياه المحيطات تؤدّي إلى انخفاض قلويّة الماء المالح، وتعرف هذه الظاهرة باسم تحمّض المحيطات، ويخشى أن يؤثّر ذلك بشكل سلبي على الأحياء التي تحوي على الكلس مثل الصدف البحري.[41] من جهة أخرى، هناك أنواع من الصدف البحري أظهرت ردود أفعال مغايرة لارتفاع تركيز CO2 في المياه، حيث أنّها تكاثرت بشكل أكبر.[42]
في المياه العذبة
يمكن للمياه العذبة نتيجة شروط جيولوجيّة معيّنة أن تحوي كمّيّات كبيرة من غاز ثنائي أكسيد الكربون، وذلك مثل مياه الينابيع المعدنيّة أو في العيون الحمئة (الحِمَام). في حالات نادرة، يمكن لكمّيّات من غاز ثنائي أكسيد الكربون أن تسبّب حوادث بالقرب من هذه الأماكن، كما حصل سنة 1986 في بحيرة نيوس في الكاميرون.[43]
خارج الغلاف الأرضي
يتكوّن الغلاف الجوي لكوكب الزهرة بشكل شبه كامل (96.5 %) من ثنائي أكسيد الكربون، وذلك عند ضغط مقداره حوالي 90 بار. من جهة أخرى، فإن درجة حرارة السطح لهذا الكوكب الأقرب إلى الشمس من الأرض تبلغ 480 °س، ويعود ذلك إلى خاصّيّة الاحتباس الحراري التي يوفّرها الغلاف الجوّي من CO2.[44] يشكّل ثنائي أكسيد الكربون حوالي 95% أيضاً من الغلاف الجوي لكوكب المرّيخ،[45] بحيث يكون في أقطاب كوكب المريخ على شكل ثلج جاف. على الرغم من أن الضغط الجوّي لغاز ثنائي أكسيد الكربون على سطح المريخ منخفض، حيث يبلغ فقط حوالي 7 ميلي بار، إلاّ أنّ ظاهرة الاحتباس الحراري لهذا الغاز تؤثّر في رفع درجة حرارة السطح إلى حوالي 5 °س. إنّ الأغلفة الجوية للكواكب المتطرّفة وأقمارها تحوي على كمّيّات من ثنائي أكسيد الكربون، والتي أتت من ارتطام المذنّبات والأجرام السماويّة مثل شوميكار-ليفي 9 على سطح تلك الكواكب ومن الغبار الكوني.[46][47] بالإضافة إلى ذلك، فإنّ ثنائي أكسيد الكربون يوجد في الكواكب خارج المجموعة الشمسيّة، حيث أعلنت ناسا وجود CO2 على الكوكب HD 189733 b وذلك باستخدام مرصد هابل الفضائي.[48]
عُثر على ثنائي أكسيد الكربون في كلّ من الأوساط بين النجميّة والأقراص الكوكبيّة المحيطة بالنجوم حديثة الولادة.[49] تحدث عملية التشكّل هذه من التفاعلات الجارية على السطح بين أحادي أكسيد الكربون والأكسجين على جسيمات من الجليد عند درجات حرارة تبلغ -123 °س (150 كلفن)، حيث أنّه عند تبخّر الجليد يتحرّر غاز ثنائي أكسيد الكربون.[50] بالمقابل، فإنّ تركيز CO2 في مناطق الأوساط بين النجميّة البعيدة عن النجوم يكون قليلاً، حيث أنّه يتفاعل مع الهيدروجين الذرّي والجزيئي ليشكّل الماء وأحادي أكسيد الكربون.[51]
التحضير والإنتاج
إنّ حرق الوقود الحاوي على الكربون، خاصّةً من الوقود الأحفوري، يعطي كمّيّات من غاز ثنائي أكسيد الكربون، وعلى هذا النحو، ينتج سنويّاً ما مقداره حوالي 36 مليار طن. ينتج غاز ثنائي أكسيد الكربون كناتج ثانوي من قمين الجير، وذلك عند حرق الجير (كربونات البوتاسيوم)، حيث أنّ هذه العمليّة تعطي حوالي 530 مليون طن سنويّاً. بما أنّ أبحاث احتجاز وتخزين ثنائي أكسيد الكربون لا زالت في المستوى البحثي، ولم تطبّق على شكل تجاري، فإنّ الكمّيّة المنتجة من ثنائي أكسيد الكربون تنتقل إلى الغلاف الجوّي.[52]
ينتج غاز ثنائي أكسيد الكربون من تفاعل الكربون مع الأكسجين:
إنّ تفاعل الأكسدة أعلاه يحدث عند احتراق كلّ أنواع الوقود الحاوية على الكربون، مثل الميثان (الغاز الطبيعي) وكل قطفات تقطير النفط (من البنزين والديزل والكيروسين وغيرها)، بالإضافة إلى الفحم والخشب والمواد العضويّة الأخرى.
كما يعطي تكليس الجير عند تسخينه إلى درجات حرارة فوق 850 °س غاز ثنائي أكسيد الكربون:
على المستوى الصناعي، ينتج ثنائي أكسيد الكربون بعدّة طرق على كافّة المستويات،[8] وغالباً على شكل ناتج ثانوي من إنتاج الأمونياك في عملية هابر-بوش ومن إنتاج الهيدروجين في عمليّات تغويز الفحم وإصلاح البخار في محطّات إنتاج الغاز الطبيعي، حيث يُحصل على ثنائي أكسيد الكربون كناتج من تفاعل انزياح ماء-غاز، والمستخدَم من أجل تحضير غاز الاصطناع.[54]
تقوم الخميرة باستقلاب السكّر لإنتاج الإيثانول، وينطلق غاز ثنائي أكسيد الكربون نتيجة لذلك:
يستخدم التفاعل أعلاه أثناء إنتاج الكحول والمشروبات الروحيّة، كما يعدّ الأساس في إنتاج الإيثانول الحيوي.
على المستوى المخبري، فقد كان ثنائي أكسيد الكربون في السابق ينتج مخبريّاً من أثر حمض الهيدروكلوريك على كربونات الكالسيوم، وذلك في جهاز كيب على سبيل المثال.
أمّا في الوقت الراهن، فيمكن الحصول على غاز CO2 ضمن أسطوانات أو على شكل الثلج الجاف الصلب.[55]
الخواص
الخواص الفيزيائيّة

إنّ غاز ثنائي أكسيد الكربون في الظروف القياسيّة من الضغط ودرجة الحرارة غاز عديم اللون، له كثافة مقدارها 1.98 كغ/م3،[56] والتي هي أكبر بمقدار 1.67 مرّة من الهواء. لا توجد هناك حالة سائلة من ثنائي أكسيد الكربون عند ضغوط أدنى من 5.2 بار. عند الضغط العادي (1 وحدة ضغط جوّي (جوّ)، فإنّ ثنائي أكسيد الكربون يوجد عند درجات حرارة أدنى من −78.5 °س على شكل صلب، يدعى باسم الثلج الجاف. لا يؤدّي تسخين الثلج الجاف إلى انصهاره، حيث يتسامى (يتصعّد)، أي أنّه يتحوّل بشكل مباشر إلى الحالة الغازيّة.
تقع النقطة الثلاثيّة، والتي تكون فيها أطوار المادة الثلاثة؛ الصلبة والسائلة والغازيّة، في حالة توازن، بالنسبة لثنائي أكسيد الكربون عند درجة حرارة مقدارها −56.6 °س، وعند ضغط مقداره 5.18 بار. أمّا النقطة الحرجة فهي تقع عند الدرجة 31.0 °س، وذلك عند ضغط 73.8 بار.[57] يمكن تحويل ثنائي أكسيد الكربون بتطبيق ضغط مرتفع دون درجة الحرارة الحرجة إلى سائل عديم اللون.[58] لا يمكن الحصول على ثنائي أكسيد الكربون السائل عند درجة حرارة الغرفة إلّا عند تطبيق ضغط حوالي 60 بار.
يكون لثنائي أكسيد الكربون الصلب (الثلج الجاف) بنية بلّوريّة مكعّبة، ذات زمرة فراغيّة من النمط Pa3، ويكون ثابت الشبكة البلّوريّة a = 562.4 بيكومتر..[59]
يمتصّ ثنائي أكسيد الكربون قسماً من الطيف الكهرومغناطيسي عند مجال طيف أشعة تحت الأحمر، حيث يؤدّي ذلك إلى حدوث اهتزاز جزيئي. على أساس هذه الخاصّيّة يعدّ ثنائي أكسيد الكربون أحد الغازات الدفيئة.
الانحلاليّة
إنّ انحلاليّة ثنائي أكسيد الكربون في الماء جيّدة جداً، وهي تقريباً في كل الحالات (أكثر من 99%) انحلال فيزيائي، حيث يتحوّل بشكل عكوس ومتوازن إلى حمض الكربونيك H2CO3. نظراً لأن ثابت توازن إماهة حمض الكربونيك هو (عند 25°س)، لذلك فإنّ معظم ثنائي أكسيد الكربون لا يتحوّل إلى حمض الكربونيك بشكل كامل، ويبقى معظمه في صورة جزيئات CO2، بالتالي فإنّ تأثير ثنائي أكسيد الكربون على قيمة الأس الهيدروجيني عند انحلاله في الماء ضعيفة.
يمكن كتابة معادلة توازن ثنائي أكسيد الكربون في الماء وتشكّل حمض الكربونيك بالشكل المبسّط التالي:
ولكن فعلياً تكون معادلات التوازن الكيميائي على الشكل التالي:
يكون حمض الكربونيك في توازن كيميائي مع نواتج تفكّكه في الماء وهي أيون البيكربونات −HCO3 وأيون الكربونات 2−CO3. تتعلّق نسبة وجود هذين الأيونين إلى بعضهما بقيمة الأس الهيدروجيني (pH الوسط). يسود انتشار أيون البيكربونات (بنسبة> 50٪) في المياه المتعادلة أو قليلة القلويّة (pH> 6.5)، وتصل نسبته إلى (> 95٪) في مياه البحر. تحوي مياه المحيطات، والتي هي متوسّطة القلويّة (pH = 8.2–8.5) على نحو 120 مغ من البيكربونات لكل لتر. أما في المياه شديدة القلويّة (pH> 10.4)، فيسود أيون الكربونات (بنسبة> 50٪)، لأنه في حال سحب أيون الأوكسونيوم +H3O من الوسط وذلك بإضافة كاشف قلوي يحوي أيون الهيدروكسيد −OH، فإن التوازن بين البيكربونات والكربونات ينزاح إلى صالح تشكّل الكربونات.
تعدّ انحلالية ثنائي أكسيد الكربون في الماء مقارنةً مع الغازات الأخرى مرتفعة نسبيّاً، حيث أنّ درجة الإشباع لغاز CO2 نقيّ في حالة توازن مع الماء عند درجة حرارة 20 °س وعند الضغط العادي (1 جوّ) تبلغ 1688 مغ/ل، في حين أنّها للأكسجين النقي 44 مغ/ل، وللنتروجين النقي 19 مغ/ل.[60]
البنية

يرتبط الكربون مع كلتا ذرّتي الأكسجين برابطة تساهميّة مضاعفة وبشكل متكافئ، بحيث يبلغ طول الرابطة C=O ما مقداره 116.3 بيكومتر.[58][61] نتيجة هذا الارتباط يكون هناك زوجين إلكترونيّين غير رابطين على كل ذرة أكسجين. إنّ لجزيء ثنائي أكسيد الكربون بنية خطّيّة، حيث تصطف الذرّات الثلاثة (ذرّتي أكسجين طرفيتين وذرّة كربون في المنتصف) على خط مستقيم، وحسب هذا الترتيب، يكون جزيء CO2 متناظر مركزيّاً.
على الرغم من استقطاب الرابطة بين الأكسجين والكربون بسبب اختلاف الكهرسلبيّة بين الذرّتين، إلاّ أنّ عزم ثنائي القطب بالنسبة للرابطتين يفني بعضه، نظراً لأنّ الجزيء متناظر مركزياً، بالتالي فإنّ ثنائي أكسيد الكربون ليس ثنائي قطب. نتيجة التناظر المركزي أيضاً، فإنّه لا يشاهد لجزيء ثنائي أكسيد الكربون في طيف مجال أشعّة تحت الحمراء سوى حزمتين اهتزازيّتين، إحداها من نمط الامتطاط اللامتناظر عند عدد الموجة 2349 سم−1، والأخرى من نمط الانحناء بالقرب من عدد الموجة 666 سم−1. هناك أيضاً اهتزاز من نمط الامتطاط المتناظر عند 1388 سم−1، والذي يلاحظ فقط في مطيافية رامان.[62]
الخواص الكيميائيّة
لا يعدّ ثنائي أكسيد الكربون من المؤكسدات القويّة، حيث أنّه يتفاعل فقط بشكل "مؤكسد" مع الفلزّات التي لها قدرة اختزال كبيرة مثل المغنسيوم، حيث يتشكّل الكربون والأكسيد الموافق.[63]
نظراً لوجود شحنة جزئية موجبة على ذرة الكربون في جزيء ثنائي أكسيد الكربون، فإنّ CO2 يتفاعل ككاشف ضعيف محب للإلكترون في تفاعلات إضافة كربوكسيل إلى الأنواع الكيميائيّة المحبّة للنواة، على سبيل المثال، يتفاعل ثنائي أكسيد الكربون مع الأنيونات الكربونيّة (الكربانيونات) التي توفّرها كواشف غرينيار ومركبات الليثيوم العضويّة لتعطي الكربوكسيلات:
حيث M هي Li أو MgBr و R عبارة عن ألكيل أو أريل.
يدخل CO2 كربيطة في تركيب المعقدات التناسقيّة مع بعض الفلزّات الانتقاليّة، والتي تقوم بتسهيل تحوّل CO2 إلى مركّبات أخرى.[64]
إنّ تفاعل اختزال ثنائي أكسيد الكربون إلى أحادي أكسيد الكربون هو من التفاعلات البطيئة صعبة التنفيذ:
إنّ جهد اختزال هذا التفاعل في وسط معتدل (pH ~ 7) يكون حوالي −0.53 فولت مقابل القطب القياسي للهيدروجين. تقوم إنزيمات "ديهيدروجيناز أحادي أكسيد الكربون" carbon monoxide dehydrogenase الحاوية على فلزّ النيكل بإجراء عمليّة تحفيز هذا التفاعل في الحيويّات.[65]
الدور الحيوي
إنّ ثنائي أكسيد الكربون هو ناتج عملية التنفس الخلوي في الأحياء التي تحصل على الطاقة من تكسير سلاسل السكريات والدهون والأحماض الأمينيّة بواسطة الأكسجين وذلك كجزء من عملية الاستقلاب. تشمل هذه الأحياء كل من النباتات والطحالب والفطور الهوائيّة، والبكتريا، بالإضافة إلى الحيوانات والبشر.
التركيب الضوئي وتثبيت الكربون
إنّ تثبيت الكربون هي عمليّة كيميائيّة حيويّة يستخدم فيها ثنائي أكسيد الكربون من قبل النباتات والطحالب والزراقم ويحول إلى جزيئات عضويّة غنيّة بالطاقة، مثل الغلوكوز، وبالتالي تشكّل غذائها بعمليّة التركيب الضوئي. يُستخدم ثنائي أكسيد الكربون والماء في عملية التركيب الضوئي لإنتاج السكر، والذي يعدّ مادّة بدائيّة للعديد من المركّبات العضويّة، وفيها ينتج الأكسجين كناتج ثانوي للعمليّة.
يعدّ إنزيم ريبولوز-5،1-مضاعف فوسفات كربوكسيلاز أوكسيجيناز المعروف بالاسم المختصر روبيسكو RuBisCO، المسؤول عن الخطوة الرئيسيّة الأولى في عملية تثبيت الكربون، وهي إنتاج جزيئتين من حمض 3-فوسفوغليسيريك من CO2 وريبولوز-5،1-مضاعف فوسفات. يعتقد أنّ أنزيم RuBisCo هو أكثر بروتين فردي متوفّر على سطح الأرض.[66]
إنّ الكائنات ضوئيّة التغذية تستخدم منتجات عمليّة التركيب الضوئي كمصدر غذاء داخلي وكمادّة أوليّة من أجل التخليق الحيوي لمركّبات عضويّة معقّدة مثل متعدّدات السكاريد والأحماض النوويّة والبروتينات. تستخدم هذه المركّبات الناتجة من أجل نموّ النباتات، وكأساس في السلاسل الغذائيّة والشبكات من أجل تأمين غذاء المتعضيّات. حتّى أنّ بعض الكائنات ضوئيّة التغذية مثل البذيرات الجيريّة (الاسم:Coccolithophore) تقوم بتصنيع كربونات الكالسيوم، ومن هذه الأنواع الإميليانيّة الهكسليّة (الاسم العلمي:Emiliania huxleyi)، والتي تقوم بإنتاج الكالسيت، والذي يعدّ أساس العديد من الصخر الرسوبية مثل الحجر الجيري، ممّا يعدّ أحد الأمثلة على عملية تثبيت الكربون.

يمكن للنباتات أن تنمو بشكل أسرع وذلك بنسبة حتى 50% في تراكيز مرتفعة من CO2 يمكن أن تصل إلى 1000 جزء في المليون، وذلك عند المقارنة مع الشروط العاديّة، وذلك مع افتراض عدم حدوث تغيير في المناخ وعدم وجود تقييد على مغذّيات أخرى.[67] إنّ تراكيز CO2 المرتفعة يمكن أن تسبّب ازدياداً في نموّ النباتات، ممّا ينعكس على مردود المحاصيل، حيث أنّ محاصيل القمح والرز والصويا أظهرت ازدياداً بنسبة 12-14% وذلك في تجارب FACE التي فيها تركيز مرتفع من ثنائي أكسيد الكربون.[68][69]
بالمقابل، فإنّ ازدياد تركيز CO2 الجوّي يؤدّي إلى تشكّل عدد أقلّ من المسام في النباتات،[70] ممّا يؤدّي إلى ازدياد في كفاءة استخدام الماء.[71] أظهرت الدراسات باستخدام تجارب تخصيب تركيز ثنائي أكسيد الكربون في الهواء الطلق (FACE) أنّ رفع تركيز ثنائي أكسيد الكربون يؤدّي إلى تناقص تراكيز المغذّيات المكروئيّة في نباتات المحاصيل.[72] هذا الأمر يمكن أن يؤدّي إلى حدوث تأثيرات على أجزاء أخرى من النظام البيئي، حيث يمكن للحيوانات العاشبة أن تحتاج إلى تناول المزيد من الغذاء لتأمين كمّيّة أكبر من البروتين.[73] إنّ تركيز المستقلبات الثانويّة مثل مركّبات فينيل بروبانويد والفلافونويد يمكن أن يختلف في النباتات التي تتعرّض إلى تراكيز مرتفعة من CO2.[74][75]
تقوم النباتات بإصدار CO2 خلال التنفّس، إلّا أنّه في المحصّلة فإنّ النباتات والطحالب، التي تستخدم التمثيل الضوئي ثلاثي الكربون، تقوم بامتصاص CO2 خلال اليوم. رغم أنّ الغابة الفتيّة ستقوم بامتصاص العديد من الأطنان من CO2 كلّ سنة، فإنّ غابة معمّرة ستنتج كمية من CO2 ناتجة عن التنفس وعن تفكّك الأجزاء والأغصان الميّتة، وذلك بشكل أكبر من المستهلَك في التركيب الضوئي للغابات الفتيّة.[76] على الرغم من ذلك، فإنّ الغابات المعمّرة تعدّ من الأماكن المفضّلة لتجميع الكربون،[77] وأحد مصارف الكربون بالغة الأهميّة من أجل المحافظة على توازن الكربون في الغلاف الجوّي للأرض. بالإضافة إلى ذلك، فإنّ هناك أمراً مهمّاً لاستمرارية الحياة على الأرض، وهو أنّ التركيب الضوئي الذي تقوم به العوالق النباتيّة يستهلك كمّيّات من CO2 المنحلّ في الطبقات العليا من المحيطات، وبالتالي يحفّز امتصاص غاز CO2 من الغلاف الجوّي.[78]
الدور الفيزيولوجي في جسم الإنسان
المحتوى
ينتج جسم الإنسان تقريباً حوالي 1 كغ من ثنائي أكسيد الكربون كل يوم،[79] وهذه الكمّيّة تحوي 290 غ من الكربون والباقي أكسجين. ينتقل ثنائي أكسيد الكربون الناتج من عملية الاستقلاب في جسم الإنسان في الأوردة بواسطة جهاز الدوران ثم ينتهي به المطاف خارج الجسم في هواء الزفير. لذلك فإنّ تركيز ثنائي أكسيد الكربون يكون مرتفعاً في الأوردة ويتناقص في جهاز التنفس، بالتالي يكون تركيزه منخفضاً في الشرايين. إنّ محتوى ثنائي أكسيد الكربون في الدمّ يعبّر عنه باستخدام الضغط الجزئي، والذي هو الضغط الذي سيطبّقه غاز ثنائي أكسيد الكربون لو كان سيشغل وحده الحجم المعطى له.[80]
يكون محتوى ثنائي أكسيد الكربون في جسم الإنسان كما يلي:
| الوحدة | في الأوردة | في الحويصلات الهوائيّة | في الشرايين |
|---|---|---|---|
| كيلوباسكال (kPa) | 5.5[81]-6.8[81] | 4.8 | 4.7[81]-6.0[81] |
| ميليمتر زئبقي (mmHg) | 41–51 | 36 | 35[82]-45[82] |
النقل في الدم
ينتقل ثنائي أكسيد الكربون CO2 في جسم الإنسان من خلال ثلاثة طرق، بحيث أن النسبة المئويّة الدقيقة تعتمد على نوع الوعاء الدموي إن كان شرياناً أو وريداً.
- أغلب ثنائي أكسيد الكربون (من 70% إلى 80%) يتحوّل إلى أيون بيكربونات -HCO3 وذلك بواسطة أنزيم الأنهيدراز الكربوني (كربوأنهيدراز) في خلايا الدمّ الحمراء،[83] وذلك عبر التفاعل:
- حوالي 5% إلى 10% ينحلّ في بلازما الدم.[83]
- حوالي 5% إلى 10% يرتبط مع خضاب الدم (الهيموغلوبين) وذلك على شكل كربامينو هيموغلوبين Carbaminohemoglobin.[83]
إنّ الهيموغلوبين هو الجزيء الحامل للأكسجين في خلايا الدم الحمراء، كما أنّه يرتبط مع ثنائي أكسيد الكربون CO2، ولكن في موقع مختلف عن موقع ارتباطه مع الأكسجين، حيث يتحدّ مع مجموعات N-الطرفيّة على سلاسل الغلوبين الأربع. بسبب وجود ضوابط تفارغيّة من حيث الارتباط مع جزيء الهيموغلبين، فإنّ ارتباط CO2 معه يؤدّي إلى تناقص كمّيّة الأكسجين المرتبط بالنسبة إلى ضغط جزئي معيّن من الأكسجين، وكذلك فالعكس صحيح، فإنّ ارتباط الأكسجين يؤدّي إلى تناقص كمّيّة ثنائي أكسيد الكربون المرتبط. تعرف هذه الظاهرة باسم تأثير هالدين، وهي مهمّة جدّاً فيما يخصّ نقل ثنائي أكسيد الكربون من الأنسجة إلى الرئتين. كما تلعب قيمة pH الوسط دوراً في مدى إلفة الهيموغلوبين إلى كلّ من الأكسجين وثنائي أكسيد الكربون، ويتمّ دراسة ذلك فيما يعرف باسم تأثير بور.
الاستخدامات
هناك طيف واسع من التطبيقات التي يدخل فيها ثنائي أكسيد الكربون، وذلك نظراً لانخفاض سعره، ولعدم خطورته، ولسهولة التعامل به، سواءً على شكل غاز أو سائل أو صلب أو في الطور فوق الحرج.
الصناعات الكيميائيّة
يدخل ثنائي أكسيد الكربون في تركيب غاز الاصطناع المستخدم في عدّة عمليّات كيميائيّة مهمّة مثل عملية هابر-بوش من أجل إنتاج الأمونياك، ومن أجل إنتاج الميثانول، حيث يستخدم ثنائي أكسيد الكربون بشكل نقي وبكمّيّات كبيرة.[84][85]
من أجل إنتاج اليوريا، يتفاعل غاز ثنائي أكسيد الكربون مع الأمونياك في خطوة أولى حيث يتشكّل مركب كربامات الأمونيوم، والذي يتفاعل لاحقاً ليشكّل كلّ من اليوريا والماء.
كما يمكن اختزال الكربامات بالهيدروجين للحصول على الفورماميد، أو مفاعلته مع الأمينات مثل ثنائي ميثيل أمين للحصول على ثنائي ميثيل فورماميد.[86]
ينتج حمض حمض الساليسيليك من تفاعل ثنائي أكسيد الكربون مع فينولات الصوديوم، وذلك حسب تفاعل كولبة-شميت.[87]
كما يعطي تفاعل أكسيد الإيثيلين مع ثنائي أكسيد الكربون مركّب كربونات الإيثيلين، والذي يحصل منه لاحقاً على غليكول الإيثيلين.
يمكن الحصول على الأحماض الكربوكسيلي من تفاعل ثنائي أكسيد الكربون مع كواشف غرينيار:
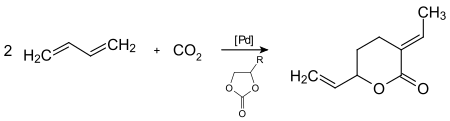
يؤدّي تفاعل ثنائي أكسيد الكربون مع 3،1-بوتاديين بوجود حفاز من البالاديوم في طور متجانس إلى الحصول على مركّبات مهمّة مثل اللاكتونات، وذلك ضمن شروط تفاعل معتدلة.
يعدّ التفاعل مع غاز ثنائي أكسيد الكربون أحد الخطوات المهمّة في عملية سولفاي من أجل الحصول على كربونات الصوديوم (الصودا). إنّ العديد من كربونات الفلزّات، والتي لها تطبيقات في صناعة الخضب مثل كربونات الرصاص الثنائي، يجري الحصول عليها من تفاعل هيدروكسيدات الفلزّات الموافقة مع ثنائي أكسيد الكربون.
الصناعات الغذائيّة
يستخدم ثنائي أكسيد الكربون كمضاف غذائي وذلك في العموم كمحتوى غازي في المشروبات ومن أجل تنظيم الحموضة في الصناعات الغذائيّة، حيث أنّ إضافته أمر موافق عليه من الجهات الرسميّة في عدّة دول في الاتحاد الأوروبي، إذ أنّ له رقم إي E290.[88] كما أنّه من الإضافات الغذائية في الولايات المتّحدة الأمريكيّة،[89] وفي أستراليا ونيوزيلندا.[90]
ينشأ غاز ثنائي أكسيد الكربون في الجعة (البيرة) والنبيذ الفوّار نتيجة التخمّر، أمّا في المشروبات الغازيّة الأخرى مثل شراب الليمون الغازي أو المياه المكربنة أو الكولا فإنّ غاز ثنائي أكسيد الكربون يضاف بشكل صناعي على الأغلب، وفي بعض الأحيان بإضافة مياه معدنية حاوية على غاز CO2 بشكل طبيعي. عادةً ما يضاف ثنائي أكسيد الكربون إلى المشروبات الغازيّة في منشآت صناعيّة مجهّزة، ولكن مؤخّراً أصبح بالإمكان استخدام أجهزة تمكّن من القيام بعملية الكربنة على الصعيد المكتبي أو المنزلي.
تقوم فطريات الخميرة بعملية تخمير للسكّر وتطلق بذلك غاز ثنائي أكسيد الكربون، لذلك فإنّ الخميرة هي من عوامل النفاشية المستخدمة من أجل تحضير عجينة الخبز. إنّ مسحوق الخَبْز، وهو مزيج من بيكربونات الصوديوم مع ملح له صفة حمضيّة، يقوم بإطلاق غاز ثنائي أكسيد الكربون عند التسخين في الفرن. و يستخدم الثلج الجاف، وهو الشكل الصلب من ثنائي أكسيد الكربون، كمادّة تبريد للعنب المقطوف، دون الحاجة إلى استخدام الماء، وذلك لتجنّب حدوث تخمّر.[91] بالإضافة إلى ذلك، فإنّ ضبط نسبة غاز ثنائي أكسيد الكربون إلى الأكسجين في مستودعات الأغذية يمكّن من تخزين الفواكه والخضراوات لمدّة أطول. ففي ثلاثينات القرن العشرين أُسّس أوّل مستودع، له ميزة الغلاف الموجّه بحيث يمكن ضبط نسبة O2 و CO2 في بريطانيا.[92] كما يستخدم غاز CO2 كوسط من أجل حفظ اللحوم والأسماك ومنتجات الألبان. تتفاوت النسبة المستخدمة حسب نوع المادّة الغذائيّة، فهي تبلغ 20% بالنسبة للحم البقر، و50% بالنسبة للحم العجل، و60% بالنسبة للمعجّنات، 80% بالنسبة للأسماك. تجدر الإشارة إلى أنه لا تستخدم نسبة كاملة 100% من غاز ثنائي أكسيد الكربون لحفظ المواد الغذائيّة، وذلك من أجل تجنّب تشكّل الجراثيم اللا هوائية، كما أنّ هذا الأمر يؤثّر على لون وعلى طعم المنتج الغذائي. لا تزال الأبحاث مستمرة في مجال صناعة الغذاء للحصول على التركيب الأمثل من الغازات الحافظة.[93][94]
يعدّ ثنائي أكسيد الكربون في الحالة فوق الحرجة أحد وسائل الاستخلاص، وهو يستخدم من أجل عملية نزع الكافيين من القهوة.[95]
التطبيقات الزراعيّة والحيويّة
تحتاج النباتات ثنائي أكسيد الكربون لإجراء عملية التركيب الضوئي. وقد تستخدم الدفيئات لإثراء الأجواء بكمّيّات من CO2 لدعم وزيادة نمو النباتات.[96][97] ومن شأن أيّ انخفاض في نسبة ثنائي أكسيد الكربون (بنسبة أقل من نصف تركيزه في الغلاف الجوي) أن يضرّ بعمليّة التركيب الضوئي في الدفيئات، وقد تؤدّي إلى قتل النباتات الخضراء، أو على الأقلّ، قد توقف نموّها تماماً. أمّا إذا زاد تركيزه بنسب عالية جداً (نحو 100 مرّة تركيزه في الغلاف الجوي أو أكثر)، قد يصبح ثنائي أكسيد الكربون سامّاً للحياة الحيوانيّة، لذا فإنّ رفع تركيزه إلى 10,000 جزء في المليون (1٪) أو أعلى لعدّة ساعات، من شأنه القضاء على الآفات مثل الذبابة البيضاء والعناكب في الدفيئات.[98]
في الطبّ، يُضاف ثنائي أكسيد الكربون بنسبة تصل إلى 5% (130 مرة تركيز الغلاف الجوي) إلى الأكسجين لتحفيز التنفّس بعد حالات توقف التنفّس ولتثبيت اتّزان نسبة O2/CO2 في الدمّ. وهناك بحث اقترح استخدام ثنائي أكسيد الكربون الناتج عن توليد الطاقة، وتحويله إلى فقاعات تُمرر في أحواض لتنمية طحالب يمكن بعد ذلك تحويلها إلى وقود ديزل حيوي.[99]
التطبيقات التقنيّة
التثليج والتبريد
يعدّ ثنائي أكسيد الكربون السائل والصلب من المُثلِّجات الهامّة، خاصة في الصناعات الغذائيّة، حيث يستخدم أثناء عمليّات النقل وتخزين المثلَّجات والأغذية المُجمّدة الأخرى. يستخدم ثنائي أكسيد الكربون الصلب الذي يعرف بالثلج الجاف لحفظ الشحنات الصغيرة التي يكون استخدام أجهزة التبريد لحفظها غير عملي، ويكون دائماً عند درجة حرارة أقل من −78.5 °س عند الضغط الجوي العادي دون أن يتأثّر ذلك بدرجة الحرارة.

أمّا ثنائي أكسيد الكربون السائل (يُعرف صناعيًا بالرمز R744 أو R-744)، فقد كان يستخدم كمُبرّد قبل اكتشاف ثنائي كلورو ثنائي فلورو الميثان (R-12). وتعدّ خواصه الفيزيائيّة مناسبة للغاية للتبريد والتجميد وأغراض التدفئة، حيث لديه سعة تبريديّة كبيرة الحجم. ونظراً لإمكانيّة استخدامه حتّى ضغوط تصل إلى 130 بار (1880 رطل/بوصة مربعة)، فإنّ أنظمة CO2 تتطلّب وجود مكوّنات شديدة المقاومة للضغوط، والتي تمّ تطويرها بالفعل لخدمة الإنتاج الكمّي في بعض القطاعات. نتيجةً لمزاياه البيئيّة، فمن الممكن أن يصبح ثنائي أكسيد الكربون سائلاً بديلاً لغازات الهيدروكربونات الفلوريّة HFC في السيارات والسوبرماركت ومضخّات المياه الساخنة الحراريّة.[100][101]
في التقانة النوويّة يستخدم ثنائي أكسيد الكربون كمادّة تبريد في المفاعلات النوويّة المبرّدة بالغاز.
إطفاء الحرائق
يستخدم ثنائي أكسيد الكربون من أجل إطفاء الحرائق، حيث أنّ بعض مطافئ الحريق، وخاصّة التي تستخدم من أجل الحرائق الكهربائيّة، تحوي في أسطواناتها على ثنائي أكسيد الكربون السائل الموضوع تحت الضغط. بالمقابل، فإنّ مطافئ الحريق الحاوية على ثنائي أكسيد الكربون السائل غير مناسبة لإطفاء الحرائق الكبيرة والتي فيها مواد قابلة للاشتعال، لأنّها تقوم بحجب الأكسجين فقط، دون أن تقوم بدور تبريدي. يمكن استخدام ثنائي أكسيد الكربون في إطفاء الحرائق على نطاق فردي ضيق، كما يستخدم في مجال الوقاية ضد الحرائق في السفن وغرف المحركّات.
من جهة أخرى، فإنّ استخدام ثنائي أكسيد الكربون كوسيلة للإطفاء يمكن أن يؤدّي إلى الاختناق في حال وجود تراكيز مرتفعة منه، حيث وجدت دراسة أمريكيّة أنّ استخدام أنظمة CO2 في إطفاء الحرائق قد سبّب 51 حادثة بين سنتي 1975 و 1997، من ضمنها 72 حالة وفاة و145 إصابة.[102]
مجالات الطاقة
استخراج النفط
يستخدم ثنائي أكسيد الكربون في استخراج النفط المحسّن، حيث يتمّ حقنه في أو بالقرب من آبار النفط، تحت ظروف فوق حرجة، حيث يصبح ثنائي أكسيد الكربون ممتزجاً مع النفط. يمكن لهذه الطريقة أن تزيد من إنتاج النفط المستخرج عن طريق الحدّ من فاقد النفط المستخرج نتيجة التشبُّع بنسبة تتراوح بين 7-23% عن الطرق العاديّة لاستخراج النفط.[103] يعمل ثنائي أكسيد الكربون أيضاً كعامل ضغط حين يذوب النفط المدفون ويقلّل لزوجته بشكل كبير، ويُغيّر من التركيب الكيميائي للطبقات، فيتمكّن النفط من التدفّق بسرعة أكبر من الخزانات إلى الآبار.[104]
استخراج الميثان من سرير الفحم
في الطريقة المحسّنة لاستخراج الميثان من الفحم، يُضخّ ثنائي أكسيد الكربون في طبقات من الفحم لإنتاج الميثان، وهي طريقة بديلة للطرق الحاليّة التي تعتمد في المقام الأول على فصل الماء من عروق الفحم لتحرير غاز الميثان المحتجز.[105]
التحوّل الحيوي إلى وقود
استطاع باحثون عمل تعديلات وراثيّة على سلالة من الزراقم تدعى المتعاقبة الحُبَيْبِيَّة المتطاولة (الاسم العلمي:Synechococcus elongatus) لتُنتج وقود إيزوبوتانال (ألدهيد) وإيزوبوتانول (كحول) من ثنائي أكسيد الكربون من خلال التركيب الضوئي.[106]
استخدامات مختلفة
نظرًا لكون ثنائي أكسيد الكربون رخيصًا للغاية وغير ضار، لذا فهو يستخدم في العديد من الاستخدامات التخصصيّة الصغيرة المختلفة.
على سبيل المثال، كان ليزر ثنائي أكسيد الكربون واحداً من أقدم أنواع أجهزة الليزر. في هذا الجهاز، يضخّ مزيج من غاز ثنائي أكسيد الكربون مع النتروجين والهيليوم بشكل مستمرّ في أنبوب التفريغ، ويمكن أن يعطي استطاعة جيّدة مقارنةً مع باقي أجهزة ليزر الغاز وذلك ضمن مجال يتراوح بين 10 واط إلى 20 كيلوواط.[107]
يستخدم ثنائي أكسيد الكربون كغاز ٍواق ٍ في عمليات اللحام، وذلك إمّا على الشكل النقي، أو كمضاف لتشكيل مزيج غازي مع الآرغون أو الهيليوم. إنّ غاز ثنائي أكسيد الكربون ليس بخامل، حيث أنّه عند درجات حرارة مرتفعة يكون غير مستقر ترموديناميكيّاً، حيث يعدّ من الغازات الفعّالة، وخاصّة في مجال اللحام القوسي باستخدام المعدن والغاز.[108]
كما يمكن استخدام ثنائي أكسيد الكربون كوسيلة لضبط الأس الهيدروجيني للمسابح، عن طريق التغذية المستمرّة للغاز في الماء، فيمنع قيمة pH من الارتفاع. ومن مميّزات تلك الطريقة، أنّها تتجنّب التعامل مع الأحماض. أيضاً وبشكل مشابه، يستخدم ثنائي أكسيد الكربون في الحفاظ على أحواض الشعاب المرجانيّة وفي مفاعلات الكالسيوم بصفة مؤقّتة لخفض قيمة pH للماء عن طريق تمريره على كربونات الكالسيوم لتتمكّن الكربونات من الذوبان في الماء ليستخدمها بعض أنواع المرجان لبناء هيكله.
يستخدم هذا الغاز كذلك في عمليات القتل الرحيم لحيوانات التجارب المخبريّة، من خلال إدخالهم إلى غرفة مغلقة ممتلئة بالغاز، أو بتعريضهم تدريجيّاً لتراكيز متزايدة من CO2. وفي سنة 2013 م، أصدرت الجمعية الأمريكية للطب البيطري دليلاً جديداً لكيفيّة استخدام ثنائي أكسيد الكربون في تلك العمليّات، حيث اعتبرت أنّ ضخّ الغاز بمعدّل تدفّق من 10% إلى 30% حجماً في الدقيقة، يعدّ الأمثل لعمليّات القتل الرحيم للقوارض الصغيرة.[109] كما يضخّ غاز ثنائي أكسيد الكربون في أحواض الأسماك أو تستخدم مياه حاوية على تراكيز عالية منه من أجل تخدير الأسماك ممّا يسهّل من صيدها.[110]
عندما تتصعّد أبخرة الثلج الجاف يتشكّل ضباب أبيض من مزيج ثنائي أكسيد الكربون مع الهواء بالإضافة إلى الرطوبة المتكثّفة. استخدم هذا الضباب سابقاً كإحدى التقنيّات في العروض والحفلات، أمّا في الوقت الحالي، فتستخدم آلات الضباب الاصطناعي، والتي يمكن تشغيلها باستخدام ثنائي أكسيد الكربون السائل كأحد السوائل المستخدمة. يمكن استخدام تيار من ثنائي أكسيد الكربون السائل على شكل تيار من أجل تنظيف السطوح،[111] كما يستخدم ثنائي أكسيد الكربون فوق الحرج من أجل التنظيف وإزالة الدهون من على الرقاقات في صناعة أشباه الموصلات، وفي التنظيف الجاف للأنسجة.[112]
السمّيّة واحتياطات الأمان
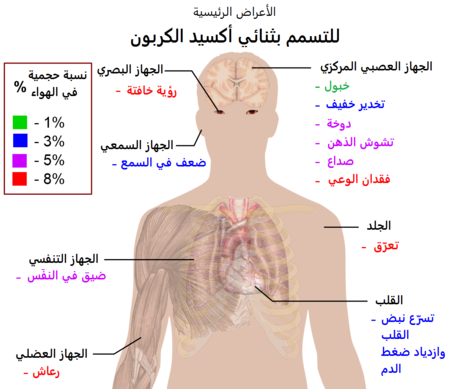
إنّ غاز ثنائي أكسيد الكربون CO2 ليس من الغازات السامّة أو المؤذية وذلك حسب النظام العالمي المتوافق لتصنيف وترميز المواد الكيميائيّة (GHS) التابع للجنة الأمم المتحدة الاقتصادية لأوروبا UNECE، وحسب معايير منظمة التنمية والتعاون الاقتصادي OECD لاختبار المواد الكيميائيّة.
عند تراكيز تصل إلى 1% (10,000 جزء في المليون ppm)، فإنّ بعض الأشخاص يشعرون بالنعاس وفقدان الوعي التدريجي.[113] أمّا عند تراكيز تتراوح بين 7% إلى 10% فيمكن حدوث اختناق، حتّى رغم وجود كمّيّات كافية من غاز الأكسجين، ويصاحب ذلك أعراض مثل الدوخة والصداع وحدوث اضطرابات سمعيّة وبصريّة، ويمكن أن تنتهي بفقدان الوعي الذي قد يدوم من بضع دقائق إلى ساعة.[114] إنّ التأثيرات الفيزيولوجيّة للتعرّض لمستويات مرتفعة من CO2 يمكن أن يعبّر عنها باسم فرط ثنائي أكسيد الكربون في الدم Hypercapnia، وهو أحد أنواع مظاهر الاختناق.
يجب أخذ الحذر في الأماكن التي يتسرّب فيها غاز CO2 من الأرض بالقرب من أماكن البراكين والنشاطات الجيوحراريّة، حيث أنّ ثنائي أكسيد الكربون أثقل من الهواء، بالتالي فإنّه يمكن أن يصعد من الطبقات القريبة من سطح الأرض بتراكيز عالية نسبياً، ويتجمّع بشكل يمكن أن يؤدّي إلى اختناق الحيوانات. وقد سُجّل وقوع حوادث وفيّات لأطفال في القارّة الأفريقيّة في مدينة غوما، وذلك نتيجة التعرّض لانبعاثات من غاز ثنائي أكسيد الكربون المحتجز في تجاويف بالقرب من بركان نيراجونجو في جمهورية الكونغو الديمقراطية.[115] يطلق على هذه الظاهرة في اللغة السواحلية اسم مازوكو mazuku، والتي تعني الريح الشرّيرة.
هناك القليل من الدراسات التي تهتمّ بالتأثيرات الصحيّة على الإنسان والحيوانات نتيجة التعرّض المستمرّ والطويل لتراكيز من CO2 تحت 1%، وذلك على الرغم من وجود احتماليّة خطورة كبيرة للبشر في المستقبل القريب مع ارتفاع مستويات غاز ثنائي أكسيد الكربون في الغلاف الجوي المترافق مع تغير المناخ.[116] يبلغ الحدّ الأعظمي المهني من مستويات التعرّض لغاز CO2 في الولايات المتّحدة الأمريكيّة 0.5% (5000 جزء في المليون ppm) وذلك لمدّة ثمان ساعات.[117] عند هذا المستوى من التركيز أصيب طاقم محطة الفضاء الدولية بالصداع والنعاس والخبول الفكري والتشوش العاطفي، بالإضافة إلى حدوث اضطرابات في النوم.[118] تشير الدراسات على الحيوانات التي تتعرّض لمستويات تبلغ 0.5% من CO2 حدوث تكلّس بالكلى وهشاشة العظام بعد ثمانية أسابيع من التعرّض.[119] أظهرت دراسة أخرى أن تعرّض البشر في فترات مدتها 2.5 ساعة يؤدّي إلى حدوث تأثيرات بالغة الأثر على القدرات الإدراكية عند تراكيز أقل من 0.1 % من CO2، ويعود ذلك إلى العلاقة بين تركيز ثنائي أكسيد الكربون ومعدّل جريان الدمّ في الدماغ.[120]
مقالات ذات صلة
كتب
- James Newton Butler: Carbon Dioxide Equilibria and Their Applications. Lewis Publishers, 1991, .
- Martin M. Halmann, Meyer Steinberg: Greenhouse Gas Carbon Dioxide Mitigation: Science and Technology. CRC Press Inc, 1998, .
- Martin M. Halmann: Chemical Fixation of Carbon Dioxide Methods Recycling: Methods of Recycling CO2 into Useful Products. CRC Press Inc, 1993, .
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/280 — تاريخ الاطلاع: 18 نوفمبر 2016 — العنوان : carbon dioxide — الرخصة: محتوى حر
- National Oceanic & Atmospheric Administration (NOAA) – Earth System Research Laboratory (ESRL), Trends in Carbon Dioxide. نسخة محفوظة 14 مارس 2018 على موقع واي باك مشين.
- "Northern Hemisphere Cracks 400 ppm CO₂ for Whole Month for First Time". National Geographic. مؤرشف من الأصل في 23 أبريل 201927 مايو 2014.
- Donald G. Kaufman; Cecilia M. Franz (1996). Biosphere 2000: protecting our global environment. Kendall/Hunt Pub. Co. . مؤرشف من الأصل في 6 أبريل 201711 أكتوبر 2011.
- Food Factories. www.legacyproject.org. Retrieved on 2011-10-10. نسخة محفوظة 12 أغسطس 2017 على موقع واي باك مشين.
- "General Properties and Uses of Carbon Dioxide, Good Plant Design and Operation for Onshore Carbon Capture Installations and Onshore Pipelines". Energy Institute. مؤرشف من الأصل في 09 نوفمبر 201814 مارس 2012.
- National Research Council. "Summary." Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. Washington, DC: The National Academies Press, 2010. 1. Print.
- Pierantozzi, Ronald (2001). "Carbon Dioxide". Kirk-Othmer Encyclopedia of Chemical Technology. Kirk-Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.0301180216090518.a01.pub2. .
- Ebbe Almqvist (2003): History of industrial gases, Springer, 2003, , p. 93
- William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, , S. 72.(بالألمانية)
- Priestley, Joseph; Hey, Wm (1772). "Observations on Different Kinds of Air". Philosophical Transactions. 62: 147–264. doi:10.1098/rstl.1772.0021. مؤرشف من الأصل في 16 أبريل 2019.
- Davy, Humphry (1823). "On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents". Philosophical Transactions. 113 (0): 199–205. doi:10.1098/rstl.1823.0020. JSTOR 107649. مؤرشف من الأصل في 14 سبتمبر 2016.
- اقرأ:
- Thilorier (1835) "Solidification de l’acide carbonique" (Solidification of carbonic acid), Comptes rendus ..., 1 : 194-196.
- "Solidification of carbonic acid," The London and Edinburgh Philosophical Magazine, 8 : 446-447 (1836). نسخة محفوظة 26 أكتوبر 2017 على موقع واي باك مشين.
- Martin Kappas: Klimatologie, Spektrum Akademischer Verlag, Heidelberg 2009, , S. 159.
- J. Ewald: Carbon Dioxide at NOAA’s Mauna Loa Observatory reaches new milestone: Tops 400 ppm. In: NOAA Research, 10. Mai 2013.
- Enting, I. G. (1987). "The interannual variation in the seasonal cycle of carbon dioxide concentration at Mauna Loa". Journal of Geophysical Research. 92: 5497–5504. doi:10.1029/JD092iD05p05497.
- Genthon, G.; Barnola, J. M.; Raynaud, D.; Lorius, C.; Jouzel, J.; Barkov, N. I.; Korotkevich, Y. S.; Kotlyakov, V. M. (1987). "Vostok ice core: climatic response to CO2 and orbital forcing changes over the last climatic cycle". Nature. 329 (6138): 414. Bibcode:1987Natur.329..414G. doi:10.1038/329414a0.
- "Carbon Dioxide through Geologic Time". Geoscience Research Division at Scripps Institution of Oceanography. مؤرشف من الأصل في 06 أكتوبر 201821 ديسمبر 2013.
- "Climate and CO2 in the Atmosphere". مؤرشف من الأصل في 06 أكتوبر 201810 أكتوبر 2007.
- Berner, Robert A.; Kothavala, Zavareth (2001). "GEOCARB III: A revised model of atmospheric CO2 over Phanerozoic Time" ( كتاب إلكتروني PDF ). American Journal of Science. 301 (2): 182–204. doi:10.2475/ajs.301.2.182. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 18 ديسمبر 201915 فبراير 2008.
- U. Siegenthaler: Stable Carbon Cycle-Climate Relationship During the Late Pleistocene. In: Science. 310, 2005, S. 1313–1317, doi:10.1126/science.1120130.
- Sigurdsson, Haraldur; Houghton, B. F. (2000). Encyclopedia of volcanoes. San Diego: Academic Press. .
- "Volcanic Gases and Climate Change Overview". US Geological Survey. مؤرشف من الأصل في 21 يناير 201626 فبراير 2013.
- van Gardingen, P.R.; Grace, J.; Jeffree, C.E.; Byari, S.H.; Miglietta, F.; Raschi, A.; Bettarini, I. (1997). "Long-term effects of enhanced CO2 concentrations on leaf gas exchange: research opportunities using CO2 springs". In Raschi, A.; Miglietta, F.; Tognetti, R.; van Gardingen, P.R. (Eds.) (المحرر). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. صفحات 69–86. .
- "After two large annual gains, rate of atmospheric CO2 increase returns to average". NOAA News Online, Story 2412. 2005-03-31. مؤرشف من الأصل في 23 يونيو 2018.
- J. G. Canadell, C. Le Quere, M. R. Raupach, C. B. Field, E. T. Buitenhuis, P. Ciais, T. J. Conway, N. P. Gillett, R. A. Houghton, G. Marland: Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks. In: Proceedings of the National Academy of Sciences. 104, 2007, S. 18866–18870, doi:10.1073/pnas.0702737104.
- Navdeep Kaur Dhami; Sudhakara M. Reddy; Abhijit Mukherjee. "Biofilm and Microbial Applications in Biomineralized Concrete". صفحة 142. مؤرشف من الأصل في 06 نوفمبر 2018.
- "Iain Colin Prentice et al.: The Carbon Cycle and Atmospheric Carbon Dioxide. In: IPCC Third Assessment Report. 2001, S. 185". مؤرشف من الأصل في 17 مايو 201621 ديسمبر 2013.
- "GRID-Arendal: Vital Climate Graphics: The present carbon cycle". Grid Arendal. مؤرشف من الأصل في 06 أكتوبر 201621 ديسمبر 2013.
- A. P. Ballantyne, C. B. Alden, J. B. Miller, P. P. Tans, J. W. C. White: Increase in observed net carbon dioxide uptake by land and oceans during the past 50 years. In: Nature. 488, 2012, S. 70–72, doi:10.1038/nature11299.
- S. A. Montzka, E. J. Dlugokencky, J. H. Butler: Non-CO2 greenhouse gases and climate change. In: Nature. 476, 2011, S. 43–50, doi:10.1038/nature10322.
- Jenkins, Amber. "Global Climate Change". Randal Jackson. مؤرشف من الأصل في 20 مايو 201905 أكتوبر 2013.
- Gerald A. Meehl, Warren M. Washington, Caspar M. Ammann, Julie M. Arblaster, T. M. L. Wigley, Claudia Tebaldi: Combinations of Natural and Anthropogenic Forcings in Twentieth-Century Climate. In: Journal of Climate. 17, 2004, S. 3721–3727, doi:10.1175/1520-0442(2004)017<3721:CONAAF>2.0.CO;2.
- James Hansen, Makiko Sato, Reto Ruedy, Larissa Nazarenko, Andrew Lacis, Gavin Schmidt, Gary Russell et al.: Efficacy of climate forcings. In: Journal of Geophysical Research. Vol. 110, Issue D18, 27. September 2005, doi:10.1029/2005JD005776.
- Climate Change Indicators in the United States. EPA.gov نسخة محفوظة 11 مايو 2012 على موقع واي باك مشين.
- أيمن الشحاذة العودة. تأثير ارتفاع تركيز غاز ثاني اكسيد الكربون في ظاهرة الاحتباس الحراري. عالم الزراعة. العدد الخامس. نيسان 2006
- Oppenheimer, M., et al., Section 19.7.1: Relationship between Adaptation Efforts, Mitigation Efforts, and Residual Impacts, in: Chapter 19: Emergent risks and key vulnerabilities (archived July 8 2014), pp.46-49, in IPCC AR5 WG2 A 2014 - تصفح: نسخة محفوظة 07 يونيو 2016 على موقع واي باك مشين.
- Zhenhao Duan, Rui Sun: An improved model calculating CO2 solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar. In: Chemical Geology. 193, 2003, S. 257–271, doi:10.1016/S0009-2541(02)00263-2.
- "How Long Can the Ocean Slow Global Warming?". Naomi M. Levine, Scott C. Doney. مؤرشف من الأصل في 27 ديسمبر 201829 نوفمبر 2006.
- Cai, W. -J.; Chen, L.; Chen, B.; Gao, Z.; Lee, S. H.; Chen, J.; Pierrot, D.; Sullivan, K.; et al. (2010). "Decrease in the CO2 Uptake Capacity in an Ice-Free Arctic Ocean Basin". Science. 329 (5991): 556–559. Bibcode:2010Sci...329..556C. doi:10.1126/science.1189338. PMID 20651119.
- Tom Garrison: Oceanography: an invitation to marine science, 2005, Verlag Thomson Brooks/Cole, Belmont, CA, , S. 505.
- J. B. Ries, A. L. Cohen, D. C. McCorkle: Marine calcifiers exhibit mixed responses to CO2-induced ocean acidification. In: Geology. 37, 2009, S. 1131–1134, doi:10.1130/G30210A.1.
- Martini, M. (1997). "CO2 emissions in volcanic areas: case histories and hazards". In Raschi, A.; Miglietta, F.; Tognetti, R.; van Gardingen, P.R. (Eds.) (المحرر). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. صفحات 69–86. .
- "The Atmosphere of Venus". Department of Physics and Astronomy Georgie State University. مؤرشف من الأصل في 07 مارس 201922 مارس 2010.
- "Kohlendioxid (fast) pur … Atmosphäre und Klima des Roten Planeten". Scinexx, das Wissensmagazin. مؤرشف من الأصل في 19 يونيو 201820 ديسمبر 2003. (بالألمانية)
- E. Lellouch, B. Bezard, J.I. Moses, G.R. Davis, P. Drossart, H. Feuchtgruber, E.A. Bergin, R. Moreno, T. Encrenaz: The Origin of Water Vapor and Carbon Dioxide in Jupiter's Stratosphere. In: Icarus. 159, 2002, S. 112–131, doi:10.1006/icar.2002.6929.
- Dale P. Cruikshank, Allan W. Meyer, Robert H. Brown, Roger N. Clark, Ralf Jaumann, Katrin Stephan, Charles A. Hibbitts, Scott A. Sandford, Rachel M.E. Mastrapa, Gianrico Filacchione, Cristina M. Dalle Ore, Philip D. Nicholson, Bonnie J. Buratti, Thomas B. McCord, Robert M. Nelson, J. Brad Dalton, Kevin H. Baines, Dennis L. Matson: Carbon dioxide on the satellites of Saturn: Results from the Cassini VIMS investigation and revisions to the VIMS wavelength scale. In: Icarus. 206, 2010, S. 561–572, doi:10.1016/j.icarus.2009.07.012.
- "Hubble finds carbon dioxide on an extrasolar planet". Inoovations-Report, Forum für Wissenschaft, Industrie und Wirtschaft. مؤرشف من الأصل في 24 ديسمبر 201310 ديسمبر 2008.
- L.B. d'Hendecourt, M. Jourdain de Muizon: The discovery of interstellar carbon dioxide. In: Astronomy and Astrophysics, 223 (1989), S. L5–L8 (النص). نسخة محفوظة 09 ديسمبر 2015 على موقع واي باك مشين.
- "Interstellar Chemistry". Department of Physics, Ohio State University. مؤرشف من الأصل في 24 يوليو 201421 ديسمبر 2013.
- D. Talbi, E. Herbst: The gas-phase destruction of interstellar carbon dioxide: Calculations on the reactions between CO2 and H2 and between CO2 and H. In: Astronomy and Astrophysics. 386, 2002, S. 1139–1142, doi:10.1051/0004-6361:20020312.
- "Verwertung und Speicherung von CO2" ( كتاب إلكتروني PDF ). Verband der Chemischen Industrie. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 15 مارس 201622 مارس 2010. (بالألمانية)
- o.A.: Schülerduden Chemie, Bibliografisches Institut & F.A. Brockhaus AG, Mannheim 2007, , S. 195.
- Susan Topham "Carbon Dioxide" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a05_165
- H. Kolbe: Antiseptische Eigenschaften der Kohlensäure. In: Journal für Praktische Chemie. 26, 1882, S. 249–255, doi:10.1002/prac.18820260116.
- Roland Benedix: Bauchemie. Vieweg+Teubner Verlag, , S. 113 (بالألمانية) .
- "Phase change data for Carbon dioxide". National Institute of Standards and Technology. مؤرشف من الأصل في 12 فبراير 201921 يناير 2008.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der anorganischen Chemie. 101. Auflage, deGruyter, 1995, , S. 860 (بالألمانية) .
- A. Simon und K. Peters: Single-crystal refinement of the structure of carbon dioxide. In: Acta Crystallographica Section B. 1980, B36, S. 2750–2751, doi:10.1107/S0567740880009879.
- Frank Wisotzky:Angewandte Grundwasserchemie, Hydrogeologie und hydrogeochemische Modellierung: Grundlagen, Anwendungen und Problemlösungen, 2011, Springer Verlag, , S. 65(بالألمانية)
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. .
- Introduction to Molecular Vibrations and Infrared Spectroscopy - تصفح: نسخة محفوظة 13 ديسمبر 2016 على موقع واي باك مشين.
- Hans-Dieter Barke: Chemiedidaktik heute. Springer-Verlag, Berlin 2001, , S. 30 (بالألمانية) .
- M. Aresta (Ed.) "Carbon Dioxide as a Chemical Feedstock" 2010, Wiley-VCH: Weinheim.
- Finn, Colin; Schnittger, Sorcha; Yellowlees, Lesley J.; Love, Jason B. (2012). "Molecular approaches to the electrochemical reduction of carbon dioxide". Chemical Communications. 2011 (10): 0000. doi:10.1039/c1cc15393e.
- Dhingra A, Portis AR, Daniell H (2004). "Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants". Proc. Natl. Acad. Sci. U.S.A. 101 (16): 6315–20. Bibcode:2004PNAS..101.6315D. doi:10.1073/pnas.0400981101. PMC . PMID 15067115.
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast;
- Blom, T.J.; W.A. Straver; F.J. Ingratta; Shalin Khosla; Wayne Brown (December 2002). "Carbon Dioxide In Greenhouses". مؤرشف من الأصل في 29 أبريل 201912 يونيو 2007.
- Ainsworth, Elizabeth A. (2008). "Rice production in a changing climate: a meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration" ( كتاب إلكتروني PDF ). Global Change Biology. 14 (7): 1642. doi:10.1111/j.1365-2486.2008.01594.x. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 19 يوليو 2011.
- Long, SP; Ainsworth, EA; Leakey, AD; Nösberger, J; Ort, DR (2006). "Food for thought: lower-than-expected crop yield stimulation with rising CO2 concentrations". Science. 312 (5782): 1918–21. Bibcode:2006Sci...312.1918L. doi:10.1126/science.1114722. PMID 16809532.
- F. Woodward and C. Kelly (1995). "The influence of CO2 concentration on stomatal density". New Phytologist. 131 (3): 311–327. doi:10.1111/j.1469-8137.1995.tb03067.x.
- Bert G. Drake; Gonzalez-Meler, Miquel A.; Long, Steve P. (1997). "More efficient plants: A consequence of rising atmospheric CO2?". Annual Review of Plant Physiology and Plant Molecular Biology. 48 (1): 609–639. doi:10.1146/annurev.arplant.48.1.609. PMID 15012276.
- Loladze, I (2002). "Rising atmospheric CO2 and human nutrition: toward globally imbalanced plant stoichiometry?". Trends in Ecology & Evolution. 17 (10): 457. doi:10.1016/S0169-5347(02)02587-9.
- Carlos E. Coviella and John T. Trumble (1999). "Effects of Elevated Atmospheric Carbon Dioxide on Insect-Plant Interactions". Conservation Biology. 13 (4): 700. doi:10.1046/j.1523-1739.1999.98267.x. JSTOR 2641685.
- Davey, M. P.; Harmens, H.; Ashenden, T. W.; Edwards, R.; Baxter, R. (2007). "Species-specific effects of elevated CO2 on resource allocation in Plantago maritima and Armeria maritima". Biochemical Systematics and Ecology. 35 (3): 121. doi:10.1016/j.bse.2006.09.004.
- Davey, M.; Bryant, D. N.; Cummins, I.; Ashenden, T. W.; Gates, P.; Baxter, R.; Edwards, R. (2004). "Effects of elevated CO2 on the vasculature and phenolic secondary metabolism of Plantago maritima". Phytochemistry. 65 (15): 2197–2204. doi:10.1016/j.phytochem.2004.06.016. PMID 15587703.
- "Global Environment Division Greenhouse Gas Assessment Handbook – A Practical Guidance Document for the Assessment of Project-level Greenhouse Gas Emissions". World Bank. مؤرشف من الأصل في 03 يونيو 201610 نوفمبر 2007.
- Luyssaert, Sebastiaan; Schulze, E. -Detlef; Börner, Annett; Knohl, Alexander; Hessenmöller, Dominik; Law, Beverly E.; Ciais, Philippe; Grace, John (2008). "Old-growth forests as global carbon sinks". Nature. 455 (7210): 213–5. Bibcode:2008Natur.455..213L. doi:10.1038/nature07276. PMID 18784722.
- Falkowski P, Scholes RJ, Boyle E, Canadell J, Canfield D, Elser J, Gruber N, Hibbard K, Högberg P, Linder S, Mackenzie FT, Moore B 3rd, Pedersen T, Rosenthal Y, Seitzinger S, Smetacek V, Steffen W. (2000). "The global carbon cycle: a test of our knowledge of earth as a system". Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. PMID 11030643.
- "How much carbon dioxide do humans contribute through breathing?". مؤرشف من الأصل في 02 فبراير 201130 أبريل 2009.
- Charles Henrickson (2005). Chemistry. Cliffs Notes. .
- Derived from mmHg values using 0.133322 kPa/mmHg
- Normal Reference Range Table. University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease. نسخة محفوظة 1 يونيو 2017 على موقع واي باك مشين.
- G. Hochgesand: Anwendung von Absorptionsverfahren für die CO2-Entfernung aus Natur- und Synthesegasen. In: Chemie Ingenieur Technik – CIT. 40, 1968, S. 432–440, doi:10.1002/cite.330400904.(بالألمانية)
- Birgit Kessler, Jörg Von Eysmondt, Heinrich Merten: Nutzung von CO2 aus Rauchgasen für chemische Synthesen. In: Chemie Ingenieur Technik. 64, 1992, S. 1075–1083, doi:10.1002/cite.330641207.(بالألمانية)
- A. Behr, P. Ebbinghaus, F. Naendrup: Verfahrenskonzepte für die Übergangsmetallkatalysierten Synthesen von Ameisensäure und Dimethylformamid auf der Basis von Kohlendioxid. In: Chemie Ingenieur Technik. 75, 2003, S. 877–883, doi:10.1002/cite.200303221(بالألمانية) .
- H. Kolbe: Ueber Synthese der Salicylsäure. In: Liebigs Ann., 113 (1860), S. 125–127, doi:10.1002/jlac.18601130120.(بالألمانية)
- UK Food Standards Agency: "Current EU approved additives and their E Numbers". مؤرشف من الأصل في 07 فبراير 201227 أكتوبر 2011.
- US Food and Drug Administration: "Food Additive Status List". مؤرشف من الأصل في 23 أبريل 201911 ديسمبر 2014.
- Australia New Zealand Food Standards Code"Standard 1.2.4 – Labelling of ingredients". مؤرشف من الأصل في 28 يونيو 201527 أكتوبر 2011.
- Hugh Johnson, Steven Brook: Der große Johnson. Die Enzyklopädie der Weine, Weinbaugebiete und Weinerzeuger der Welt, Verlag Gräfe und Unzer GmbH, 2009, , S. 135.
- A. Keith Thompson: Fruit and Vegetables Harvesting, Handling and Storage, Blackwell Publishing, Oxford 2003, , S. 61–70.
- Anne Emblem: Predicting packaging characteristics to improve shelf-life. In: David Kilcast und Persis Subramaniam (Hrg.): The stability and shelf-life of food, 2000, Woodhead Publishing, Cambridge (UK), , S. 145–169.
- Joseph P. Kerry (Hrg.): Advances in meat, poultry and seafood packaging, 2012, Woodhead Publishing, Cambridge (UK), .
- Emden, Lorenzo. "Decaffeination 101: Four Ways to Decaffeinate Coffee". Coffee Confidential. مؤرشف من الأصل في 25 سبتمبر 201829 أكتوبر 2014.
- Plant Growth Factors: Photosynthesis, Respiration, and Transpiration. Ext.colostate.edu. Retrieved on 2011-10-10. نسخة محفوظة 20 مايو 2016 على موقع واي باك مشين.
- Carbon dioxide. Formal.stanford.edu. Retrieved on 2011-10-10. نسخة محفوظة 04 يونيو 2016 على موقع واي باك مشين.
- Stafford, Ned (7 February 2007). "Future crops: The other greenhouse effect". Nature. 448 (7153): 526–8. Bibcode:2007Natur.448..526S. doi:10.1038/448526a. PMID 17671477.
- Clayton, Mark (2006-01-11). "Algae – like a breath mint for smokestacks". Christian Science Monitor. مؤرشف من الأصل في 02 أبريل 201911 أكتوبر 2007.
- "Kohlendioxid – Besonderheiten und Einsatzchancen als Kältemittel". Klima- und Kältetechnischer Verein جمعية تقنيي التبريد والتكييف الألمان. مؤرشف من الأصل في 07 مارس 201622 مارس 2010. (بالألمانية)
- "Natürliches Kältemittel für Pkw-Klimaanlagen". Umweltbundesamt وزارة البيئة الألمانية. مؤرشف من الأصل في 29 يونيو 201309 يونيو 2008. (بالألمانية)
- "Carbon Dioxide as a Fire Suppressant: Examining the Risks". Environmental Protection Agency. مؤرشف من الأصل في 28 سبتمبر 201519 أغسطس 2010.
- "CO2 for use in enhanced oil recovery (EOR)". Global CCS Institute. مؤرشف من الأصل في 01 يناير 201425 فبراير 2012.
- Austell, J Michael (2005). "CO2 for Enhanced Oil Recovery Needs – Enhanced Fiscal Incentives". Exploration & Production: the Oil & Gas Review. مؤرشف من الأصل في 07 فبراير 201228 سبتمبر 2007.
- "Enhanced coal bed methane recovery". ETH Zurich. 2006-08-31. مؤرشف من الأصل في 29 نوفمبر 2014.
- Shota Atsum; Wendy Higashide; James C Liauo (November 2009). "Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde". Nature Biotechnology. 27 (12): 1177–1180. doi:10.1038/nbt.1586. PMID 19915552. مؤرشف من الأصل في 29 مايو 2017.
- Douglas A. Skoog, James J. Leary, S. Hoffstetter-Kuhn: Instrumentelle Analytik: Grundlagen – Geräte – Anwendungen. Springer-Verlag, , S. 285 (بالألمانية) .
- "Metall-Aktivgasschweißen (MAG/135)" ( كتاب إلكتروني PDF ). Deutscher Verband für Schweißen und verwandte Verfahren. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 05 أبريل 201622 مارس 2010.
- "2013 AVMA Guidelines for the Euthanasia of Animals" ( كتاب إلكتروني PDF ). مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 28 أبريل 201914 يناير 2014.
- Lindsay G. Ross und Barbara Ross (Hrg.): Anaesthetic and Sedative Techniques for Aquatic Animals. Third Edition, 2008, Blackwell Publishing, Oxford, , Kap. 9: Anaesthesia of Fish: II. Inhalation Anaesthesia Using Gases, S. 127–135.
- Mark Krieg: Trockeneisstrahlen – mit Schnee oder mit Pellets? In: JOT Journal für Oberflächentechnik, 45.6 (2005): S. 50–55.
- N. Dahmen, P. Griesheimer, A. Hebach: Reinigung und Oberflächenbehandlung mit komprimiertem Kohlendioxid. In: Galvanotechnik, 98 (2007) S. 1111–1120.
- Toxicity of Carbon Dioxide Gas Exposure, CO2 Poisoning Symptoms, Carbon Dioxide Exposure Limits, and Links to Toxic Gas Testing Procedures By Daniel Friedman – InspectAPedia نسخة محفوظة 28 سبتمبر 2009 على موقع واي باك مشين.
- "Carbon Dioxide as a Fire Suppressant: Examining the Risks". U.S. Environmental Protection Agency:. مؤرشف من الأصل في 28 سبتمبر 2015.
- Volcano Under the City. PBS.org (1 November 2005). نسخة محفوظة 21 يونيو 2017 على موقع واي باك مشين.
- Bierwirth P., (2014). "How will rising carbon dioxide in the atmosphere directly affect human health via breathing toxicity? A Science Review" ( كتاب إلكتروني PDF ). مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 27 أبريل 2019.
- "Exposure Limits for Carbon Dioxide Gas - CO2 Limits". www.InspectAPedia.com. مؤرشف من الأصل في 16 سبتمبر 2018.
- Law J., Watkins S., Alexander, D. (2010). "In-Flight Carbon Dioxide Exposures and Related Symptoms: Associations, Susceptibility and Operational Implications" ( كتاب إلكتروني PDF ). NASA Technical Report. TP–2010–216126. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 30 أبريل 201926 أغسطس 2014.
- Schaefer K. E. (1979). "Effect of Prolonged Exposure to 0.5% CO2 on Kidney Calcification and Ultrastructure of Lungs". Undersea Biomed Res. S6: 155–11719 أكتوبر 2014.
- Satish U., Mendell M. J., Shekhar K., Hotchi T., Sullivan D., Streufert S., Fisk W.J. (2012). "Is CO2 an Indoor Pollutant? Direct Effects of Low-to-Moderate CO2 Concentrations on Human Decision-Making Performance" ( كتاب إلكتروني PDF ). Environmental Health Perspectives. 120 (12). مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 6 يوليو 201726 أغسطس 2014.
وصلات خارجية
- ثنائي اكسيد الكربون على موقع chemcalc
- CID 280 من بوبكيم
- Carbon dioxide MSDS by Amerigas in the SDSdata.org database.
- CDC – NIOSH Pocket Guide to Chemical Hazards – Carbon Dioxide
- CO2 Carbon Dioxide Properties, Uses, Applications
- Dry Ice information
- Trends in Atmospheric Carbon Dioxide (NOAA)
- "A War Gas That Saves Lives." Popular Science, June 1942, pp. 53–57.
- NASA's Orbiting Carbon Observatory
- The on-line catalogue of CO2 natural emissions in Italy
- Reactions, Thermochemistry, Uses, and Function of Carbon Dioxide
- Carbon Dioxide – Part One and Carbon Dioxide – Part Two at The Periodic Table of Videos (University of Nottingham)












![K_{{{\mathrm h}}}={\frac {{\rm {{[H_{2}CO_{3}]}}}}{{\rm {{[CO_{2}(aq)]}}}}}=1.70\times 10^{{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/880be9280cefa51b14dc80f037e4296c81a15e6b)