السربين هي مجموعة من البروتينات ذات الهياكل المتماثلة والتي تم تحديدها أولا أنها مجموعة من البروتينات القادرة على تثبيط البروتياز (البيتيداز)، وقد اُبتكرت ترخيمة السربين لأن العديد من السربينات تثبط الكيموتربسين (أنزيم بيتيدي بنكرياسي) مثل سيرين البورتياز (مثبطات سيرين البورتياز).[1][2][3]
| سربين (مثبط سيرين بروتياز) Serpin (serine protease inhibitor) | |||||
|---|---|---|---|---|---|

| |||||
| سربين (باللون الأبيض) مع 'حلقة المركز التفاعلية' (باللون الأزرق) التي ترتبط بالبروتياز (باللون الرمادي). (ببب: 1K9O) | |||||
| معرف | |||||
| رمز | Serpin, SERPIN (root symbol of family) | ||||
| قاعدة بيانات عوائل البروتينات | PF00079 | ||||
| إنتربرو | IPR000215 | ||||
| بروسايت | PDOC00256 | ||||
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1hle | ||||
| |||||

كانت أول أفراد فصيلة السربين تدرس بشكل واسع هي: بروتينات البلازما البشرية أنتي ثرومبين وأنتي تريبسين، واللتان تلعبان دورا رئيسيا في السيطرة على تخثر الدم والالتهابات على التوالي (مثال: الشكل 1). في البداية، ركزت البحوث على دورهما في مرض الإنسان، حيث ينتج عن نقص بروتين أنتي ثرومبين حدوث خثار ويسبب نقص بروتين أنتي تريبسين النفاخ الرئوي. وقدم هانت وديهوف اكتشافا مذهلا في عام 1980 حيث أن كلا من هذه الجزيئات تمتلك سلسلة هامة من الأحماض الأمينية تشابه تلك الموجودة في البروتين الرئيس في بياض بيض الدجاج وفي الزلال، واقترحا فصيلة بروتين جديدة.[4] وتم تحديد أكثر من 1000 سيربين الآن، تتضمن هذه السربينات على 36 بروتينات بشرية، وكذلك الجزيئات الموجودة في النباتات والفطريات والبكتيريا والبَدْئِيَات وبعض الفيروسات.[5][5][6] ولذلك فإن السربينات هي أكبر وأكثر عائلة تنوعا لمثبطات البروتياز.[7]
في حين أن معظم السربين يتحكم بتحلل البروتين المتسلسل، هناك سربين معين لا يثبط الإنزيمات ولكن يقوم بوظائف متنوعة مثل التخزين (مثل تخزين ألبومين وهو البروتين الأساسي في البيض)، هرمون حامل بروتينات (بروتين القلوبيولين المرتبط بهرمون الثايروكسين أو الكورتيزول والماسبين (ورم الجينات القامع). مصطلح السربين يستخدم ليصف الأجزاء الأخيرة أيضًا على الرغم من عدم تثبيطهم.[8]
لأن السربين يتحكم في عمليات كالتجلط والالتهابات، هذه البروتينات هي هدف عمليات البحث الطبي. ومع ذلك، السيربين بحد ذاته محط اهتمام مجتمعات علم الأحياء التركيبي وعلم طي البروتين، لأنها تخضع لتغييرات فريدة ودراماتيكية في الشكل (أو التكوين) عندما يثبط عملية تكسير البروتين بالإنزيمات.[9] وهذه عملية غير اعتيادية، لأن وظيفة معظم مثبطات عمليات تكسير البروتين التقليدية بسيطة كنظرية " المفتاح والقفل " الجزيئات التي ترتبط ووتعيق دخول المناطق النشطة لتكسير البروتين (انظر، على سبيل المثال، مثبط انزيم بوفاين البنكرياسي لبروتين التريبسين). بينما آلية عمل السيربين كمثبط لعملية تكسير البروتين يضفي فوائد معينة، وأيضا لديه سلبيات، والسيربين معرض للطفرات الجينية والتي تكون نتيجة خطأ في عملية طي البروتين وتكوين سلسة طويلة من البلمرات الغير نشطة (سيربينوباثيز) .[10][11][12] بلمرة السيربين يختزل كمية المثبط النشط، إضافة إلى تراكم أو تكدس في بلمرة السيربين، مسببا موت الخلية أو فشل الأعضاء. على سبيل المثال: السيربين مضاد لبروتين التربسين يتصنع مبدئيا في الكبد، وبلمرة مضاد البروتين تسبب تليف الكبد.[12] فهم سيربينوباثيز، أيضا يزود لمحة أو رؤية للخطأ في طي البروتين عموما، عملية تسبب أمراضا لكثير من الناس، كالزهايمر ومرض كريوتزفيلدت- جاكوب .[11]
مثبطات الأنواع الأخرى

تستهدف معظم مثبطات السربين الكيموتربسين مثل: إنزيم سيرين البروتياز (انظر جدول 1 وشكل 2). وتحدد هذه الإنزيمات من خلال وجود بقايا سيرين أليف النواة في مقرها الحفّازي. وتتضمن الأمثلة على الثرومبين، التربسين، وإيلاستاز العدلة في الإنسان .[14]
تثبط بعض السربينات الأنواع الأخرى من البروتياز والتي تسمى بـ "مثبطات الأنواع الأخرى". وقد ثبت أن عدد من هذه السربينات تستهدف سيستين البروتياز و وتختلف هذه الإنزيمات عن سيرين البروتياز من ناحية أنه يتم تحديدها من خلال وجود بقايا السيستين أليف النواة، بدلا من بقايا السيرين في مقرها المحفز.[15] ومع ذلك، فإن كيمياء الأنزيمات متشابهة، ويثبط السربين على الأرجح كلا نوعي الإنزيم بطريقة مماثلة.[16]
من الأمثلة على بروتين السربين المضاد: مضاد سرطان الخلايا الحرشفيه 1 (SCCA-1)، سربين الوباء النخاعي والمحمر الخاصة بمرحلة معينه (MENT) جميعها مضادة لبروتين البابايين مثل: سستين البروتياز.[17][18][19]
السربين الفيروسي crmA يعمل كمانع للالتهابات من خلال منع IL-1 و IL-18 الذي تنتجه سيستين البروتيازكاسبيس.[20] في الكائنات حقيقة النواة يظهر السربين لمنع الميتا كاسبيس[21]، كما يظهر البابايين مثل سستين البروتياز.[22] وفي الوقت الحاضر لايمكننا معرفة ما إذا كان بروتين السربين لدى الثدييات يعمل كمضاد للكاسبيس في الجسم الحي أم لا.
تحديد المكان والوظيفة

ما يقارب من ثلثي السيربينات الموجودة في جسم الإنسان تقوم بوظائف خارج الخلية، مثل السيربينات المسؤولة عن تنظيم سلسلة عمليات التحلل البروتيني المهمة لعملية تخثر الدم (مضاد الثرومين)، الاستجابة المناعية للالتهابات (مضاد التربسين ومضاد الكيموتربسين ومثبط سي1)، تجديد الأنسجة (مثبط منشط البلازموجين PAI-1). كما أن السيربينات الغير مُثًبِطة تقوم بوظائف مهمة، حيث يقوم كل من الجلوبيولين الرابط للثايروكسين والجلوبيولين الرابط للكورتيزول بنقل هرموني الثايروكسين والكورتيزول على التوالي (الشكل 3)،[23][23] ويقوم إنزيم الرينين بشطر إنزيم الأنجيوتنسينوجين مولداً هرمون الأنجيوتنسين-1 المكون من ببتيد ذو نهاية أمينية N-terminal تحتوي على 10 أحماض أمينية.[24] يوضح الجدول رقم 1 نبذة مختصره عن وظائف السيربينات في جسم الإنسان وبعض الأمراض.
تم التعرف وتحديد الإنزيمات التي تنتمي إلى فصيلة السيربينات داخل الخلايا خلال بدايات التسعينات الميلادية.[25][26] جميع السيربينات التسعة في دودة الربداء الرشيقة تفتقد سلسلة الأحماض الأمينية المؤشرة لذلك فهي الغالب تكون داخل الخلايا.[27] وبناءً على هذه المعطيات يبدو من المرجح أن السيربينات البشرية نتجت عن أسلافها التي كانت داخل الخلايا أيضاً.
كان من الصعب تحديد الأهداف البروتينية للسيربينات داخل الخلايا المثبطة. ومما زاد الأمر تعقيداً ملاحظة أن العديد من هذه الجزيئات تقوم بوظائف متداخلة، أيضاً العديد من السيربينات البشرية تفتقد لأشباه مطابقة لها في الكائنات المخبرية مثل الفئران. واحدة من الوظائف الهامة جداً للسيربينات داخل الخلايا هي حماية الخلية من الأنشطة العشوائية لإنزيم البروتياز.[28] مثال على ذلك سيربين 9 الموجود في جسم الإنسان، حيث يقوم بتثبيط الجرانزيم ب (بروتياز) الموجود داخل الحبيبات في الخلايا السامة وبذلك يحمي الخلية من الإطلاق غير المتعمد للجرانزيم ب أو تفعيل عملية موت الخلية المبرمج بشكل غير مقصود أو مبكر.[29]
تقوم بروتينات سيربين الخلوية بأدوار تختلف عن تثبيط البروتياز، على سبيل المثال يعد بروتين ماسبين من بروتينات سيرين غير المثبطة ومهم للوقاية من الأورام الخبيثة لسرطان الثدي وسرطان البروستات، ومثال آخر أيضاً أحماض السيئستين النووية المثبطة للبروتياز في الطيور والتي تعمل بمثابة الكروماتين الذي يقوم بإعادة بناء جزيئات خلايا الدم الحمراء للطيور.[18][30]
وتشير دراسات تطور السلالات إلى أن معظم بروتينات السيربين الخلوية تنتمي إلى كليد أحادي، وتشمل الإستثناءات بروتين السيربين غير المثبط للصدمة الحرارية، والذي يعد بروتيناً ضرورياً للقيام بطي مناسب للكولاجين وللقيام بدورات بين جهاز جولجي والشبكة الإندوبلازمية.[31]
البِـنْـيَـة
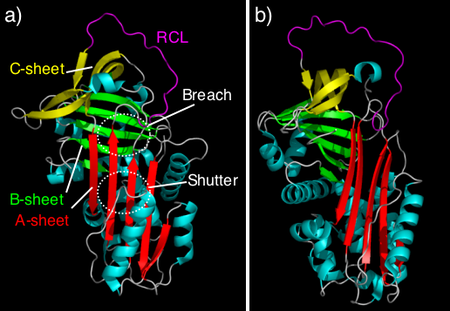
كان للبنيةِ الحيويةِ دورٌ محوريّ في فهم حيوية بروتينات السِربين وطريقة عملها، وقد اكتُشفت حتى اليوم أكثر من ثمانين بنية سربينية بعدّة تشكيلات متعددة (مشروحة في الأسفل). ومع أن طريقة عمل السربينات تتنوع بشكل كبير إلا أن كل هذه الجزيئات لها نفس البنية (أو الطيّة).
لقد كشفت بنية السربينات غير المثبطة وبنية المثبطات السربينية "مضاد التريبسين" عن البنية الأصلية لِطيّة السربينات[33][34]، التي تحوي جميعها غالبًا ثلاث بنىً بروتينية "شرائح بروتينية" (تسمى أ، ب، ج)، وثمانية أو تسعة حلزّ ألفا (راجع الشكل 4). كما تمتلك السربينات منطقة مكشوفة تسمى الحلقة المركزية التفاعلية، التي تتضمن المحددات في المنطقة المعنيّة داخل المثبطات الجزيئية والتي تُكوّن رد الفعل المبدئي مع الإنزيم البروتيني المستهدف. وتوجد الحلقة المركزية التفاعلية في مضاد التريبسين في الجزء العلوي من الجزيء وليست مضافة داخل الشرائح البروتينية من قبل (يسار الشكل 4). تكون هذه التشكيلة عادةً موجودة في التوازن الحيوي مع القليل من تشكيلة البنية الأصلية[35] والمشاهدة في مثبطات سربينية أخرى (يمين الشكل 4).
التغيير الجزئي وآلية التثبيط
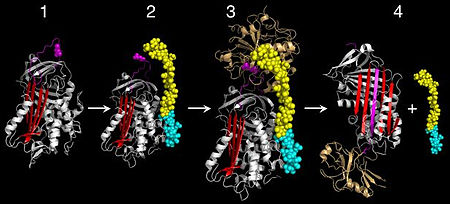
كشفت الدراسات المبكرة عن مثبطات الإنزيم البروتيني سيرين أن الآلية التي تمنع جزيئات هذا الإنزيم من الظهور بشكل مختلف عما يعرف بآلية القفل والمفتاح والتي تستخدمها مثبطات الإنزيم البروتيني صغيرة مثل مثبطات من نوع كيونتز مثل مثبط التربسين الأساسي في البنكرياس. مثبطات الأنزيم البروتيني سيرين شكلت مجموعات مع الإنزيمات البروتينية المستهدفة.[36] الدراسات الهيكلية على مثبطات الإنزيم البروتيني سيرين كشفت أن أعضاء الأسرة المثبطة تخضع لتغيير غير عادي، وتم وصفه ب (التحول من الضغط إلى الاسترخاء) (S إلى R) وهي مرحلة انتقالية.[33][35][37][38] وخلال هذا التحول الهيكلي في أر سي إل يدرج في ورقة (باللون الأحمر كما هو موضح في الشكل 4 و5) بالإضافة إلى (الرابع) الذي تم الاستغناء عنه. التغيير المرتبط بتكوين مثبطات الأنزيم البروتيني سيرين هو المفتاح لآلية تثبيط الإنزيمات البروتينية المستهدفة.
عندما تهاجم أنزيمات السيرين بروتياز (أنزيم يقوم بهدم البروتينات) الركائز فإنها تحفز انقسام الرابطة الببتيدية في عملية من خطوتين، الأولى يقوم السيرين المحفز بمهاجمة الرابطة الببتيدية للركيزة (الشكل 5) مما يطلق النهاية الأمينية الجديدة NH2 (N-terminus) ويشكل رابطة إستر بين الإنزيم والركيزة. يُطلَق اسم "إنزيم اسيل الوسيط" على هذا المركب الوسيط المكون من الإنزيم مع الركيزة المشتركان برابطة تساهمية. بعد ذلك تتحل رابطة الإستر بعملية حلمأة فتنطلق النهاية الأمينية الجديدة سي تيرمينوس (C-terminus). تعمل الحلقة المركزية التفاعلية للسيربن كركيزة للبروتياز المصاحب لها، وعندما تنقسم - ولكن قبل تحلل مركب انزيم اسيل الوسيط - تتحول بسرعة من الشكل S إلى R. بما أن الحلقة المركزية التفاعلية للسيربن لا تزال مرتبطة بالبروتياز بشكل تساهمي من خلال رابطة الإستر فإن التحول التشكيلي لجزيء للسيربن من Sالى R يتسبب في حركة البروتياز من أعلى إلى أسفل السيربن، ويصاحب هذه الحركة حدوث تشوه في تشكيل جزء البروتياز، بينما يتحلل أنزيم أسيل الوسيط ببطء شديد وبهذا تحدث عملية التثبيط.[9] بما أنه لابد لجزء السيربن أن ينقسم ليقوم بتثبيط البروتياز المستهدف فإن عملية التثبيط تستهلك السيربن كذلك، ولذلك تعتبر السيربينات مثبطات أنزيمية غير عكوسية. آلية تثبيط السيربن موضحة في الأشكال 5 و6. يمكن مشاعدة بعض الأفلام حول ميكانيكية السربين على هذا الرابط.

تحويرات التركيب لنشاط السربينات
توفر حركة التركيب للسربينات فائدة أساسية لنظام الغلق الثابت لمثبطات البروتيز، وعلى وجه الخصوص يمكن السيطرة على وظيفة السربينات المثبطة بسهولة بواسطة عوامل مساعدة محددة. كما يُظهِر التركيب البلوري للأنتي ثرومبين، الهيبارين العامل المساعد الثاني، والإم إي إن تي وأنتيكيموتريبسينات الفأرية أن هذه السربينات تتركب بأي طريقة في الحمضين الأمينين الأولين للآر سي إل الموجودان في الجزء العلوي من التركيب الثانوي أ وب للبروتين (انظر الشكلين 4 و7). والتركيب الموجود جزئيًا مهم؛ لأن العوامل المشتركة قادرة على تحويل تركيب نوع محدد من السربينات الموجودة جزئيًا إلى أشكال منفصلة بالكامل.[39][40] أيضًا إعادة ترتيب تركيب هذه السربينات تجعلها مثبطات أكثر فعالية. مثال النموذج الأصلي لهذه الحالة هو مضاد الثرومبين الذي ينتشر في البلازما في حالة غير نشطة نسبيًا مندمجة جزئيًا. ويشير التأثير الأولي المحدد للبقايا (أرجينين بي 1) نحو جسم السربين وهو غير متاح في إنزيم البروتيز (شكل 7). إضافة لتقييد سلسلة بنتاساكرايد هيبارين عالي التقارب ضمن سلسلة طويلة من الهيبارين يخضع مضاد التثرومبين بتغير متعلق بالتكوين وإخراج آر سي إل وتعرض لأرجينين بي 1. وبالتالي فإن الهيبارين مقيد البنتاساكرايد مانع أكثر فعالية للثرومبين وعامل عشرة آي (شكل 7).[41][42] إضافة لذلك يحتوي كلا إنزيمي بروتيز تجلط الدم على مراكز ربط للهيبارين تسمى إكسوسايتز (مراكز ربط ثانوية). ويعمل الهيبارين من ثم كقالب لربط كلًا من البروتيز والسربين مسرّعًا بشكل كبير من التفاعل بين الاثنين (شكل 7). وبعد التفاعل الأولي يتكون مركب السربين الأخير وتتحرر جزيئات الهيبارين. وهذا التفاعل مهم من الناحية الفسيولوجية، فعلى سبيل المثال بعد إصابة جدار الأوعية الدموية يكتشف الهيبارين وينشط مضاد الثرومبين للتحكم باستجابة التخثر. كما يشكل إدراك الأساس الجزيئي لهذا التفاعل الأساس لتطوير فوندابارينكس وهو هيئة اصطناعية لهيبارين بنتاساكرايد يستخدم كدواء مضاد للتخثر.[43]
تقوم بعض السربينات إلى الانتقال من S إلى R كجزء من عملها لتكوين مركب يصطلح عليه ب"الحالة الكامنة " (الصورة 8). في السربينات الفرع الأول من ورقة سي (C-sheet) يجب أن تنتزع للسماح الكامل بإدراج ال RCL. السربينات الكامنة غير قادر على التفاعل مع البروتياز ولا مثبطات البروتياز الانتقال إلى الكمون يمثل آلية مراقبة لالسربين PAI-1. يتم تحرير PAI-1 في التشكيلة المثبطة ومع ذلك، يخضع تغيير متعلق بتكوين جزئي إلى حالة كامنة ما لم ينضم إلي بال فايرونكتين (نوع من أنواع البروتين السكري) كمساعد.[44] بذلك يحتوي ال- PAI-1 على آلية تثبيط تلقائي وبالمثل، يستطيع أيضا مضاد الثرومبين بصورة تلقائية التحويل إلى حالة كامنة كجزيء من وظيفته العادية. أخيراً نهاية الطرف N لبروتين التنجبين (tengpin) (راجع 2PEE و2PEF) وهو سيربين مُشتق من نوع من البكتيريا اللاهوائية تُسمى الثيرمونا أيروباكتير تينقكوجينيسيس مهمته لتحفظ الجزئ في في حالته المُضبطة الأصلية. لذافإن أي إخلال للتفاعل الذي يَتم بواسطة طَرف N يَنتُج عنه تَغيرات مُفاجئة على السِربين فَيتحول إلى الوَضع الكَامن.[45][46]
مستقبلات السربين وتفاعلاته
يعمل إنزيم السربين على إفراز المركبات المعقدة خارج جسم الإنسان وبسرعة، ففي الثديات، تحدث هذه الآلية بسبب انخفاض كثافة نسبة البروتين الدهني، والتي ترتبط باستقبال البروتين (مستقبلات ال آر بي LRP)، والذي بدوره يربط المركبات المثبطة التي كونها مضاد الثرومبين، بي اي 1-1 PA1-1، (السربين العصبي)، وهو الذي يتسبب في امتصاص الإنزيمات الأخرى.[47][48] مما يؤدي إلى تغير التركيب الجزيئي أثناء تشكيل إنزيم السربين المعقد، ويمكن للسربين أيضا تكوين إشارات جزيئية لتنبيه الخلايا عن وجود نشاط في إنزيم البروتين.[47] في حين لا تزال خلايا مركبات إنزيم السربين الداخلية قيد التحديد.
تم مؤخرا إثبات أن نخرية سربين الذباب تؤخذ من خلال مستقبلا ليبوفورين والتي لها علاقة بمجموعة مستقبلات LDL للحيوانات اللبونة.[49]
التغيرات التشكيلية والوظائف غير المتعلقة بالتثبيط
تستخدم بعض أنواع السربينات غَير المُثبِطة التَغيرات التَشكيلية في شكلها الجُزيئي كَجزء من وَظيفتها، فمثلاً الشكل الأصلي للبروتين الجلوبيولين الرابط للثايروكسين thyroxine-binding globulin الذي يشبه حرف S لديه قابلية عالية للارتباط بالثايروكسين بينما تكون البروتين على شكل R المشقوق ذات قابلية أقل للارتباط بالثايروكسين. وبطريقة مماثلة فإن الشكل الأصلي للبروتين الجلوبيولين الرابط للكورتيزول Cortisol-Binding Globulin والذي يشبه حرف S لديه قابلية أعلى للارتباط بالكورتيزول من نظيره ذو الشكل R المشقوق. إذن فإن التحول من الشكل S إلى R والانشقاق في الحلقة المركزية التفاعلية لهذه الأنواع من السربينات ينتج عنه تحرر الروابط (الربيطة) بدلاً عن وظيفة تثبيط البروتياز .[23][23][50]
السربينات، الاعتلالات المتعلقة بالسربينات وأمراض البشر

بشكل عام فإن السربينات عرضة للطفرات والتحورات التي قد تعطل وظيفتها وتسبب الأمراض، وينتج عن هذه الطفرات مبلمرات ذات طيات بروتينية خاطئة أو تكتلات بروتينية (اعتلالات ناتجة عن نقص السربينات)،
من ضمن هذه الأمراض مرض نقص مضاد التربسين ألفا 1 والذي قد يؤدي إلى الانتفاخ الرئوي الوراثي وأحيانا تشمع الكبد، وأيضا مرض نقص مضاد الثرومبين والذي يتسبب في الخثار الوراثي، نقص مثبط سي1 والذي يتسبب في الوذمة الوعائية الوراثية بنوعيها 1و2، الاعتلال الدماغي الوراثي المصاحَب بالأجسام المشتملة البروتينية النيوروسربين (نوع نادر من الخرف ناتج عن تكتل النيوروسربينات الشاذة.[11][12]
بالتالي فإن السربينات تنتمي إلى مجموعة كبيرة من الجزيئات مثل بروتينات البريون والجلوتامينات المكررة المحتوية على البروتينات المسببة لاعتلالات البروتين أو الأمراض التشكيلية.[11]
تسببت بلمرة السربين المرض بطريقتين. أولًا : يؤدي نقص السربين النشط إلى نشاط بروتيني غير منضبط وإلى تدمير الأنسجة ويتضح هذا في حالة نقص الانتيتريبسين. ثانيا: تسد البوليمرات نفسها الشبكة الإندوبلازمية للخلايا التي تكوّن السربين، وتؤدي في النهاية إلى موت الخلية وتلف الأنسجة. وفي حالة نقص الانتيتريبسين فإن بوليمراته تسبب موت خلايا الكبد وتؤدي أحيانا إلى تلف وتشمع الكبد. وفي داخل الخلية تزيل الشبكة الإندوبلازمية عن طريق الانحلال بوليمرات السربين.[52] ومع ذلك تبقى التقنية التي بواسطتها تسبب بوليمرات السربين موت الخلية مفهومة كليا.
مثل السربين المتشقق فإن بوليمرات السربين مفرطة الاستقرار فيما يتعلق بالتسخين. ويبدو كل مونيمر سربين بأنه خضع للانتقال من الضغط إلى الاسترخاء. إضافة إلى ذلك، فإن بوليمرات السربين غير قادرة على سكن بروتياز الهدف مقترحا أن آر سي إل غير موجود ومندمج في صفيحة آي. ومن أجل ذلك وفي ظل غياب البيانات الهيكلية النهائية تم افتراض خضوع السربين للبلمرة من خلال تقنية تعرف بصفيحة البلمرة آي.[12] ويندمج آر سي إل في المهمة العادية مع صفيحة إي بي لتكوين سلسلة رابعة (الشكل 4) وقد اقترح في نموذج بلمرة صفيحة إي أن آر سي إل لجزء سربين واحد يندمج بطريقة تلقائية مع صفيحة آي لجزيء آخر لتكوين سلسلة طويلة من البوليمر (شكل 9) وفي الواقع بالتالي تمت الإشارة إلى أن البلمرة حدثت كنتيجة لحاجة هيكل السربين لقبول سلسلة بي إضافية.
يُعد السربينُ أحدَ المجموعاتِ الأولى من الطفرات الجينية التي تسببُ الأمراضَ، والتي تحلل بشكل مباشر إلى تراكيبَ بلوريةٍ.[53] وكدعم لنموذج البلمرة كان من الملاحظ أن الطفراتِ السربينية التي تسبب البلمرة تتمركزُ في منطقتين مختلفتين من الجزيء(كما وضح في الشكل4أ) الذي أُطلق علية الغلقُ والاختراق. ويحتوي الغلق والاختراق على بقايا محفوظةٍ بشكل جيد، كما أنهما يحددان مسارَ إدخال RCL حيث أنها مقترحة أن تكون مهمةً للتغير في التكوين الجزيئي.
لقد تم تحليل تركيبتين من السربين المبلمرة المخترقة واللتان تظهران RCL / A ترابطَ الأوراق المشابهةِ للأوراق التي تنبأت بها آليةُ البلمرة ولكن في تناقضٍ مباشر مع الخصائص المعروفةِ لبوليمرات السربين الفسيولوجية وبلورات بوليمرات السربين المخترقة فإنها تفصل بسهولةٍ إلى شكل أحادي.[54][55]
كمية كبيرة من البيانات تقترح أن الأحداث المتعلقة ببلمرة السربينات تحدث خلال طي الجزيء، والطفرات التي تسبب اضطرابات تراكم السربين تتداخل مع قدرة السربين لإضعاف الحالة الأصلية دونية الاستقرار.[56] في حالة طي السربين الطبيعية يتحرك السربين بسرعة من خلال مفتاح ترابط وسطي لتحقيق عملية الاستقرار.دراساتٌ عديدة أكدت أن مفتاح الترابط الوسطي هو الذي لديه القدرة على البلمرة من هنا يظهر أنه من المهم أن تكون الجزيئات المتداخلة متحركة بسرعة لتتخذ الحالة الأصلية ولقد ظهر أن هذه التحولات مثل ز-انتيتريبسين تتنوع (جلو 342 إلى ل ي س) تمنع بعض الشي المرحلة الاخيرة لتدخل السربين وتسبب تراكم التداخل الوسطيات. وكنتيجة لذلك، تعداد الوسطيات المتداخلة نتج في تكون البوليمرات[56] لوحظ أنه بمجرد التداخل، متنوع ز-انتيتريبسين يتشابه إلى حد كبير مع مواد النوع البري في شكل الاتزان الحراري والأنشطة المثبطة.[56][57]
تمثل هذه البيانات مجتمعة تحديًا مهمًا لنظرية تبلمر "السربين" المعتمدة على نموذج الصفيحة -أ A-sheet، فمن ناحية فإن فكرة استغلال آلية حدوث التغيرات التشكيلية في "السربين" لتكوين مبلمرات "السربين" فكرة جذابة، ومن الناحية الأخرى فإن المعطيات الفيزيائية الحيوية تحديدًا توحي بأن وسيط الطي هو الذي يقوم بعملية البلمرة -عوضًا عن الشكل الأصلي للجزيء- ومن الواضح أن هذا الوسيط يجب أن تختلف خصائصه التشكيلية عن الشكل المطوي الأصلي للسربين.
في عام 2008 م أدى الكشف عن التشكيل البلوري لأحد أنواع السيربن الرئيسية إلى الإشارة إلى أن تكوين مبلمرات السيربن الفسيولوجية لا يحدث عبر آلية الصفيحة -أ، بل عن طريق عملية أشمل تُعرف "بتبادل النطاق البروتيني".[10] كان مضاد الثرومبين أول نوع يتم تحليله (الشكل 10) وكشف أن كِلا الشريطين s5A والحلقة المركزية التفاعلية RCL يمكنها الدخول والاندماج مع صفيحة -أ لجزيء سيربن آخر، مما يجعل من السهل تكوين سلاسل مبلمرات طويلة.[10] عام 2011م أدى الكشف عن تركيب جزيء مضاد التربسين الحلقي الثلاثي الذي خضع لعملية "تبادل النطاق البروتيني" إلى توضيح أن مبلمرات هذا النوع من السيربن تتكون من إدخال الحلقة المركزية التفاعلية RCL إلى الجزيء المجاور، وشكّل جزيء مجموعة الكربوكسيل النهائي (والتي يتكون من الشرائط s1C وs4B وs5B) عملية تبادل النطاق (الشكل 11).[58] ومما دعم الأهمية الفسيولوجية لهذا الكشف أنه تبين أن مبلمرات مضاد التربسين التي تكونت عن طريق تبادل النطاق البروتيني لمجموعة الكربوكسيل النهائي تم التعرف عليها من قِبَل الأجسام المضادة وحيدة النسيلة[59] والتي تختص بمضادات التربسين المُمْرِضة (الباثوجينية).[58]
يبدأ نموذج "تبادل المجالات" الجديد لبلمرة السربين في التوفيق بين بيانات الفيزياء الحيوية وبيانات الكيمياء الحيوية المتوفرة. وتشير هذه البيانات معا إلى أن أحداث تبادل المجالات تظهرعندما تتداخل الطفرات أو العوامل البيئية بطريقة ما مع المراحل الأخيرة من السربين القابلة للطي إلى الحالة الأصلية. وتكشف هذه البيانات أيضا أن هذه السربينات من الممكن أن تتبلمر في الأخيرعن طريق أنواع مختلفة من نماذج تبادل المجالات. وفي النهاية، يتم تسليط الضوء لهذه البيانات على الشكل النهائي للبوليمر. من المهم أن نلاحظ أن الفصائل السامة عينها، الدقيقة من المتوسطة أو/ و البوليمر الذي يسبب موت الخلايا، مثل نقص الآنتي تربيسن الذي لايزال معلوم.[60]
تطور استراتيجيات العلاج لمكافحة السيربينوباثيز
العديد من التوجهات العلاجية تُستخدم أو جارية البحث والإستسقاء لتعالج أمراض التراكم الإنزيمي غير الطبيعي في الجسم الأكثر شيوعًا، وهو نقص مضاد الإنزيم تريبسين. علاج زيادة مضاد الإنزيم تريبسين مصدق عليه لنقص مضاد الانزيم تريبسين الحاد – المرتبط بانتفاخ الرئة .[61] زراعة الرئة و/ أو الكبد كذلك يستخدم في علاج عدد من الأمراض المرتبطة بنقص مضاد الإنزيم تريبسين الحاد.[62] في النماذج الحيوانية، استهداف الجينات المحفزة في الخلايا الجذعية تم تطويره بنجاح ليصحح الخلل في زد-مضاد البروتين تريبسين وليسترجع القدرة ولضمان إفراز مضاد الأنزيم تريبسين على أن يفرز من كبد الثدييات.[63] وقد أفادت عدد من المجموعات أيضاً ان الجزيئات الصغيرة تعمل على منع مضاد تريبسين البلمرة في المختبر.[64][65]
الطفرات التي تؤدي إلى تكون الأشكال الخاملة (أو شبه الخاملة) الغير نشطة تلقائيًا

يمكن للطفرات (المسببة للأمراض) التي تحدث لجزيء السيربين أن تؤدي إلى تحويله إلى الحالة الخاملة الأحادية (انظر الشكل 8أ الذي يوضح تركيب الحالة الخاملة)، فيحدث المرض نتيجة نقص في عدد السيربينات المُثبِطة الفعالة. على سبيل المثال يؤدي الشكلان المتغيران لمضاد الثرومبين "ويبل" و"ووبل"[67] المرتبطان بالمرض إلى تشكل الحالة الخاملة. من الجدير بالذكر أيضًا أن أحد الأشكال المتغيرة لمضاد الكيموتربسين المسبب للمرض في الإنسان يوضح المرونة الاستثنائية العالية جدًا لهيكل السيربين. أظهر تركيب بُنية مضاد الكيموتربسين (ليوسين 55 إلى برولين) شكل دلتا "δ" جديد وغير مألوف، من الممكن أن يكون مركبًا وسيطًا بين الحالتين الأصلية والخاملة (شكل 12). في هذا التركيب الجديد يظهر أربع بقايا من الحلقة المركزية التفاعلية مدرجة في الجزء العلوي من الصفيحة-أ بيتا β-sheet A، أما الجزء السفلي من الصفيحة فيمتلئ نتيجة تحول جزئي لواحدة من لولبيات ألفا (اللولب- (F إلى شكل شريط بيتا مكملة رابطة الهيدروجين للصفيحة-بيتا.[66] من غير الواضح إلى الآن إذا كان بإمكان السيربينات الأخرى اتخاذ هذا التشكيل، أو إذا كان لهذا التشكيل أي وظيفة عملية. مع هذا يُعتقد أن الجلوبيولين الرابط للثايروكسين يتخذ تشكيل دلتا δ أثناء إطلاق الثايروكسين.[23]
آليات أخرى من الأمراض المرتبطة بالسربين
في البشر، نقص بسيط من العديد من السربين (على سبيل المثال، من خلال طفرة فارغة) قد يؤدي إلى المرض (راجع الجدول 1).
فمن النادر أن يتغير أحد من الأحماض الأمينية للـ "آر سي إل" من السربين يبدل خصوصية العامل المانع للمرض والسماح له بأن يستهدف الخميرة التي تحفز ذوبان البروتين. على سبيل المثال، طفرة انتيتريبسين-بيتسبرغ (ميثيونين 358 إلى أرجينين) يسمح للسربين لمنع الثرومبين، مما تسبب في اضطرابات النزيف.[68]
السيربين هي مثبطات انتحار، والـ" آر سي إل" تعمل كـ طُعم. بعض طفرات الأمراض المعروفة في ال "آر سي إل" في الإنسان تسمح بركيزة السلوك الحقيقي والانقسام دون تشكيل معقد. والتكهن لمثل هذه المتغيرات تؤثر على معدل أو مدى الـ" آر إل سي" المدرج في ورقة الإيه. هذه الطفرات، في الواقع، تؤدي إلى نقص السربين من خلال الفشل في السيطرة بشكل صحيح على الهدف.[53][69]
العديد من السربين الغير مثبط يلعب دورًا أساسيا في الأمراض البشرية الخطيرة. على سبيل المثال، وظائف الماسبين بمثابة قامع لسرطان الثدي والبروستاتا. ويجب أن تفهم آلية وظيفة الماسبين بشكل كامل. وأثبتت الدراسات إلى أن الماسبين يلعب دورًا أساسيا في التنمية.[70]
التطور
لقد كان يُعتقد منذ البدء بأن السربين مقتصرة على كائنات اليوكاريوت ولكنها قد وجدت فيما بعد في عدد من البكتيريا والعتائق،[5][5][71] وما زال من غير الواضح ما إذا كانت هذه الجينات بدائية النواة هي أحفاد لأسلافها من السربين ثنائية النواة أو نتاج انتقال جينات فرعي (انتقال جيني بين الكائنات الحية لا بالنسب التطوري)، وقد أوضح رولينغز وآخرون بأن السربين هي أكبر عائلة من مثبطات الأنزيم البروتيني وأكثر عائلة موزعة على نطاق واسع.[7]
أنواع السربين
البشرية
وُضعت في عام 2001 تسميات للسربين (انظر للجدول 1 في الأسفل)[8] ويعتمد نظام التسمية على تحليل النشوء والتطور لـ 500 سربين،[5] ويشمل الجينوم البشري على 16 منظومة من السربين تسمى بسربين إيه وصولا إلى سربين بي، محتوية بذلك على 29 بروتين سربين مثبط و7 غير مثبطة (انظر إلى لوو وآخرون 2006، وهايت وأخرون 2013 من أجل أحدث مراجعة حول الموضوع)[72][73]، وتسمى البروتينات بسربين إكس واي؛ حيث أن إكس هي منظومة البروتين وواي هو عدد البروتينات في المنظومة، ويسرد الجدول 1 قائمة بكل سربين بشري مع ملاحظات مختصرة تتعلق بكل وظيفة للجزيئات والنتيجة (إذا عُرفت) للخلل والنقص.
سربينات ثديية مخصصة
كثير من السربينات (أنواع من البروتينات) الثديية تم تمييزها على أنها لا تشارك أي أورثولوجي (وجود سلف مشترك) بشكل واضح مع السربين النظير الموجود في الإنسان. أمثلة تضم كثير من السربينات في القواضم (خاصة بعض من السربينات الموجودة في خلايا الفئران) وأيضا في سربينات الرحم. (المذكورة أدناه). يشير مصطلح سربين الرحم لأعضاء السربين A التي تم ترميزها بواسطة جينات سربينا 14. ويتم إنتاج سربين الرحم من بطانته وهي مجموعة محدودة من الثدييات في طور اللوراسيات تحت تأثير هرمون البروجسترون أو هرمون الأستروجين.[74] وهما على الأرجح مثبطات بروتين غير فعالة ويمكن لها أن تعمل خلال فترة الحمل لمنع الاستجابات المناعية ضد الأمهات أو الحمل المستكن وللمساعدة في نقل المشيمة.[75]
حشرة
تحتوي جينوم ذبابة الفاكهة سوداء البطن (دورسوفيليا ميلانوجستر) على 29 جينة لترمز السربين (مجموعة من بروتينات بأشكال متشابهة تعمل على تثبيط الإنزيمات الفاعلة في الروتينات). تحليل سلسلة الأحماض الأمينية قد استبدلت 14 من هذه السربينات في مجموعة السربين Q وثلاثة في مجموعة السربين K، مع البقية ال12 كسربينات يتيمة لا تنتمي إلى أي مجموعة.[76] النظام المجموعي للتصنيف ليس سهل الاستخدام في سربينات ذبابة الفاكهة وبدلاً منه تم تبني نظام المصطلحات حيث تسمى المصطلحات بناءً على مركز جينة ذبابة الفاكهة في الكروموزم. 13 من جينة السربين لذبابة الفاكهة تظهر على أنها معزولة في الجينوم (شاملا السربين 27A، انظر إلى الأسفل) مع بقية 16 منظمة إلى ثلاث كتل جينية والتي تظهر في مراكز الكروموزوم 28D (سربينين) 42D (خسمة سربينات) 43A (أربعة سربينات)، 77B (ثلاثة سربينات)، و88E (سربينين).[77][78][79]
كشفت دراسات على سربينات ذبابة الفاكهة أن سربين 27A تثبط إيستر المكسر للبروتين وبهذا تنظم نمط الظهري البطني. فهو يعمل على شق السباتزل (وهو ليغاند كيميائي) مما يمكّنه على التحكم في نمط الجينات بوساطة الإشارات. وقد يؤدي إلى قتل عدد من الإشارات بالإضافة إلى دورها الأساسي في الوضع النمطي عند الجنين، الإشارات الجينية أيضا مهمة في الردود الفعلية الغريزية عند مناعة الحشرات. وفقا لذلك، السربين 27A أيضا تعمل على التحكم في ردود الأفعال المناعية في الحشرة.[80][81][82] في "تنبريوا موليتر (وهي خنفساء كبيرة) بروتين (SPN93) محتوية على حقلين لسربينين مرادفين منفصلين تعمل على ضبط العملية المتتابعة للجين الذي يعطي رموز مكسرات البروتين.[83]
الديدان
يحتوي جينوم الديدان الخيطية من فصيلة الربداء الرشيقة على تسعة أنواع من السربينات، ولكن خمسة منها فقط تعمل كمثبطات للبروتياز.[27] أحد هذه السربينات وهو سربين-6 يقوم بوظائف وقائية ودفاعية ضد التحلل اللايزوزومي (اليحلولي) الناتج عن الضغط والمرتبط ببروتين الكالبين، كما يعمل أيضاً كمثبط لبروتياز السيستين اليحلولي والذي يتم إطلاقه من بعد التمزق اليحلولي للخلية. ووفقاً لهذا فإن الديدان التي تفتقر إلى سربين-6 حساسة للضغط. والجدير بالذكر أن الديدان التي تم فيها تعطيل جين سربين-6 تموت عند وضعها في الماء (نوع الديدان ذو النمط الظاهري الحساس لضغط القصور الأسموزي Osl). استنادًا إلى هذه البيانات فإنه يُعتقد أن اليحاليل (اللايزوزومات) تلعب دورًا هامًا يمكن مراقبته في تحديد مصير الخلية.[84]
النبات
تم التعرف على وجود السربينات في النباتات منذ فترة طويلة،[85] حيث يُعد السربين (بروتين الشعيرZ) المتواجد بكثرة في حبوب الشعير هو أحد مكونات البروتين الرئيسية في شراب الشعير (البيرة).
قامت قاعدة بيانات الببتيدات (MEROPS) بالتعرف على تصنيف ثمانية عشر عضوًا من عائلة السربينات في جينوم نبات الأربيدوبسس ثاليانا، ولكن ثمانية منها فقط تشكل سلسلة سربين كامل الطول. سربينات النباتات هي مثبطات قوية ونشطة للسيرين بروتياز الشبيه بالكيموتربسين لدى الثديّات في المختبر. أكثر نوع تم دراسته من قبل العلماء هو سربين Zx (BSZx)، والذي يقوم بتثبيط التربيسن والكيموتربسين والعديد من عوامل تخثر الدم،[86] بالرغم من أن النباتات لا تحتوي على السيرين بروتياز الشبيه بالكيموتربسين أو أي فصائل مشابهة له. الحلقة المركزية التفاعلية RCL للعديد من السربينات المتواجدة في حبوب القمح والجاودار.[87] تحتوي على سلسلة متعددة ومكررة من جلوتامين (أحماض أمينية مشفرة) مشابهة لتلك الموجودة في بروتينات تخزين البرولامين في سويداء البذرة،[87] ولهذا فقد افترض العلماء أن سربينات النباتات تعمل على تثبيط البروتياز الموجود في الحشرات أو الميكروبات التي تمزق وتهاجم بروتين تخزين الحبوب. لدعم هذه النظرية تم التعرف على سربينات محددة في نسغ اللحاء الخاص بنبات اليقطين (CmPS-1)[88] والخيار.[89][90] مع أنه لوحظ أن هناك علاقة عكسية بين التواجد المنظم لسربين ال CmPS-1 في النبات وبقاء حشرات المن على قيد الحياة، إلا أن التجارب المخبرية كشفت أن سربين CmPS-1 المؤتلف ليس لديه تأثير على حياة الحشرات.[88]
تم اقتراح وعرض الأدوار البديلة وأهداف البروتياز لسربينات النباتات. وقد تبين في المختبر (خارج الوسط الحيوي) أن السربينات الخاصة بنبات الأربيدوبسيس [22] يثبط البروتياز (إنزيمات البروتين) كالميتاكازباس[21]. وكذلك تم التعرف حديثا على الهدف الأساسي للبروتياز فيما يتعلق بالسربينات في الوسط الحيوي بالباين الذي يشبه بروتياز السيستئين المعرض للجفاف. ومن خلال هذه التجربة، أظهرت السربينات سيطرتها على مجموعة نقاط في موت الخلية في نبات الاربيبدوبسيس.[91]
وقد ظهر اثنان من سربينات نبات الاربيدوبسيس AtSRP2 و AtSRP3 اشتراكهما معا كردا فعل لأضرار يتعرض لها الحمض النووي بسبب تعرض النبات لميثان ميثيل سولفانات.[92]
الفطريات
أحادي السربين الفطري يتميز حتى الآن بـ : سلبين من البيرومسات سلالة هـ2. البيرومسات فطريات لاهوائية توجد في أمعاء الحيوانات المجترة ومهمة في هضم المواد النباتية. يُتوقع أن السلبين جزيء مثبط ويحتوي طرفين من مجالات الدوكرين بالإضافة إلى مجال السربين. الدوكرينات تكون عادة في البروتينات الموجودة في السليولوسوم الفطري، عديد البروتين المعقد الكبير خارج الخلية يحطم السليولوز.[6] ولذا يقترح أن يحمي السلبين السليولوسوم من إنزيمات البروتين (بروتياز). تتواجد أيضا سربينات بكتيرية معينة في السليولوسوم.[93]
بدائيات النوى
تتوزع جينات السربين في الخلايا بدائية النوى؛ يوجد دراسات مختبرية على بعض هذه الجزيئات قد كشفت عن أنها قادرة على كبح أنزيم البروتياز، ويقترح أنها من الممكن أن تعمل كمثبطات في الجسم الحي، العديد من جزئيات سربين بدائيات النوى وُجدت في الاكستريموفيز*، وفقًا لذلك وعلى العكس من جزئيات سربين الثديات فإن هذه الجزئيات لديها مقاومة عالية للتفسخ الحراري.[94][95] دور بكتيريا سربين الدقيق مازال غامضًا، على أية حال، كلوستريديوم ثيرموسيلوم السربين يتموضع إلى سيليولوسوم، يُقترح أن السيليولسوم المرتبط بالسربين قد يكون لمنع نشاط الأنزيم البروتيني غير المرغوب فيها ضد سيليولوسوم.[93]
ڤيروسيًا
تُظهر الفيروسات السِربينات على سطحها كَطريقة لِحماية نَفسها من الجهاز المناعي.[96] على وجه الخصوص، فإن السِربينات التي تُستخدم بواسطة فَيروسات الجُدري بما في ذلك جُدري البَقر وجُدري الأرانب ذات أهمية مُميزة وذلك لإمكانية استخدامها في علاجات جّديدة لاضطرابات المَناعة والالتهابات وأيضاً زراعة الأعضاء، وقد كَشفت دراسة على السِربين رقم 1 أن هذا الجُزيء يَقوم بتَثبيط المَناعة الفِطرية ويَسمح لقَلب مَزروع بالعَيش في الفئران إلى أجل غير مسمى،[97][98] وكَشفت دراسة أخرى على السِربين رقم 2 والكرما أنهما مُثبطات من نوع المتقاطع وتَستهدف السِربين (قرانزايم بي) والإنزيم البروتيني السِيستيني (كاسبيس 1و كاسبيس 8)،[99][100] وبِمقارنة السِربينات الفَيروسية بنَظائرها في الثَدييات فإن السِربينات الڤيروسية تَحتوي على حَذف كَبير في عناصر البُنية الثَانوية. على وجه التَحديد فإن الدراسات على هَيكل جُزيء الكُرما "أي" بَينت أنهُ يَفتقد لَولب "الدِي" وأيضا أجزاء مُهمة من لولب "الأي" ولَولب "الإي".[101]
مقالات ذات صلة
المراجع
- R. Carrell and J. Travis. (1985). "α1-Antitrypsin and the serpins: Variation and countervariation". Trends Biochem. Sci. 10: 20–24. doi:10.1016/0968-0004(85)90011-8.
- Whisstock JC, Silverman GA, Bird PI, Bottomley SP, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Huntington JA (May 2010). "Serpins Flex Their Muscle: II. STRUCTURAL INSIGHTS INTO TARGET PEPTIDASE RECOGNITION, POLYMERIZATION, AND TRANSPORT FUNCTIONS". J Biol Chem 285 (32): 24307–12.doi:10.1074/jbc.R110.141408. PMC 2915666.ببمد 20498368.
- Silverman GA, Whisstock JC, Bottomley SP, Huntington JA, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Bird PI (May 2010). "Serpins Flex Their Muscle: I. PUTTING THE CLAMPS ON PROTEOLYSIS IN DIVERSE BIOLOGICAL SYSTEMS". J Biol Chem 285 (32): 24299–305.doi:10.1074/jbc.R110.112771. PMC 2915665.ببمد 20498369.
- Hunt LT, Dayhoff MO (1980). "A surprising new protein superfamily containing ovalbumin, antithrombin-III, and α1-proteinase inhibitor". Biochem. Biophys. Res. Commun. 95 (2): 864–71. doi:10.1016/0006-291X(80)90867-0. ببمد 6968211.
- Irving JA, Pike RN, Lesk AM, Whisstock. (2000). "Phylogeny of the Serpin Superfamily: Implications of Patterns of Amino Acid Conservation for Structure and Function". Genome Res. 10 (12): 1845–64.doi:10.1101/gr.GR-1478R. ببمد 11116082.
- Steenbakkers PJ, Irving JA, Harhangi HR, et al. (August 2008). "A serpin in the cellulosome of the anaerobic fungus Piromyces sp. strain E2". Mycol. Res. 112 (Pt 8): 999–1006.
- Rawlings ND, Tolle DP, Barrett AJ. (2004)."Evolutionary families of peptidase inhibitors". Biochem J.378 (Pt 3): 705–16. نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC. (2001). "'The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature". J Biol Chem 276 (36): 33293–6.
- Huntington J, Read R, Carrell R (2000). "Structure of a serpin-protease complex shows inhibition by deformation". Nature 407 (6806): 923–6
- Yamasaki M, Li W, Johnson DJ, Huntington JA (October 2008). "Crystal structure of a stable dimer reveals the molecular basis of serpin polymerization". Nature 455 (7217): 1255–8
- Carrell RW, Lomas DA. (1997). "Conformational disease".Lancet. 350 (9071): 134–8. doi:10.1016/S0140-6736(97)02073-4.ببمد 9228977.
- Lomas DA, Evans DL, Finch JT & Carrell RW (1992). "The mechanism of Z alpha 1-antitrypsin accumulation in the liver". Nature 357(6379): 605–607
- Tsukada H, Blow DM (1985). "Structure of alpha-chymotrypsin refined at 1.68 A resolution". J. Mol. Biol. 184 (4): 703–11
-
Barrett AJ, Rawlings ND. (1995). "Families and clans of serine peptidases". Arch Biochem Biophys. 318 (2): 247–50. - Barrett AJ, Rawlings ND. (2001). "Evolutionary lines of cysteine peptidases". Biol Chem 382 (5): 727–33.
- rving JA, Pike RN, Dai W, Bromme D, Worrall DM, Silverman GA, Coetzer TH, Dennison C, Bottomley SP, Whisstock JC. (2002). "Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases".Biochemistry. 41 (15): 4998–5004.
- Irving JA, Pike RN, Dai W, Bromme D, Worrall DM, Silverman GA, Coetzer TH, Dennison C, Bottomley SP, Whisstock JC. (2002). "Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases". Biochemistry. 41 (15): 4998–5004. نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- McGowan S, Buckle A, Irving J, Ong P, Bashtannyk-Puhalovich T, Kan W, Henderson K, Bulynko Y, Popova E, Smith A, Bottomley S, Rossjohn J, Grigoryev S, Pike R, Whisstock J (2006). "X-ray crystal structure of MENT: evidence for functional loop–sheet polymers in chromatin condensation". The EMBO Journal 25 (13): 3144–55. نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- Ong PC, McGowan S, Pearce MC, Irving JA, Kan WT, Grigoryev SA, Turk B, Silverman GA, Brix K, Bottomley SP, Whisstock JC, Pike RN (2007). "DNA accelerates the inhibition of human cathepsin V by serpins". Journal of Biological Chemistry 282 (51): 36980–6.
- Ray C, Black R, Kronheim S, Greenstreet T, Sleath P, Salvesen G, Pickup D (1992). "Viral inhibition of inflammation: cowpox virus encodes an inhibitor of the interleukin-1 beta converting enzyme". Cell 69 (4): 597–604.
- Vercammen D, Belenghi B, van de Cotte B, Beunens T, Gavigan JA, De Rycke R, Brackenier A, Inze D, Harris JL, Van Breusegem F. (2006). "Serpin1 of Arabidopsis thaliana is a suicide inhibitor for metacaspase 9". J Mol Biol. 364 (4): 625–36.
- Lampl N, Budai-Hadrian O, Davydov O, Joss TV, Harrop SJ, Curmi PM, Roberts TH, Fluhr R. (2010). "Arabidopsis AtSerpin1, Crystal Structure and in Vivo Interaction with Its Target Protease RESPONSIVE TO DESICCATION-21 (RD21)". J Biol. Chem. 285 (18): 13550–60. نسخة محفوظة 9 يناير 2020 على موقع واي باك مشين.
- Klieber MA, Underhill C, Hammond GL, Muller YA. (2007). "Corticosteroid-binding globulin: structural basis for steroid transport and proteinase-triggered release". J Biol Chem. 282 (40): 29594–603.
- Campbell DJ. (2003). "The renin-angiotensin and the kallikrein-kinin systems". Int J Biochem Cell Biol. 35 (6): 784–91.
- Remold-O'Donnell E, Chin J, Alberts M. (1992). "Sequence and molecular characterization of human monocyte/neutrophil elastase inhibitor". Proc. Natl. Acad. Sci. U.S.A. 89 (12): 5635–9.
- Coughlin P, Sun J, Cerruti L, Salem HH, Bird P., (1993). "Cloning and molecular characterization of a human intracellular serine proteinase inhibitor". Proc. Natl. Acad. Sci. U.S.A. 90 (20): 9417–21.
- Pak SC, Kumar V, Tsu C, Luke CJ, Askew YS, Askew DJ, Mills DR, Bromme D, Silverman GA. (2004). "SRP-2 is a cross-class inhibitor that participates in postembryonic development of the nematode Caenorhabditis elegans: initial characterization of the clade L serpins". J Biol Chem. 279 (15): 15448–59.
- Bird PI. (1999). "Regulation of pro-apoptotic leucocyte granule serine proteinases by intracellular serpins". Immunol Cell Biol 77 (1): 47–57.
- Bird CH, Sutton VR, Sun J, Hirst CE, Novak A, Kumar S, Trapani JA, Bird PI (1998). "Selective regulation of apoptosis: the cytotoxic lymphocyte serpin proteinase inhibitor 9 protects against granzyme B-mediated apoptosis without perturbing the Fas cell death pathway". Mol Cell Biol. 18 (11): 6387–98.
- Grigoryev SA, Bednar J, Woodcock CL. (1999). "MENT, a heterochromatin protein that mediates higher order chromatin folding, is a new serpin family member". J Biol Chem. 274 (9): 5626–36
- Tasab M, Batten MR, Bulleid NJ (2000). " Horvath AJ, Irving JA, Rossjohn J, Law RH, Bottomley SP, Quinsey NS et al. (2005). "The murine orthologue of human antichymotrypsin: a structural paradigm for clade A3 serpins.". J Biol Chem 280 (52): 43168–78
- Loebermann H, Tokuoka R, Deisenhofer J, Huber R. (1984). "Human alpha 1-proteinase inhibitor. Crystal structure analysis of two crystal modifications, molecular model and preliminary analysis of the implications for function". J Mol Biol. 177 (3): 531–57.
- Stein PE, Leslie AG, Finch JT, Turnell WG, McLaughlin PJ, Carrell RW. (1990). "Crystal structure of ovalbumin as a model for the reactive centre of serpins". Nature. 347 (6288): 99–102.
- Whisstock J, Bottomley S (2006). "Molecular gymnastics: serpin structure, folding and misfolding". Current Opinion in Structural Biology 16(6): 761–8.
- Egelund R, Rodenburg K, Andreasen P, Rasmussen M, Guldberg R, Petersen T (1998). "An ester bond linking a fragment of a serine proteinase to its serpin inhibitor". Biochemistry 37 (18): 6375–9.
- Gettins P (2002). "Serpin structure, mechanism, and function". Chem Rev 102 (12): 4751–804.
- Whisstock JC, Skinner R, Carrell RW, Lesk AM (2000). "Conformational changes in serpins: I. The native and cleaved conformations of alpha(1)-antitrypsin". J Mol Biol. 296 (2): 685–99
- Jin L, Abrahams JP, Skinner R, Petitou M, Pike RN, Carrell RW. (1997)."The anticoagulant activation of antithrombin by heparin". Proc. Natl. Acad. Sci. U.S.A. 94 (26): 14683–8. نسخة محفوظة 06 فبراير 2012 على موقع واي باك مشين.
- Whisstock JC, Pike RN, Jin L, Skinner R, Pei XY, Carrell RW, Lesk AM. (2000). "Conformational changes in serpins: II. The mechanism of activation of antithrombin by heparin". J Mol Biol. 301 (5): 1287–305.
- Li W, Johnson DJ, Esmon CT, Huntington JA (2004). "Structure of the antithrombin-thrombin-heparin ternary complex reveals the antithrombotic mechanism of heparin". Nature Structural & Molecular Biology 11 (9): 857–62.
- Johnson DJ, Li W, Adams TE, Huntington JA (2006)."Antithrombin–S195A factor Xa-heparin structure reveals the allosteric mechanism of antithrombin activation".EMBO J. 25 (9): 2029–37 نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- Petitou M, van Boeckel CA (2004). "A synthetic antithrombin III binding pentasaccharide is now a drug! What comes next?". Angew. Chem. Int. Ed. Engl. 43 (24): 3118–33.
- Lindahl T, Sigurdardottir O, Wiman B (1989). "Stability of plasminogen activator inhibitor 1 (PAI-1)". Thromb Haemost 62 (2): 748–51.
- Zhang Q, Buckle AM, Law RH, Pearce MC, Cabrita LD, Lloyd GJ, Irving JA, Smith AI, Ruzyla K, Rossjohn J, Bottomley SP, Whisstock JC. (2007). "The N terminus of the serpin, tengpin, functions to trap the metastable native state". EMBO Reports 8 (7): 658–63.
- Zhang Q, Law RH, Bottomley SP, Whisstock JC, Buckle AM (March 2008). "A structural basis for loop C-sheet polymerization in serpins". Journal of Molecular Biology376 (5): 1348–59.
- Cao C, Lawrence DA, Li Y, Von Arnim CA, Herz J, Su EJ, Makarova A, Hyman BT, Strickland DK, Zhang L. (2006). "Endocytic receptor LRP together with tPA and PAI-1 coordinates Mac-1-dependent macrophage migration". EMBO J. 25 (9): 1860–70.
- Jensen JK, Dolmer K, Gettins PG (May 2009). "Specificity of Binding of the Low Density Lipoprotein Receptor-related Protein to Different Conformational States of the Clade E Serpins Plasminogen Activator Inhibitor-1 and Proteinase Nexin-1". J. Biol. Chem. 284 (27): 17989–97.
- Soukup SF, Culi J, Gubb D (June 2009). Rulifson, Eric, ed. "Uptake of the Necrotic Serpin in Drosophila melanogaster via the Lipophorin Receptor-1". PLOS Genetics 5 (6): e1000532
- Pemberton PA, Stein PE, Pepys MB, Potter JM, Carrell RW (1988). "Hormone binding globulins undergo serpin conformational change in inflammation". Nature. 336 (6196): 257–8.
- Chang WS, Whisstock J, Hopkins PC, Lesk AM, Carrell RW, Wardell MR. (1997). "Importance of the release of strand 1C to the polymerization mechanism of inhibitory serpins". Protein Sci. 6 (1): 89–98.
- Kroeger H, Miranda E, Macleod I, Perez J, Crowther DC, Marciniak SJ, Lomas DA (June 2009). "Endoplasmic Reticulum-associated Degradation (ERAD) and Autophagy Cooperate to Degrade Polymerogenic Mutant Serpins". J. Biol. Chem. 284 (34): 22793–802.
- Stein PE, Carrell RW. (1995). "What do dysfunctional serpins tell us about molecular mobility and disease?". Nature Structural & Molecular Biology 2 (2): 96–113.
- Huntington JA, Pannu NS, Hazes B, Read RJ, Lomas DA, Carrell RW (October 1999). "A 2.6 A structure of a serpin polymer and implications for conformational disease". Journal of Molecular Biology 293(3): 449–55.
- Dunstone MA, Dai W, Whisstock JC, Rossjohn J, Pike RN, Feil SC, Le Bonniec BF, Parker MW & Bottomley SP (2000). "Cleaved antitrypsin polymers at atomic resolution". Protein Sci 9 (2): 417–420.
- Yu MH, Lee KN, Kim J (May 1995). "The Z type variation of human alpha 1-antitrypsin causes a protein folding defect". Nature Structural & Molecular Biology 2 (5): 363–7.
- Knaupp AS, Bottomley SP (September 2011). "Structural Change in β-Sheet A of Z α(1)-Antitrypsin Is Responsible for Accelerated Polymerization and Disease". J Mol Biol 413 (4): 888–98.
- Yamasaki M, Sendall TJ, Pearce MC, Whisstock JC, Huntington JA (September 2011). "Molecular basis of α(1)-antitrypsin deficiency revealed by the structure of a domain-swapped trimer". EMBO Reports 12(10): 1011–7. نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- Miranda E, Pérez J, Ekeowa UI, et al. (September 2010). "A novel monoclonal antibody to characterize pathogenic polymers in liver disease associated with alpha1-antitrypsin deficiency". Hepatology 52 (3): 1078–88.
- Bottomley SP (September 2011). "The structural diversity in α1-antitrypsin misfolding". EMBO Reports 12 (10): 983–4 نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- Sandhaus RA (October 2004). "alpha1-Antitrypsin deficiency . 6: new and emerging treatments for alpha1-antitrypsin deficiency". Thorax 59(10): 904–9. نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- Fregonese L, Stolk J (2008)."Hereditary alpha-1-antitrypsin deficiency and its clinical consequences". Orphanet J Rare Dis3: 16.
- Yusa K, Rashid ST, Strick-Marchand H, et al. (October 2011). "Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells". Nature 478 (7369): 391–4. نسخة محفوظة 26 مايو 2016 على موقع واي باك مشين.
- Mallya M, Phillips RL, Saldanha SA, et al. (November 2007). "Small molecules block the polymerization of Z alpha1-antitrypsin and increase the clearance of intracellular aggregates". Journal of Medicinal Chemistry50 (22): 5357–63.
- Gosai SJ, Kwak JH, Luke CJ, et al. (2010). "Automated high-content live animal drug screening using C. elegans expressing the aggregation prone serpin α1-antitrypsin Z". PLOS ONE 5 (11): e15460.
- Gooptu B, Hazes B, Chang WS, Dafforn TR, Carrell RW, Read RJ, Lomas DA. (2000). "Inactive conformation of the serpin α1-antichymotrypsin indicates two-stage insertion of the reactive loop: Implications for inhibitory function and conformational disease". Proc. Natl. Acad. Sci. U.S.A. 97 (1): 67–72.
- Beauchamp NJ, Pike RN, Daly M, Butler L, Makris M, Dafforn TR, Zhou A, Fitton HL, Preston FE, Peake IR, Carrell RW (1998). "Antithrombins Wibble and Wobble (T85M/K): archetypal conformational diseases with in vivo latent-transition, thrombosis, and heparin activation". Blood 92 (8): 2696–706.
- Owen MC, Brennan SO, Lewis JH, Carrell RW. (1983). "Mutation of antitrypsin to antithrombin. alpha 1-antitrypsin Pittsburgh (358 Met leads to Arg), a fatal bleeding disorder". N Engl J Med. 309 (12): 694–8.
- Hopkins PC, Carrell RW, Stone SR. (1993). "Effects of mutations in the hinge region of serpins". Biochemistry. 32 (30): 7650–7.
- Homan EP, Rauch F, Grafe I, et al. (August 2011). "Mutations in SERPINF1 Cause Osteogenesis Imperfecta Type VI". J Bone Miner Res26 (12): 2798–803.
- Cabrita LD, Irving JA, Pearce MC, Whisstock JC, Bottomley SP. (2007). "Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap". J Biol Chem. 282 (37): 26802–9.
- Law RH, Zhang Q, McGowan S, Buckle AM, Silverman GA, Wong W, Rosado CJ, Langendorf CG, Pike RN, Bird PI, Whisstock JC (2006). "An overview of the serpin superfamily". Genome Biol. 7 (5): 216.
- Heit, C; Jackson, BC; McAndrews, M; Wright, MW; Thompson, DC; Silverman, GA; Nebert, DW; Vasiliou, V (Oct 30, 2013). "Update of the human and mouse SERPIN gene superfamily.". Human genomics 7: 22.
- Padua MB, Kowalski AA, Cañas MY, Hansen PJ (February 2010). "The molecular phylogeny of uterine serpins and its relationship to evolution of placentation". FASEB J. 24 (2): 526–37.
- Padua MB, Hansen PJ (October 2010). "Evolution and function of the uterine serpins (SERPINA14)". Am. J. Reprod. Immunol. 64 (4): 265–74.
- Reichhart JM. (2005). "Tip of another iceberg: Drosophila serpins". Trends Cell Biol. 15 (12): 659–665.
- Reichhart JM. (2005). "Tip of another iceberg: Drosophila serpins".Trends Cell Biol. 15 (12): 659–665. doi:10.1016/j.tcb.2005.10.001.ببمد 16260136.
- Tang H, Kambris Z, Lemaitre B, Hashimoto C (October 2008)."A SERPIN THAT REGULATES IMMUNE MELANIZATION IN THE RESPIRATORY SYSTEM OF DROSOPHILA".Developmental cell 15 (4): 617–26.
- Scherfer C, Tang H, Kambris Z, Lhocine N, Hashimoto C, Lemaitre B (September 2008). "Drosophila Serpin-28D regulates hemolymph phenoloxidase activity and adult pigmentation". Developmental biology 323 (2): 189–96.
- Rushlow C (2004). "Dorsoventral patterning: a serpin pinned down at last". Curr. Biol. 14 (1): R16–8.
- Ligoxygakis P, Roth S, Reichhart JM (2003). "A serpin regulates dorsal-ventral axis formation in the Drosophila embryo". Curr. Biol. 13 (23): 2097–102.
- Hashimoto C, Kim DR, Weiss LA, Miller JW, Morisato D (2003). "Spatial regulation of developmental signaling by a serpin". Dev. Cell 5 (6): 945–50
- Jiang R, Zhang B, Kurokawa K, et al. (August 2011). "93-kDa Twin-domain Serine Protease Inhibitor (Serpin) Has a Regulatory Function on the Beetle Toll Proteolytic Signaling Cascade". J Biol Chem 286 (40): 35087–95.
- Cliff J. Luke, Stephen C. Pak, Yuko S. Askew, Terra L. Naviglia, David J. Askew, Shila M. Nobar, Anne C. Vetica, Olivia S. Long, Simon C. Watkins, Donna B. Stolz, Robert J. Barstead, Gary L. Moulder, Dieter Brömme, and Gary A. Silverman (2007). "An Intracellular Serpin Regulates Necrosis by Inhibiting the Induction and Sequelae of Lysosomal Injury". Cell 130 (6): 1108–1119.
- Hejgaard J, Rasmussen SK, Brandt A, SvendsenI (1985). "Sequence homology between barley endosperm protein Z and protease inhibitors of the alpha-1-antitrypsin family". FEBS Lett. 180 (1): 89–94.
- Dahl SW, Rasmussen SK, Peterson LC, Hejgaard J. (1996). "Inhibition of coagulation factors by recombinant barley serpin BSZx". FEBS Lett.394 (2): 165–8.
- Ostergaard H, Rasmussen SK, Roberts TH, Hejgaard J. (2000). "Inhibitory serpins from wheat grain with reactive centers resembling glutamine-rich repeats of prolamin storage proteins. Cloning and characterization of five major molecular forms". J Biol Chem. 275 (43): 33272–9.
- Yoo BC, Aoki K, Xiang Y, Campbell LR, Hull RJ, Xoconostle-Cázares B, Monzer J, Lee JY, Ullman DE, Lucas WJ. (2000). "Characterization of cucurbita maxima phloem serpin-1 (CmPS-1). A developmentally regulated elastase inhibitor". J Biol Chem. 275 (45): 35122–8.
- la Cour Petersen M, Hejgaard J, Thompson GA, Schulz A. (2005). "Cucurbit phloem serpins are graft-transmissible and appear to be resistant to turnover in the sieve element-companion cell complex". J Exp Bot. 56 (422): 3111–20.
- Roberts TH, Hejgaard J. (2008). "Serpins in plants and green algae".Funct Integr Genomics. 8 (1): 1–27.
- Lampl N, Alkan N, Davydov O, Fluhr R (2013). "Set-point control of RD21 protease activity by AtSerpin1 controls cell death in Arabidopsis". Plant J. 74 (3): 498–510.
- Ahn J-W, Atwell BJ, Roberts TH. (2009). "Serpin genes AtSRP2 and AtSRP3 are required for normal growth sensitivity to a DNA alkylating agent in Arabidopsis". BMC Plant Biol. 9: 52. doi:10.1186/1471-2229-9-52. PMC 2689219. ببمد 19426562. نسخة محفوظة 23 ديسمبر 2019 على موقع واي باك مشين.
- Kang S, Barak Y, Lamed R, Bayer EA, Morrison M. (2006). "The functional repertoire of prokaryote cellulosomes includes the serpin superfamily of serine proteinase inhibitors". Mol Microbiol. 60 (6): 1344–54.
- rving JA, Cabrita LD, Rossjohn J, Pike RN, Bottomley SP, Whisstock JC (2003). "The 1.5 A crystal structure of a prokaryote serpin: controlling conformational change in a heated environment". Structure. 11 (4): 387–97.
- Fulton KF, Buckle AM, Cabrita LD, Irving JA, Butcher RE, Smith I, Reeve S, Lesk AM, Bottomley SP, Rossjohn J, Whisstock JC. (2005). "The high resolution crystal structure of a native thermostable serpin reveals the complex mechanism underpinning the stressed to relaxed transition". J Biol Chem. 280 (9): 8435–42.
- Turner PC, Moyer RW (2002). "Poxvirus immune modulators: functional insights from animal models". Virus Res. 88 (1–2): 35–53.
- Richardson J, Viswanathan K, Lucas A (2006). "Serpins, the vasculature, and viral therapeutics". Front. Biosci. 11: 1042–56.
- Jiang J, Arp J, Kubelik D, Zassoko R, Liu W, Wise Y, Macaulay C, Garcia B, McFadden G, Lucas AR, Wang H (2007). "Induction of indefinite cardiac allograft survival correlates with toll-like receptor 2 and 4 downregulation after serine protease inhibitor-1 (Serp-1) treatment".Transplantation (Subscription required) 84 (9): 1158–67.
- Turner PC, Sancho MC, Thoennes SR, Caputo A, Bleackley RC, Moyer RW (1999). "Myxoma Virus Serp2 Is a Weak Inhibitor of Granzyme B and Interleukin-1β-Converting Enzyme In Vitro and Unlike CrmA Cannot Block Apoptosis in Cowpox Virus-Infected Cells". J. Virol. 73 (8): 6394–404.
- Munuswamy-Ramanujam G, Khan KA, Lucas AR (2006). "Viral anti-inflammatory reagents: the potential for treatment of arthritic and vasculitic disorders". Endocr Metab Immune Disord Drug Targets 6 (4): 331–43.
- Renatus M, Zhou Q, Stennicke HR, Snipas SJ, Turk D, Bankston LA, Liddington RC, Salvesen GS (2000). "Crystal structure of the apoptotic suppressor CrmA in its cleaved form". Structure 8 (7): 789–97.