صرع الفص الصدغي (Temporal lobe epilepsy) هو اضطراب مزمن في الجهاز العصبي يتميز بنوبات بؤرية متكررة غير محفَّزة (يعرف أيضا باسم النوبات الجزئية) التي تنشأ في الفص الصدغي للدماغ وتستمر حوالي دقيقة أو دقيقتين. صرع الفص الصدغي هو الشكل الأكثر شيوعا من الصرع ذو النوبات البؤرية.[2]
| صرع الفص الصدغي (TLE) | |
|---|---|
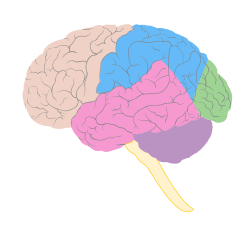
فصوص الدماغ، يظهر الفص الصدفي باللون الوردي.
| |
| معلومات عامة | |
| الاختصاص | طب نفسي، طب الجهاز العصبي |
| من أنواع | صرع جزئي |
| الموقع التشريحي | فص صدغي[1] |
| الإدارة | |
| أدوية | |
قد يعاني الأشخاص المصابون بصرع الفص الصدغي من نوبات جزئية بسيطة لا تؤثر إلا على الفص الصدغي، أو نوبات جزئية معقدة تنتشر في مناطق أخرى من الدماغ. خلال النوبات الجزئية البسيطة، تبقى بعض الناس واعية. اعتمادا على مناطق الدماغ المتضررة، قد يعاني الأشخاص المصابون بصرع الفص الصدغي من متاعب في الصدر والغثيان ومشاعر غير مبررة (مثل الفرح أو الخوف الشديدين)، أو فقدان الوعي (على سبيل المثال، التحديق أو السلوكيات المتكررة مثل الرمْش، النفضان، الإنظام، إلخ.. ). قد يكونون أيضا في حالة تشبه الحلم ولديهم تغييرات في الوعي أو الأحاسيس الغريبة أو الهلوسة ورؤية أو سماع أو الشعور أو شم أو تذوق أشياء ليست حقيقية. يبلغ بعض الناس عن "الهالات" (إشارات تحذيرية من اقتراب النوبة)، وعادة ما توصف بأنها مشاعر شديدة من "ديجا فو" أو الخوف. عادة ما تكون الهالات في الواقع هي نفسها النوبة البؤرية، ولكن بعض الناس يتطور لديهم تزايد منتظم للأعراض قبل كل نوبة بحيث يمكن أن يكون بمثابة تحذير.[2]
عادة ما يتم تشخيص صرع الفص الصدغي في مرحلة الطفولة أو في سن المراهقة. يقوم الأطباء بتشخيص صرع الفص الصدغي من خلال أخذ التاريخ الطبي واختبارات الدم وتصوير الدماغ (مخطط كهربية الدماغ، والأشعة المقطعية، والتصوير المَقطعي بالإصدار البوزيتروني، و / أو التصوير بالرنين المغناطيسي). يمكن أن يكون له عدد من الأسباب مثل إصابة الرأس والسكتة الدماغية والتهابات الدماغ وإصابات في تركيب الدماغ، أو أورام الدماغ، أو يمكن أن يكون مجهول السبب وليس لها سبب واضح. يتكون الخط الأول من العلاج من خلال الأدوية المضادة للتشنج. قد تكون الجراحة خيارا لبعض الحالات، خاصة عندما يكون هناك شذوذ يمكن ملاحظته في الدماغ. هناك خيار آخر للعلاج وهو التحفيز الكهربائي للدماغ من خلال غرس ما يسمى بجهاز تحفيز العصب المبهم (VNS).
أنواعه
يتم التعرف على أكثر من أربعين نوعا من الصرع وهي تنقسم إلى اثنتين من النوبات الرئيسية: النوبة الجزئية والنوبة المتعممة. تمثل النوبات الجزئية حوالي ستين في المئة من جميع حالات البالغين.[3] صرع الفص الصدغي هو الشكل الأكثر شيوعا من النوبة الجزئية.[4]
تعترف الرابطة الدولية لمكافحة الصرع بنوعين رئيسين من صرع الفص الصدغي: صرع الفص الصدغي المتوسطي (MTLE) الذي ينشأ في الحُصين، والتلفيف المجاور للحُصين واللوزة الدماغية الذين يقعون في الجانب الداخلي (الإنسي) للفص الصدغي، وصرع الفص الصدغي الجانبي (LTLE)، هو النوع النادر، الذي ينشأ في القشرة المخية الحديثة على السطح الخارجي (الجانبي) للفص الصدغي. تتميز النوبات في صرع الفص الصدغي الجانبي بميزات سمعية أو بصرية . صرع الفص الصدغي الجانبي ذو الصبغي المهيمن هو حالة وراثية نادرة.
في عام 2013، نشرت إيلاي تصنيف جديد لصرع الفص الصدغي المتوسطي على أساس تشوهات (تصلب الحُصين) وجدت على المستوى المجهري في أنسجة الحُصين.[5] مع ذلك، فإن التغيرات المَرَضية المستخدمة في التصنيف لا يمكن التنبؤ بها بسهولة من قبل الميزات السريرية.[6]
العلامات والأعراض
عندما تبدأ نوبة في الفص الصدغي، فإن الأعراض وسلوكيات المريض كما يراها المحيطين به، تعتمد على الموقع الدقيق لنقطة المنشأ، مكانها المحدد. في عام 1981، اعترفت الرابطة الدولية لمكافحة الصرع "إيلاي" بثلاثة أنواع من النوبات التي تحدث في صرع الفص الصدغي. استند التصنيف إلى نتائج مخطط كهربية الدماغ.[7]
النوبات الجزئية البسيطة
النوبات الجزئية البسيطة (SPS) تشمل مناطق صغيرة من الفص الصدغي مثل اللوزة والحصين. مصطلح "بسيطة" يعني أن مستوى وعي المريض لا يتغير أثناء النوبات. في صرع الفص الصدغي، عادة ما تسبب النوبة الجزئية البسيطة أحاسيس غير طبيعية فقط.
قد تكون هذه الأحاسيس: متعلقة بالذاكرة مثل ديجا فو (شعور بالألفة)، وجامي فو (شعور بعدم الألفة). فقدان الذاكرة؛ أو ذكرى واحدة أو مجموعة من الذكريات. أحاسيس سمعية (صوت غير طبيعي أو لحن)؛ أو تذوقية (طعم غير طبيعي)، أو شمية (رائحة غير موجودة فيزيائيا)، أو بصرية، أو حسية (التي تنطوي على أحاسيس على الجلد أو في الأعضاء الداخلية) . يبدو أن الاضطرابات الحسية تتحرك عبر الجسم. قد يتولد الحس المرافق (تحفيز شعور واحد من خلال اختبار شعور آخر). مشاعر مزعجة أو مبتهجة، أو الخوف، أو الغضب، وقد تحدث غيرها من العواطف أيضا.[8] في كثير من الأحيان، لا يستطيع المريض وصف ما يختبره من أحاسيس.[9]
النوبات الجزئية البسيطة يمكن أن تسمى "أورة" /"الهالات" من قبل الناس العاديين الذين تلتبس عندهم علامات التحذير من النوبات القادمة. بدلا من ذلك، ما يسمى هالة هو في الواقع النوبة الجزئية نفسها. الناس الذين يعانون فقط من نوبات جزئية بسيطة قد لا يعرفون ماذا تكون، ولا يسعون للمشورة الطبية حولها. قد تتحول أو لا تتحول النوبة الجزئية البسيطة إلى أي من أنواع النوبات المدرجة أدناه.[10]
النوبات الجزئية المعقدة
النوبات الجزئية المعقدة (CPS) هي النوبات التي تضعف الوعي إلى حد ما: فهي تحول دون قدرة الشخص على التفاعل بشكل طبيعي مع ما حوله. عادة ما تبدأ بنوبة جزئية بسيطة، ثم تنتشر إلى جزء أكبر من الفص الصدغي، مما يؤدي إلى ضعف الوعي. العلامات قد تشمل التحديق بدون حركة، حركة أوتوماتيكية من اليدين أو الفم، تعطل القدرة على الاستجابة للآخرين، التكلم بشكل غير طبيعي، أو غيرها من السلوكيات غير العادية.[11]
غالبا ما تُسبق هذه النوبات بتحذير أو هالة قبل حدوثها، وعندما تحدث فإنها عادة ما تستمر 1-2 دقائق فقط. من المألوف أن يبقى الفرد متعبا أو مرتبكا لمدة تصل إلى 15 دقيقة بعد حدوث النوبة. على الرغم من أنها قد لا تبدو ضارة، ويرجع ذلك إلى حقيقة أن الفرد لا يدخل في نوبات عادة، إلا أنها يمكن أن تكون ضارة للغاية إذا ترك الفرد وحده وحوله أشياء خطرة. على سبيل المثال، إذا كان الشخص المصاب بنوبات جزئية معقدة يقود وحده، يمكن أن يؤدي ذلك إلى سقوطه في هاوية، أو ما هو أسوأ فقد يقع حادث يضم عدة أشخاص. مع هذا النوع، بعض الناس لا يدركون حتى أنهم يعانون من النوبات ومعظم الوقت تنمحي ذكراهم عن قبل النوبة مباشرة أو بعدها. الإسعافات الأولية مطلوبة فقط إذا كانت هناك إصابة أو إذا كانت هذه هي المرة الأولى التي يدخل فيها الشخص في النوبة.
النوبة التوترية الرمعية
النوبات التي تبدأ في الفص الصدغي، ثم تنتشر لتشمل الدماغ كله والمعروفة باسم النوبات التوترية الرمعية الثانوية الانتشار. يتيبّس فيها كل من الذراعين، والجذع، والساقين (في مرحلة التوتر)، إما في وضع الانثناء أو الانبساط، ثم تليها رعشة (في المرحلة الرمعية / الارتجاجية). تعرف النوبات التوترية الرمعية ثانوية الانتشار بشكل عام في العامية بالتشنجات أو النوبات الكبرى. كلمة "الصرع الكبير" (grand mal) تأتي من المصطلح الفرنسي، وهي تعني الشدة الكبرى.
فترة ما بعد النوبة الصرعية
هناك فترة من التعافي حيث يحدث تغيير وظيفي في الجهاز العصبي بعد كل من هذه النوبات. هذه هي حالة ما بعد النوبة. درجة وطول العجز ما بعد النوبة يرتبط بشكل مباشر مع شدة نوع النوبة. النوبات الجزئية البسيطة غالبا ما تستمر أقل من ستين ثانية. قد تستغرق النوبات الجزئية المعقدة ما يصل إلى دقيقتين؛ والنوبة التوترية الرمعية قد تستمر لمدة تصل إلى ثلاث دقائق. فترة ما بعد النوبة في حالة النوبات الجزئية المعقدة والنوبة التوترية الرمعية، قد تستمر أطول بكثير من النوبة نفسها.
لأن إحدى وظائف الفص الصدغي الرئيسية هي الذاكرة ذات المدى القصير، فإن النوبات الجزئية المعقدة والنوبات الوترية الرمعية قد تسببان فقد الذاكرة لفترة النوبة. ونتيجة لذلك، المرضى الذين يعانون من نوبات الفص الصدغي المعقدة الجزئية والنوبات التوترية الرمعية قد لا يتذكرون تعرضهم لنوبة.
فترة ما بين النوبات الصرعية
الفحوص التي تدرس تدفق الدم الدماغي تظهر انخفاضا في إرواء الفص الصدغي في نفس الجانب بين النوبات في المرضى الذين يعانون من صرع الفص الصدغي المستعصي على العلاج. تشمل هذه التحقيقات H (2) (15) O ، والتصوير المقطعي بالإصدار البوزيتروني، والمسح الضوئي وتصوير الشريان النابض بالرنين المغناطيسي.[12]
الأسباب
تشمل أسباب صرع الفص الصدغي: التصلب الصدغي المتوسطي، وإصابات صدمات الدماغ، والتهابات الدماغ، مثل التهاب الدماغ والتهاب السحايا، وإصابات الدماغ نتيجة نقص الأكسجين، والسكتة الدماغية، والأورام الدماغية، والمتلازمات الوراثية. لا ينتج صرع الفص الصدغي عن اضطرابات الصحة العقلية أو هشاشة الشخصية.
النوبات المصحوبة بالحمى
على الرغم من أن النظرية مثيرة للجدل، فإن هناك صلة بين النوبات المصحوبة بالحمى (نوبات تتزامن مع حلقات من الحمى في الأطفال الصغار) وبين نوبات صرع الفص الصدغي اللاحقة، على الأقل الوبائية.[13][14][15][16]
فيروس الهربس البشري 6
في منتصف الثمانينيات، اقتُرح فيروس الهربس البشري 6 (HHV-6) كعلاقة سببية محتملة بين التشنجات الحموية وصرع الفص الصدغي المتوسط. مع ذلك، وعلى الرغم من أنه تم العثور على الفيروس في الأنسجة الفص الصدغي في جراحة لصرع الفص الصدغي، لم يتم التعرف عليه كعامل رئيسي في النوبات الحموية أو صرع الفص الصدغي.[17][18][19]
ريلين
أحيانا يُرى تشتت طبقة الخلايا الحبيبية في التلفيف الحصين المسنن في صرع الفص الصدغي، وقد تم ربطه بانخفاض تنظيم بروتين ريلين، وهو البروتين الذي يحافظ عادة على اندماج الطبقات عن طريق احتواء الهجرة العصبية. من غير المعروف ما إذا كانت التغيرات في عمل الريلين تلعب دورا في الصرع.[20][21]
الفيسيولوجيا المرضية
فقدان الخلايا العصبية
في صرع الفص الصدغي، هناك فقدان في الخلايا العصبية في المنطقة CA1 و CA3 من الحصين.[22][23] وهناك أيضا أضرار تلحق بالخلايا الدبقية الصغيرة والخلايا بين العصبية المثبطة في المنطقة الهلامية من الحصين (المنطقة الرابعة) وبالخلايا الحبيبية للتلفيف المسنن. في النماذج الحيوانية، يحدث فقدان الخلايا العصبية أثناء النوبات، ولكن في البشر يحدث فقدان الخلايا العصبية قبل النوبة الأولى ولا تستمر بالضرورة مع نشاط النوبة.[24][25][26][27][28] قد يؤدي فقدان الخلايا بين العصبية المثبطة الخاضعة لجابا إلى زيادة فرط نشاط الخلايا العصبية في الحصين مما يؤدي إلى النوبات المتكررة.[29] وفقا لفرضية "خلية السلة الخاملة"، الخلايا الدبقية الصغيرة عادة ما تثير خلايا السلة والتي بدورها تمنع الخلايا الحبيبية. فقدان الخلايا الدبقية يخفض عتبة بدء عمل الخلايا الحبيبية.[30]
تشتت الخلايا الحبيبية في التلفيف المسنن
تشتت الخلايا الحبيبية هو نوع من الهجرة التطورية وتغيير مرضي يحدث في الدماغ في حالات صرع الفص الصدغي والذي وصف لأول مرة في عام 1990.[31][32] الخلايا الحبيبية للتلفيف المسنن مرصوصة بإحكام لتكيل طبقة موحدة مغلفة، مع عدم وجود وصلات أحادية الشبكية. يوفر هذا الهيكل مُرشِّح لاستثارة الخلايا العصبية.[33]
في صرع الفص الصدغي، يتم فقدان الخلايا الحبيبية،[34] لا يعُد الهيكل مرصوص بشكل متقارب، وهناك تغييرات في اتجاه التشعبات. هذه التغييرات قد تكون أو لا تكون محفزة للصرع. على سبيل المثال، إذا أعيد اتصال تشعبات الخلايا الحبيبية، قد يكون بطريقة (من خلال سطوح رقائقية) تسمح بفرط الحساسية. مع ذلك، ليس كل المرضى لديهم تشتت الخلايا الحبيبية.
إنبات ألياف دبقية شاذة
الألياف الدبقية هي محاور عصبية لخلايا نوى بونتي. إنها تنغرز في نقير التلفيف المسنن والطبقة المتوسطة في منطقة CA3 موصلة المدخلات إلى كل من الخلايا العصبية المثيرة والمثبطة.[35][36]
في دماغ المصاب بصرع الفص الصدغي، حيث تتلف الخلايا الحبيبية أو تُفقد، "تنبت" المحاور العصبية والألياف الدبقية، من أجل إعادة الاتصال مع غيرها من تشعبات الخلايا الحبيبية. هذا مثال على إعادة تنظيم متشابك. وقد لوحظ هذا في الأنسجة البشرية في عام 1974 وفي النماذج الحيوانية في عام 1985. في صرع الفص الصدغي، تكون الألياف الدبقية أكبر منها في الدماغ العادي وقد تكون صلاتهم شاذة. يستمر إنبات الألياف الدبقية من أسبوع إلى شهرين بعد الإصابة.[37][38][39]
قد يخلق إنبات ألياف دبقية شاذة دوائر من ردود الفعل المستثارة التي تؤدي إلى نوبات الفص الصدغي. هذا واضح في التسجيلات[40] داخل الخلايا. تحفيز مناطق الألياف الشاذة يزيد من الاستجابة المستثارة المحتملة بعد المشبكية.[41][42]
مع ذلك، قد يثبط إنبات الخلايا الدبقية الشاذة الانتقال الاستثاري عن طريق تشابك مع خلايا السلة ( basket cells ) والتي هي خلايا عصبية مثبطة، وعن طريق جابا والببتيد العصبي Y التي هي ناقلات عصبية مثبطة. أيضا، في النماذج الحيوانية، تم تسجيل فرط استثارة الخلايا الحبيبية قبل حدوث إنبات الخلايا الدبقية الشاذة.[43][44][45][46]
العلاج
الأدوية المضادة للصرع
هناك العديد من الأدوية عن طريق الفم المتاحة لعلاج نوبات الصرع. كانت تسمى سابقا مضادات التشنج. مع ذلك، هذا المصطلح مضلل لأن معظم نوبات صرع الفص الصدغي في الواقع ليست تشنجات. المصطلح الحديث هو الأدوية المضادة للصرع (AEDs). تقريبا كل الأدوية المضادة للصرع تعمل عن طريق خفض إثارة الخلايا العصبية، على سبيل المثال، عن طريق إغلاق قنوات الصوديوم السريعة أو البطيئة، أو عن طريق تعديلات في قنوات الكالسيوم. أو عن طريق تعزيز تثبيط الخلايا العصبية، على سبيل المثال عن طريق تعزيز تأثير الناقلات العصبية المثبطة مثل جابا.
في صرع الفص الصدغي، أقدم الأدوية المضادة للصرع الأكثر شيوعا هي الفينيتوين، وكاربامازيبين، وبريميدون، وفالبروات، والفينوباربيتال. الأدوية الجديدة، مثل جابابنتين، وتوبيراميت، وليفيتيراسيتام، ولاموتريجين، وبريجابالين، وتياجابين، ولاكوساميد، وزونيساميد، جميعها أدوية واعدة بفعالية مماثلة، مع احتمال آثار جانبية أقل. فيلبامات وفيجاباترين هي أحدث الأدوية المضادة للصرع، ولكن يمكن أن يكون لها آثار سلبية خطيرة لذلك فهي لا تعتبر الخط الأول للعلاج.
ما يصل إلى ثلث المرضى الذين يعانون من الصرع الفص الصدغي الأنسي لن يكون لديهم السيطرة الكافية على النوبات مع الدواء وحده. للمرضى الذين يعانون من صرع الفص الصدغي الأنسي الذين لا تزال لديهم النوبات خارجة عن السيطرة بعد محاولات العلاج بالأدوية المضادة للصرع (هذا هو الصرع المستعصي على الدواء)، يمكن عندها النظر في الاستئصال الجراحي للفص الصدغي المتأثر.[47]
التدخلات الجراحية
أجريت جراحة الصرع منذ ستينيات القرن التاسع عشر، وقد لاحظ الأطباء أنها فعالة للغاية في تحرير المريض من النوبات. ومع ذلك، لم تكن قبل عام 2001 قد أجريت دراسة سليمة علميا لدراسة فعالية استئصال الفص الصدغي.[48]
يمكن أن ينتج عن جراحة الفص الصدغي انخفاض الوظيفة الإدراكية. ومع ذلك، بعد استئصال الفص الصدغي، تُدعم وظيفة الذاكرة من قبل الفص الصدغي المعاكس، وتطويع الفص الجبهي.[49][50]
قد يساعد إعادة التأهيل المعرفي أيضا.[51]
علاجات أخرى
إذا كان الشخص ليس المرشح الأمثل لجراحة الصرع، تكون هناك خيارات علاجية أخرى تتضمن، الأدوية الجديدة المضادة للصرع (بما في ذلك التجريبية)، وتحفيز العصب المبهم، وفي الأطفال، النظام الغذائي المولد للكيتون. وتشمل السبل الأخرى للعلاج المحفزات العصبية المؤثرة على قشرة الدماغ ، التحفيز العميق للدماغ، الجراحة الإشعاعية التجسيمية، مثل سكين غاما، والتذرية الليزرية.[52]
المضاعفات وتوقعات سير المرض
البداية منذ الطفولة
بعد البداية في الطفولة سوف تؤول ثلث الحالات إلى صرع الفص الصدغي، قد يوجد توقف دائم يصل إلى ما متوسطه 20 عاما. ويتوقع أن يؤدي حدوث إصابة مثل تصلب الحصين (ندبة في الحصين)، أو ورم، أو خلل التنسج على التصوير بالرنين المغناطيسي (MRI) إلى استعصاء النوبات على العلاج.[53]
الشخصية
تأثير صرع الفص الصدغي على الشخصية هي الملاحظة التاريخية التي يرجع تاريخها إلى بداية القرن التاسع عشر.
يعتبر تغيير الشخصية والسلوك في صرع الفص الصدغي حالة مزمنة عندما تستمر لأكثر من ثلاثة أشهر. قد يكون موقع عصبي معين (خاصة على سطح الفص الصدغي) هو منشأ هذه التغييرات.[54]
الاكتئاب
يرتفع معدل انتشار الاكتئاب لدى الأفراد الذين يعانون من الصرع الفص الصدغي. على الرغم من أن الآثار النفسية والاجتماعية للصرع قد تكون سببية، فإن هناك أيضا روابط بين الظواهر وعلم الأعصاب بين صرع الفص الصدغي والاكتئاب.[55]
الذهان
قد يحدث الذهان في فترات ما قبل نوبة الصرع، وما بعد نوبة الصرع، وخلال النوبة في صرع الفص الصدغي.[56]
الذاكرة
الفص الصدغي وخاصة الحصين يلعب دورا هاما في عملية الذاكرة. تتشكل الذاكرة الواعية (الذكريات التي يمكن استدعاؤها بوعي) في منطقة بالحصين تسمى التلفيف المسنن.
يرتبط صرع الفص الصدغي باضطرابات الذاكرة وفقدان الذاكرة. تشير النماذج الحيوانية والدراسات السريرية إلى أن فقدان الذاكرة يرتبط بفقدان الخلايا العصبية للفص الصدغي في صرع الفص الصدغي. العجز في الذاكرة اللفظية يرتبط مع فقدان الخلايا الهرمية في صرع الفص الصدغي. يحدث هذا التأثير على اليسار أكثر في فقدان الذاكرة اللفظية. يكون فقدان الخلايا العصبية على اليمين أكثر وضوحا في فقدان الذاكرة غير اللفظي (فقدان الذاكرة البصري الفراغي).[57][58][59][60][61]
التشخيص
يمكن أن يتم تشخيص الصرع الفص الصدغي عن طريق الطرق / الاختبارات التالية:[62]
- التصوير بالرنين المغناطيسي
- الأشعة المقطعية
- التصوير المقطعي بالإصدار البوزيتروني
- تخطيط كهربية الدماغ
- تصوير مغناطيسية الدماغ
التشخيص التفريقي
من بين التشخيصات التفريقية التي نبحث عنها: نوبات الهلع، وخلل الحركة المتأخر، وصرع الفص القفوي، والنوبات النفسية (على الرغم من أن هذه ليست قائمة مفصلة)[63]
ربط مع التدين
كان نورمان جيسكويند هو أول من سجل وصنف الأعراض والعلامات غير الطبيعية لصرع الفص الصدغي . وجد مجموعة من الأعراض التي شملت هيبيرغرافيا، والتدين المبالغ فيه ، والانهيار، والتحذلق، وتسمى الآن متلازمة جيسكويند.
اكتشف فيليانور إس. راماشاندران الأساس العصبي للتدين المبالغ فيه في صرع الفص الصدغي باستخدام استجابة الجلد الجلفانية (GSR)، التي ترتبط مع الإثارة العاطفية، لتحديد ما إذا كانت ظاهرة التدين المبالغ فيه عند مرضي صرع الفص الصدغي راجعة إلى حالة عاطفية متزايدة عموما أو أنها محددة بمحفزات دينية . قدم راماشاندران بعرض موضوعين بشكل محايد، أحدهما يحوي إثارة جنسية والآخر كلمات دينية أثناء قياس استجابة الجلد الجلفانية. كان راماشاندران قادرا على أن يظهر أن المرضى الذين يعانون من صرع الفص الصدغي يظهرون ردود فعل عاطفية متأثرين بالكلمات الدينية، وتضاؤل الاستجابات للكلمات المشحونة جنسيا، واستجابات طبيعية للكلمات المحايدة. وقد عرضت هذه الدراسة على أنها دراسة مختصرة في مؤتمر علم الأعصاب وأُشير إليها في كتاب راماشاندران، "خيالات في الدماغ" (بالانجليزية:Phantoms in the Brain)،[64] لكنها لم تنشر أبدا في الصحافة العلمية التي استعرضها النظراء.[65]
أظهرت دراسة حديثة أن التدين المتأصل والتدين خارج الدين المنظم كان أعلى في المرضى الذين يعانون من الصرع مما كان عليه في الخاضعين للعلاج.[66] انخفاض مستوى التعليم، وخلفية من النشاط غير الطبيعي لمخطط رسم الدماغ ، وتصلب الحصين يمكن أن تكون عوامل مساهمة في المبالغة في التدين في صرع الفص الصدغي.[67]
اقترح صرع الفص الصدغي كتفسير مادي للتجارب الإلهامية عند الشخصيات الدينية البارزة مثل إبراهيم وموسى ويسوع ومحمد وبولس الطرسوسي وجوزيف سميث. وصفت هذه التجارب بأنها تفاعلات معقدة مع رؤى، ولكن تفتقر إلى القوالب النمطية،[68] ويعتقد أن عقيدة البابا بيوس التاسع للمفهوم الطاهر قد تأثرت بصرعه الجزئي الذي تم تشخيصه على يد الطب الشرعي.[69] وقد اقترح أيضا أن رؤى جان دارك ربما كانت تعبيرا عن الصرع الجزئي.[70] في الآونة الأخيرة، وجدت حالة واحدة تاريخية بصرع الفص الصدغي شهدت رؤية الإله بعد نوبة من صرع الفص الصدغي، وخلال خضوعه لمخطط رسم المخ. ذكر المريض أن الله قد أرسله إلى العالم "لجلب الخلاص لشعب إسرائيل".[71] ألهم الرابط المزعوم بين صرع الفص الصدغي والتدين عمل مايكل بيرسينجر والعديد من الباحثين الآخرين في مجال علم الأعصاب، ولكن البعض شكك في الأدلة على وجود صلة بين الصرع الفص الصدغي والتدين.[72][73] تتناول رواية لينغ أويك، لكاتبها مارك سالزمان موضوع صرع الفص الصدغي والدين.
مقالات ذات صلة
مصادر
- معرف أنطولوجية المرض: http://www.disease-ontology.org/?id=DOID:3328 — تاريخ الاطلاع: 15 مايو 2019 — الاصدار 2019-05-13
- NINDS (1 February 2016), The Epilepsies and Seizures: Hope Through Research, National Institute of Neurological Disorders and Stroke (NINDS), U.S. National Institutes of Health (NIH), مؤرشف من الأصل في 19 ديسمبر 2016,08 أغسطس 2016
- Engel J (2001). "A proposed diagnostic scheme for people with epileptic seizures and with epilepsy: report of the ILAE Task Force on Classification and Terminology". Epilepsia. 42 (6): 796–803. doi:10.1046/j.152a8-1157.2001.10401.x. PMID 11422340. مؤرشف من الأصل في 02 مارس 2020.
- Wiebe S (May 2000). "Epidemiology of temporal lobe epilepsy". Can J Neurol Sci. 27 Suppl 1: S6–10, discussion S20–1. doi:10.1017/s0317167100000561. PMID 10830320.
- Blumke I, et al. (2013). "International consensus classification of hippocampal sclerosis in temporal lobe epilepsy: a task force report from the ILAE commission on diagnostic methods". Epilepsia. 54 (7): 1315–1329. doi:10.1111/epi.12220. PMID 23692496.
- Fauser S, et al. (2013). "Is there evidence for clinical differences related to the new classification of temporal lobe cortical dysplasia?". Epilepsia. 54 (5): 909–917. doi:10.1111/epi.12147. PMID 23551067. مؤرشف من الأصل في 02 مارس 2020.
- ILAE (1981). "Proposal for revised clinical and electroencephalographic classification of epileptic seizures". Epilepsia. 22: 489–501. doi:10.1111/j.1528-1157.1981.tb06159.x. PMID 6790275.
- Marcel Neckar; Petr Bob (11 January 2016). "Synesthetic associations and psychosensory symptoms of temporal epilepsy". Neuropsychiatric Disease and Treatment. 12: 109–12. doi:10.2147/NDT.S95464. PMC . PMID 26811683.
- Sacks, Oliver (2012). Hallucinations. Knopf. صفحات 144. . مؤرشف من الأصل في 2 مارس 2020.
- "Simple partial seizures." Johns Hopkins Medicine website. Accessed 2 February 2014. نسخة محفوظة 24 مايو 2014 على موقع واي باك مشين.
- "Temporal lobe epilepsy." Mayo Clinic patient information website. Accessed 2 February 2014. نسخة محفوظة 21 أغسطس 2017 على موقع واي باك مشين.
- Lim Y. M.; et al. (2008). "Usefulness of pulsed arterial spin labeling MR imaging in mesial temporal lobe epilepsy". Epilepsy Res. 82 (2–3): 183–189. doi:10.1016/j.eplepsyres.2008.08.001. PMC . PMID 19041041.
- Shinnar S, et al. (2008). "Phenomenology of prolonged febrile seizures: results of the FEBSTAT study". Neurology. 71 (3): 170–176. doi:10.1212/01.wnl.0000310774.01185.97. PMID 18525033. مؤرشف من الأصل في 02 مارس 2020.
- Tarkka R, et al. (2003). "Febrile seizures and mesial temporal sclerosis: no association in a long-term follow-up study". Neurology. 60 (2): 215–218. doi:10.1212/01.WNL.0000037482.55894.B1. PMID 12552033.
- Berg A. T.; et al. (1999). "Childhood-onset epilepsy with and without preceding febrile seizures". Neurology. 53 (8): 1742–1748. doi:10.1212/WNL.53.8.1742. PMID 10563622.
- Provenzale J. M.; et al. (2008). "Hippocampal MRI signal hyperintensity after febrile status epilepticus is predictive of subsequent mesial temporal sclerosis". Am J Roentgenol. 190 (4): 976–983. doi:10.2214/AJR.07.2407. PMID 18356445. مؤرشف من الأصل في 02 مارس 2020.
- Karatas H, Gurer G, Pinar A, et al. (January 2008). "Investigation of HSV-1, HSV-2, CMV, HHV-6 and HHV-8 DNA by real-time PCR in surgical resection materials of epilepsy patients with mesial temporal lobe sclerosis". J. Neurol. Sci. 264: 151–6. doi:10.1016/j.jns.2007.08.010. PMID 17804017. مؤرشف من الأصل في 04 أكتوبر 2017.
- Fotheringham J.; et al. (2007). "Association of Human Herpesvirus-6B with Mesial Temporal Lobe Epilepsy". PLoS Med. 4 (5): e180. doi:10.1371/journal.pmed.0040180. PMC . PMID 17535102.
- Donati D, et al. (2003). "Detection of human herpesvirus-6 in mesial temporal lobe epilepsy surgical brain resections". Neurology. 61 (10): 1405–1411. doi:10.1212/01.WNL.0000094357.10782.F9. PMID 14638964.
- Haas C. A.; et al. (2002). "Role for reelin in the development of granule cell dispersion in temporal lobe epilepsy". J. Neurosci. 22 (14): 5797–6802. PMID 12122039.
- Heinrich C, et al. (2006). "Reelin deficiency and displacement of mature neurons, but not neurogenesis, underlie the formation of granule cell dispersion in the epileptic hippocampus". J. Neurosci. 26 (17): 4701–4713. doi:10.1523/JNEUROSCI.5516-05.2006. PMID 16641251.
- de Lanerolle N. C. and Noebels J. L. (ed.) Jasper's basic mechanisms of the epilepsies: histopathology of human epilepsy. Oxford University Press 2012 chapter 30 .
- Liu Z, et al. (1994). "Quantitative evaluation of neuronal loss in the dorsal hippocampus in rats with long-term pilocarpine seizures". Epilepsy Research. 17 (3): 237–247. doi:10.1016/0920-1211(94)90054-x. PMID 8013446.
- Blümcke I, et al. (2000). "Loss of hilar mossy cells in Ammon's horn sclerosis". Epilepsia. 40 (6): 174–180. doi:10.1111/j.1528-1157.2000.tb01577.x. PMID 10999540.
- Sloviter R. S. (1987). "Decreased hippocampal inhibition and a selective loss of interneurons in experimental epilepsy". Science. 235 (4784): 73–76. doi:10.1126/science.2879352. PMID 2879352.
- Kobayashi M.; Buckmaster P. S (2003). "Reduced inhibition of dentate granule cells in a model of temporal lobe epilepsy". Journal of Neuroscience. 23 (6): 2440–2452. PMID 12657704.
- Bouilleret V, et al. (1999). "Recurrent seizures and hippocampal sclerosis following intrahippocampal kainate injection in adult mice: electroencephalography, histopathology and synaptic reorganization similar to mesial temporal lobe epilepsy". Neuroscience. 89 (3): 717–729. doi:10.1016/s0306-4522(98)00401-1. PMID 10199607.
- Thorn M, et al. (2005). "Quantitative post-mortem study of the hippocampus in chronic epilepsy: seizures do not inevitably cause neuronal loss". Brain. 128 (6): 1344–1357. doi:10.1093/brain/awh475. PMID 15758032.
- Meldrum B (1989). "GABAergic mechanisms in the pathogenesis and treatment of epilepsy". British Journal of Clinical Pharmacology. 1: 3–11. doi:10.1111/j.1365-2125.1989.tb03454.x. PMC . PMID 2667605.
- Sloviter R. S.; et al. (2003). "Dormant basket cell" hypothesis revisited: relative vulnerabilities of dentate gyrus mossy cells and inhibitory interneurons after hippocampal status epilepticus in the rat". Journal of Comparative Neurology. 459 (1): 44–76. doi:10.1002/cne.10630. PMID 12629666.
- Thom M, et al. (2005). "Cell proliferation and granule cell dispersion in human hippocampal sclerosis". J Neuropathol Exp Neurol. 64 (3): 194–201. PMID 15804050.
- Houser C. R. (1990). "Granule cell dispersion in the dentate gyrus of humans with temporal lobe epilepsy". Brain Research. 535 (2): 195–204. doi:10.1016/0006-8993(90)91601-c. PMID 1705855.
- Nadler J. V. (2003). "The recurrent mossy fiber pathway of the epileptic brain". Neurochemical Research. 28 (11): 1649–1658. doi:10.1023/a:1026004904199. PMID 14584819.
- Freimanr T. M.; et al. (2011). "Granule cell dispersion in temporal lobe epilepsy is associated with changes in dendritic orientation and spine distribution". Experimental Neurology. 229 (2): 332–338. doi:10.1016/j.expneurol.2011.02.017. PMID 21376037.
- Lim C, et al. (1997). "Connections of the hippocampal formation in humans: I. The mossy fiber pathway". Journal of Comparative Neurology. 385 (3): 325–351. doi:10.1002/(sici)1096-9861(19970901)385:3<325::aid-cne1>3.0.co;2-5. PMID 9300763.
- Henze D. A.; et al. (2000). "The multifarious hippocampal mossy fiber pathway: a review". Neuroscience. 98 (3): 407–427. doi:10.1016/s0306-4522(00)00146-9. PMID 10869836.
- Scheibel P, et al. (1974). "The hippocampal-dentate complex in temporal lobe epilepsy". Epilepsia. 15 (1): 55–80. doi:10.1111/j.1528-1157.1974.tb03997.x. PMID 4523024.
- Steward O. "Lesion-induced synapse reorganization in the hippocampus of cats: sprouting of entorhinal, commissural/associational, and mossy fiber projections after unilateral entorhinal cortex lesions, with comments on the normal organization of these pathways." Hippocampus 1992 2(3) pp. 247-268 ببمد 1284974 doi:10.1002/hipo.450020305
- Babb T. L.; et al. (1991). "Synaptic reorganization by mossy fibers in human epileptic fascia dentata". Neuroscience. 42 (2): 351–363. doi:10.1016/0306-4522(91)90380-7. PMID 1716744.
- Buckmaster P, et al. (2002). "Axon sprouting in a model of temporal lobe epilepsy creates a predominantly excitatory feedback circuit". Journal of Neuroscience. 22 (15): 6650–6658. PMID 12151544.
- Nadler J. V.; et al. (1985). "Evidence of functional mossy fiber sprouting in hippocampal formation of kainic acid-treated rats". Journal of Neuroscience. 5 (4): 1016–1022. PMID 3981241.
- Scharfman H. E.; et al. (2003). "Electrophysiological evidence of monosynaptic excitatory transmission between granule cells after seizure-induced mossy fiber sprouting". Journal of Neurophysiology. 90 (4): 2536–2547. doi:10.1152/jn.00251.2003. PMID 14534276.
- Sloviter R. S.; et al. (2006). "Kainic acid-induced recurrent mossy fiber innervation of dentate gyrus inhibitory interneurons: possible anatomical substrate of granule cell hyperinhibition in chronically epileptic rats". Journal of Comparative Neurology. 494 (6): 960. doi:10.1002/cne.20850. PMC . PMID 16385488.
- Sloviter R. S.; et al. (2003). "Dormant basket cell hypothesis revisited: relative vulnerabilities of dentate gyrus mossy cells and inhibitory interneurons after hippocampal status epilepticus in the rat". Journal of Comparative Neurology. 459 (1): 44–76. doi:10.1002/cne.10630. PMID 12629666.
- Tu B, et al. (2005). "Spontaneous release of neuropeptide Y tonically inhibits recurrent mossy fiber synaptic transmission in epileptic brain". Journal of Neuroscience. 25 (7): 1718–1729. doi:10.1523/JNEUROSCI.4835-04.2005. PMID 15716408.
- Schwarzer C.; Sperk G. (1995). "Hippocampal granule cells express glutamic acid decarboxylase-67 after limbic seizures in the rat". Neuroscience. 69 (3): 705–709. doi:10.1016/0306-4522(95)00348-m. PMID 8596641.
- Kwan P (2000). "Early identification of refractory epilepsy". NEJM. 342 (5): 314–319. doi:10.1056/NEJM200002033420503. PMID 10660394.
- Wiebe S, et al. (2001). "A randomized, controlled trial of surgery for temporal lobe epilepsy". NEJM. 345 (5): 311–318. doi:10.1056/NEJM200108023450501. PMID 11484687.
- Cheung; et al. (2009). "Pre- and postoperative fMRI and clinical memory performance in temporal lobe epilepsy". J Neurol Neurosurg Psychiatry. 80 (10): 1099–1106. doi:10.1136/jnnp.2009.173161. PMID 19389718.
- Maccotta L, et al. (2007). "Changing frontal contributions to memory before and after medial temporal lobectomy". Cereb Cortex. 17 (2): 443–456. doi:10.1093/cercor/bhj161. PMID 16547345.
- Helmstaedter C, et al. (2008). "The effects of cognitive rehabilitation on memory outcome after temporal lobe epilepsy surgery". Epilepsy Behav. 12 (3): 402–409. doi:10.1016/j.yebeh.2007.11.010. PMID 18155965.
- MR-guided stereotactic laser ablation of epileptogenic foci in children - Epilepsy & Behavior
- Spooner C. G. (2006). "New-onset temporal lobe epilepsy in children: lesion on MRI predicts poor seizure outcome". Neurology. 67 (12): 2147–2153. doi:10.1212/01.wnl.0000248189.93630.4f. PMID 17082466.
- Geschwind N. [1] Registration required to view.
- Butler T, et al. (2012). "Cortical thickness abnormalities associated with depressive symptoms in temporal lobe epilepsy". Epileps Behav. 23 (1): 64–67. doi:10.1016/j.yebeh.2011.10.001. PMC . PMID 22099527.
- Engel J. (2008) Epilepsy: A Comprehensive Textbook Lippincott Williams & Wilkins vol 3 , 9780781757775. p 2115 نسخة محفوظة 25 مارس 2017 على موقع واي باك مشين.
- Sutula T, et al. (2002). "Repeated brief seizures induce progressive hippocampal neuron loss and memory deficits". Progress in Brain Research. 135: 95–110. doi:10.1016/S0079-6123(02)35010-6. PMID 12143373.
- Sass K. J.; et al. (1992). "Specificity in the correlation of verbal memory and hippocampal neuron loss: dissociation of memory, language, and verbal intellectual ability". Journal of Clinical & Experimental Neuropsychology. 14 (5): 662–672. doi:10.1080/01688639208402854. PMID 1474137.
- Babb T, et al. (1993). "Hippocampal neuron loss and memory scores before and after temporal lobe surgery for epilepsy". Archives of Neurology. 50 (8): 812–817. doi:10.1001/archneur.1993.00540080023008. PMID 8352666.
- Sass K. J.; et al. (1990). "Verbal memory impairment correlates with hippocampal pyramidal cell density". Neurology. 40 (11): 1694–1697. doi:10.1212/wnl.40.11.1694. PMID 2234424.
- Reminger S. L.; et al. (2004). "Bilateral hippocampal volume predicts verbal memory function in temporal lobe epilepsy". Epilepsy & Behavior. 5 (5): 687–695. doi:10.1016/j.yebeh.2004.06.006. PMID 15380120.
- "Temporal Lobe Epilepsy Workup: Approach Considerations, Computed Tomography Scanning, Magnetic Resonance Imaging". emedicine.medscape.com. مؤرشف من الأصل في 21 فبراير 201924 أغسطس 2016.
- "Temporal Lobe Epilepsy; TLE medical Information Page | Patient". Patient. مؤرشف من الأصل في 3 أبريل 201924 أغسطس 2016.
- Ramachandran, V. and Blakeslee (1998). Phantoms in the Brain.
- Craig Aaen-Stockdale (2012). "Neuroscience for the Soul". The Psychologist. 25 (7): 520–523. مؤرشف من الأصل في 24 مايو 2019.
- Tedrus, Glória Maria Almeida Souza; Fonseca, Lineu Corrêa; Fagundes, Tatiane Mariani; da Silva, Gabriela Leopoldino (2015). "Religiosity aspects in patients with epilepsy". Epilepsy & behavior : E&B. 50: 67–70. doi:10.1016/j.yebeh.2015.06.003. PMID 26133113.
- Tedrus, Glória Maria Almeida Souza; Fonseca, Lineu Corrêa; Höehr, Gabriela Chaves (2013). "Spirituality aspects in patients with epilepsy". Seizure. 23 (1): 25–8. doi:10.1016/j.seizure.2013.09.005. PMID 24094727.
Patients with mesial temporal lobe epilepsy with hippocampal sclerosis (MTLE-HS) had significantly higher SSRS scores than those with other epileptic syndromes and, than in individuals of the CG (control Group)
- Murray E. D.; et al. (2012). "The role of psychotic disorders in religious history considered". J Neuropsychiatry Clin Neuroscience. 24 (4): 410–426. doi:10.1176/appi.neuropsych.11090214. PMID 23224447.
- Sirven, Joseph I; Drazkowski, Joseph F; Noe, Katherine H (2007). "Seizures among public figures: lessons learned from the epilepsy of Pope Pius IX". Mayo Clinic Proceedings. 82 (12): 1535–1540. doi:10.1016/S0025-6196(11)61100-2. PMID 18053463.
- d'Orsi, Giuseppe; Tinuper, Paolo (2006). "I heard voices...": from semiology, a historical review, and a new hypothesis on the presumed epilepsy of Joan of Arc". Epilepsy & behavior. 9 (1): 152–157. doi:10.1016/j.yebeh.2006.04.020. PMID 16750938.
- Arzy, Shahar; Schurr, Roey (2016). "God has sent me to you": Right temporal epilepsy, left prefrontal psychosis". Epilepsy & behavior. 60: 7–10. doi:10.1016/j.yebeh.2016.04.022. PMID 27176877. ضع ملخصا.
In this patient, a messianic revelation experience occurred several hours after a complex partial seizure of temporal origin, compatible with postictal psychosis (PIP)
- Craig Aaen-Stockdale (2012). "Neuroscience for the Soul". The Psychologist. 25 (7): 520–523. مؤرشف من الأصل في 27 أغسطس 2019.
- Benson, D.F. & Hermann, B.P. (1998) Personality disorders. In J. Engel Jr. & T.A. Pedley (Eds.) Epilepsy: A comprehensive textbook. Vol. II (pp. 2065–2070). Philadelphia: Lippincott–Raven.