| Causes | Clostridium botulinum ou toxine botulique |
|---|---|
| Incubation min | 6 h |
| Incubation max | 10 j |
| Symptômes | Vision floue (en), mydriase, ptosis, constipation, météorisme abdominal, rétention aiguë d'urine, diplopie, dystonie neurovégétative, xérostomie, dysarthrie, faiblesse musculaire (en) et insuffisance respiratoire aiguë |
| Traitement | Inactivation métabolique, médecine hyperbare, lavage gastrique, lavement, traitement symptomatique et ventilation mécanique |
|---|---|
| Médicament | Heptavalent botulism antitoxin (en), clindamycine, métronidazole et ipidacrine (en) |
| Spécialité | Infectiologie |
| CISP-2 | D70 |
|---|---|
| CIM-10 | A05.1 |
| CIM-9 | 005.1,040.41,040.42 |
| DiseasesDB | 2811 |
| MedlinePlus | 000598 |
| eMedicine | 213311 |
| MeSH | D001906 |
| Patient UK | Botulism |
![]() Mise en garde médicale
Mise en garde médicale
Le botulisme (dérivé savamment — en 1879 — du radical latin botulus, « boudin », d'après les premiers aliments mis en cause) est une maladie paralytique rare mais grave, le plus souvent d'origine alimentaire, touchant les humains et les animaux. Elle est due à une neurotoxine bactérienne, la toxine botulique (anciennement appelée toxine botulinique) ou botuline, produite par plusieurs bactéries anaérobies du genre Clostridium, la plus connue étant Clostridium botulinum.
La toxine botulique est la plus puissante de toutes les toxines connues dans la nature. Il en existe sept types antigéniques distincts (nommés A à G)[1]. Elle est fragile, ne résistant pas à la chaleur, ni à une exposition prolongée à l'oxygène. L'intoxication se produit généralement par des aliments mal conservés (salaisons, séchage, fumage, conserves … le plus souvent familiales) à la suite de défaut technique ou de manque d'hygiène lors de la fabrication[2]. En pratique, elle ne survient presque jamais avec des produits frais.
Chez l'être humain, il existe trois variétés de botulisme : le botulisme alimentaire (toxi-infection alimentaire due à la toxine présente dans l'aliment), le botulisme par blessure, dû à la toxine produite dans une blessure infectée par Clostridium botulinum ; et le botulisme infantile, provoqué par la consommation de spores de bactéries, qui se développent ensuite dans les intestins où elles libèrent la toxine.
Non traitées, toutes les formes de botulisme peuvent être mortelles. La suspicion de botulisme constitue une alerte de santé publique, déclenchant une enquête de surveillance épidémiologique recherchant l'aliment causal, et son origine familiale ou industrielle.
La maladie n'est pas contagieuse et ne procure pas d'immunité.
Historique
Période clinique et familiale
La maladie existe probablement depuis que les humains conservent leurs aliments (séchage, fumage, salage, etc.)[3], mais au regard médical, elle ne se distingue qu'à la fin du XVIIIe siècle.
Au début du XIXe siècle, les autorités médicales du duché de Wurtemberg sont alertées par une augmentation du nombre de cas d'empoisonnement fatal par ingestion de nourriture avariée. La cause identifiée est une diminution des précautions d'hygiène dans la préparation des charcuteries et salaisons fermières à la campagne en raison de la pauvreté générale provoquée dans la population par les guerres napoléoniennes. En 1802, le gouvernement de Stuttgart émet une mise en garde publique sur « la consommation dangereuse de boudin noir fumé », l'agent toxique supposé étant l'acide prussique[4].
Ce n'est que vingt ans plus tard, en 1822 que le poète et médecin Justinus Kerner, alors médecin de district, rend des rapports officiels où il conclut en identifiant correctement l'origine de ce nouveau poison qu'il pense être un acide gras. Il donne dès cette époque une description détaillée des symptômes du botulisme et a l'intuition des applications thérapeutiques potentielles de ce poison. En 1870, le médecin allemand Müller renomme la « maladie de Kerner » en botulisme (du latin botulus, évoquant le boyau animal utilisé en charcuterie et au-delà tout boyau farci, dont le boudin).
Une maladie similaire est aussi décrite en Russie, au XIXe siècle, sous le terme « ichthiosismus », liée à l'ingestion de poissons fumés ou marinés[5].
Période bactériologique et industrielle
En 1895, à la suite d'un dramatique foyer de botulisme apparu lors d'une fête d'un bourg belge[5] (Ellezelles[6]), la bactérie responsable est identifiée en laboratoire par le microbiologiste belge Émile van Ermengem. Il s'agit d'un bacille anaérobie, sporulé et producteur de toxines, qu'il nomme « Bacillus botuliniques »[7].
Aux États-Unis, les premiers cas reconnus de botulisme surviennent en 1899[5]. En 1904, une mauvaise stérilisation des conserves est mise en évidence à l'occasion de l'intoxication de 32 personnes (21 malades et 11 morts) par Landman qui isole une souche de Bacillus botulinus s'étant développée dans des haricots blancs en conserve. Des cas analogues répétés se produisent aux États-Unis, liés aux débuts de la commercialisation des conserves alimentaires.
À partir des années 1920, des études scientifiques intensives, commanditées par l'industrie alimentaire américaine (la National Canners Association[8]), sont menées sur le botulisme et le conditionnement industriel des conserves. Ces études sont à l'origine de pratiques et procédures, permettant un conditionnement sûr, toujours en vigueur dans l'industrie agroalimentaire[5].
En 1923, Bergey classe « Bacillus botulinus » dans le genre Clostridium en le renommant Clostridium botulinum. De 1910 à 1970, sept différents types de toxines (A à G) sont isolées. En 2014, un huitième type H est identifié.
Types

Pour la bactériologie et la toxine botulique, voir :
Il existe sept types de toxines, désignés par la lettre A à G (subdivisés en sous-types chiffrés), qui n'ont pas de protection croisée entre elles (une antitoxine qui en neutralise une, ne neutralise pas les autres).
La maladie humaine est due aux types A, B, E, et rarement F.
La maladie animale est surtout due aux types C, D, E, rarement A, F et G.
- Botulisme de type A (sérotype pathogène pour l'Homme et rarement certains animaux), le plus grave pour l'Homme, est lié aux conserves de légumes et produits laitiers, dominant aux États-Unis.
- Botulisme de type B (sérotype pathogène pour l'Homme), moins grave, lié aux conserves de viande et charcuteries, dominant en France et en Europe centrale.
- Botulisme de type C (sérotype pathogène pour certains animaux dont les bovins et oiseaux), plutôt dans le Grand Ouest en France depuis les années 1980.
- Botulisme de type D (sérotype pathogène pour certains animaux, dont le chien)
- Botulisme de type E (sérotype pathogène pour l'Homme et pour certains animaux, identifié en 1935), avec une augmentation préoccupante en France en élevage avicole depuis 1997[1], normalement lié aux poissons et fruits de mer.
- Botulisme de type F (rare, sérotype pathogène pour l'Homme et certains animaux).
- Botulisme de type G (très rare, sérotype pathogène pour certains animaux).
Le mécanisme d'action est une inhibition de la libération d'Acétylcholine au niveau des jonctions neuromusculaires, ce qui bloque la transmission entre nerf et muscle et conduit à une paralysie motrice et respiratoire. Ce blocage dure de quelque semaines à quelques mois, il n'entraine pas de lésions cellulaires ce qui permet la récupération totale des patients[9].
La toxine ne franchit pas la barrière hémato-encéphalique, d'où l'absence d'atteinte du système nerveux central[9].
Épidémiologie
Botulisme humain
Au cours du XXe siècle
Dans le monde, la maladie est rare et sporadique, mais quand elle survient, son taux de mortalité peut être élevé. Il était le plus fort aux États-Unis dans les années 1890-1920 lors des premières conserves industrielles (60 à 70 %). Il a chuté en deux temps : à la fin des années 1920, avec l'amélioration des procédures industrielles, et au début des années 1950, avec les soins intensifs et la réanimation respiratoire (ventilation assistée)[10].
Les principaux aliments responsables de botulisme varient selon les habitudes culturelles alimentaires. En Pologne, Allemagne et France, les viandes conservées (fermières, artisanales ou familiales) sont majoritairement en cause (le jambon en France, les saucisses en Allemagne) avec prédominance du type B, alors qu'en Russie et au Japon, ce sont les poissons fumés ou marinés, avec prédominance du type E. Aux États-Unis, ce sont les conserves de légumes (haricots, maïs, champignons…), avec prédominance du type A[5].
Épidémiologie actuelle
En France
C'est une maladie assez rare en France (45 cas identifiés sur la période 2007-2009[11]) ; son incidence annuelle est de l'ordre de 0,5 cas par million d'habitants. Il s'agit de cas sporadiques, le plus souvent d'origine alimentaire : salaisons, charcuteries et conserves de fabrication familiale, plus rarement fermières, artisanales ou industrielles ou par inoculation chez le toxicomane. Le risque de botulisme humain acquis à partir de sources avicole ou bovine est faible dans ce pays, mais des foyers récents dans d'autres pays comportant un nombre significatif de malades (plusieurs dizaines) ont montré un taux de létalité de plus de 5 % qui incite à la prudence[1].
En 2011, le taux d’incidence du botulisme est descendu à 0,27 cas par million d’habitants. Ce taux est en dessous du taux d’incidence moyenne observé pour la période 1991-2009 qui est de 0,42 cas par million d’habitants et par an[12].
Dans la période 2013-2016, on compte de 11 à 22 cas annuels (18 en moyenne), soit 69 cas répartis en 39 foyers, un peu plus souvent dans le centre de la France. 75 % des patients ont été hospitalisés, le plus souvent en réanimation. Deux décès sont survenus (femmes âgées de 73 et 85 ans)[13].
La forme la plus fréquente (85 % des cas) est le botulisme alimentaire. Le botulisme type B est le plus souvent lié à des produits de charcuteries : jambon artisanal ou familial, cru ou mal cuit (23 cas), charcuteries industrielles d'origine polonaise (1 cas) et portugaise (4 cas). Le botulisme type A est plus rare, d'origine plus variée : lié à des conserves familiales de légumes, comme les asperges (deux foyers), à un pâté de faisan (un foyer)[13].
Les deux premiers foyers de botulisme type F à apparaitre en France, dus à Clostridium baratti, ont été détectés. L'origine du premier n'a pas été retrouvée ; dans le second il s'agissait d'une viande hachée de bœuf industrielle utilisée dans un restaurant pour une sauce bolognaise préparée à l'avance (trois cas survenus dans la même tranche horaire)[13].
Six cas de botulisme infantile ont été identifiés dans la même période, d'origine probablement environnementale : pas d'aliments à risques retrouvé, mais contamination possible d'aliments par une infime quantité de poussières (travaux en chantier près du domicile du nourrisson)[13].
En septembre 2019, une femme habitant l'Essonne est devenue paralysée peut-être après avoir consommé une soupe de légumes périmée depuis trois semaines[14].
Au 14 septembre 2023, quinze cas de botulisme, dont dix hospitalisés et un décès, ont été recensés à Bordeaux après que tous ont consommé des conserves de sardines "faites maison" par le Tchin Tchin Wine bar[15].
En Europe
Le botulisme y est rare (environ 200 cas par an, soit 0,3 cas par million d'habitants). Il est très rare chez l'enfant ; quand il survient, il touche surtout les enfants de moins de six mois[16].
C'est en Europe centrale que le botulisme est le moins rare (Pologne et Lituanie surtout).
Le botulisme inoculé par seringue par des usagers de drogues est devenu le botulisme le plus fréquent au Royaume-Uni et en Irlande.
Aux États-Unis
Sur la période 2011-2015, on compte en moyenne 162 cas de botulisme par an : moins de 20 % sont d'origine alimentaire, et plus de 71 % sont infantiles ; le reste provenant de blessure ou de causes inconnues.
Les épidémies de botulisme alimentaire (deux personnes ou plus) sont habituellement dues à une mauvaise stérilisation de conserves faites à la maison. Il n'y a pas eu de cas par bioterrorisme ; on note un cas de botulisme iatrogénique (par toxine thérapeutique non homologuée)[17].
Le taux de botulisme alimentaire et infantile varie peu depuis les années 2000, mais le botulisme par blessure a augmenté en raison de l'utilisation de l'héroïne brune (black tar), surtout en Californie.
Botulisme animal
Chez les bovins
En France, dans la période 1945-1970, des cas de botulisme type C ont touché des bovins et équins, souvent à la suite de présence de cadavres de petits rongeurs dans les fourrages[18].
Des cas de botulisme type D ont été diagnostiqués en Bretagne, Normandie et Pays de Loire, dans les années 1979-1983, liés à la proximité d'élevage industriel de volailles. Les volailles domestiques sont résistantes au botulisme D mais elles constituent un réservoir pour les bactéries type D qui se retrouvent dans les lisiers. La transmission des volailles aux bovins se fait par les fumiers épandus sur les pâtures, par les eaux de ruissellement (dissémination des spores), ou par le vent à partir des lisiers desséchés et pulvérulents. À cette époque, la contamination principale a été celle des farines de viandes (de volaille) servant à l'alimentation des bovins[18].
Il peut exister une répartition saisonnière du botulisme bovin, survenant de préférence lors de mois d'été et d'automne, chauds et secs ; la température optimum de croissance des clostridium C et D étant relativement élevée (30 - 40 °C)[18].
Chez les oiseaux


Le botulisme aviaire, de type C, est endémique, au nord de l'hémisphère Nord (Canada, Japon, Europe occidentale), chez les oiseaux sauvages, en particulier aquatiques, surtout en saison chaude et sèche. En Grande-Bretagne, lors de l'été exceptionnellement chaud et sec de 1976, les niveaux des fleuves sont tombés si bas en quelques endroits que des cygnes ont été atteints de botulisme en s’alimentant dans des couches anaérobies (sapropèle), qu’ils n’atteignent pas généralement.
L'année 1995, avec un été chaud et prolongé, a été particulièrement meurtrière en France, en Allemagne et les pays anglo-saxons. Des dizaines de milliers de cadavres d'oiseaux ont été retrouvés près des points d'eau (étangs, lacs, marais…). Ce phénomène se retrouve tous les ans, mais d'importance variable selon les conditions climatiques[18]. Il y a ainsi eu 30 000 oiseaux morts dans le lac de Grand-Lieu en Loire-Atlantique[19].
En février 1996, en France, pour la première fois, un épisode inhabituel de botulisme de « type E » est survenu sur la façade littorale du Pas-de-Calais essentiellement, en baie de Canche et au nord de celle-ci[19]. Les pertes ont été estimées à plus de 5 000 à 10 000, voire 16 000 oiseaux laridés (mouettes rieuses Chroicocephalus ridibundus). La cause probable serait l'alimentation de ces oiseaux sur une décharge locale de déchets de poissonneries[20]. Les Clostridum type E se développent à basse température, à partir de 3 °C pour la croissance et de 7 °C pour la production de toxines[18].
Dans les élevages industriels (poulet, dinde, canard, faisan), le botulisme type C, (plus rarement D), peut se déclarer dans des effectifs de 10 000 à 50 000 sujets, avec des mortalité de 10 à 70 % de l'effectif. On a estimé que la source la plus probable est l'alimentation par farine de viande. Depuis 1998, un botulisme type E est détecté dans des élevages industriels de poulets[18].
Chez les chiens
Il s'agit généralement de chiens vivant en zone rurale (où sévit du botulisme aviaire ou bovin). Le chien se contamine en consommant des cadavres de volailles[18].
Facteurs de risques
Un microbiote équilibré diminue le risque ou la gravité du botulisme (quand il n'est pas dû à l'ingestion directe de toxines botuliques).
- Modèle animal :
- chez la souris de laboratoire utilisée comme modèle murin de botulisme infantile, la dysbiose intestinale favorise le botulisme (de « type E » notamment[21],[22] ; « De nombreuses bactéries du tractus gastro-intestinal (GIT) produisent des bactériocines dirigées contre C. botulinum et d'autres agents pathogènes: les bactéries productrices d'acide lactique (LAB) comme les lactobacilles, les lactocoques et les entérocoques, génèrent des bactériocines efficaces contre Clostridium spp. »[21],[22] ;
- en Allemagne, il a été constaté que les cas de botulisme de la vache laitière ont augmenté de la fin des années 1990 et au début des années 2000, pour des raisons inconnues[21]. Ces années sont celles de l'expansion des cultures OGM (presque toutes biotechnologiquement rendues résistantes au glyphosate) ; ces années sont pour cette raison aussi celle d'une explosion de la consommation de glyphosate dans le monde. Or le glyphosate est toxique pour les Enterococcus spp. qui sont antagonistes des espèces de Clostridium[22]. Une réduction des bactéries productrices d'acide lactique dans le microbiote intestinal, à la suite de l'ingestion de biocides puissants comme le glyphosate pourrait être une explication de l'augmentation observée des niveaux de maladies associées à C. botulinum. dans le tractus digestif des bovins[22]. « L'ingestion de cet herbicide pourrait être un facteur prédisposant important associé à l'augmentation des maladies induites par C. botulinum chez les bovins »[21], la présence de C. botulinum s'accompagne de modifications spécifiques du microbiote fécal (moins de bactéries aérobies, de bactéries anaérobies totales, d'entérocoques, de Clostridium perfringens et de levures et champignons) ; dans le même temps, le contenu liquide du rumen voit les espèces de Bacteroides proliférer de même que C. histolyticum, Alfa-protéobactéries, Gammaproteobacteria et bactéries sulfato-réductrices, alors qu'au contraire les Euryaracheota et les protozoaires Epidinium spp. Dasytricha spp., Diplodiniinae spp. et Ophryoscolex spp. diminuent[22].
C. botulinum est commun chez ces vaches laitières mais la maladie botulisme ne survient que lors de changements microbiens et en lien avec un changement de composition macrobiotique du tractus gastro-intestinal. Le rôle précis des bactéries, levures et protozoaires n'est pas encore clairement compris[22].
- Chez l'Humain, on a récemment montré que l'exposition au glyphosate (matière active du Roundup, herbicide le plus vendu au monde) accroit la vulnérabilité au botulisme[23],[21].
Incubation
Les symptômes classiques du botulisme surviennent le plus souvent entre 12 et 36 heures après l'ingestion de la toxine botulinique, mais ils peuvent parfois s'observer précocement dès la 6e heure ou tardivement après dix jours.
La période d'incubation et la gravité des symptômes dépendent du type et de la quantité de toxine absorbée par l'organisme, ainsi que du mode de contamination.
Le « type A » donne les formes les plus graves et les plus rapides, alors que le type B est plus progressif.
Formes cliniques
Botulisme alimentaire
Les formes alimentaires sont les plus fréquentes. Elles sont dues à la présence de la toxine, déjà préformée, dans les aliments. La maladie se présente comme une gastro-entérite, non fébrile, mais avec des troubles neurologiques visuels caractéristiques (qui peuvent apparaître en premier).
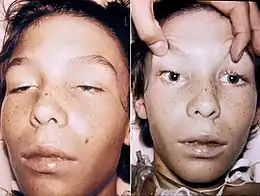
Outre les troubles digestifs (coliques, diarrhées ou constipation, vomissements), apparait une paralysie de nerfs crâniens (en particulier du nerf oculomoteur) avec une sécheresse de la bouche (paralysie sécrétoire des glandes salivaires), des difficultés à avaler, une élocution incompréhensible, une vision double et trouble (paralysie oculaire et de l'accommodation), avec chute des paupières.
Dans un second temps, survient une paralysie descendante avec une faiblesse musculaire généralisée, bilatérale et symétrique, sans troubles de la sensibilité. Elle peut s'aggraver jusqu'à la paralysie des muscles des membres et du tronc, avec iléus paralytique et rétention d'urine. La paralysie respiratoire peut conduire au décès. Dans tous les cas, c’est la toxine botulique qui provoque la maladie, et non la bactérie C. botulinum elle-même.
Botulisme infantile
Les premiers cas sont publiés aux États-Unis (Californie) en 1976[5].
Appelé aussi botulisme par colonisation, il s'agit de l'ingestion de spores de C. botulinum largement répandues dans l'environnement, normalement détruites par l'acidité gastrique ou dont le développement est empêché par la flore intestinale (microbiote). Chez le nourrisson ou l'adulte avec facteurs prédisposants (chirurgie intestinale, maladie de l'intestin, antibiothérapie)[11], l'acidité gastrique et le microbiote sont insuffisants. Les spores germent et colonisent l'intestin, produisant ainsi la toxine botulique in situ dans un second temps.
Le botulisme infantile est aux États-Unis la forme la plus répandue de la maladie. L'enfant présente une faiblesse générale[24], avec perte de la tenue de la tête, difficulté à s’alimenter et constipation, d'où le nom de « floppy baby » (bébé flasque).
L'origine de la contamination des nourrissons est le plus souvent attribuée à l'ingestion de produits sucrés, tels que le miel[25], le sirop de maïs. En effet les spores de C. botulinum peuvent persister dans le miel. C'est la raison pour laquelle il est recommandé de ne jamais donner aux bébés ni miel, ni aucun autre produit sucré quel qu’il soit jusqu’au sevrage, en tous cas jamais avant l'âge d'un an de l'enfant[26].
Botulisme d'inoculation
Les premiers cas sont publiés aux États-Unis en 1973[3].
Il s'agit de botulisme par blessure, analogue à la transmission du tétanos. Le plus souvent, il s'agit d'usagers de drogues injectables, comme l'héroïne de mauvaise qualité. Dans ce dernier cas, les symptômes apparaissent dès six heures après l'injection et perdurent jusqu'à deux semaines. Ils peuvent être une vision dédoublée, des paupières lourdes, des confusions de langage ou d'élocution, des difficultés à avaler, une faiblesse bilatérale des bras, puis une paralysie flasque accompagnée de détresse respiratoire[27].
La toxine ne peut pas traverser une peau saine et intacte, mais elle peut provoquer des troubles par les muqueuses (conjonctives par exemple)[18].
Botulisme d'inhalation
C'est une forme exceptionnelle, qui ne survient pas de façon naturelle chez l'Homme. Les seuls cas connus concernent trois chercheurs vétérinaires dans un laboratoire allemand, en 1962, exposés accidentellement à un aérosol de toxine botulique[28],[10]. La toxine inhalée passe dans le sang, et provoque les mêmes troubles neurologiques que la forme alimentaire, mais avec une incubation très courte, environ 6 heures[29]. La maladie a été reproduite expérimentalement chez des primates, en 1993, pour tester l'utilisation d'antitoxines[28]. L'utilisation bioterroriste de ce type de botulisme est discutée.
Diagnostic
Le diagnostic est le plus souvent clinique, basé sur l'examen, l'histoire et les circonstances, et l'entourage du patient. Le botulisme se distingue des autres déficits moteurs aigus par l'importance de l'atteinte des nerfs oculaires par rapport à une faiblesse musculaire généralisée d'abord modérée[28].
Il y a absence de fièvre, de troubles sensitifs et de troubles de la conscience[9],[29]. La survenue d'au moins deux cas groupés de paralysie descendante évoque fortement un botulisme[11].
Le botulisme est confirmé par la présence de la toxine botulique dans le sérum ou les selles du patient, dont l'injection à la souris reproduira les signes de la maladie. Le test d'inoculation à la souris est la seule méthode de référence pour la détection et l'identification de la toxine botulique. En France, ce test n'est réalisable que dans le centre national de référence « Bactéries anaérobies et botulisme » de l'Institut Pasteur.
La bactérie peut également être isolée dans les selles des patients atteints de botulisme alimentaire ou infantile, ou par un prélèvement de la plaie infectée lors d'un botulisme par blessure. La bactérie et la toxine peuvent être recherchées dans des aliments suspects d'être à l'origine de la contamination.
Une électroneuromyographie (ENMG) peut être utile au diagnostic en montrant un bloc de la jonction neuromusculaire de type pré-synaptique (défaut de libération de l'acétylcholine dans la synapse)[30]. De nouvelles méthodes de diagnostic sont en cours de développement comme la PCR[29].
D'autres affections neurologiques avec déficits moteurs comme le syndrome de Guillain-Barré, les accidents vasculaires cérébraux et la myasthénie peuvent ressembler au botulisme, en étant plus fréquentes que lui. Le botulisme peut donc faire partie du diagnostic différentiel de ces affections (recherche de toxine botulique dans le sérum du patient)[11].
Traitement
La surveillance et le traitement des patients suspects de botulisme se fait en milieu hospitalier. Les risques essentiels sont les troubles de la déglutition, l'atteinte des muscles respiratoires et les troubles cardiaques[9].
Mesures symptomatiques
Le traitement est symptomatique. La paralysie respiratoire en cas de botulisme grave nécessite une ventilation mécanique (« respiration artificielle ») avec intubation trachéale en milieu de soins intensifs[9], parfois de plusieurs semaines. La guérison est lente, en général les signes oculaires disparaissent en dernier, après des semaines ou des mois. Une fatigue au long cours peut persister[3].
La nutrition par voie entérale (sonde nasogastrique) ou parentérale peut être nécessaire en cas de troubles de la déglutition ; une sonde vésicale est mise en place en cas de rétention urinaire[9].
La survenue d'un syndrome sec impose le maintien d'une bonne hydratation des muqueuses (aérosols, brumisateur, larmes artificielles…)[9].
En cas de botulisme par blessure, la plaie responsable est traitée chirurgicalement pour faire disparaître la source des bactéries toxinogènes.
Sérothérapie
Le traitement spécifique par sérothérapie précoce (antitoxines d'origine équine) est exceptionnel en France, alors qu'il est systématique aux États-Unis mais son utilisation reste difficile, avec des risques allergiques importants. La sérothérapie est indiquée dans les formes sévères, mais elle n'est efficace qu'administrée précocement dans les deux jours après l'apparition des symptômes[28],[9].
Le produit utilisé agit contre les types A, B et E, il a une autorisation de mise sur le marché en Allemagne, mais pas en France où il n'est disponible que par une autorisation temporaire d'utilisation (ATU) nominative octroyée par l'ANSM[9], devenue depuis le 1er juillet 2021 une autorisation d'accès compassionnel (AAC)[31].
Résultats
La récupération est complète, mais après une longue durée (de quelques semaines à plusieurs mois). Les décès précoces (deux premières semaines) sont le plus souvent dus à un retard diagnostique ou des infections pulmonaires secondaires. Au-delà, la mortalité est liée aux complications de la réanimation respiratoire[9].
Aux États-Unis, la létalité du botulisme alimentaire (mortalité des sujets atteints) a diminué de 25 % (1950-1959) à 6 % (1990-1996), avec réduction similaire pour chaque type de toxine[28]. Dans la période 1975-2009, celle du botulisme infantile a été de 1 %, de 5 % pour le botulisme par blessure et de 22 % pour les autres causes ou causes inconnues[17].
En France, la létalité a été de 1 % (1991-2000), liée à la prépondérance du botulisme type B, moins grave[32]. Ainsi, la létalité en France n'a jamais dépassé 6 % depuis les années 1950[32].
Recherches
Une neurotoxine composant du venin de Veuve noire, l'alpha-latrotoxine (causant un latrodectisme), est susceptible d'avoir une action indirecte contre les effets paralysants du botulisme, en permettant une entrée de Ca2+ intracellulaire importante au niveau des terminaisons synaptiques. De plus, l'alpha-latrotoxine pourrait agir en restaurant l'activité de la protéine SNAP2 au niveau de la jonction neuro-musculaire[33].
Les effets de cette neurotoxine, antagonistes à ceux du botulisme, ont été étudiés sur des cellules souches embryonnaires de neurones de souris. Ces recherches ouvrent la perspective d'un traitement contre les paralysies du botulisme en accélérant leur récupération[33].
Prévention
Hygiène alimentaire
Le botulisme alimentaire peut être évité par le respect des règles d'hygiène de préparation des aliments à conserver, et des consignes de stérilisation, surtout pour les conserves familiales préparées à la maison, qui sont les causes les plus fréquentes. Les procédés de conservations (température, concentration saline, pH) doivent être scrupuleusement respectés[34].
Les salaisons demandent une concentration en sel et un temps de salage suffisant ; les aliments à mettre en conserve, susceptibles d'être souillés par de la terre, doivent être nettoyés soigneusement et stérilisés suffisamment longtemps[11] : les toxines botuliques sont thermolabiles, inactivées à partir de 85 °C pendant 5 minutes[28], et détruites par ébullition pendant 10 minutes. À l'inverse, les spores sont très résistantes, nécessitant d'autres moyens et des températures supérieures (fabrication industrielle de conserves)[10].
Les conserves ou les emballages type Tetrapack peuvent révéler la présence de C. botulinum (ou d'autres bactéries) par un bombement extérieur caractéristique qui résulte de la pression exercée à l’intérieur par les gaz produits par les bactéries, avec un risque de projection lors de l'ouverture[18] ; le mieux est de jeter purement et simplement de telles conserves.
Les gaz produits par des C. botulinum en croissance sont d'odeur désagréable (odeur de beurre rance), mais la toxine pure en solution est incolore, inodore, et autant qu'on puisse le savoir, sans goût[28].
Vaccination
En 2018, il existe un vaccin expérimental aux États-Unis, contre 5 types de toxine botulique, à la disposition de personnes exposées à haut risque durant une période limitée (personnel militaire et de laboratoire). Il n'est pas disponible pour le grand public, à cause de son coût, du nombre d'injections nécessaires, et de sa courte durée de protection[17].
Dispositions légales
En France et en Belgique, cette maladie est sur la liste des maladies infectieuses à déclaration obligatoire.
En France, le Centre National de Référence des bactéries anaérobies et du botulisme a été créé en 1972. Il participe à la surveillance du botulisme humain en signalant les cas confirmés biologiquement à l'Institut National de Veille Sanitaire[11].
En France, depuis 1986, la déclaration du botulisme a été individualisée par rapport aux autres toxi-infections alimentaires collectives (où il faut au moins 2 cas pour la déclaration). Depuis 1986, un seul cas isolé de botulisme doit être déclaré aux autorités sanitaires qui déclenchent alors une enquête[11] .
En France, un cas suspect ou confirmé de botulisme doit être signalé sans délai à l’Agence régionale de santé (ARS), qui déclenche une enquête épidémiologique : recherche de cas dans l'entourage, analyses alimentaires, enquêtes vétérinaires, traçabilité des produits. Le botulisme et la toxine botulique font partie des pathologies infectieuses et toxiques soumises depuis 2001 à une surveillance renforcée dans le cadre du plan Biotox[35]. Ce plan peut être déclenché par des données inhabituelles, évoquant un acte malveillant ou bioterroriste[32].
En Europe, le botulisme est surveillé par le Centre européen de prévention et de contrôle des maladies (surveillance de santé publique, données épidémiologiques) et, sur requête, l'Autorité européenne de sécurité des aliments (avis d'expertise).
Utilisations de la toxine botulique
En utilisation massive, la toxine botulique pourrait servir d'arme biologique. À l'inverse, à très faibles concentrations, elle est utilisée comme un moyen thérapeutique.
Les journalistes Robert Harris et Jeremy Paxman affirment l'existence d'au moins un cas de botulisme provoqué par l'utilisation d'une arme antipersonnel contaminée volontairement par la toxine botulique (celle-ci étant mêlée à la couche de colle enduisant une grenade), lors de l'assassinat du dignitaire nazi Reinhard Heydrich en 1942[36]. Cette hypothèse, reprise notamment par le biologiste Patrick Berche[37], est jugée invraisemblable et non étayée par les sources par les historiens spécialistes[38].
Il est avisé très tôt que la puissance de la toxine botulique pouvait être exploitée comme un avantage, lorsqu'une paralysie musculaire locale s'avère utile ou souhaitable. Déjà Kerner au XIXe siècle avait entrevu le potentiel d'utilisation de la toxine à des fins thérapeutiques, allant jusqu'à en expérimenter les effets sur lui-même. La toxine botulique est souvent efficace dans le traitement des maladies neurologiques comportant une trop grande activité musculaire (contractions et mouvements anormaux, crampes, spasticité, dystonie). La toxine botulique est aussi employée en cosmétique, par exemple pour réduire les rides faciales ou la transpiration excessive.
Un surdosage accidentel de toxine thérapeutique, ou l'utilisation de produit non homologué (de trop forte concentration), peuvent être à l'origine de botulisme iatrogénique[10].
Notes et références
- 1 2 3 Le Botulisme d'origine aviaire et bovine, AFSSA, France ; Paris ; octobre 2002 ; 82 pages (PDF, 1 377 Ko)
- ↑ Guillaume Coudray, Cochonneries : comment la charcuterie est devenue un poison, Paris, la Découverte, 267 p. (ISBN 978-2-7071-9358-2 et 2707193585, OCLC 1011036745, lire en ligne), chapitre 8: "le botulisme, poison des boudins"
- 1 2 3 M. Sebald, « le botulisme », Le Concours Médical, , p. 6669l'auteur se réfère à L. Smith, « Botulism : The organism, its toxins, the disease », Springfield, 1977, Charles C.Thomas (ed.).
- ↑ Erbguth FJ, Naumann M. « Historical aspects of botulinum toxin. Justinus Kerner (1786-1862) and the "sausage poison" ». Neurology 1999; 53: 1850-1853.
- 1 2 3 4 5 6 (en) W. H. Barker, Botulism, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 623-625dans The Cambridge World History of Human Disease, K.F. Kiple (ed.).
- ↑ (en) « Botulism,Background », sur emergency.cdc.gov
- ↑ Van Ermengem EP. Über einen neuen anaeroben Bacillus und seine Beziehung zum Botulismus. Z Hyg Infektionskrankh 1897 ; 26 : 1-56
- ↑ La National Canners Association (des industriels de la conserve) a été fondée en 1907, elle devient la National Food Processors Association en 1978, et la Food Products Association en 2005. Depuis 2007, elle est fusionnée avec la Grocery Manufacturers Association (des industriels et commerciaux des boissons et produits alimentaires), dont le siège est à Washington, DC.
- 1 2 3 4 5 6 7 8 9 10 P. Delobel, CMIT, Botulisme, Paris, Alinéa Plus, , 720 p. (ISBN 978-2-916641-68-3), p. 348-349.dans E. PILLY 2020, 27e édition.
- 1 2 3 4 (en) J. Sobel, « Botulism », Clinical Infectious Diseases, , p. 1167-1173
- 1 2 3 4 5 6 7 Bulletin épidémiologique hebdomadaire du 22 février 2011
- ↑ Caractéristiques épidémiologiques du botulisme humain en 2011 Institut de veille sanitaire (InVS),
- 1 2 3 4 « Le botulisme humain en France, 2013-2016 », sur invs.santepubliquefrance.fr (consulté le )
- ↑ « Une femme paralysée et atteinte de botulisme après avoir consommé une soupe périmée », lefigaro.fr, (lire en ligne, consulté le )
- ↑ « Cas de botulisme alimentaire à Bordeaux : 15 cas recensés, dont 10 hospitalisés et 1 décès. Point de situation au 14 septembre 2023. », sur www.santepubliquefrance.fr (consulté le )
- ↑ (en) « Factsheet for the general public », sur ecdc.europa.eu (consulté le )
- 1 2 3 « Botulism », sur ncbi.nlm.nih.gov (consulté le )
- 1 2 3 4 5 6 7 8 9 J.P. Carlier, « Le botulisme en France à la fin du deuxième millénaire », Bulletin épidémiologique hebdomadaire, no 09, , p. 38
- 1 2 Serge Morand, François Moutou, Céline Richomme et al. (préf. Jacques Blondel), Faune sauvage, biodiversité et santé, quels défis ?, Quæ, coll. « Enjeux Sciences », , 190 p. (ISBN 978-2-7592-2202-5, lire en ligne), IV. Santé animale et sociétés humaines, chap. 12 (« Quels questionnements sanitaires en milieu urbain ? »), p. 123 - 127, accès libre.
- ↑ Gourreau JM. et al. « Étude d'un épisode de botulisme de type E chez des mouettes rieuses (Larus ridibundus) et des goélands argentés (Larus argentatus) en baie de Canche (Pas-de-Calais)» Gibier faune sauvage 1998, vol. 15, HS2 (541 p.) (8 ref.), p. 357-363 ISSN 0761-9243 Fiche INIST/CNRS Congrès de l'Union internationale des biologistes du gibier (UIBG) no 23, Lyon, FRANCE (1er septembre 1997) Congress of the International Union of Game Biologists (IUGB) no 23, Lyon, FRANCE (1er septembre 1997)
- 1 2 3 4 5 (en) Monika Krüger, Awad A. Shehata, Anke Grosse-Herrenthey et Norman Ständer, « Relationship between gastrointestinal dysbiosis and Clostridium botulinum in dairy cows », Anaerobe, vol. 27, , p. 100–105 (DOI 10.1016/j.anaerobe.2014.03.013, lire en ligne, consulté le )
- 1 2 3 4 5 6 (en) Monika Krüger, Awad Ali Shehata, Wieland Schrödl et Arne Rodloff, « Glyphosate suppresses the antagonistic effect of Enterococcus spp. on Clostridium botulinum », Anaerobe, vol. 20, , p. 74–78 (DOI 10.1016/j.anaerobe.2013.01.005, lire en ligne, consulté le )
- ↑ Comité scientifique de l’Agence fédérale pour la Sécurité de la Chaîne Alimentaire (2017) Avis no 26-2017 : Risque associé à l’épandage de fumiers et de digestats contaminés par Clostridium botulinum (SciCom no 2017/04) ; Avis approuvé par le Comité scientifique le 15 décembre 2017
- ↑ (en) Pifko E, Price A, Sterner S, « Infant botulism and indications for administration of botulism immune globulin », Pediatr Emerg Care, vol. 30, no 2, , p. 120-4; quiz 125-7. (PMID 24488164, DOI 10.1097/PEC.0000000000000079)
- ↑ Botulisme et miel (Abeille de France)
- ↑ « Pas de miel pour les enfants de moins de 1 an », sur www.anses.fr (consulté le )
- ↑ Brève Two Botulism Cases due to Black Tar Heroin
- 1 2 3 4 5 6 7 (en) Stephen S. Arnon, Schechter R., Inglesby T.V. et al., « Botulinum Toxin as a Biological Weapon: Medical and Public Health Management », JAMA, vol. 285, no 8, , p. 1059–1070 (PMID 11209178, DOI 10.1001/jama.285.8.1059, lire en ligne [PDF])
- 1 2 3 (en) A.A. Adalja, « Clinical Management of Potential Bioterrorism-related Conditions », The New England Journal of Medicine., , p. 959-960
- ↑ (en) Anlar O, Irmak H, Tombul T, Akdeniz H, Caksen H, Kose D, Ceylan A, « Food-borne botulism cases in Van region in eastern Turkey: importance of electromyography in the diagnosis », Electromyogr Clin Neurophysiol., vol. 43, no 6, , p. 373-6. (PMID 14535050)
- ↑ DGOS ;DGS, « Autorisation d'accès précoce, autorisation d'accès compassionnel et cadre de prescription compassionnelle », sur Ministère de la Santé et de la Prévention, (consulté le )
- 1 2 3 S. Haeghebaert, « Caractéristiques épidémiologiques du botulisme humain en France », Bulletin épidémiologique hebdomadaire, no 14, , p. 57-59
- 1 2 Mariano Mesngon et Patrick McNutt, « Alpha-Latrotoxin Rescues SNAP-25 from BoNT/A-Mediated Proteolysis in Embryonic Stem Cell-Derived Neurons », Toxins, vol. 3, no 5, , p. 489–503 (ISSN 2072-6651, DOI 10.3390/toxins3050489, lire en ligne, consulté le )
- ↑ Guillaume COUDRAY, Cochonneries : comment la charcuterie est devenue un poison, Paris, La Decouverte, , 224 p. (ISBN 978-2-7071-9358-2 et 2707193585, OCLC 1011036745, lire en ligne), chapitre 8: "Le botulisme, poison des boudins", et chapitre 12 "Le mensonge du "pas d'alternative"
- ↑ DGS (Direction générale de la santé) - AFSSAPS (Agence française de sécurité sanitaire des produits de santé), « Botulisme », La Revue du Praticien - médecine générale, , p. 1991-1992
- ↑ (en) Robert Harris, Jeremy Paxman, A Higher Form of Killing: The Secret Story of Gas and Germ Warfare, Chatto & Windus, 1982, p. 88-94
- ↑ Patrick Berche,L'Histoire secrète des armes biologiques. Mensonges et crimes d'État, Robert Laffont, 2009, p. 65
- ↑ (en) « Their general accunt of the assassination is riddled with inaccuraties and they present no documentary evidence to support their claim », Callum MacDonald, The Killing Of Reinhard Heydrich: The SS "Butcher Of Prague", Da Capo Press, 2009, p. 227.
Voir aussi
Cinéma
- 1956 : Si tous les gars du monde
Bibliographie
- (en) Louis Smith, Botulism : The organism, its toxins, the disease, Springfield, Charles C. Thomas, 1977.
Articles connexes
- Épidémiologie
- Écoépidémiologie
- Empoisonnement
- Intoxication alimentaire
- Liste des maladies infectieuses
- Toxine botulique
Liens externes
- Le botulisme sur le site de l'Institut de veille sanitaire (InVS), France
- Le Centre National de Référence du botulisme, France
- Ressources relatives à la santé :
- ICD9Data.com
- Orphanet
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) ICD-10 Version:2016
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (en) PatientLikeMe
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :