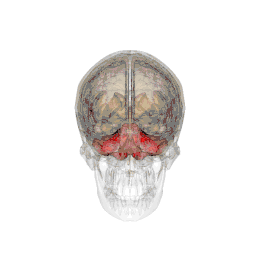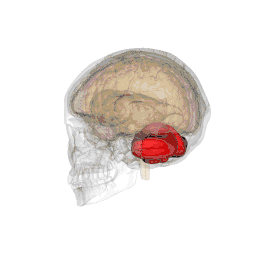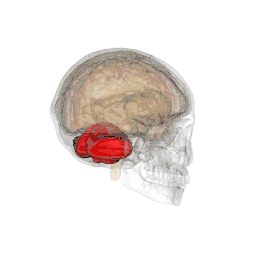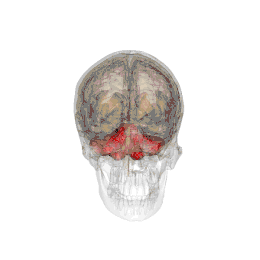
| Système |
Métencéphale |
|---|---|
| Vascularisation |
Artère cérébelleuse supérieure, artère cérébelleuse antéro-inférieure, artère cérébelleuse postéro-inférieure |
| Drainage veineux | |
| Comprend |
Neurone, cellule gliale, Vermis du cervelet |
| Nom latin |
Cerebellum |
|---|---|
| MeSH |
D002531 |
| TA98 |
A14.1.07.001 |
| TA2 |
5788 |
| FMA |
67944 |
Le cervelet (du latin : cerebellum, « petit cerveau ») est une structure de l'encéphale des vertébrés qui joue un rôle important dans le contrôle moteur et est impliqué, dans une moindre mesure, dans certaines fonctions cognitives, telles que l'attention, le langage et la régulation des réactions de peur et de plaisir[1].
Le cervelet n'est généralement pas à l'origine du mouvement, il contribue à la coordination et la synchronisation des gestes, et à la précision des mouvements. Il reçoit des signaux en provenance des différents systèmes sensoriels, ainsi que d'autres parties du cerveau et de la moelle épinière. Il intègre ces signaux pour ajuster au mieux l'activité motrice[2]. En plus de son rôle direct dans le contrôle moteur, le cervelet est nécessaire pour différents types d'apprentissages moteurs, le plus remarquable étant l'apprentissage de l'ajustement aux variations dans les relations sensorimotrices.
Du fait de ces fonctions d'ajustement, des dommages au cervelet ne provoquent pas la paralysie, mais des troubles dans la précision des mouvements, l'équilibre, la posture ou l'apprentissage moteur[2].
Anatomiquement, le cervelet apparaît comme une structure isolée, située sous les hémisphères cérébraux et derrière le tronc cérébral. La surface du cervelet est couverte de stries parallèles très rapprochées, qui contrastent fortement avec les circonvolutions larges et irrégulières du cortex cérébral. Ces stries parallèles dissimulent le fait que le cervelet est constitué d'une couche mince et continue de tissu nerveux, le cortex cérébelleux, fortement replié sur lui-même, tel un accordéon, ce qui lui donne cet aspect caractéristique.
Le cortex cérébelleux présente plusieurs types de neurones rangés très régulièrement, les plus importants étant les cellules de Purkinje et les cellules granulaires. Ce réseau complexe de neurones permet une remarquable capacité de traitement du signal. Néanmoins, l'essentiel des signaux efférents est dirigé vers un ensemble de petits noyaux cérébelleux profonds, à l'intérieur du cervelet.
Généralités
Le cervelet est situé en dessous du lobe occipital du cerveau, et en arrière du tronc cérébral, en particulier, en arrière de la moelle allongée et du pont.
- Situation : il se situe dans la fosse postérieure du crâne, en arrière du tronc cérébral et sous la face ventrale du lobe occipital dont il est séparé par la tente du cervelet.
- Structure : cortex tri-laminaire se projetant sur des noyaux cérébelleux profonds.
- Origine embryologique : rhombencéphale et, partiellement, mésencéphale.
- Origine phylogénétique : ostracodermes (protochordés).
- Subdivisions phylogénétiques :
- archicerebellum à partir des poissons cartilagineux ;
- paleocerebellum à partir des reptiles ;
- neocerebellum à partir des mammifères.
- Subdivisions anatomiques sagittales :
- vermis ;
- partie parasagittale des hémisphères cérébelleux ou paravermis ;
- partie latérale des hémisphères cérébelleux.
- Subdivisions anatomiques longitudinales
- Afférences, lobules de I à X :
- fibres grimpantes issues des noyaux de l'olive bulbaire ;
- fibres moussues issues de la moelle, du tronc cérébral et du cerveau.
- Efférences :
- faisceaux issus des noyaux cérébelleux profonds ;
- faisceau issu du cortex cérébelleux vers les noyaux vestibulaires latéraux.
- Fonctions :
- motricité : coordination des mouvements, apprentissage supervisé et automatisation des mouvements (mémoire procédurale motrice), régulation du gain des réflexes ;
- cognition et affectivité : contrôle des fonctions exécutives, végétatives et émotionnelles.
Structure
Au niveau macroscopique, le cervelet consiste en une couche particulièrement repliée sur elle-même du cortex, qui recouvre une substance blanche enveloppant elle-même plusieurs noyaux profonds, avec un ventricule rempli de liquide à sa base. À un niveau intermédiaire, le cervelet et ses structures auxiliaires peuvent être décomposés en plusieurs centaines, voire plusieurs milliers de modules fonctionnant indépendamment les uns des autres, appelés « microzones » ou « microcompartiments ». Au niveau microscopique, chaque partie de ce cortex cérébelleux consiste en un même petit ensemble de neurones, disposés selon une géométrie fortement stéréotypée.
Anatomie
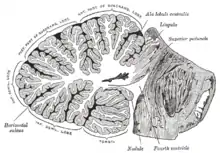
Le cervelet est situé tout en bas du cerveau, sous la masse imposante du cortex cérébral, et en face de la portion du tronc cérébral appelée Pont[3]. Il est séparé du cortex cérébral qui le surplombe par une couche de dure-mère ; toutes ses connexions avec d'autres parties du cerveau transitent par le pont. Les anatomistes classent le cervelet comme appartenant au métencéphale, qui comprend également le pont ; le métencéphale est lui-même la partie la plus haute du rhombencéphale.
Comme le cortex cérébral, le cervelet est divisé en deux hémisphères. Il comprend également une étroite zone centrale appelée vermis. Par convention, la structure globale est divisée en dix « lobules » plus petits, chacun étant un large ensemble de replis. Du fait de son grand nombre de minuscules cellules granulaires, le cervelet contient 3,6 fois [4] plus de neurones que le néocortex, mais il ne représente que 10 % du volume total du cerveau[5].
L'apparence inhabituelle de la surface du cervelet masque le fait que la plus grande partie de son volume est constituée d'une couche de matière grise fortement repliée sur elle-même, le cortex cérébelleux. On estime que si l'on dépliait complètement le cortex cérébelleux humain, on obtiendrait une couche de tissu neuronal d'environ 1 mètre de long pour 5 centimètres de largeur moyenne, soit une surface totale de près de 500 cm2, entassée dans un volume de dimensions 6 cm × 5 cm × 10 cm[5]. Sous la matière grise du cortex se trouve la substance blanche, constituée majoritairement de fibres nerveuses myélinisées partant du cortex ou allant vers celui-ci. Elle est parfois appelée l'arbor vitae, en référence à son apparence, ressemblant à un arbre en coupe sagittale. Quatre noyaux cérébelleux profonds, composés de matière grise, sont enfoncés dans cette substance blanche[6].
Subdivisions
Sur la base de l'apparence de la surface, on peut distinguer trois lobes dans le cervelet :
- le lobe flocculo-nodulaire ;
- le lobe antérieur (au-dessus du sillon primaire) ;
- et le lobe postérieur (en dessous du sillon primaire).
Chez l'humain, ces lobes divisent le cervelet de haut en bas. En termes de fonction cependant, la distinction est plus importante le long du sillon postéro-latéral. En laissant de côté le lobe flocculo-nodulaire, qui a des fonctions et des connexions distinctes, le cervelet peut être séparé fonctionnellement en un secteur médian appelé spinocerebellum, et un secteur latéral plus large appelé cerebrocerebellum[6]. L'étroite bande de tissu protubérant le long de la ligne médiane est appelée vermis[6].
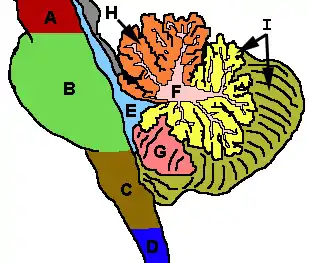 Cervelet et régions voisines ; vue sagittale d'un hémisphère. A : Mésencéphale.
B : Pont (système nerveux).
C : Moelle allongée.
D : Moelle épinière.
E : Quatrième ventricule.
F : lamelles du cortex cérébelleux.
G : Tonsille (amygdale) cérébelleuse.
H : Lobe antérieur.
I : Lobe postérieur. | 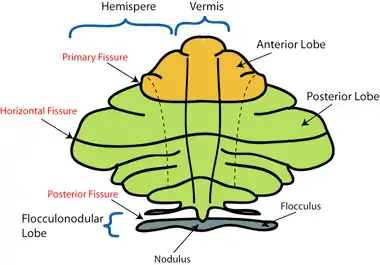 Représentation schématique des subdivisions anatomiques majeures du cervelet. Vue supérieure d'un cervelet «déroulé». |
La plus petite région, le lobe flocculo-nodulaire, est souvent appelée vestibulocerebellum ou archéocervelet. C'est la partie la plus ancienne, d'un point de vue évolutif, et elle participe principalement à l'équilibre et à l'orientation spatiale. L'archéocervelet fait ses connexions primaires avec le noyau vestibulaire, bien qu'il reçoive également des signaux visuels et d'autres afférences sensorielles. Des dommages à l'archéocervelet provoquent des troubles de l'équilibre et de la démarche[6].
La région médiane des lobes antérieurs et postérieurs constitue le spinocerebellum, également connu sous le nom de paléocervelet. Ce secteur du cervelet agit surtout en ajustant précisément les mouvements du corps et des membres. Il reçoit des messages de proprioception en provenance des colonnes dorsales de la moelle épinière et du nerf trijumeau, ainsi que des systèmes visuel et auditif. Le paléocervelet envoie des fibres aux noyaux cérébelleux profonds qui, à leur tour, projettent leurs axones sur le cortex cérébral comme sur le tronc cérébral, faisant ainsi office de modulation du système moteur descendant[6].
La région latérale, majoritaire chez l'humain, constitue le cerebrocerebellum, ou néocervelet. Il reçoit des signaux provenant exclusivement du cortex cérébral (particulièrement du lobe pariétal) via les noyaux dentelés (formant les voies cortico-ponto-cérébelleuses), et envoie des messages principalement vers le thalamus ventrolatéral (connecté à son tour aux aires motrices du cortex prémoteur et à l'aire motrice primaire du cortex cérébral) et le noyau rouge[6]. Il y a un désaccord entre les spécialistes à propos des fonctions du néocervelet : on le pense impliqué dans la planification des mouvements en préparation[7], dans l'évaluation des informations sensorielles dans l'intérêt de l'action[6], aussi bien que dans nombre de fonctions purement cognitives[8].
Composants cellulaires
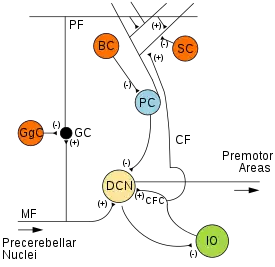

Deux types de neurones jouent un rôle dominant dans le circuit cérébelleux : les cellules de Purkinje et les cellules granulaires. Trois types d'axones jouent également un rôle prépondérant : les fibres parallèles (les axones des cellules granulaires), les fibres moussues et les fibres grimpantes (qui entrent dans le cervelet par l'extérieur). Il existe deux voies principales de signalisation à travers le cervelet, une provenant des fibres moussues et l'autre des fibres grimpantes. Ces deux voies se terminent au niveau des noyaux cérébelleux profonds.
Certaines fibres moussues se projettent directement dans les noyaux profonds et d'autres donnent lieu à la voie :
fibres moussues → cellules granulaires → fibres parallèles → cellules de Purkinje → noyaux profonds.
Les fibres grimpantes font synapse avec les cellules de Purkinje, mais envoient également des prolongements collatéraux directement vers les noyaux profonds[5]. Chacun des signaux issus de fibres moussues ou de fibres grimpantes porte des informations spécifiques à cette fibre. Le cervelet reçoit également des inputs dopaminergiques, sérotoninergiques, noradrénalinergiques et cholinergiques, qui assurent vraisemblablement une neuromodulation globale[9].
Le cortex cérébelleux est divisé en trois couches :
- à sa base, se trouve la couche granulaire, épaisse et densément remplie de cellules granulaires accompagnées d'interneurones, principalement des cellules de Golgi mais aussi des cellules de Lugaro et des cellules unipolaires à brosse ;
- la couche intermédiaire est celle de Purkinje, une zone étroite qui contient uniquement les corps cellulaires des cellules de Purkinje ;
- la couche la plus externe est la couche moléculaire, qui contient l'arbre dendritique aplati des cellules de Purkinje, ainsi qu'un large éventail de fibres parallèles qui pénètrent perpendiculairement les arbres dendritiques des cellules de Purkinje. Cette couche extérieure du cortex cérébelleux contient également deux types de cellules inhibitrices : les cellules en étoile, et les cellules en corbeille. Ces deux types de cellules forment des synapses GABA-ergiques avec les dendrites des cellules de Purkinje[5].
Cellules de Purkinje
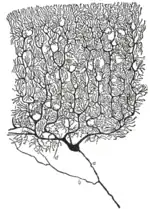
Les cellules de Purkinje font partie des neurones les plus faciles à reconnaitre du système nerveux. Ce sont ainsi les premiers spécimens neuronaux à avoir été décrits, la première fois par l'anatomiste tchèque Jan Evangelista Purkinje en 1837. Elles sont caractérisées par la forme de leur arbre dendritique : les branches dendritiques sont abondantes, mais sont sévèrement aplaties dans un plan perpendiculaire au repli du cortex cérébelleux. Les dendrites des cellules de Purkinje forment ainsi un réseau plan très dense, au travers lequel passent perpendiculairement les fibres parallèles[5]. Leurs dendrites sont couvertes d'épines dendritiques, chacune d'elles formant une synapse avec une fibre parallèle. Les cellules de Purkinje forment davantage de synapses que n'importe quel autre type de cellule dans le cerveau - on estime que le nombre d'épines dendritiques sur une seule cellule de Purkinje humaine peut monter jusqu'à 200 000[5].
Les corps cellulaires des cellules de Purkinje, larges et sphériques, sont serrés dans une étroite couche (d'une seule cellule d'épaisseur) du cortex cérébelleux, appelée couche de Purkinje. Après avoir émis des collatérales qui vont innerver les proches régions du cortex, leurs axones atteignent les noyaux cérébelleux profonds, où chacun d'entre eux réalise environ 1 000 contacts avec différents types de cellules nucléaires, tous dans une zone restreinte. Les cellules de Purkinje utilisent le GABA comme neurotransmetteur, et exercent ainsi une action inhibitrice sur les cellules cibles[5].
Les cellules de Purkinje forment le cœur du circuit cérébelleux, et leur large taille ainsi que leurs patterns d'activité particuliers ont rendu relativement aisée l'étude de leurs réponses stéréotypées chez des animaux vigiles par des techniques d'enregistrement extracellulaire. Les cellules de Purkinje émettent normalement des potentiels d'action à une fréquence élevée, même en l'absence d'influx synaptique entrant. Chez des animaux vigiles et éveillés, les fréquences moyennes typiques avoisinent les 40 Hz. Les trains de potentiels d'action résultent d'un mélange de ce que l'on appelle des potentiels simples et complexes :
- le potentiel d'action simple est unique et peut survenir à des intervalles aussi courts que 3-5 millisecondes (voir par ex. figure 3 dans [10]) ;
- le potentiel d'action complexe est une séquence stéréotypée de plusieurs potentiels d'action séparés par un intervalle de temps très bref et une faible baisse d'amplitude.
Des études physiologiques ont montré que les potentiels d'action complexes (qui surviennent à des fréquences comprises entre 1 et 10 Hz, rarement plus) sont très vraisemblablement toujours consécutifs à l'activation d'une fibre grimpante, tandis que les potentiels d'action simples sont produits par une combinaison d'une activité de base avec l'entrée d'un signal provenant d'une fibre parallèle. Les potentiels d'action complexes sont souvent suivis d'une pause de plusieurs centaines de millisecondes, pendant laquelle toute activité de potentiel simple est supprimée[11].
Cellules granulaires
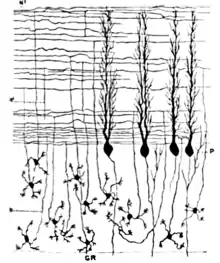
Contrairement aux cellules de Purkinje, les cellules granulaires du cervelet sont parmi les plus petits neurones du cerveau. Ce sont également, et de loin, les neurones les plus nombreux de tout le cerveau : on estime que leur nombre total chez l'humain atteint environ 50 milliards, ce qui signifie que ces cellules représentent à elles seules trois quarts des neurones cérébraux[5]. Leurs corps cellulaires sont serrés dans une épaisse couche, en bas du cortex cérébelleux. Une cellule granulaire n'émet que quatre dendrites, chacune d'elles se terminant par un élargissement. C'est au niveau de ces élargissements que la cellule Granulaire reçoit des synapses excitatrices des fibres moussues et des synapses inhibitrices des cellules de Golgi.
Les axones fins et non myélinisés des cellules granulaires s'élèvent verticalement jusqu'à la couche la plus haute du cortex cérébelleux, la couche moléculaire, où ils se divisent en deux, chaque branche progressant horizontalement pour former une fibre parallèle ; la séparation de l'axone vertical en deux branches horizontales donne lieu à une forme en T caractéristique. Une fibre parallèle se prolonge d'environ 3 mm dans les deux directions à partir du point de séparation, pour une longueur totale de près de 6 mm, soit 1/10 de la largeur totale de la couche corticale[5]. Le long de cette distance, les fibres parallèles traversent les arbres dendritiques des cellules de Purkinje et établissent des synapses avec 1/3 à 1/5 d'entre elles, formant au total 80 à 100 synapses avec les épines dendritiques de diverses cellules de Purkinje[5]. Les cellules granulaires utilisent le glutamate comme neurotransmetteur, et exercent par conséquent une action excitatrice sur les cellules cibles.
Les cellules granulaires reçoivent tous leurs signaux des fibres moussues, mais surpassent celles-ci en nombre (proportion de 200 pour 1 chez l'humain). Ainsi l'information qui circule dans la population de cellules granulaires en activité est identique à l'information véhiculée par les fibres moussues, mais encodée d'une manière plus «expansive». À cause de la petite taille et de la densité des cellules granulaires, il a été très difficile d'enregistrer leur émission de potentiels d'action chez l'animal vigile, de sorte que nous ne disposons que de peu de données pour établir des théories. La conception la plus célèbre de leur fonction a été proposée par David Marr, qui a suggéré que les cellules granulaires pourraient encoder des combinaisons de signaux en provenance de diverses fibres moussues. L'idée est que chaque cellule granulaire ne reçoit des signaux que de 4 ou 5 fibres moussues, et ne répond que si plus d'un signal lui parvient. Ce schéma de codage combinatoire pourrait potentiellement permettre au cervelet de faire des distinctions plus fines entre les patterns d'information que ce que permettraient les fibres moussues seules[12].
Fibres moussues
Les fibres moussues pénètrent dans la couche granulaire en provenance de diverses origines, telles que les noyaux pontiques, la moelle épinière, les noyaux vestibulaires, etc. Dans le cervelet humain, on estime le nombre total de fibres moussues à environ 200 millions[5]. Ces fibres forment des synapses excitatrices avec les cellules granulaires et les cellules des noyaux cérébelleux profonds. À l'intérieur de la couche granulaire, une fibre moussue donne naissance à une série d'élargissements appelés « rosettes ». Les contacts entre les fibres moussues et les dendrites des cellules granulaires s'effectuent dans des structures appelées glomérules. Chaque glomérule comporte une rosette de fibre moussue en son centre, en contact avec jusqu'à 20 arbres dendritiques de cellules granulaires. Les terminaisons axonales des cellules de Golgi infiltrent la structure de l'ensemble, et forment des synapses inhibitrices sur les dendrites des cellules granulaires. L'assemblage tout entier est enveloppé dans une gaine de cellules gliales[5]. Chaque fibre moussue envoie des branches collatérales vers plusieurs folia cérébelleux, donnant naissance à un total de 20 à 30 rosettes ; ainsi une seule fibre moussue peut être en contact avec 400 à 600 cellules granulaires[5].
Fibres grimpantes
Les cellules de Purkinje reçoivent également des afférences en provenance du noyau olivaire inférieur, sur le versant controlatéral du tronc cérébral, via les fibres grimpantes. Bien que le noyau olivaire inférieur se trouve dans la moelle allongée, et reçoive ses signaux de la moelle épinière, du tronc cérébral et du cortex cérébral, il envoie des influx exclusivement vers le cervelet. Une fibre grimpante émet des collatérales vers les noyaux cérébelleux profonds avant d'entrer dans le cortex cérébelleux, où elle se divise en une dizaine de terminaisons axonales, innervant chacune une seule cellule de Purkinje[5]. Contrastant fortement avec la centaine de milliers (ou davantage) de signaux en provenance des fibres parallèles, une seule et unique fibre grimpante entre en contact avec une cellule de Purkinje ; mais cette fibre suit les dendrites les plus proches du soma de la cellule de Purkinje, jusqu'à former un total de près de 300 synapses sur autant d'épines dendritiques[5]. Le signal du réseau dans son ensemble est si puissant qu'un seul potentiel d'action dans une fibre grimpante est capable de produire dans la cellule de Purkinje l'émission d'une bouffée de potentiels d'actions qui constituent un potentiel d'action "complexe". Les synapses des fibres grimpantes se situent essentiellement sur les dendrites basales des cellules de Purkinje, une zone dénuée de contacts avec les fibres parallèles, mais se rencontrent aussi sur le corps cellulaire[5].
Le contraste entre les afférences des fibres parallèles et des fibres grimpantes (~200 000 fibres parallèles avec 1 contact/fibre parallèle vs 1 seule fibre grimpante avec plus de 200 contacts pour chaque cellule de Purkinje) est probablement la caractéristique la plus étonnante de l'anatomie du cervelet, et a motivé une grande partie des théories établies au fil du temps sur ce dernier. La fonction des fibres grimpantes est, parmi tous les sujets qui touchent au cervelet, le plus controversé. Deux écoles de pensées se font ici face : l'une suit Marr et Albus, et soutient que l'input de la fibre grimpante sert d'abord de signal professeur ; l'autre propose qu'il a pour but de moduler directement les signaux sortant du cervelet. Chaque point de vue a été défendu en de longues lignes dans de nombreuses publications. Selon les mots d'une revue»[11], « En essayant de synthétiser les diverses hypothèses sur la fonction des fibres grimpantes, on a le sentiment d'examiner une œuvre de Escher. Chaque point de vue semble rendre compte d'un certain nombre de découvertes, mais lorsqu'on tente de réunir les opinions, aucune image cohérente de la fonction des fibres grimpantes n'apparaît. Pour la majorité des chercheurs, les fibres grimpantes signalent une erreur dans l’exécution d'une commande motrice, soit d'une manière habituelle par la modulation des fréquences de décharge, soit par une simple annonce d'un « évènement inhabituel ». Pour les autres experts, l'information se trouve dans la synchronie de l'ensemble et la rythmicité au sein d'une population de fibres grimpantes. »[11]
Noyaux profonds
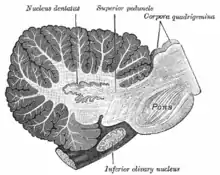
Les noyaux profonds du cervelet sont des grappes de matière grise enchâssées dans la substance blanche au cœur du cervelet. Ce sont, à l'exception des noyaux vestibulaires et du noyau parabrachial qui recoivent directement des projections des cellules de Purkinje, les uniques sources d'efférences du cervelet. Ces noyaux reçoivent des projections collatérales des fibres parallèles et des fibres grimpantes, aussi bien que des signaux inhibiteurs des cellules de Purkinje du cortex cérébelleux. Chacun des trois noyaux (dentelés, interposés, fastigiaux) communique avec différentes régions du cerveau et du cortex cérébral. Les noyaux fastigiaux et interposés (globuleux et emboliformes) appartiennent au paléocervelet. Les noyaux dentelés, qui chez les mammifères sont beaucoup plus larges que les autres, sont formés d'une fine couche de matière grise en circonvolutions, et communiquent exclusivement avec les régions latérales du cortex cérébelleux. L'archéocervelet avec le lobe flocculo-nodulaire est la seule partie du cortex cérébelleux qui n'a pas d'efférence vers les noyaux profonds, mais vers les noyaux vestibulaires[5].
La majorité des neurones des noyaux cérébelleux profonds ont de larges corps cellulaires, des arbres dendritiques sphériques avec un rayon d'environ 400 µm, et utilisent le glutamate comme neurotransmetteur. Ces cellules se projettent vers un large éventail de cellules hors du cervelet. Une petite population de neurones de projection des noyaux cérébelleux utilise la glycine comme neurotransmetteur. Accompagnant ces neurones, un nombre moins élevé de petites cellules utilisent le GABA comme neurotransmetteur, et se projettent soit uniquement au sein des noyaux cérébelleux (interneurones), soit vers le noyau olivaire inférieur, la source des fibres grimpantes. Ainsi, les projections du noyau olivaire exercent une rétroaction inhibitrice pour contrebalancer l'action excitatrice des fibres grimpantes sur les noyaux. Certaines données tendent à prouver que chaque petite grappe de cellules nucléaires projette vers la même grappe de cellules du noyau olivaire qui lui envoient des fibres grimpantes[5].
Lorsque l'axone d'une cellule de Purkinje pénètre l'un des noyaux profonds, il se ramifie pour entrer en contact à la fois avec des cellules larges et petites, le nombre total de cellules contactées avoisinant 35 (chez le chat). À l'inverse, chaque cellule nucléaire profonde forme environ 860 connexions avec autant de cellules de Purkinje (à nouveau chez le chat)[5].
Compartimentation
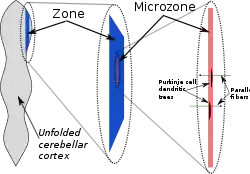
Dans une étude anatomique grossière, le cortex cérébelleux apparaît comme une feuille homogène de tissu neuronal ; dans une étude anatomique détaillée, tous les morceaux de cette feuille semblent présenter la même structure interne. Il y a cependant un certain nombre de points pour lesquels la structure du cervelet est compartimentée. On trouve des compartiments larges, appelés «zones», que l'on peut décomposer en plusieurs compartiments plus petits que l'on appelle « microzones »[13].
Les premiers indices de la compartimentation de la structure du cervelet sont venus d'études sur les champs récepteurs des cellules dans différentes régions du cortex cérébelleux[13]. Chaque partie du corps correspond à des points spécifiques dans le cervelet, mais la carte de base se répète de nombreuses fois, en formant une organisation appelée « somatotopie fracturée »[14]. Un indice plus explicite de la compartimentation est obtenu par un immunomarquage du cervelet affectant uniquement certaines protéines. Les plus connus de ces marqueurs sont les « zébrines », appelées ainsi parce que leur utilisation donne naissance à un motif très particulier rappelant les rayures d'un zèbre. Ces rayures provoquées par les zébrines (ainsi que les autres marqueurs de la compartimentation) sont orientées perpendiculairement aux replis du cervelet — c'est-à-dire qu'on en trouve en bandes étroites dans la direction médiolatérale, et en bandes beaucoup plus étendues dans la direction longitudinale. Différents marqueurs génèrent différents ensembles de rayures, et les dimensions des rayures varient en fonction de leur localisation, mais on retrouve une forme similaire à chaque fois[13].
À la fin des années 1970, Oscarsson suggéra que ces zones corticales pouvaient être découpées en plusieurs unités plus réduites, appelées microzones[15]. Plusieurs caractéristiques permettent de définir une microzone:
- La définition initiale d'une microzone est un groupe de cellules de Purkinje partageant un même champ récepteur somatotopique. Cette définition n'a de sens que dans les régions du cervelet pourvue d'entrées somato-sensorielles. Chaque microzone comprend environ 1 000 cellules de Purkinje, disposées dans une rayure longue et étroite, orientées perpendiculairement aux replis du cervelet[13]. Ainsi, les dendrites des cellules de Purkinje sont aplaties dans la même direction au fur et à mesure de l'extension de la microzone, tandis que les fibres parallèles les croisent à angle droit.
- Une deuxième caractéristique des microzones concerne l'innervation des cellules de Purkinje. Au sein d'une microzone, l'innervation provient de fibres grimpantes en provenance de petit groupes de cellules du noyau olivaire inférieur. Les branches d'une fibre grimpante (au nombre de 10 environ) innervent habituellement les cellules de Purkinje appartenant à une même microzone. De plus, les neurones olivaires qui envoient des fibres grimpantes vers une même microzone ont tendance à être unis par des jonctions communicantes, qui synchronisent leur activité et entraînent les cellules de Purkinje à manifester une émission coordonnée de potentiels d'action complexes à l'échelle de la milliseconde[13]. Par ailleurs, les axones des cellules en corbeille sont beaucoup plus longs dans la direction longitudinale que dans la direction médiolatérale, les cantonnant à une seule microzone[13]. La conséquence principale de cette structure est que les interactions cellulaires sont bien plus intenses à l'intérieur d'une microzone qu'entre plusieurs microzones.
- Une troisième caractéristique des microzones concerne les projections des cellules de Purkinje. Les cellules de Purkinje appartenant à une même microzone envoient leurs axones vers une même grappe des cellules efférentes dans les noyaux cérébelleux profonds[13].
En 2005, Richard Apps et Martin Garwicz ont récapitulé les preuves que les microzones elles-mêmes ne sont qu'une partie d'une entité plus importante, qu'ils nomment un microcomplexe microzonal. Un tel microcomplexe englobe plusieurs microzones corticales spatialement séparées, qui toutes se projettent vers le même groupe de noyaux cérébelleux profonds, ainsi qu'un groupe de neurones olivaires couplés qui émettent leurs axones vers les microzones corticales incluses aussi bien que vers la zone des noyaux profonds formant ainsi des boucles imbriquées [13].
Vascularisation
Le cervelet est vascularisé par trois paires d'artères provenant des artères vertébrales : les artères cérébelleuses postéro-inférieures, issues directement des artères vertébrales ; les artères cérébelleuses antéro-inférieures et les artères cérébelleuses supérieures, issues de l'artère basilaire, celle-ci étant une artère issue de la réunion des deux artères vertébrales.
Afférences et efférences
D'une manière générale, les fibres moussues (en) font synapse avec les dendrites des grains au niveau des glomérules (et des cellules de Golgi (en)) et les fibres grimpantes font synapse avec les cellules de Purkinje, mais ces deux types de fibres envoient une collatérale aux noyaux cérébelleux profonds.
Afférences
- Afférences moussues :
- afférences spinales : Faisceaux spino-cérébelleux dorsal, spino-cérébelleux ventral, spino-cérébelleux rostral, et cunéocérébelleux ;
- afférences réticulaires : noyaux réticulaires latéral, paramédian, tegmental pontique ;
- afférences pontiques : noyaux pontiques, raphé, trigeminal, péri-hypoglossiens, du tractus solitaire, du vague, vestibulaires et parabracchial ;
- afférences mésencéphaliques : colliculi inférieurs et supérieurs ;
- afférences diencéphaliques : hypothalamus, pallidum.
Les noyaux pontiques situés dans la région ventrale de la protubérance (basis pontis) forment les principaux relais des afférences corticales vers le cervelet. Ces afférences comprennent, chez le singe, des faisceaux issus des cortex sensori-moteur et prémoteur, ainsi que des faisceaux « associatifs » : prefronto-pontique (aires de Brodmann 8A, 9, 10, 45B, 46, 32), temporo-pontique (la berge supérieure du sillon temporal supérieur), pariéto-pontique (lobules pariétaux supérieur et inférieur), para-hippocampo-pontique, occipito-pontique (région parastriée), et cingulo-pontique (aires 23, 24, 25, 35 et cortex rétrosplénial)[16].
- Afférences « grimpantes » :
- olive bulbaire principale et olives accessoires médiale et caudales.
L'olive bulbaire reçoit des afférences multiples via le faisceau cortico-bulbaire (cortex moteur), via le faisceau tegmental central (notamment la partie parvocellulaire du noyau rouge), via les noyaux cérébelleux profonds et via le faisceau spino-olivaire. Le noyau de l'olive bulbaire participe ainsi à une boucle cérébello-rubro-olivo-cérébelleuse dont le fonctionnement est modulé principalement par les projections corticales. Les fibres grimpantes se terminent sur les troncs primaires et secondaires des cellules de Purkinje, du côté opposé.
Les neurones olivaires présentent une oscillation endogène de leur potentiel membranaire à une fréquence d'environ 10 Hz, et la survenue des potentiels d'action coïncide avec le maximum d'amplitude de ces oscillations[17]. L'activité de plusieurs neurones olivaires peut être synchronisée par des jonctions communicantes au niveau de leurs dendrites[18]. À l'opposé, les projections GABAergiques des noyaux cérébelleux concourent à désynchroniser le fonctionnement de ces neurones[19]. L'activité de ces «agrégats» de neurones olivaires permettrait de séquencer dans le temps l'activité des cellules de Purkinje en définissant des fenêtres d'activation[20].
Efférences
- des noyaux fastigiaux :
- faisceau unciné cheminant dans le pédoncule cérébelleux supérieur controlatéral et se terminant au niveau: de la formation réticulée, du raphé, des noyaux pontiques, des noyaux vestibulaires, de l'hypothalamus et du thalamus ;
- faisceau fastigio-bulbaire direct cheminant dans le pédoncule cérébelleux inférieur ipsi-latéralement et se terminant sur les noyaux vestibulaires, olivaires accessoires, et la formation réticulée ;
- faisceau fastigio-spinal : se terminant sur des motoneurones cervicaux contro-latéraux ;
- des noyaux interposés :
- faisceau principal cheminant dans le pédoncule cérébelleux supérieur, décussant dans le tegmentum mésencéphalique ventral et bifurquant en une branche ascendante vers la partie magnocellulaire du noyau rouge, l'hypothalamus et le thalamus, et une branche descendante vers le noyau réticulaire tegmental pontique, les olives bulbaires accessoires et des interneurones médullaires ;
- des noyaux dentelés :
- faisceau principal cheminant dans le pédoncule cérébelleux supérieur, décussant dans le tegmentum mésencéphalique ventral et bifurquant en une branche ascendante vers la partie parvocellulaire du noyau rouge, l'hypothalamus, la zona incerta et le thalamus, et une branche descendante vers le noyau réticulaire tegmental pontique, et l'olive bulbaire principale ;
- faisceau dentato-spinal : faisceau polysynaptique dont une partie fait relais dans la formation réticulée[21].
- faisceau principal cheminant dans le pédoncule cérébelleux supérieur, décussant dans le tegmentum mésencéphalique ventral et bifurquant en une branche ascendante vers la partie parvocellulaire du noyau rouge, l'hypothalamus, la zona incerta et le thalamus, et une branche descendante vers le noyau réticulaire tegmental pontique, et l'olive bulbaire principale ;
Les noyaux cérébelleux profonds se projettent aussi sous forme de fibres moussues glutaminergiques ou, moins densément, GABAergiques sur les grains.
Les noyaux thalamiques recevant des projections cérébelleuses comprennent chez le singe: les noyaux ventro-postéro-latéral oral, ventro-latéral caudal, X, dorso-médian et intralaminaire (paracentral)[22].
Par l'intermédiaire du thalamus, le cervelet se connecte, chez le singe, aux cortex moteur (aire 4), prémoteur (aire 6 incluant l'aire motrice supplémentaire), pariétal (aire 7) et préfrontal (aires 8, 9 latérale et médiane et 46 dorsale)[23]. Les voies cérébello-préfrontales sont issues de la région ventrale du noyau dentelé.
Fonctions
Les indices les plus forts sur la fonction du cervelet sont venus avec l'examen des conséquences de lésions cérébelleuses. Les animaux et les humains ayant un dysfonctionnement cérébelleux montrent par-dessus tout des troubles du contrôle moteur. Ils sont toujours capables de générer une activité motrice, mais elle est imprécise, avec des mouvements erratiques, mal coordonnée ou mal synchronisée. Un test standard de la fonctionnalité du cervelet est de tenter d'atteindre avec le bout du doigt une cible placée à une distance d'un bras : une personne saine bougera son doigt dans un mouvement rapide et droit vers la cible, là où des personnes lésées au cervelet auront des mouvements lents et maladroits, avec de nombreuses corrections à mi-parcours. Des pertes dans des fonctions non motrices sont plus difficiles à détecter. On est ainsi parvenu, il y a des décennies de cela, à la conclusion que la fonction première du cervelet n'est pas d'initier les mouvements ou de décider de ceux qui vont être exécutés, mais bien de déterminer la forme détaillée de chaque mouvement[6].
Avant les années 1990, on croyait presque unanimement que la fonction du cervelet n'était relative qu'au mouvement, mais des découvertes plus récentes ont remis sérieusement en cause ce point de vue. Des études par imagerie cérébrale fonctionnelle ont montré l'activité du cervelet dans des tâches impliquant le langage, l'attention, ou l'imagerie mentale ; des études corrélées ont mis en évidence les interactions entre le cervelet et des aires non motrices du cortex cérébral ; enfin, une grande variété de symptômes non moteurs ont été observés chez des patients qui avaient subi des lésions confinées au seul cervelet[24],[25].
Kenji Doya a soutenu que la fonction du cervelet est mieux comprise, non pas en considérant dans quels comportements il est impliqué, mais bien en examinant le type de calcul neuronal qu'il effectue ; le cervelet consiste en un grand nombre de modules plus ou moins indépendants, tous avec la même structure interne (même types cellulaires, même organisation des connections), et par conséquent supposés réaliser le même type de calcul. Si les afférences ou les efférences d'un module se portent sur une aire motrice du cortex cérébral (comme c'est souvent le cas), alors le module sera impliqué dans des comportements moteurs ; si en revanche les aires corticales concernées ne sont pas motrices, le module sera concerné dans d'autres types de comportements. Le cervelet, suggère Doya, est mieux compris comme dispositif d'apprentissage supervisé, au contraire des ganglions de la base qui opèrent un apprentissage par renforcement, et du cortex cérébral, qui concerne l'apprentissage non supervisé[25].
Principes
Les relatives simplicités et régularités de l'anatomie du cervelet ont mené à un premier espoir qu'elles pouvaient impliquer une simplicité comparable au niveau de la fonction computationnelle, comme il est dit dans l'un des premiers ouvrages sur l'électrophysiologie du cervelet, The Cerebellum as a Neuronal Machine (« Le cervelet comme une machine neuronale »), écrit conjointement par John Eccles, Masao Ito et Janos Szentágothai[26]. Bien que la compréhension totale de la fonction du cervelet nous échappe encore, quatre principes ont été identifiés comme primordiaux : (1) le traitement par contrôle en boucle ouverte, (2) la divergence et la convergence, (3) la modularité et (4) la plasticité.
Traitement par contrôle en boucle ouverte
Le cervelet diffère de l'immense majorité des régions du cerveau (en particulier du cortex cérébral) en ce que le traitement du signal se fait presque entièrement par contrôle en boucle ouverte — c'est-à-dire que les signaux se déplacent de façon unidirectionnelle à travers le système, de l'afférence vers l'efférence, avec très peu de transmission rétroactive en interne. Le peu de rétroaction existant consiste en une inhibition mutuelle ; il n'y a pas de circuit d'excitation mutuelle. Ce mode opératoire en « feedforward » signifie que le cervelet, contrairement au cortex cérébral, ne peut pas générer de schéma auto-entretenu d'activité neuronale. Les signaux entrent dans le circuit, sont traités par les différents modules dans un ordre séquentiel, puis quittent le circuit. Comme l'écrivaient Ito, Eccles et Szentágothai : « cette élimination de toute possibilité de chaînes rétroactives d'excitation neuronale est sans aucun doute un immense avantage pour la performance de calcul du cervelet, car ce que le reste du système nerveux demande à ce dernier n'est probablement pas de produire un signal exprimant le fonctionnement de circuits de rétroaction complexes dans le cervelet, mais plutôt une réponse claire et rapide à un quelconque ensemble particulier d'informations[27]. » Ce modèle néglige cependant la présence de connections rétroactives des noyaux cérébelleux vers la couche granulaire, et des cellules de Purkinje dans le cortex cérébelleux.
Divergence et convergence
Dans le cervelet humain, l'information en provenance de 200 millions de fibres moussues est transmise à 50 milliards de cellules granulaires, dont les fibres parallèles convergent sur 15 millions de cellules de Purkinje[5]. De par leur alignement longitudinal, le millier de cellules de Purkinje qui appartiennent à une même microzone peuvent recevoir des informations de près de 100 millions de fibres parallèles, et concentrent leur propre émission vers moins d'une cinquantaine de cellules des noyaux profonds[13]. Ainsi, le réseau cérébelleux reçoit un nombre modeste de signaux, les traite de façon extensive à travers un réseau interne rigoureusement structuré, et renvoie les résultats via un nombre limité de cellules efférentes.
Modularité
Le système cérébelleux est divisé en modules plus ou moins indépendants, qui se comptent probablement par centaines ou par milliers. Tous ces modules ont une structure interne similaire, mais des entrées et des sorties différentes. Un module (un « microcompartiment multizonal » pour reprendre les termes de Apps et Garwicz) consiste en une petite grappe de neurones dans le noyau olivaire inférieur, un ensemble de longues et étroites bandes de cellules de Purkinje dans le cortex cérébelleux (les microzones), et un petit groupe de neurones dans l'un des noyaux cérébelleux profonds. Différents modules partagent les mêmes signaux en provenance des fibres moussues et des fibres parallèles, mais ils apparaissent comme fonctionnant différemment à d'autres égards — le signal émis par un module ne semble pas influencer significativement l'activité des autres modules[13].
Plasticité
Les synapses entre les fibres parallèles et les cellules de Purkinje, et les synapses entre les fibres moussues et les cellules des noyaux profonds, sont susceptibles chacune de voir leur force renforcée. Dans un seul module du cervelet, des signaux en provenance d'un nombre de fibres parallèles pouvant atteindre un milliard convergent sur un groupe de moins de 50 cellules nucléaires profondes, et l'influence de chaque fibre parallèle est adaptable. Cette organisation procure une formidable souplesse dans l'ajustement des relations entre les afférences et les efférences cérébelleuses[28].
Apprentissage
On dispose de fortes preuves que le cervelet joue un rôle important dans certains types d'apprentissages moteurs. Les tâches où le cervelet entre le plus clairement en action sont celles dans lesquelles il est nécessaire de procéder à un ajustement précis de la manière d'exécuter une action. Il y a eu cependant de nombreux litiges, pour savoir si l'apprentissage se déroulait dans le cervelet lui-même, ou si ce dernier servait davantage à émettre des signaux qui favorisaient l'apprentissage dans d'autres structures du cerveau[28]. La plupart des théories qui associent l'apprentissage aux circuits du cervelet d'idées originales de David Marr et James Albus, qui postulèrent que les fibres grimpantes émettent un signal professeur qui induit une modification dans les synapses entre les fibres parallèles et les cellules de Purkinje[29]. Marr supposa que le signal des fibres grimpantes provoque un renforcement des signaux issus de l'activation synchrone des fibres parallèles. Les modèles plus récents de l'apprentissage dans le cervelet ont cependant présumé à la suite d'Albus que l'activité des fibres grimpantes marque un signal d'erreur, et provoquerait un affaiblissement des signaux issus de l'activation synchrone des fibres parallèles. Quelques-uns de ces modèles tardifs, comme le modèle du «Filtre adaptatif» de Fujita[30], ont tenté de comprendre la fonction du cervelet à travers la théorie du contrôle optimal.
L'idée que l'activité des fibres grimpantes fonctionne comme un signal d'erreur a été examiné dans de nombreuses études expérimentales, certaines y étant favorables, d'autres plus réservées[11]. Dans une étude pionnière de Gilbert et Thach en 1977, les cellules de Purkinje de singes en plein apprentissage montraient une émission élevée de potentiels d'action complexes pendant les périodes où la performance du singe était médiocre[31]. Plusieurs études sur l'apprentissage moteur chez le chat ont montré qu'il y avait une émission de potentiels d'action complexes lorsque le mouvement exécuté ne correspondait pas au mouvement voulu. Les études sur le réflexe vestibulo-oculaire (qui stabilise l'image sur la rétine quand on tourne la tête) ont trouvé que l'activité des fibres grimpantes indique un « glissement rétinien », mais pas de manière directe[11]. Les études du réflexe optokinétique (qui permet de suivre du regard une cible mobile) ont montré que l'occurrence d'une décharge de la fibre grimpante lors d'un test du réflexe modifie la décharge des cellules de Purkinje ainsi que le réflexe lors du test suivant, ce qui soutient l'idée que la fibre grimpante induit une plasticité et un apprentissage moteur[32]. Toutefois, d'autres expériences montrent une activation de la fibre grimpante indépendante de l'erreur, par exemple en réponse à un simple stimulus sensoriel ou même à la réception d'une récompense attendue, ce qui limite le caractère universel de la théorie du message d'erreur porté par la fibre grimpante.
L'une des tâches d'apprentissage cérébelleux les plus largement étudiées est le paradigme du conditionnement du clignement des paupières, dans lequel un stimulus neutre conditionnel (SC) tel qu'une lumière ou une tonalité est répétitivement associé avec un stimulus inconditionnel (SI), comme un jet d'air, qui provoque un clignement des paupières en réponse. Après de telles présentations répétées du SC et du SI, le SC provoquera finalement un clignement des paupières avant même l'arrivée du SI : c'est ce que l'on appelle une réponse conditionnelle (RC). Les expériences ont montré que des lésions localisées dans une région spécifique du noyau interposé (un des noyaux cérébelleux profonds) ou à certains points spécifiques du cortex cérébelleux peuvent abolir l'apprentissage d'une réponse des paupières correctement synchronisée. Si les efférences du cervelet sont pharmacologiquement inactivées tandis que les afférences et les circuits intracellulaires restent intactes, l'apprentissage aura lieu même si l'animal échoue à montrer une quelconque réponse, alors que si les circuits intracellulaires sont perturbés, aucun apprentissage n'a lieu — ces faits pris ensemble constituent un argument de poids en faveur du fait que l'apprentissage s'effectue dans le cervelet[33].
Théories et modèles computationnels
La grande base de données sur l'anatomie et les fonctions comportementales du cervelet en a fait un terrain fertile pour la théorisation — il y a probablement davantage de théories sur la fonction du cervelet que sur n'importe quelle autre partie du cerveau. La distinction la plus simple que l'on puisse faire entre celles-ci les sépare entre les « théories de l'apprentissage » et les « théories de l'action » — c'est-à-dire entre les théories qui utilisent la plasticité synaptique du cervelet pour expliquer son rôle dans l'apprentissage, et celles qui rendent compte de certains aspects d'un comportement en cours sur la base du traitement du signal dans le cervelet. Plusieurs théories de chaque type ont été mises sous la forme de modèles mathématiques qui ont été simulés sur ordinateur[29].
La première des « théories de l'action » fut peut-être l'hypothèse de la « ligne à retard » de Valentino Braitenberg. La théorie initiale mise en avant par Braitenberg et Atwood en 1958 suggérait que la propagation lente des signaux le long des fibres parallèles impose des retards prévisibles qui permettent au cervelet de déterminer les relations temporelles entre les signaux dans un certain cadre[34]. Les données expérimentales ne confirmèrent pas cette première théorie, mais Braitenberg continua de plaider pour des versions modifiées[35]. Ce modèle est peu compatible avec l'organisation modulaire du cervelet qui est maintenant largement acceptée. L'hypothèse que le cervelet fonctionne essentiellement comme un système de perception temporelle a également été soutenue par Richard Ivry[36]. Une autre « théorie de l'action » influente est la théorie des réseaux de tenseurs de Pellionisz et Llinás, qui a fourni une formulation mathématique avancée de l'idée que le calcul fondamental opéré par le cervelet est la conversion des signaux sensoriels en coordonnées motrices[37].
Les « théories de l'apprentissage » dérivent presque toutes des premières publications de David Marr[12] et James Albus[38]. L'article de Marr de 1969 propose que le cervelet est un dispositif d'apprentissage qui associe les mouvements élémentaires encodés par les fibres grimpantes avec le contexte sensoriel encodé par les fibres moussues. Albus supposa qu'une cellule de Purkinje fonctionne comme un perceptron, un dispositif d'apprentissage abstrait d'inspiration neuronale. La différence la plus simple entre les théories de Marr et d'Albus est que Marr suppose que l'activité des fibres grimpantes provoque un renforcement des synapses avec les fibres parallèles, alors qu'Albus considère qu'il s'agit davantage d'un affaiblissement de ces synapses. Albus a également formulé son hypothèse dans un algorithme qu'il a appelé CMAC (pour l'anglais : Cerebellar Model Articulation Controller), et qui a été testé dans de nombreuses applications[39].
Pathologie
La sémiologie cérébelleuse admet trois grands types de troubles moteurs selon la localisation et l'importance de la lésion causale[40] :
- une hypotonie, à la phase aigüe et souvent transitoire, caractérisée par une diminution de la résistance des muscles à leur étirement ;
- une incoordination statique se traduisant par des troubles de l'équilibre ou du maintien d'attitude. On parle d'ataxie cérébelleuse ; cette incoordination est le principal facteur des chutes;
- une incoordination cinétique regroupant différents symptômes : hypermétrie/hypométrie (anomalie de l'amplitude des mouvements avec dépassement de la cible ou arrêt prématuré avant la cible), asynergie (perte de l'enchaînement harmonieux et fluide des mouvements), adiadococinésie (incapacité à alterner les mouvements rapides), dyschronométrie (délai à l'initiation des mouvements), et tremblement. Le tremblement est dit « cinétique » car il augmente en fin de mouvement. Il est diminué par l'addition d'inertie (masse fixée au niveau du membre en mouvement), contrairement à l'hypermétrie.
Il s'y associe des troubles de la reproduction des mouvements rythmiques, et du contrôle de l'impédance articulaire, de la force musculaire et des gains de certains réflexes comme le réflexe vestibulo-oculaire.
Ces altérations concernent non seulement les mouvements des membres mais également la démarche, la parole, l'écriture et l'oculomotricité (nystagmus horizontal). Les globes oculaires peuvent également présenter des oscillations rapides (flutter).
La symptomatologie motrice des membres peut être expliquée par un déséquilibre entre les activités musculaires agonistes et antagonistes.
Récemment, cette symptomatologie motrice a été complétée par l'individualisation d'un syndrome cérébelleux cognitif et affectif[41] comportant une atteinte des fonctions exécutives de planification, d'abstraction, de mémoire de travail, et de la mémoire visuospatiale, une diminution de la fluence verbale, des persévérations, une simultagnosie et des changements émotionnels (comportements inappropriés, désinhibition, irritabilité, impulsivité, labilité et pauvreté des affects. Quelques erreurs de langage ont été aussi notées (dysprosodie, agrammatisme et anomie modérée). Ce syndrome porte aussi le nom de syndrome de Schmahmann[42].
Le syndrome cognitif surviendrait lors de lésions affectant les hémisphère cérébelleux (et le noyau dentelé), alors que le syndrome affectif résulterait d'une lésion du vermis (et du noyau fastigial). Dans ce dernier cas, un dysfonctionnement autonomique avec des accès d'éternuements, une bradycardie, une hyperventilation, une dilatation pupillaire et des pertes de connaissance ont aussi été décrits[43]. Ces symptômes n'ont cependant pas toujours été retrouvés.
Anatomie comparée et évolution
Les circuits du cervelet sont similaires chez toutes les classes de vertébrés, incluant les poissons, les reptiles, les oiseaux et les mammifères[44]. Il existe une structure cérébrale analogue chez les céphalopodes au cerveau développé, comme la pieuvre[45]. Ce fait a été considéré comme une preuve que le cervelet joue un rôle important chez tous les vertébrés.
Les variations de la forme et de la taille du cervelet sont considérables d'une espèce vertébrée à l'autre. Chez les amphibiens, les lamproies et les myxines, le cervelet est peu développé ; chez les deux dernières, il se distingue à peine du tronc cérébral. Bien que le paléocervelet soit présent chez ces groupes, l'archéocervelet y est réduit à de petits noyaux couplés[46]. Le cervelet est un peu plus gros chez les reptiles, nettement plus important chez les oiseaux et plus important encore chez les mammifères. Les lobes jumelés et faits de circonvolutions que l'on trouve chez l'homme sont typiques des mammifères, mais le cervelet est, en règle générale, un simple lobe central chez les autres groupes, soit lisse, soit strié de légères rainures. Chez les mammifères, le néocervelet constitue la majeure partie du cervelet par sa masse, mais chez les autres vertébrés, cette distinction est habituellement réservée au paléocervelet[46].
Le cervelet des poissons osseux et des poissons cartilagineux est extraordinairement large et complexe. Sur au moins un point important, il diffère dans sa structure interne du cervelet mammalien : le cervelet des poissons ne contient pas de noyaux cérébelleux profonds. À la place, les cibles primaires des cellules de Purkinje constituent un type bien distinct de cellules distribuées au travers du cortex cérébelleux, un type de cellules que l'on n'observe pas chez les mammifères. Chez les mormyridés (une famille de poissons d'eau fraîche faiblement électrosensitifs), le cervelet est nettement plus volumineux que tout le reste du cerveau mis ensemble. La plus grande partie du cervelet est une structure appelée valvula, qui a une architecture inhabituellement régulière et reçoit la plupart de ses signaux du système électrosensoriel[47].
La marque du cervelet mammalien est un développement important des lobes latéraux, qui interagissent principalement avec le néocortex. Comme les primates évoluaient en grands singes, l'extension des lobes latéraux a continué, en même temps que le développement des lobes frontaux du néocortex. Chez les hominidés ancestraux, et chez Homo sapiens jusqu'au milieu du Pléistocène, le cervelet a continué de s'étendre, mais les lobes frontaux se sont développés plus vite encore. La période la plus récente de l'évolution humaine peut cependant être associée à l'accroissement de la taille relative du cervelet, comme le néocortex se réduisait et le cervelet s'étendait[48].
Structures semblables au cervelet
Beaucoup d'espèces de vertébrés ont des aires cérébrales qui ressemblent au cervelet de par leur architecture cellulaire et leur neurochimie[44]. La seule de ces aires que l'on trouve chez les mammifères est le noyau cochléaire dorsal (NCD), l'un des deux noyaux sensoriels primaires qui reçoivent des signaux directement du nerf auditif. Le NCD est une structure en couches, la couche inférieure contenant des cellules granulaires similaires à celles du cervelet, donnant naissance à des fibres parallèles qui s'élèvent jusqu'à la couche superficielle et la parcourent horizontalement. La couche superficielle contient un ensemble de neurones GABA-ergiques qui ressemblent anatomiquement et chimiquement aux cellules de Purkinje — ils reçoivent des signaux des fibres parallèles, mais d'aucun corps ressemblant aux fibres grimpantes. Les neurones efférents du NCD sont les cellules fusiformes. Ce sont des neurones glutamatergiques, mais qui ressemblent également aux cellules de Purkinje à certains égards : ils ont des arbres dendritiques superficiels épineux et aplatis qui relayent l'information des fibres parallèles, mais ils reçoivent également grâce à leurs dendrites basales des informations en provenance des fibres du nerf auditif, qui traversent le NCD perpendiculairement aux fibres parallèles. Le NCD est le plus développé chez les rongeurs et d'autres petits animaux, et considérablement réduit chez les primates. Sa fonction n'est pas encore comprise ; les hypothèses les plus populaires la rapprochent d'une manière ou d'une autre de l'audition spatiale[49].
La plupart des espèces de poissons et d'amphibiens possèdent un système de ligne latérale, capable de déceler les variations de la pression sous l'eau. L'une des aires cérébrales qui reçoit les informations de la ligne latérale, l'aire octavolatérale, a une structure semblable à celle du cervelet, avec des cellules granulaires et des fibres parallèles. Chez les poissons électro-sensibles, les signaux du système électrosensitif vont vers le noyau dorsal octavolatéral, qui a également une structure similaire à celle du cervelet. Chez les poissons à nageoires rayonnées (le groupe le plus diversifié des vertébrés), le colliculus supérieur a une couche — la couche marginale — qui ressemble également au cervelet[44].
Toutes ces structures similaires au cervelet semblent d'abord se rapporter plutôt au système sensoriel qu'au système moteur. Toutes possèdent des cellules granulaires donnant naissance à des fibres parallèles, qui sont connectées à des neurones semblables aux cellules de Purkinje par des synapses modifiables, mais aucune n'a de fibres grimpantes comparables à celles du cervelet ; à la place, elles reçoivent leurs informations directement des organes sensoriels périphériques. Aucune n'a de fonction clairement démontrée, mais l'hypothèse la plus influente veut qu'elles servent à transformer les signaux sensoriels de manière sophistiquée, peut-être pour compenser des changements dans la position du corps[44]. En réalité, James Bower et d'autres chercheurs ont soutenu, en se fondant à la fois sur ces structures et sur des études du cervelet, que le cervelet lui-même est fondamentalement une structure sensorielle, et qu'il contribue au contrôle moteur en déplaçant le corps de façon à contrôler les signaux sensoriels en résultant[50].
Histoire

L'apparence particulière du cervelet lui permit d'être caractérisé facilement par les pionniers de l'anatomie, dès l'Antiquité. Aristote et Galien ne le considéraient cependant pas comme une véritable partie du cerveau : ils l'appelèrent paracephalon (« semblable au cerveau »), par opposition à l’encephalon proprement dit. Galien a été le premier à en donner une description étendue ; en remarquant que le tissu cérébelleux semblait plus solide que le reste du cerveau, il supposa que sa fonction était de renforcer les nerfs moteurs[51].
Les descriptions plus approfondies du cervelet ne vinrent qu'à la Renaissance. Vésale l'examina brièvement, mais il fut étudié plus minutieusement par Thomas Willis en 1664. Ses travaux furent approfondis durant le XVIIIe siècle, mais ce n'est pas avant le XIXe siècle que l'on conçut les premières idées de sa fonction. En 1809, Luigi Rolando établit que des lésions dans le cervelet provoquaient des troubles moteurs. Durant la première moitié du XIXe siècle, Pierre Flourens mena des études expérimentales détaillées, qui révélèrent que des animaux ayant subi des dommages au cervelet pouvaient encore bouger, mais avec une perte de coordination (mouvements étranges, démarche maladroite, faiblesse musculaire), et qu'ils pouvaient récupérer presque complètement tant que la lésion n'était pas très étendue[52]. À l'aube du XXe siècle, il était largement accepté que la fonction du cervelet était principalement motrice. La première moitié du XXe siècle produisit plusieurs descriptions détaillées des symptômes cliniques associés à des lésions dans le cervelet humain[2].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cerebellum » (voir la liste des auteurs).
- ↑ (en) U Wolf, MJ Rapoport et TA Schweizer, « Evaluating the affective component of the cerebellar cognitive affective syndrome », J. Neuropsychiatry Clin. Neurosci., vol. 21, no 3, , p. 245–53 (PMID 19776302, DOI 10.1176/appi.neuropsych.21.3.245)
- 1 2 3 (en) EJ Fine, CC Ionita et L Lohr, « The history of the development of the cerebellar examination », Semin Neurol, vol. 22, no 4, , p. 375–84 (PMID 12539058, DOI 10.1055/s-2002-36759)
- ↑ Vitorio Delage, « Dictionnaire médical de l'Académie de Médecine », sur dictionnaire.academie-medecine.fr (consulté le )
- ↑ (en) Herculano-Houzel S, « Coordinated scaling of cortical and cerebellar numbers of neurons », Frontiers in Neuroanatomy, vol. 4, , p. 12 (PMID 20300467, PMCID 2839851, DOI 10.3389/fnana.2010.00012
 )
) - 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 (en) Llinas RR, Walton KD, Lang EJ et Shepherd GM (éditeur), The Synaptic Organization of the Brain, New York, Oxford University Press, (ISBN 0-19-515955-1), « Ch. 7 Cerebellum »
- 1 2 3 4 5 6 7 8 (en) Ghez C, Fahn S, Kandel ER (éditeur) et Schwartz JH (éditeur), Principles of Neural Science, New York, Elsevier, , 2e éd., « The cerebellum », p. 502–522
- ↑ (en) RE Kingsley, Concise Text of Neuroscience, Lippincott Williams and Wilkins, , 2e éd. (ISBN 0-683-30460-7)
- ↑ (en) D Timmann et I Daum, « Cerebellar contributions to cognitive functions: a progress report after two decades of research », Cerebellum, vol. 6, no 3, , p. 159–62 (PMID 17786810, DOI 10.1080/14734220701496448)
- ↑ (en) N Schweighofer, K Doya et S Kuroda, « Cerebellar aminergic neuromodulation: towards a functional understanding », Brain Res. Brain Res. Rev., vol. 44, nos 2–3, , p. 103–116 (PMID 15003388, DOI 10.1016/j.brainresrev.2003.10.004)
- ↑ (en) T. Yakusheva, P. M. Blazquez et D. E. Angelaki, « Relationship between Complex and Simple Spike Activity in Macaque Caudal Vermis during Three-Dimensional Vestibular Stimulation », Journal of Neuroscience, vol. 30, no 24, , p. 8111–8126 (ISSN 0270-6474 et 1529-2401, PMID 20554862, PMCID PMC3640351, DOI 10.1523/JNEUROSCI.5779-09.2010, lire en ligne, consulté le )
- 1 2 3 4 5 (en) JI Simpson, DR Wylie et CI De Zeeuw, « On climbing fiber signals and their consequence(s) », Behav. Brain Sci., vol. 19, no 3, , p. 384–398 (DOI 10.1017/S0140525X00081486)
- 1 2 (en) David Marr, « A theory of cerebellar cortex », J. Physiol., vol. 202, no 2, , p. 437–70 (PMID 5784296, PMCID 1351491)
- 1 2 3 4 5 6 7 8 9 10 (en) R Apps et M Garwicz, « Anatomical and physiological foundations of cerebellar information processing », Nat. Rev. Neurosci., vol. 6, no 4, , p. 297–311 (PMID 15803161, DOI 10.1038/nrn1646)
- ↑ (en) E Manni et L Petrosini, « A century of cerebellar somatotopy: a debated representation », Nat. Rev. Neurosci., vol. 5, no 3, , p. 241–9 (PMID 14976523, DOI 10.1038/nrn1347)
- ↑ (en) O Oscarsson, « Functional units of the cerebellum-sagittal zones and microzones », Trends Neurosci., vol. 2, , p. 143–145 (DOI 10.1016/0166-2236(79)90057-2)
- ↑ (en) Schmahmann & Pandya, 1997
- ↑ (en) Llinas & Yarom, 1986
- ↑ (en) Llinas et al. 1974.
- ↑ (en) Lang et al. 1996
- ↑ (en) Llinas, 1985
- ↑ (en) Bantli & Bloedel, 1976
- ↑ G. Percheron, C. François, B. Talbi et J. Yelnik, « The primate motor thalamus », Brain Research. Brain Research Reviews, vol. 22, no 2, , p. 93–181 (PMID 8883918, lire en ligne, consulté le )
- ↑ (en) Middleton & Strick, 1994,1997, 2001
- ↑ (en) Brenda Rapp, The Handbook of Cognitive Neuropsychology : What Deficits Reveal about the Human Mind, Psychology Press, , 652 p. (ISBN 1-84169-044-9, lire en ligne), p. 481
- 1 2 (en) K Doya, « Complementary roles of basal ganglia and cerebellum in learning and motor control », Curr. Op. Neurobiology, vol. 10, no 6, , p. 732–739 (PMID 11240282, DOI 10.1016/S0959-4388(00)00153-7)
- ↑ (en) JC Eccles, M Ito et J Szentágothai, The Cerebellum as a Neuronal Machine, Springer-Verlag,
- ↑ (en) The Cerebellum as a Neuronal Machine, p. 311
- 1 2 (en) ES Boyden, A Katoh et JL Raymond, « Cerebellum-dependent learning: the role of multiple plasticity mechanisms », Annu. Rev. Neurosci., vol. 27, , p. 581–609 (PMID 15217344, DOI 10.1146/annurev.neuro.27.070203.144238)
- 1 2 (en) JC Houk, JT Buckingham et AG Barto, « Models of the cerebellum and motor learning », Behav. Brain Sci., vol. 19, no 3, , p. 368–383 (DOI 10.1017/S0140525X00081474)
- ↑ (en) M Fujita, « Adaptive filter model of the cerebellum », Biol Cybern, vol. 45, no 3, , p. 195–206 (PMID 7171642, DOI 10.1007/BF00336192)
- ↑ (en) PF Gilbert et WT Thach, « Purkinje cell activity during motor learning », Brain Res., vol. 128, no 2, , p. 309–28 (PMID 194656, DOI 10.1016/0006-8993(77)90997-0)
- ↑ Yan Yang et Stephen G. Lisberger, « Purkinje-cell plasticity and cerebellar motor learning are graded by complex-spike duration », Nature, vol. 510, no 7506, , p. 529–532 (ISSN 1476-4687, PMID 24814344, PMCID 4132823, DOI 10.1038/nature13282, lire en ligne, consulté le )
- ↑ (en) KM Christian et RF Thompson, « Neural substrates of eyeblink conditioning: acquisition and retention », Learn. Mem., vol. 10, no 6, , p. 427–55 (PMID 14657256, DOI 10.1101/lm.59603)
- ↑ (en) V Braitenberg et RP Atwood, « Morphological observations on the cerebellar cortex », J. Comp. Neurol., vol. 109, no 1, , p. 1–33 (PMID 13563670, DOI 10.1002/cne.901090102)
- ↑ (en) V Braitenberg, D Heck et F Sultan, « The detection and generation of sequences as a key to cerebellar function: Experiments and theory », Behav. Brain Sciences, vol. 20, no 2, , p. 229–277 (PMID 10096998)
- ↑ (en) RB Ivry, RM Spencer, HN Zelaznik et J Diedrichsen, « The cerebellum and event timing », Ann. N. Y. Acad. Sci., vol. 978, , p. 302–307 (PMID 12582062, DOI 10.1111/j.1749-6632.2002.tb07576.x)
- ↑ (en) A Pellionisz et R Llinas, « Space-time representation in the brain. The cerebellum as a predictive space-time metric tensor », Neuroscience, vol. 7, no 12, , p. 2949–70 (PMID 7162624, DOI 10.1016/0306-4522(82)90224-X)
- ↑ (en) JS Albus, « A theory of cerebellar function », Math. Biosciences, vol. 10, nos 1–2, , p. 25–61 (DOI 10.1016/0025-5564(71)90051-4)
- ↑ (en) G Horváth, « CMAC: Reconsidering an old neural network », Intelligent Control Systems and Signal Processing, (lire en ligne [PDF], consulté le )
- ↑ (en) Holmes, 1939 ; Garcin, 1939 ; Gilman et al., 1981
- ↑ (en) Schmahmann & Sherman, 1998
- ↑ Manto M, Mariën P. Schmahmann’s syndrome - identification of the third cornerstone of clinical ataxiology. Cerebellum and Ataxias 2015, 2:2
- ↑ (en) Haines et al. 1997
- 1 2 3 4 (en) CC Bell, V Han et NB Sawtell, « Cerebellum-like structures and their implications for cerebellar function », Annu Rev Neurosci., vol. 31, , p. 1–24 (PMID 18275284, DOI 10.1146/annurev.neuro.30.051606.094225)
- ↑ (en) PL Woodhams, « The ultrastructure of a cerebellar analogue in octopus », J Comp Neurol, vol. 174, no 2, , p. 329–45 (PMID 864041, DOI 10.1002/cne.901740209)
- 1 2 (en) AS Romer et TS Parsons, The Vertebrate Body, Philadelphie, Holt-Saunders International, (ISBN 0-03-910284-X), p. 531
- ↑ (en) Z Shi, Y Zhang, J Meek, J Qiao et VZ Han, « The neuronal organization of a unique cerebellar specialization: the valvula cerebelli of a mormyrid fish », J. Comp. Neurol., vol. 509, no 5, , p. 449–73 (PMID 18537139, DOI 10.1002/cne.21735)
- ↑ (en) AH Weaver, « Reciprocal evolution of the cerebellum and neocortex in fossil humans », Proc Natl Acad Sci. USA., vol. 102, no 10, , p. 3576–3580 (PMID 15731345, PMCID 553338, DOI 10.1073/pnas.0500692102)
- ↑ (en) PD Roberts et CV Portfors, « Design principles of sensory processing in cerebellum-like structures. Early stage processing of electrosensory and auditory objects », Biol Cybern, vol. 98, no 6, , p. 491–507 (PMID 18491162, DOI 10.1007/s00422-008-0217-1)
- ↑ (en) JM Bower, « Is the cerebellum sensory for motor's sake, or motor for sensory's sake: the view from the whiskers of a rat? », Prog Brain Res., progress in Brain Research, vol. 114, , p. 463–96 (ISBN 9780444823137, PMID 9193161, DOI 10.1016/S0079-6123(08)63381-6)
- ↑ (en) E Clarke et CD O'Malley, The Human Brain and Spinal Cord, Norman Publishing, (ISBN 0-930405-25-0), chap. 11 (« Cerebellum »)
- ↑ (en) M Ito, « Historical review of the significance of the cerebellum and the role of Purkinje cells in motor learning », Ann N Y Acad Sci., vol. 978, , p. 273–288 (PMID 12582060, DOI 10.1111/j.1749-6632.2002.tb07574.x)
Voir aussi
Bibliographie
- ECCLES JC, ITO M, SZENTAGOTAI J (1967) The cerebellum as neuronal machine. Springer-verlag, Berlin.
- GARCIN R (1939) « Syndrome cérébelleux: étude analytique » In: « Système nerveux » Encyclopédie médico-chirurgicale. Ire édition. 17040B: 1-7.
- GILMAN S, BLOEDEL JR, LECHTENBERGER R (1981) Disorders of the cerebellum. FA Davis Company, Philadelpia.
- GRUOL DL, KOIBUCHI N, MANTO M, MOLINARI M, SCHMAHMANN JD, SHEN Y. (éditeurs)(2016) Essentials of cerebellum and cerebellar disorders. Springer, New York.
- HABAS C. (2001) « Le cervelet de la coordination motrice aux fonctions cognitives » Revue Neurologique (Paris) 157:1471-97.
- HOBBS MJ, YOUNG JZ. (1973) « A cephalopod cerebellum » Brain Res. 15;55(2):424-30.
- HOLMES (1939) « The cerebellum of man » Brain 62: 1-30.
- ITO M (1984) The cerebellum as neural control, Raven Press, New York.
- MANTO M, HABAS C (2013) Le cervelet. De l'anatomie et la physiologie à la clinique. Springer (https://www.springer.com/medicine/book/978-2-8178-0446-0)
- MANTO MU (2010) Cerebellar disorders. A practical approach to diagnosis and management. Cambridge University Press.
- MANTO MU, PANDOLFO M (éditeurs)(2002) The cerebellum and its disorders. Cambridge University Press.
- MANTO M, HUISMAN T (éditeurs). (2018). The cerebellum. Disorders and Treatment. Handbook of Clinical Neurology. Elsevier
- MARIËN P, MANTO M (éditeurs)(2016). The linguistic cerebellum. Academic Press, London.
- MIDDLETON FA, STRICK PL (2000) « Basal ganglia and cerebellar loops: motor and cognitive circuits » Brain Research Review, 31:236-250.
- PALAY SL, CHAN-PALAY (1974) Cerebellar cortex. Cytology and organization, Springer-Verlag, Berlin, Heidelberg, New York.
- RAMON Y CAJAL S. (1911) Histologie du système nerveux de l'homme et des vertébrés traduction française par le Dr Azoulay. 2 volumes. Maloine, Paris.
- SCHMAHMANN JD (éditeur)(1997) « The cerebellum and cognition » International Review of Neurobiology, Volume 41, Academic Press.
- SCHMAHMANN JD, SHERMAN JC (1998) « The cerebellar cognitive affective syndrome » Brain, 121: 561-579.
- WOODHAM, PL (1977) « The ultrastructure of a cerebellar analogue in octopus » J. Comp. Neurol. 174(2):329-45.
Articles connexes
- Vermis du cervelet
- Tente du cervelet
- Aire gnosique, zone située au-dessus du cervelet
- Abiotrophie cérébelleuse
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- FMA
- TA2
- Uberon
- Xenopus Anatomy Ontology
- (en) Medical Subject Headings
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (la + en) TA98
- (cs + sk) WikiSkripta
- Vidéo diaporamique du cervelet, 1re partie, par le Dr Dominique Hasboun (cours sous vidéo nécessitant le décodeur vidéo gratuit Distens)
- Vidéo diaporamique du cervelet, 2e partie, par le Dr Dominique Hasboun (cours sous vidéo nécessitant le décodeur vidéo gratuit Distens)
- Une liste de « laboratoires effectuant des recherches sur le cervelet »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), dans le monde entier.
- Revue The Cerebellum