| Chlorure de vinyle | |||

| |||
 | |||
| Identification | |||
|---|---|---|---|
| Synonymes |
chloroéthène |
||
| No CAS | |||
| No ECHA | 100.000.756 | ||
| No CE | 200-831-0 | ||
| Apparence | gaz comprimé liquefié, incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C2H3Cl [Isomères] CH2=CHCl |
||
| Masse molaire[2] | 62,498 ± 0,004 g/mol C 38,44 %, H 4,84 %, Cl 56,73 %, |
||
| Propriétés physiques | |||
| T° fusion | −154 °C[1] | ||
| T° ébullition | −13 °C[1] | ||
| Solubilité | 1 100 mg l−1 à 25 °C | ||
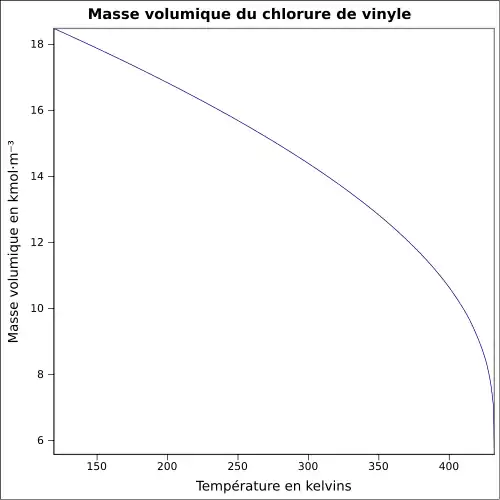
| Masse volumique | du liquide 0,9 g cm−3 et de la vapeur à 15 °C : 8 g l−1[1]
|
||
| T° d'auto-inflammation | 472 °C[1] | ||
| Point d’éclair | −78 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 3,6–33 % vol[1] | ||
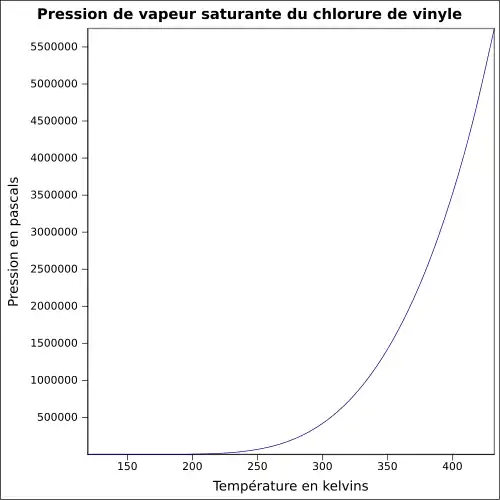
| Pression de vapeur saturante | |||
| Point critique | 51,5 bar, 151,85 °C[4] | ||
| Thermochimie | |||
| ΔfH0gaz | −28,45 kJ/mol | ||
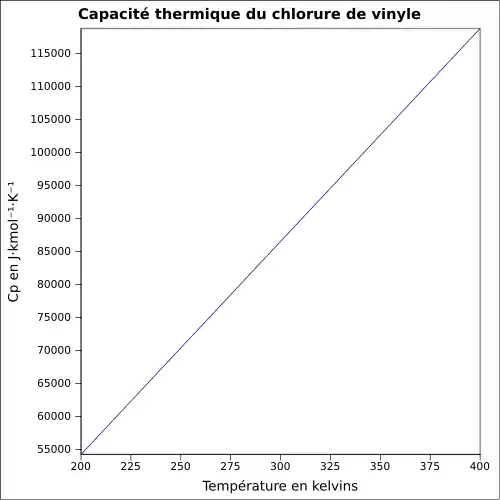
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,99 ± 0,02 eV (gaz)[6] | ||
| Précautions | |||
| SGH[7] | |||
  Danger |
|||
| SIMDUT[8] | |||
    A, B1, D2A, D2B, F, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 1 : Cancérogène pour l'homme[9] | |||
| Inhalation | Peut provoquer de la confusion, de la perte de conscience et une déficience respiratoire. Il peut en résulter des effets à long terme, tels de l'asthme. | ||
| Peau | Le contact avec le liquide réfrigéré peut provoquer des engelures et de l'irritation. | ||
| Yeux | Irritant possible. | ||
| Ingestion | Peut provoquer des nausées, des vomissements, une grave douleur stomacale. | ||
| Écotoxicologie | |||
| LogP | 0,6[1] | ||
| Seuil de l’odorat | bas : 10 ppm haut : 20 ppm[10] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le chlorure de vinyle, également connu sous le nom de chloroéthène dans la nomenclature IUPAC, est un important composé organique industriel principalement utilisé pour produire son polymère, le polychlorure de vinyle (PVC). À température ambiante, il se présente sous la forme d’un gaz toxique incolore à l’odeur douceâtre.
Histoire
Le chlorure de vinyle a été produit pour la première fois en 1835 par Justus von Liebig et son assistant Henri Victor Regnault. Ils l'ont obtenu par traitement du 1,2-dichloro-éthane avec une solution d'hydroxyde de potassium dans l’éthanol.
En 1912, Fritz Klatte, un chimiste allemand travaillant pour Griesheim-Elektron, a fait breveter un procédé pour produire le chlorure de vinyle à partir de l’acétylène et de l'acide chlorhydrique en utilisant le chlorure mercurique comme catalyseur. Cette méthode a été couramment employée pendant les années 1930 et les années 1940. Depuis cette époque, elle a été remplacée par des procédés plus économiques.
Production
Le vinyle est fabriqué industriellement à partir de l’éthylène et du dichlore. En présence de chlorure ferreux agissant comme catalyseur, ces composants produisent du dichloroéthane suivant l’équation chimique :
- CH2=CH2 + Cl2 → ClCH2CH2Cl.
Cette réaction se produit dans un bain de dichlorure d'éthylène en ébullition. À la température de 500 °C sous une pression de 30 atm (3 MPa), le dichlorure d'éthylène se décompose pour produire du chlorure de vinyle et de l’acide chlorhydrique :
- ClCH2CH2Cl → CH2=CHCl + HCl.
En pratique industrielle, l'acide chlorhydrique produit dans cette étape est mélangé à l'oxygène et mis à réagir avec l'éthylène additionnel sur le chlorure de cuivre agissant comme catalyseur pour produire davantage de dichlorure d'éthylène par l'intermédiaire de la réaction :
Les acides chlorhydriques consommés dans la première étape équilibrent exactement la quantité produite dans la deuxième étape, et le processus stable qui en résulte n’entraîne pas de perte d’acide chlorhydrique et n'exige pas d’apport supplémentaire du produit en cours de réaction. En raison des avantages économiques de ce procédé, l’essentiel du chlorure de vinyle produit depuis la fin des années 1950 l’a été par l'intermédiaire de cette technique.
Utilisations
L'utilisation de loin la plus importante du chlorure de vinyle est sa polymérisation pour fabriquer le PVC. L'opération à risque étant le décroutage des autoclaves après polymérisation.
De grandes quantités sont consommées pour produire d’autres hydrocarbures chlorés, notamment éthylidène, 1,1,1-trichloréthane, trichloréthylène, tétrachloroéthylène et chlorure de vinylidène.
La toxicité du chlorure de vinyle limite son utilisation dans les biens de consommation, bien qu'il ait historiquement (jusqu'en 1974) servi de gaz propulseur pour les aérosols. Le risque cancérigène a été établi depuis longtemps et la responsabilité légale éventuelle des industriels est comparable à celle qu'ils ont connue pour l’amiante (impliqué dans l’origine du mésothéliome).
L'accumulation d'émanations de chlorure de vinyle dans les salons de coiffure excédant largement les directives limitant l'exposition et son risque mutagène élevé, l’ont rendu responsable d'une probable augmentation de l'incidence des cancers professionnels dans les métiers les plus exposés.
Il a été brièvement utilisé comme gaz anesthésique, et comme fluide frigorigène dans la même mesure que le chlorure d'éthyle. Sa toxicité a conduit à abandonner cette pratique. Dans cette utilisation, il est en effet le seul représentant de la classe B3 (hautement toxique, hautement inflammable).
Également utilisé dans la fabrication des filtres de cigarettes.
Effets sur la santé
Gaz dangereux sous la forme monomère à cause du risque cancérogène avéré chez l'humain :
- cancérigène : angiosarcome du foie ;
- spasmes vasculaires douloureux des extrémités : syndrome de Raynaud ;
- atteintes osseuses : ostéolyse des phalanges unguéales (aspect de pseudo-fractures sur les radiographies des doigts).
De plus, D. Belpomme (responsable du plan Cancer sous Jacques Chirac) précise dans son livre « Ces maladies créées par l'homme » que le chlorure de vinyle est toujours cancérigène une fois polymérisé, qu'il soit polymérisé en PVC ou bien copolymérisé, c'est-à-dire polymérisé avec un autre monomère. En 1970, des mesures draconiennes ont été prises, à l'initiative en particulier de Joseph Réty (1923-2014) : la limite est désormais de 5 ppm dans l’air des ateliers lors de la polymérisation du PVC et de 1 ppm dans les matériaux et objets en PVC en contact avec les denrées alimentaires.
Notes et références
- 1 2 3 4 5 6 7 8 CHLORURE DE VINYLE, Fiches internationales de sécurité chimique .
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- ↑ « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub., (ISBN 0-88415-857-8).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008, 16 décembre 2008.
- ↑ « Chlorure de vinyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme », sur monographs.iarc.fr, CIRC, (consulté le ).
- ↑ « Vinyl chloride », sur hazmap.nlm.nih.gov (consulté le ).