| Trichloréthylène | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,1,2-trichloroéthène | ||
| Synonymes |
Trichlor(o)éthylène |
||
| No CAS | |||
| No ECHA | 100.001.062 | ||
| No CE | 201-167-4 | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique[1] | ||
| Propriétés chimiques | |||
| Formule | C2HCl3 [Isomères] |
||
| Masse molaire[2] | 131,388 ± 0,008 g/mol C 18,28 %, H 0,77 %, Cl 80,95 %, |
||
| Moment dipolaire | 0,80 D[3] | ||
| Diamètre moléculaire | 0,529 nm[3] | ||
| Propriétés physiques | |||
| T° fusion | −73 °C[1] | ||
| T° ébullition | 87 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 1 g l−1[1] | ||
| Paramètre de solubilité δ | 18,8 MPa1/2 (25 °C)[4] | ||
| Masse volumique | 1,5 g cm−3[1], Vapeurs plus denses que l'air |
||
| T° d'auto-inflammation | 410 °C[1] | ||
| Limites d’explosivité dans l’air | 8–10,5 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 7,8 kPa[1] | ||
| Point critique | 50,5 bar, 298,85 °C[5] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,46 ± 0,02 eV (gaz)[7] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,475[3] | ||
| Précautions | |||
| SGH[8] | |||
  Danger |
|||
| SIMDUT[9] | |||
 D1B, D2A, D2B, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 1 : agent cancérogène pour l’homme[10] | |||
| Inhalation | amener à l'air frais, éventuellement réanimation cardiopulmonaire | ||
| Peau | enlever les vêtements souillés, laver à grande eau, montrer à un médecin | ||
| Yeux | laver à grande eau en maintenant les paupières ouvertes, montrer à un ophtalmologiste | ||
| Ingestion | ne pas faire boire, ne pas faire vomir, contacter un médecin. | ||
| Écotoxicologie | |||
| LogP | 2,42[1] | ||
| Seuil de l’odorat | bas : 0,5 ppm haut : 167 ppm[11] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
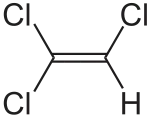
Le trichloréthylène est un composé organique de formule brute C2HCl3 et de formule semi-développée ClCH=CCl2.
En nomenclature de l'UICPA, il est dénommé 1,1,2-trichloroéthène ; il est également appelé trichloroéthylène, trichloroéthène, trichloréthène, trichlorure d'acétylène, d'éthylène ou d'éthène, trilène et dans le langage courant abrégé en trichlo ou trichlore.
Il s'agit d'une molécule d'éthène dont trois atomes d'hydrogène ont été remplacés par des atomes de chlore. Il est principalement employé dans l'industrie où son utilisation est réglementée.
Dangers et précautions d'emploi
En 1995, le trichloréthylène a été classé « CMR probable » (il était auparavant classé « CMR possible ») par le Centre international de recherche sur le cancer (CIRC). Ceci a été entériné par la directive européenne 2001/59/CE de la Commission du portant vingt-huitième adaptation au progrès technique de la directive 67/548/CEE. Il est classé « cancérogène » (Groupe 1) par le CIRC depuis le .
Il irrite la peau et les muqueuses, et est un toxique pour le système nerveux central : inhalé à de fortes teneurs (au-delà de 3 000 ppm), il peut entraîner le coma voire la mort en quelques minutes. De nombreux cas de maladie professionnelle ont été rapportés à la suite d'une manipulation prolongée.
En présence de flamme ou à une température supérieure à 120 °C, il peut se décomposer en trois gaz extrêmement toxiques :
- monoxyde de carbone CO ;
- chlorure d'hydrogène HCl ;
- dichlore Cl2.
S'il est lui-même non combustible, en revanche, ses vapeurs peuvent être explosives si elles se mélangent avec l'air (elles sont plus lourdes que l'air). L'eau ainsi que certains métaux (aluminium) provoquent la décomposition du trichloréthylène avec production d'acide chlorhydrique. L'acide chlorhydrique peut être neutralisé par ajout de stabilisants.
Il doit être stocké dans un endroit bien ventilé, avec une température comprise entre 15 °C et 25 °C. Il doit être manipulé en milieu bien ventilé, avec des gants et des lunettes de protection. L'Institut national de recherche et de sécurité (INRS) préconise l'utilisation de gants en PVA (alcool polyvinylique)[12]. En cas d'exposition accidentelle de la peau et des muqueuses, il faut enlever les vêtements souillés, laver abondamment à l'eau et consulter un médecin.
Un lien significatif entre l’exposition au trichloréthylène et le risque de survenue de la maladie de Parkinson est établi[13],[14].
Substitution
Selon la réglementation européenne, son utilisation est interdite pour les particuliers à une concentration supérieure à 0,1 %. Dans l'industrie, il était nécessaire de procéder à son remplacement avant le [15] (sauf exemption demandée avant le ) par d'autres produits comme le tétrachloroéthylène (ou perchloroéthylène), le chlorure de méthylène (ou dichlorométhane (DCM)), d'autres dérivés d'’hydrocarbures (cétones, alcools…), certains mélanges contenant des fluoroalcanes ou fluoroéthers, ou encore par des mélanges stabilisés à base de bromure de n-propyle (nPB).
Tous les substituants possibles ont des avantages et des inconvénients. Certains sont inflammables (alcools, cétones, esters, éthylène-glycol, propylène-glycol) et nécessitent d'investir dans des machines permettant d'éviter tout risque d'incendie. D'autres présentent la phrase de risque H351 : « susceptible de provoquer le cancer » (perchloroéthylène et dichlorométhane). Les mélanges à base de fluoroalcanes/fluoroéthers sont très chers ; s'ils sont ininflammables (constitués majoritairement de trans-1,2-dichloroéthylène et de dérivés fluorés), ils sont par contre des agents responsables du réchauffement climatique. Les mélanges ininflammables[16] à base de bromure de n-propyle sont efficaces en termes de dégraissage et inoffensifs pour l'environnement[17], mais sont classés H360FD (« peut nuire à la fertilité et au fœtus »)[18] et suspectés d'être cancérigènes[19].
Tous ces solvants sont généralement utilisés dans des machines de dégraissage à la vapeur dont le choix judicieux permet de limiter considérablement les valeurs limites d'exposition (enceinte ouverte ou fermée, une ou deux chambres de dégraissage, circuit fermé de distillation, etc.).
Valeurs limites d'exposition
Le comité scientifique de l'Union européenne compétent en matière de valeurs limites d'exposition professionnelle (SCOEL ou CSLEP) recommande les valeurs limites suivantes pour le trichloréthylène : 10 ppm (54,7 mg/m3) en moyenne pour une exposition quotidienne de huit heures et 30 ppm (164,1 mg m−3) pour une exposition brève de quinze minutes[20].
Le trichloréthylène est nocif pour la santé s’il est ingéré. Il cause une sensation de brûlure dans la bouche et la gorge, suivie de douleurs abdominales et des signes et des symptômes de dépression du système nerveux central. L'ingestion accidentelle de 30 ml à 50 ml cause un affaiblissement musculaire, des vomissements et la perte de conscience ou le délire, mais la victime récupère dans les deux semaines. Aucun effet n'a été signalé sur le cœur, le foie et les reins. Dans un cas seulement, l'ingestion de moins de 50 ml s'est avérée fatale à la suite d'une insuffisance rénale et hépatique. Certains des effets nocifs décrits, par exemple les effets sur le foie, peuvent être dus à d'autres substances chimiques (stabilisants) ajoutées au trichloréthylène[21].
La concentration maximale acceptable dans l’eau potable pour le trichloréthylène est de 0,005 mg l−1[22].
Utilisation
Les deux principales caractéristiques intéressantes du trichloréthylène sont :
- qu'il s'agit d'un solvant ;
- que contrairement à la plupart des solvants, il est peu inflammable.
Il a beaucoup été utilisé pour le dégraissage de pièces métalliques, le nettoyage à sec de vêtements — notamment comme détachant domestique sous la marque Sassi[23] — et l'extraction de produits organiques. Il fut utilisé comme anesthésiant sous le nom trilène et d’ercylène par Robert et Carrière dans les années 1950.
Il tend à être progressivement remplacé par des produits moins dangereux, et est d'ores et déjà interdit pour les particuliers dans l'Union européenne.
Le trichloréthylène sert surtout au dégraissage à la vapeur des pièces métalliques dans les industries de l'automobile et des métaux. Il sert aussi de composante d'adhésifs et de solvant dans les décapants à peinture, les lubrifiants, les peintures, les vernis, les pesticides, les nettoyeurs à froid pour métaux, les caoutchoucs et les élastomères. Il est utilisé comme caloporteur à basse température et comme intermédiaire chimique dans la production de produits pharmaceutiques, d'agents chimiques ignifuges et d'insecticides. Il est utilisé dans la phosphatation des métaux, la transformation des textiles, la production de chlorure de vinyle et les opérations aérospatiales[24].
Le trichloréthylène passe en catégorie 2 des substances cancérogènes (Directive de l'Union européenne sur les substances dangereuses) avec la phrase de risque R45 « peut causer le cancer ». C'est ce qu'ont décidé les experts européens lors de la réunion (28e Adaptation au Progrès Technique) du , confirmant ainsi la recommandation du groupe de travail de l'Union européenne, chargé de la classification, de l'emballage et de l'étiquetage. Le trichloréthylène était en catégorie 3 des cancérogènes, étiqueté R40 « Effet cancérogène suspecté-preuves insuffisantes ». En 2014, il est classé cancérogène pour l'homme par le CIRC[25].
Autre utilisation
Comme d'autres substances chimiques volatiles contenues dans des produits d'usage courant et que l'on peut légalement se procurer dans le commerce de façon peu onéreuse[26], le trichloréthylène est utilisé pour ses effets psychoactifs, en particulier par des enfants ou de jeunes adolescents qui l'inhalent par le nez (« sniffing »), par la bouche (« snorting »), le pulvérisent directement dans la gorge ou le nez (« dusting ») ou sur un linge à inhaler (« huffing ») ou en inhalent les effluves dans un sac (« bagging »)[27],[28].
Effets
Ce détournement d'usage engendre rapidement des effets psychotropes. L’intensité de ses effets dépend de sa composition, de la quantité inhalée, du temps d’inhalation, de l'endroit où il est inhalé (fermé, ouvert, plein air) et de l’éventuelle tolérance développée par l’usager[29].
« Inhalés, les solvants agissent sur le système nerveux central en induisant des manifestations ébrieuses. Chez certains consommateurs, s’ensuivent des troubles de la perception pouvant conduire à des hallucinations puis à une somnolence »[29]. Cet état est appelé « ébrio-narcotique » et peut parfois être suivi de nausées ou céphalées ou vertiges[30] voire aller jusqu’à la perte de conscience[29]. « Sniffés, les solvants produisent des effets extrêmement rapides où se succèdent une phase euphorique, des perturbations sensorielles (allant parfois jusqu’à l’hallucination visuelle) et enfin, une phase de sédation, avec parfois sommeil et coma. Ils peuvent donner lieu à une dépendance psychique et physique et à une tolérance. Ils ont surtout un effet neurotoxique, entraînant une détérioration des capacités mentales »[31],[29]. Le trichloréthylène semble provoquer une dépendance psychique mais non physique[32].
Toute prise de solvant comporte « un risque aigu de mort subite par trouble du rythme cardiaque. Lors de prises répétées, les solvants peuvent engendrer des lésions neurologiques (notamment des polynévrites), des lésions rénales, gastriques ou encore pneumologiques » irréversibles[29],[33].
« Le trichloroéthylène est irritant pour les voies respiratoires supérieures, les yeux et la peau. L'inhalation de fortes concentrations de trichloroéthylène provoque une dépression du système nerveux central pouvant aller jusqu'au décès, une irritation bronchique et des troubles du rythme cardiaque. Lors d'ingestion apparaissent des troubles digestifs, neurologiques, cardiaques et respiratoires souvent graves. L'exposition répétée par inhalation peut provoquer des atteintes neuropsychiques parfois sévères. Une dermatite d’irritation est observée en cas de contacts répétés. Le trichloroéthylène semble perturber le système immunitaire et avoir un rôle dans la maladie veino-occlusive pulmonaire. Les données épidémiologiques mettent en évidence un effet cancérogène du trichloroéthylène pour le rein ; des associations causales moins fortes ont été établies pour le cancer hépatique et le lymphome non-Hodgkinien. »
— INRS[34].
Usagers
Peu élevées dans la population adulte, les expérimentations se trouvent plus fréquemment chez les enfants, les adolescents et les jeunes adultes de différentes couches sociales et ethniques[31],[32],[33]. « L’abus de substances volatiles est un problème mondial particulièrement courant au sein des populations minoritaires et marginalisées »[33].
Statut juridique
Comme les colles, les poppers (nitrites d'alkyle aliphatiques) et d'autres solvants[26], le trichloréthylène est soumis au régime juridique applicable aux produits classés stupéfiants et relèvent des substances identifiées par l'Organisation mondiale de la santé (OMS) comme susceptibles d'engendrer une dépendance aux solvants volatils[29].
En France, la vente du trichloréthylène est interdite aux mineurs par l'arrêté du [35].
Règlementation
La législation européenne actuelle sur la protection des travailleurs contre les risques de santé (notamment la Directive sur les agents chimique 98/24/EC[36] et la Directive sur les Carcinogènes 2004/37/EC[37]) n'impose pas d'exigences minimum obligatoires pour le contrôle des risques à la santé des travailleurs lors de l'usage ou pendant le cycle de vie du trichloréthylène. Cependant, si les discussions en cours sur la Directive des Carcinogènes devaient produire une valeur contraignante pour la limite d'exposition au trichloréthylène des travailleurs, cette conclusion devrait être revue.
La Directive sur les Émissions de Solvants 1999/13/EC[38] et la Directive sur les Émissions Industrielles 2010/75/EU[39] imposent des exigences minimum contraignantes pour les émissions de trichloréthylène dans l'environnement pour certaines activités, y compris pour le traitement de surfaces. Cependant, les activités ayant une consommation de solvant en deçà d'un certain seuil ne sont pas concernées par ces exigences.
Le règlement 348/2013/UE[15] de la Commission européenne, modifiant le règlement REACH (1907/2006/CE[40]), en incluant le trichloréthylène à l'annexe XIV de REACH, aura pour conséquence l'interdiction de la substance en Europe au , ceci en raison de ses propriétés cancérogènes (cat. 1B). Les demandes d'autorisations pour les cas où la substance ne pourrait pas être substituée peuvent être communiquées à l'ECHA jusqu'au .
Contamination au TCE
Les eaux souterraines constituent la seule source d'eau pour 25 à 30 % de la population canadienne, c’est-à-dire 7,1 millions de Canadiens[22]. En , des analyses réalisées par la municipalité de Shannon, dans la province de Québec (Canada), ont révélé que la nappe phréatique était contaminée par du trichloréthylène (TCE)[41]. Une étude épidémiologique de l'état de santé de la population exposée, et en particulier de l'incidence des cancers dans la région, a été demandée à la Direction de santé publique. Néanmoins, l'Institut national de santé publique du Québec précise dans un rapport que l'analyse des données n'a pas permis de conclure à la présence d'un excès significatif entre l'incidence des cas de cancer et l'exposition potentielle au TCE[42]. Les gens de la ville ont décidé d'intenter un recours collectif contre le gouvernement du Canada car celui-ci connaissait le problème depuis trente ans[43].
Un cluster de cancer (leucémie et autres), impliquant des composés organiques volatils dégagés par une entreprise de nettoyage à sec, dont du trichloréthylène, du 1,2-dichloroéthylène, du perchloroéthylène, du dichlorométhane et du chlorure de vinyle, a été découvert à Camp Lejeune, en Caroline du Nord[44].
Certains végétaux, dont des plantes trouvées dans les jardins[45] se montrent capables d’absorber de grandes quantités de polluants organiques[46] et parfois de les dégrader, en disposant par exemple de mécanismes de détoxication face au trichloréthylène qui est toxique et génotoxique[47]. Le peuplier en fait partie.
Dépollution
Les principales méthodes de dépollution des sols et des eaux souterraines impactées par du trichloroéthylène sont des méthodes mécaniques (venting/sparging) permettant l'aération des milieux et le transfert du TCE vers une phase gazeuse captée en surface et traitée sur charbon actif), chimiques à travers une barrière réactive perméable, par oxydation chimique (permanganate de potassium/sodium, persulfate de sodium) ou réduction chimique (fer zéro-valent), ou biologique (déchloration bio-anaérobie) par injection dans les eaux souterraines de source de carbone (lactate, mélasse, micro-émulsion d'huile de soja, etc.). La dernière méthode (bio-anaérobie) a actuellement la préférence des sociétés de dépollution dans la mesure où elle n'est pas très onéreuse et permet atteindre de très bons niveaux de décontamination dans les eaux souterraines.
La fongoremédiation est une des solutions étudiées.
la phytoépuration en est une autre, potentiellement complémentaire : le peuplier pouvait avoir un potentiel supplémentaire en matière de phytoépuration des sols in situ'' (d’autres essences pourraient aussi peut-être avoir une telle aptitude)[48].
Des tests faits dans les années 1990 avec des peupliers hybrides (Populus trichocarpa x P. deltoides ; clones H1-11 et 50-189[49], plantés dans un sol irrigué par une eau volontairement polluée par du trichloréthylène[49]) ont montré que ces peupliers absorbaient du TCE et en dégradaient une partie en plusieurs déchets métaboliques connus : trichloroéthanol, acide trichloracétique et acide dichloracétique)[48]. Une autre partie (moins de 5 % lors d’une des expériences, mais ce taux pourrait être différent dans la nature[50]) était évacuée via l’évapotranspiration (« phytovolatilization », habituellement mesurée en culture sous serre), en quantités mesurables. Il s’agit bien d’une biodégradation qui ne résulte pas de l’activité de bactéries de la rhizosphère ou de symbiotes fongiques du peuplier (qui existe aussi par ailleurs pour un certain nombre de polluants[51]), car en laboratoire des cultures pures de cellules de peupliers dégradent effectivement le trichloréthylène, en produisant les mêmes produits métaboliques intermédiaires[48], et quand on les a exposé à du trichloréthylène marqué au carbone 14 (traceur[52]), ces cultures cellulaires ont aussi produit du dioxyde de carbone radiomarqué, ce qui montre qu’il y a bien eu dégradation du trichloréthylène au niveau cellulaire[48]. Des boutures de peupliers plantées dans un sol pollué par le TCE ont produit les mêmes métabolites. Le degré d’oxygénation de la rhizosphère semble avoir peu d’importance[50].
- L'ADEME considère que l'argument « plantes dépolluantes » n'est pas validé scientifiquement au regard des niveaux de pollution généralement rencontrés dans les habitations et des nouvelles connaissances scientifiques dans le domaine[53].
L’extraction augmente avec l’évapotranspiration (indice métabolique) et n’est donc efficace que durant la saison de croissance, mais avec semble-t-il un très bon rendement : « au moins 95 % du TCE supprimés » pour le TCE solubilisé dans le flux d'eau entrant dans les cellules des arbres[49].
Il faut néanmoins que le TCE soit assez dilué, car il est toxique pour les cellules du peuplier, qu’il tue au-dessus d’une certaine dose[49].
Dosage
Le trichloréthylène est un contaminant émergent problématique pour l’environnement, la faune et l’humain. Il est issu de l’activité industrielle de l’homme et s’accumule peu à peu dans la nature, causant des dommages importants. L’accumulation du trichloréthylène dans les eaux des nappes phréatiques est un des principaux problèmes touchant les eaux potables souterraines des petites municipalités. C’est pourquoi il est important de doser le trichloréthylène dans les eaux souterraines ou de surface. Pour cela on peut utiliser une technique d’analyse telle la chromatographie en phase gazeuse couplée à un spectromètre de masse avec analyse du rapport isotopique (IR en anglais) : P&T-GC-MSIR[54],[55].
Avant l’analyse, les échantillons d’eau souterraine ont été conservés à 4 °C dans des contenants de verre scellés avec du Téflon. Pour doser le trichloréthylène, on utilise d’abord une pompe à extraction offline qui a pour rôle de préconcentrer l’analyte volatil organique.
D’abord, l’échantillon de 500 ml contenu dans le contenant d’échantillon en acier inoxydable est transféré vers le contenant d’extraction en acier inoxydable en ouvrant la valve (V1)[55].
Ensuite, le contenant d’extraction est brassé mécaniquement à une vitesse de 120 tr/min. La valve (V2) est ouverte et le composé volatil organique, le trichloréthylène, passe par un tuyau d’acier inoxydable chauffé à 50 °C pour éviter la condensation de vapeur d’eau durant l’extraction. Le montage entier est en acier inoxydable pour éviter l’adsorption du composé organique. Ensuite, un système à quatre capillaires est utilisé (C), pour éviter la rétro-diffusion du composé[55].
À ce point, la vapeur d’eau et le trichloréthylène se retrouvent emprisonnés dans les trappes (T1 et T2) qui sont refroidies à l’azote liquide à −196 °C. La première trappe (T1) est plongée à 50 % dans l’azote liquide, tandis que la deuxième trappe (T2) est plongée à 100 % dans l’azote liquide. La justification est que, lorsque les deux trappes sont entièrement submergées, l’efficacité de l’extraction est diminuée de 50 %, car les vapeurs d’eau gèlent et bloquent le flux de vapeur)[55].
Sur 500 ml de l’échantillon d’eau souterraine seulement, 0,4 ml est emprisonné dans la trappe (T1) et c’est dans ce volume qu’est renfermé le composé organique volatil, le trichloréthylène. Sachant que le composé se retrouve presque entièrement emprisonné dans la première trappe, la deuxième trappe ne s’avère pas essentielle pour l’extraction. La trappe (T1) qui contient l’analyte préconcentré est conservée et branchée sur le système d’analyse P&T-GC-MSIR. L’analyte est chauffé à 250 °C pendant une minute et est désorbé thermiquement du P&T et envoyé par un flux d’hélium vers une cellule cryogénique à −120 °C. Par la suite, cette dernière est chauffée et l’hélium envoi l’analyte vers le GC (pour faire la séparation chromatographique)[55].
La séparation se fait à une température de 40 °C pendant 2 min, 50 °C à une vitesse de 2 °C/min, 50 °C pendant 4 min, 100 °C à une vitesse de 8 °C/min, 100 °C pendant 2 min, 210 °C à une vitesse de 40 °C/min et finalement 210 °C pendant 3,5 min[56]. Une fois les composés organiques séparés, ils sont analysés par MSIR. Avec le spectromètre de masse avec ratio isotopique, on peut déterminer la signature isotopique du trichloréthylène. Il permet de déterminer l’abondance du 13C et du 12C avec le ratio 13C/12C. En utilisant la technique de pompe à extraction, le pourcentage de recouvrement varie entre 80 et 110 %. La limite de quantification était de 1,4 µg l−1 pour le P&T et s’est abaissée à 0,24 µg l−1[55] en combinant avec la pompe à extraction.
Notes et références
- 1 2 3 4 5 6 7 8 9 TRICHLOROETHYLENE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- ↑ (en) « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, 2 et 3, Huston, Texas, Gulf Pub., , 396 p. (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Trichloréthylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- ↑ International Agency for Research on Cancer, Trichloroethylene, tetrachloroethylene, and some other chlorinated agents, (ISBN 978-92-832-0144-1, 92-832-0144-2 et 978-92-832-0172-4, OCLC 1132223060, lire en ligne).
- ↑ « Trichloroethylene », sur hazmap.nlm.nih.gov (consulté le ).
- ↑ Trichloroéthylène, INRS (consulté le 6 février 2013).
- ↑ (en) Samuel M. Goldman, Patricia J. Quinlan, G. Webster Ross et Connie Marras, « Solvent exposures and parkinson disease risk in twins », Annals of Neurology, vol. 71, no 6, , p. 776–784 (ISSN 0364-5134, PMID 22083847, PMCID PMC3366287, DOI 10.1002/ana.22629, lire en ligne, consulté le ).
- ↑ (en) Samuel M. Goldman, Frances M. Weaver, Kevin T. Stroupe, Lishan Cao, Beverly Gonzalez, Kalea Colletta, Ethan G. Brown et Caroline M. Tanner, « Risk of Parkinson Disease Among Service Members at Marine Corps Base Camp Lejeune », JAMA Neurology, (PMID 37184848, PMCID PMC10186205, DOI 10.1001/jamaneurol.2023.1168).
- 1 2 Règlement (UE) no 348/2013 de la Commission du 17 avril 2013 modifiant l’annexe XIV du règlement (CE) no 1907/2006 du Parlement européen et du Conseil concernant l’enregistrement, l’évaluation et l’autorisation des substances chimiques, ainsi que les restrictions applicables à ces substances (REACH), (lire en ligne).
- ↑ « Organic Solvent Cleaning », sur forwardtech.com (consulté le ).
- ↑ (en) « 1665704580 », sur nih.gov (consulté le ).
- ↑ Numéro index 106-94-5 dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 [PDF], 16 décembre 2008.
- ↑ « NTP Peer Reviewers Back Listing of Cumene, 1-Bromopropane in Report on Carcinogens » (consulté le ).
- ↑ (en) SCOEL/SUM/142, avril 2009.
- ↑ Centre canadien d’hygiène et de sécurité au travail, 1998, /chemicals/chem_profiles/trichloroethylene/ Effet du trichloroéthylène sur la santé (consulté le 23 mars 2010).
- 1 2 Santé Canada, « Recommandations pour la qualité de l'eau potable au Canada : document technique – le trichloroéthylène », sur canada.ca, (consulté le ).
- ↑ « Trichloroéthylène (BELAC no 128-MED/TEST) », sur CHU de Liège, Référentiel des examen.
- ↑ Centre canadien d’hygiène et de sécurité au travail (1998), /chemicals/chem_profiles/trichloroethylene/ Trichloroéthylène. Effet du trichloroéthylène sur la santé (consulté le 23 mars 2010).
- ↑ (en) IARC, « List of Classifications by cancer site », sur monographs.iarc.fr, (consulté le ).
- 1 2 Comme les « colles contenant des solvants (différentes des colles à base d’eau non toxiques et non psychotropes), l’eau écarlate, l’éther (disponible uniquement sur ordonnance médicale depuis 1984 en France), les solvants pour peintures (white spirit), certains produits d’entretien ménagers, les solvants cosmétiques (laques), certains produits automobiles (essence, antigel), le Fréon (propulseurs pour spray), les gaz de briquets (butane propane), certains gaz anesthésiants (protoxyde d'azote) ». Lire en ligne. Peuvent s'ajouter à cette liste d'autres hydrocarbures volatils : l’acétone, les dissolvants à vernis à ongles et les diluants de peinture, certains liquides de nettoyage, le gaz ménager, le gaz propulseur des aérosols des désodorisants, insecticides, etc. Lire en ligne
- ↑ MILD & CA (Mission interministérielle de lutte contre les drogues et les conduites additives), « Poppers colles solvants », sur drogues.gouv.fr, (consulté le ).
- ↑ « L’abus de substances volatiles : Ce que les parents devraient savoir - Soins de nos enfants », sur soinsdenosenfants.cps.ca, (consulté le ).
- 1 2 3 4 5 6 OFDT (Observatoire français des drogues et des toxicomanies), « Poppers, colles et autres solvants - Synthèse des connaissances », sur ofdt.fr (consulté le ).
- ↑ Fédération Alcool Assistance, « Les solvants : Les effets recherchés », sur alcoolassistance.net (consulté le ).
- 1 2 Michel Gandilhon, Agnès Cadet-Taïrou, « Poppers, colles et autres solvants » dans OFDT, « Drogues et addictions, données essentielles, Saint-Denis », OFDT, 2013, p. 273-277, lire en ligne.
- 1 2 Jean-Paul Carcel, « Les autres hallucinogènes », sur caat.online.fr (consulté le ).
- 1 2 3 L. Baydala, « L’abus de substances volatiles », Paediatrics & Child Health, vol. 15, no 7, , p. 449–454 (ISSN 1205-7088, PMCID 2948778, lire en ligne, consulté le ).
- ↑ « Trichloroéthylène (FT 22). Pathologie - Toxicologie - Fiche toxicologique », sur inrs.fr (consulté le ).
- ↑ Gilles Leclair, La Drogue, Plon (réédition numérique FeniXX), , 180 p. (ISBN 978-2-259-24398-8, lire en ligne), chap. 1 (« Présentation générale des drogues »).
- ↑ Directive 98/24/CE du Conseil du 7 avril 1998 concernant la protection de la santé et de la sécurité des travailleurs contre les risques liés à des agents chimiques sur le lieu de travail [PDF], sur eur-lex.europa.eu.
- ↑ Directive 2004/37/CE du Parlement européen et du Conseil du 29 avril 2004 concernant la protection des travailleurs contre les risques liés à l'exposition à des agents cancérigènes ou mutagènes au travail [PDF], sur eur-lex.europa.eu.
- ↑ Directive 1999/13/CE du Conseil du 11 mars 1999 relative à la réduction des émissions de composés organiques volatils dues à l’utilisation de solvants organiques [PDF], sur eur-lex.europa.eu.
- ↑ Directive 2010/75/UE du Parlement européen et du Conseil du 24 novembre 2010 relative aux émissions industrielles [PDF], sur eur-lex.europa.eu.
- ↑ Règlement (CE) no 1907/2006 du Parlement européen et du Conseil du 18 décembre 2006 (REACH) [PDF], sur eur-lex.europa.eu.
- ↑ « Le trichloroéthylène (TCE) à Shannon », sur Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Québec.
- ↑ « Analyse spatio-temporelle des cas de cancer à Shannon répertoriés dans le Fichier des tumeurs du Québec en relation avec la contamination de la nappe d’eau souterraine dans le secteur Valcartier » [PDF], Institut national de santé publique du Québec, .
- ↑ Cancers à Shannon : une histoire d'eau, enquête de Radio-Canada, 2008-2009, sur radio-canada.ca.
- ↑ (en) Survey of Childhood Cancers and Birth Defects at USMC Camp Lejeune (Full Report), ATSDR, juillet 2003.
- ↑ (en) Schnabel W.E., Dietz A.C., Burken J.G., Schnoor J.L. et Alvarez P.J. (1997), Uptake and transformation of trichloroethylene by edible garden plants, Water Res., 31, 816–824.
- ↑ (en) Schroll R., Bierling B., Cao G., Dörfler U., Lahaniati M., Langenbach T., Scheunert I. et Winkler R. (1994), Uptake pathways of organic chemicals from soil by agricultural plants, Chemosphere, 28, 297–303.
- ↑ (en) Dekant W., New Concepts and Developments in Toxicology. Dans Metabolic Conversion of Tri- and tetrachloroethylene: Formation and Deactivation of Genotoxic Intermediates, Chambes P.L., Gehring P. et Sakai F., éds, Amsterdam, Elsevier Science, 1986, 211-221.
- 1 2 3 4 (en) Lee A. Newman, Stuart E. Strand, Nami Choe, James Duffy, Gordon Ekuan, Martin Ruszaj, B. Brook Shurtleff, Jodi Wilmoth, Paul Heilman et Milton P. Gordon, « Uptake and Biotransformation of Trichloroethylene by Hybrid Poplars », Environ. Sci. Technol., 1997, 31 (4), p. 1062-1067, DOI 10.1021/es960564w, 1997-03-27 (Résumé).
- 1 2 3 4 M. Gordon, N. Choe, J. Duffy, G. Ekuan, P. Heilman, I. Muiznieks, M. Ruszaj, B. B. Shurtleff, S. Strand, J. Wilmoth et L. A. Newman, « Phytoremediation of trichloroethylene with hybrid poplars », Environ. Health Perspect., aout 1998, 106 (Suppl 4), 1001–1004 ((en) Résumé) et article complet.
- 1 2 Orchard, B. J., Doucette, W. J., Chard, J. K. et Bugbee, B. (2000), « Uptake of trichloroethylene by hybrid poplar trees grown hydroponically in flow-through plant growth chambers », Environmental Toxicology and Chemistry, 19, 895–903, DOI 10.1002/etc.5620190416 ((en) Résumé et article complet).
- ↑ Anderson T.A., Guthrie E.A. et Walton B.T., Bioremediation in the rhizosphere: plant roots and associated microbes dean contaminated soil, Environ. Sci. and Technol., 27 (13), 2630-2636 (1993).
- ↑ Anderson T.A. et Walton B.T. (1995), « Comparative fate of 14C trichloroethylene in the root zone of plants from a former solvent disposal site », Environ. Toxicol. Chem., 14, 2041–2047.
- ↑ « Plantes et épuration de l'air intérieur – ADEME », sur ADEME (consulté le ).
- ↑ P&T, en anglais : purge and trap.
- 1 2 3 4 5 6 (en) Amaral If Helena, Berg Michael, Brennwald S. Matthias, Hofer Markus et Kipfer Rolf, « 13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction », Environ. Sci. Technol., 2010, 44, 1023-1029.
- ↑ (en) Zwank L., Berg M., Schmidt T. et Haderlain S., Compound-specific Carbon isotope Analysis of volatile organic compounds in the low-microgram per liter range, Anal. Chem., 2003, 75, 5575-5583.
Liens externes
- Le nouvel étiquetage du trichloréthylène : la reclassification et ses conséquences, sur fr.prevent.be
- (en) Usages durables et recommandations de l'Industrie, sur chlorinated-solvents.eu
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :





