| Pentane | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | pentane | ||
| Synonymes |
n-pentane |
||
| No CAS | |||
| No ECHA | 100.003.358 | ||
| No CE | 203-692-4 | ||
| PubChem | 8003 | ||
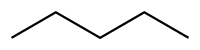
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique[1] | ||
| Propriétés chimiques | |||
| Formule | C5H12 [Isomères] |
||
| Masse molaire[2] | 72,148 8 ± 0,004 8 g/mol C 83,24 %, H 16,76 %, |
||
| Diamètre moléculaire | 0,546 nm[3] | ||
| Propriétés physiques | |||
| T° fusion | −129 °C[1] | ||
| T° ébullition | 36,06 °C[4] | ||
| Solubilité | 38 mg·l-1 (eau, 25 °C)[5] | ||
| Paramètre de solubilité δ | 14,3 MPa1/2 (25 °C)[6] | ||
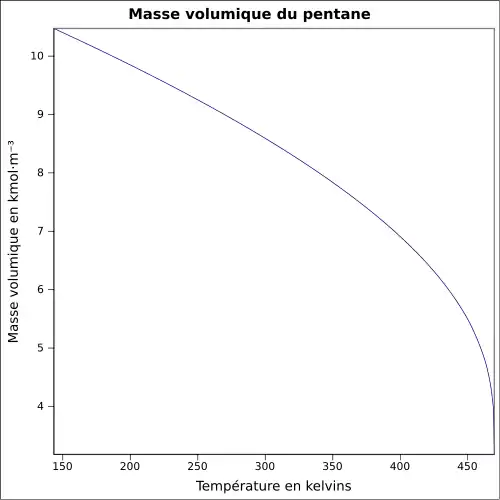
| Masse volumique | 0,621 0 g·cm-3 à 24,95 °C[7]
|
||
| T° d'auto-inflammation | 309 °C[1] | ||
| Point d’éclair | −49 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 1,5–7,8 %vol[1] | ||
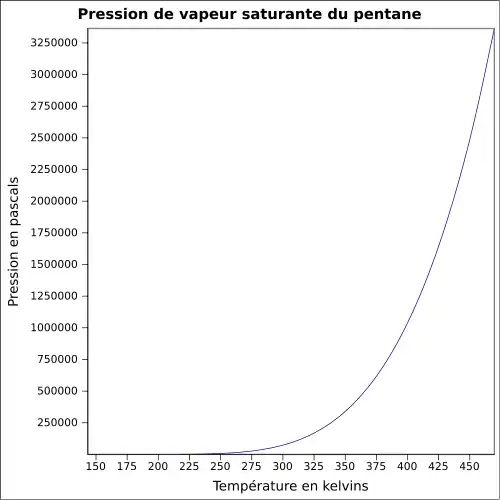
| Pression de vapeur saturante | à 18,5 °C : 53,3 kPa[1]
|
||
| Viscosité dynamique | 0,225 mPa·s à 24,95 °C[7] | ||
| Point critique | 3 370 kPa[4], 196,55 °C[9] | ||
| Vitesse du son | 1 008 m·s-1 à 20 °C[10] | ||
| Thermochimie | |||
| S0gaz, 1 bar | 347,82 ± 0,84 kJ mol−2[11] | ||
| S0liquide, 1 bar | 263,47 kJ mol−2[11] | ||
| ΔfH0gaz | −146,8 ± 0,59 kJ mol−1[11] | ||
| ΔfH0liquide | −173,5 ± 0,59 kJ mol−1[11] | ||
| ΔvapH° | 26,5 ± 0,6 kJ mol−2[11] | ||
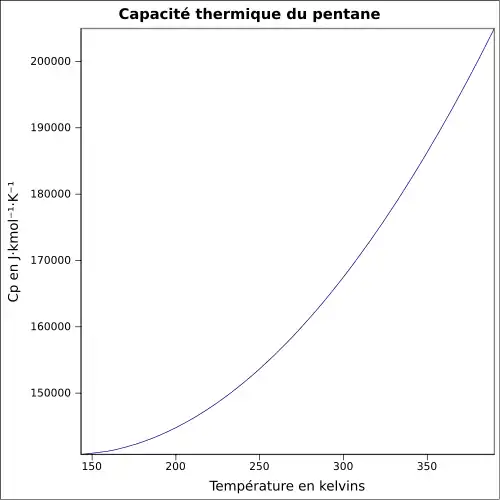
| Cp | |||
| PCS | 3 509,0 kJ·mol-1 (25 °C, liquide)[13] | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,28 ± 0,10 eV (gaz)[14] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,3547[3] | ||
| Précautions | |||
| SGH[15] | |||
    Danger |
|||
| SIMDUT[16] | |||
 B2, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 3,39[1] | ||
| Seuil de l’odorat | bas : 119 ppm haut : 1 147 ppm[17] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le pentane, ou n-pentane, est un alcane linéaire de formule C5H12.
Le terme pentane désigne aussi par extension abusive[alpha 1] les deux autres isomères C5H12 : le 2-Méthylbutane (isopentane) et le 2,2-Diméthylpropane (néopentane). Ces diverses molécules comportent toutes cinq [en grec πέντε (pénte), cinq] atomes de carbone. Le cyclopentane, également avec cinq atomes de carbone, est de composition différente : C5H10.
Utilisations
Le pentane est un solvant couramment utilisé en chimie organique.
Le pentane est un fluide frigorigène, de code R601. Dans certains circuits frigorifiques (congélateurs −80 °C par exemple), du pentane peut faire partie du mélange utilisé comme fluide frigorigène[18]. Il est utilisé dans les thermomètres de basse température[19].
Propriétés chimiques
Le pentane brûle dans l'air selon la réaction :
- C5H12 + 8O2 —> 5CO2 + 6H2O
Notes et références
Notes
- ↑ C'est-à-dire qui ne respecte pas les règles IUPAC.
Références
- 1 2 3 4 5 6 7 n - PENTANE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1)
- 1 2 (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 35, no 4, , p. 1461 (DOI 10.1063/1.2201061)
- ↑ « PENTANE », sur Hazardous Substances Data Bank (consulté le )
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- 1 2 (en) Makio Iwahashi, Yoshimi Yamaguchi, Yoshio Ogura et Masao Suzuki, « Dynamical Structures of Normal Alkanes, Alcohols, and Fatty Acids in the Liquid State as Determined by Viscosity, Self-Diffusion Coefficient, Infrared Spectra, and 13CNMR Spin-Lattice Relaxation Time Measurements », Bulletin of the Chemical Society of Japan, vol. 8, , p. 2154-2158 (DOI 10.1246/bcsj.63.2154)
- 1 2 3 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- ↑ (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 32, no 4, , p. 1411 (DOI 10.1063/1.1556431)
- ↑ (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40
- 1 2 3 4 5 (en) « Pentane », sur NIST
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-858-6)
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Pentane normal » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ « n-Pentane », sur hazmap.nlm.nih.gov (consulté le )
- ↑ « Pentane », be-atex.com (consulté le 31 août 2023).
- ↑ « Fiche complète pour Pentane normal », sur Commission des normes, de l'équité, de la santé et de la sécurité du travail (consulté le ).