| Trioxyde de soufre | |
 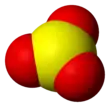 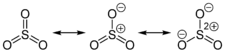 Structure du trioxyde de soufre. |
|
| Identification | |
|---|---|
| Nom UICPA | Trioxyde de soufre |
| Synonymes |
anhydride sulfurique |
| No CAS | |
| No ECHA | 100.028.361 |
| No CE | 231-197-3 |
| No RTECS | WT4830000 |
| PubChem | 24682 |
| ChEBI | 29384 |
| SMILES | |
| InChI | |
| Apparence | liquide fumant, hygroscopique, incolore ou cristaux incolores à blancs[1]. |
| Propriétés chimiques | |
| Formule | SO3 |
| Masse molaire[2] | 80,063 ± 0,006 g/mol O 59,95 %, S 40,05 %, |
| Moment dipolaire | 0 |
| Propriétés physiques | |
| T° fusion | 16,9 °C |
| T° ébullition | 45 °C[1] |
| Solubilité | dans l'eau : réaction[1] |
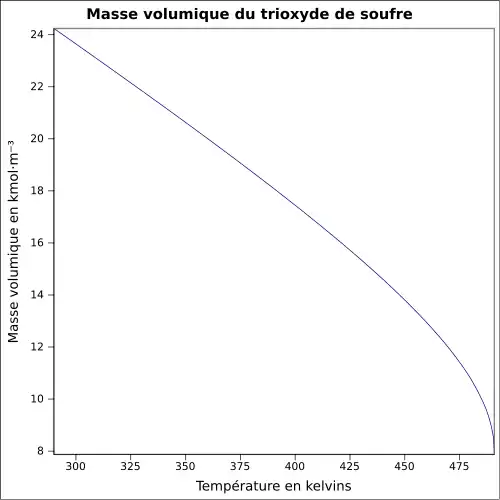
| Masse volumique | 1,9 g cm−3[1]
|
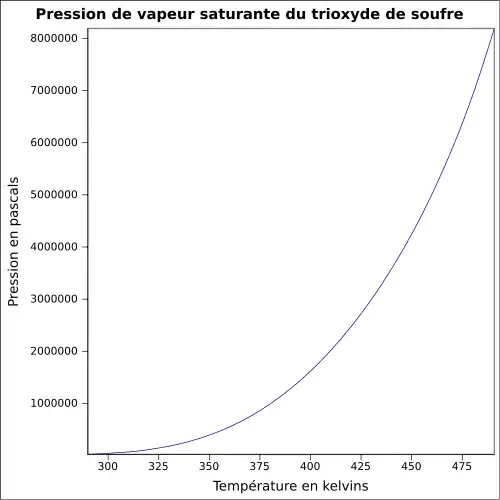
| Pression de vapeur saturante | |
| Viscosité dynamique | 1,820 cP à 25 °C |
| Point critique | 82,1 bar, 217,85 °C[4] |
| Thermochimie | |
| S0gaz, 1 bar | 256,77 J mol−1 K−1 |
| ΔfH0gaz | −397,77 kJ/mol |
| ΔvapH° | 40,69 kJ mol−1 (1 atm, 44,5 °C) ; 43,14 kJ mol−1 (1 atm, 25 °C)[5] |
| Cp | 24,02 J mol−1 K−1 |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,82 ± 0,03 eV (gaz)[6] |
| Précautions | |
| SGH[7] | |
     Danger |
|
| SIMDUT[8] | |
Produit non classé |
|
| Unités du SI et CNTP, sauf indication contraire. | |

Le trioxyde de soufre, jadis également appelé anhydride sulfurique, est un composé chimique de formule SO3. Cet oxyde du soufre, élément non métallique, est un solide cristallisé incolore fondant dès 16,9 °C. Il se présente souvent sous forme de particules blanches par dépôt de ses fumées. Entre 16,9 et 44,8 °C, il est liquide, incolore et hygroscopique.
C'est un polluant majeur de l'atmosphère terrestre, résultant de l'oxydation du dioxyde de soufre SO2, et notamment responsable des pluies acides. Il est produit industriellement comme précurseur de l'acide sulfurique, principalement dans le cadre du procédé de contact.
Propriétés
La molécule de SO3 en phase gazeuse est trigonale et plane avec une symétrie D3h, comme prédit par la théorie VSEPR. En phase gazeuse, SO3 est en équilibre avec le trimère S3O9[9]. La constante d'équilibre est Kp = 1 atm−1 à 25 °C et ΔH° = 125 kJ/mol de S3O9.
Le trioxyde de soufre est un liquide hygroscopique de masse volumique 1,92 g/cm3, de point d'ébullition 43,7 °C, et de point de fusion 16,8 °C.
Il existe trois variétés polymorphiques du trioxyde de soufre[10] :
- α-SO3 cristallise en aiguilles (apparence de fibre d’amiante[11]), fond à 16,83 °C et bout à 44,8 °C ;
- β-SO3 qui est le dimère (SO3)2, fond à 62,4 °C et se sublime vers 50 °C ;
- γ-SO3 vitreux, orthorhombique, qui est le trimère S3O9, fond à 16,83 °C et bout à 44,8 °C, seule forme présente à l'état solide[9].
Le trioxyde de soufre réagit avec l'eau pour donner l'acide sulfurique, un acide fort dans l'eau.
- SO3 gaz + H2O liquide (en pratique avec excès) → H2SO4aqueux
En milieu aqueux, le trioxyde de soufre est plus acide que le pentaoxyde d'azote N2O5 ou que le dioxyde de carbone ou gaz carbonique CO2.
Le trioxyde de soufre est un déshydratant puissant (comme l'acide sulfurique). Il déshydrate par exemple les sucres et la matière organique, laissant un résidu charbonneux.
Le trioxyde de soufre pur est extrêmement agressif vis-à-vis de la plupart des matériaux, par piqûres de surface. Les attaques (à chaud) de différents minerais par l'acide sulfurique libèrent lors des procédés industriels des quantités non négligeables de trioxyde de soufre non consommées. L'atmosphère environnante générée, par défaut de filtres efficaces, se révèle en pratique corrosive, et ceci d'autant plus que l'air en présence peut contenir d'autres fines dispersions de poussières salines (chlorure de sodium, de potassium, sulfates, etc.).
Autres réactions
Sa réaction avec les acides halogénohydriques (HCl, HBr…) donne l'acide halosulfurique correspondant.
- SO3 + HCl → HSO3Cl
où un atome de Cl a remplacé un groupe OH de l'acide sulfurique.
Il réagit comme acide de Lewis vis-à-vis d'une large variété de ligands inorganiques et organiques :
- avec les oxydes, il donne l'ion sulfate SO2–
4 ; - avec la triphénylphosphine Ph3P, il donne Ph3P·SO3 avec une distance P-S de 217,6 pm.
Toxicité et danger de manipulation
Le corps gazeux ou liquide pur est toxique et très dangereux. Comme il peut être souvent manipulé en simple capsule ou ampoule de verre, casser accidentellement le petit récipient étanche entraîne la libération du gaz, la contamination de l'air (irrespirable), l'agression des mains et des muqueuses des opérateurs sans compter l'attaque oxydante des matériaux à son voisinage.
Production
La production américaine annuelle de ce composé (hors production pour l'acide sulfurique) est de 90 000 tonnes[9].
La production française est d'environ deux millions de tonnes par an, exclusivement par le procédé de contact, également appelé « procédé Bayer ». Sa production est quasi intégralement transformée en acide sulfurique.
Production industrielle
Le trioxyde de soufre est produit comme intermédiaire de la production industrielle d'acide sulfurique par le procédé de contact, également appelé « procédé Bayer ». Le dioxyde est oxydé par le dioxygène en présence d'oxyde de vanadium(V) V2O5 comme catalyseur. Chaque réacteur industriel en contient environ 80 tonnes. Ce dernier est constitué de kieselguhr enrobé d'un mélange de VOSO4 et de KHSO4 qui produit V2O5 lors de l'oxydation de SO2[12].
En sortie de réacteur, le trioxyde de soufre est absorbé par de l'acide sulfurique initialement à 98,5 %, et non par de l'eau car la réaction,
bien que très exothermique (ΔH = −88 kJ/mol), est lente.
La solution résultante de trioxyde de soufre dans l'acide sulfurique s'appelle « oléum ». L'acide sulfurique pouvant être considéré comme un mélange particulier de 1 H2O avec 1 SO3, l'oléum est un mélange de 1 H2O avec x SO3 (x > 1). Le trioxyde de soufre est infiniment soluble dans l'acide sulfurique.
Le trioxyde de soufre et l'acide sulfurique sont en équilibre avec l'acide disulfurique H2S2O7 :
- H2SO4 (l) + SO3 (g) H2S2O7 (l).
Détail du procédé Bayer
Le procédé Bayer consiste à faire passer le mélange de dioxyde de soufre et d'air dans un premier lit de catalyseur. La transformation est de 90 %. Le mélange passe dans un second lit, ce qui pousse le taux de conversion à 98 %. Après le 4e lit, la conversion est quasiment totale (99,6 %) et le trioxyde de soufre formé est refroidi à 200 °C. Il est alors conduit dans une tour d'absorption. Cette succession de lits permet d'une part d'augmenter le rendement du procédé, mais surtout de limiter les rejets de dioxyde de soufre à 350 ppm dans l'atmosphère.
Histoire de la production de SO3
Le procédé des chambres de plomb préexistait au procédé Bayer. En 1954, il permettait encore 55 % de la production de trioxyde de soufre. En 1979, seul 1 % de cet oxyde était produit par les chambres de plomb, procédé maintenant totalement disparu[12].
Production non industrielle
Au laboratoire
Le trioxyde de soufre peut être obtenu au laboratoire par une double distillation de l'oléum dans un appareillage en verre. Une petite quantité de permanganate de potassium est généralement ajoutée pour oxyder les traces de dioxyde de soufre[9].
Autres productions
Le trioxyde peut être produit par thermolyse de sulfates à température élevée[9]. Ce procédé n'est pas industriel.
Le trioxyde de soufre est produit pour lui-même en quantité faible au regard de ce qui est converti en acide sulfurique. Il lui est adjoint un additif pour l’empêcher de polymériser. Il s'agit le plus souvent d'oxyde de bore B2O3[9].
Notes et références
- 1 2 3 4 TRIOXYDE DE SOUFRE, Fiches internationales de sécurité chimique .
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- ↑ (en) « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- ↑ (en) « Sulphur trioxide », sur European Chemicals Agency (ECHA) (consulté le ).
- ↑ « Trioxyde de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- 1 2 3 4 5 6 (en) Greenwood N. N. et Eanrshaw A. (2003), Chemistry of the elements, 2e éd., Elsevier.
- ↑ (en) CRC Handbook of Chemistry and Physics, Physical constants of inorganic compounds.
- ↑ Douanes suisses, Produits chimiques inorganiques ; composés inorganiques ou organiques de métaux précieux, d'éléments radioactifs, de métaux des terres rares ou d'isotopes, chap. 28.
- 1 2 (en) J. L. Vigne et A. G. Kapala (2009), Données industrielles, économiques, géographiques sur les principaux produits chimiques, métaux et matériaux, 8e éd., SFC Éds., http://www.societechimiquedefrance.fr/extras/Donnees/acc.htm