Le zéro absolu[1],[2] est la température la plus basse qui puisse exister. Il correspond à la limite basse de l'échelle de température thermodynamique, soit l'état dans lequel l'enthalpie et l'entropie d'un gaz parfait atteint sa valeur minimale, notée 0. Cette température théorique est déterminée en extrapolant la loi des gaz parfaits : selon un accord international, la valeur du zéro absolu est fixée à −273,15 °C (Celsius) ou −459,67 °F (Fahrenheit). Par définition, les échelles Kelvin[3] et Rankine prennent le zéro absolu[4] comme valeur 0. À noter que l'échelle Kelvin ne peut aller dans les nombres négatifs.
En physique quantique, la matière au zéro absolu se trouve dans son état fondamental, point d'énergie interne minimale.
Les lois de la thermodynamique impliquent que le zéro absolu ne peut pas être atteint en utilisant uniquement des moyens thermodynamiques : la température de la substance refroidie se rapproche asymptotiquement de celle de l'agent de refroidissement. Un système qui se trouve au zéro absolu possède en mécanique quantique l'énergie du point zéro, soit l'énergie de son état fondamental au zéro absolu. L'énergie cinétique de l'état fondamental ne peut être éliminée.
Des scientifiques ont réussi à atteindre des températures proches du zéro absolu, où la matière présentait des effets quantiques tels que la supraconductivité ou la superfluidité.
Histoire
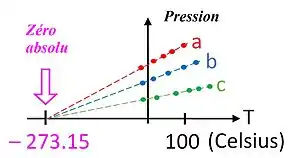
En 1702, l'état du zéro absolu a été proposé pour la première fois par Guillaume Amontons, physicien et académicien français, qui travaillait sur la relation entre température et pression dans les gaz, même s'il n'avait pas à sa disposition de thermomètre précis. Bien que ses résultats soient qualitatifs, il établit que la pression d'une quantité donnée de gaz confinée dans un volume donné augmente d'à peu près un tiers lorsqu'il passe d'une température « froide » à celle de l'ébullition de l'eau, ce qui l'amène à supposer qu'une réduction suffisante de température entraînerait une absence de pression.
Bien que le zéro absolu puisse être défini de cette façon, la plupart des gaz se liquéfient avant d'atteindre 0 K (voir thermomètre à gaz).
En 1824, Sadi Carnot publie son œuvre majeure : Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance. Dans une note en bas de page, qui fut négligée par les premiers commentateurs, il laisse entendre que le rendement d’un moteur thermique idéal pourrait servir de base à une échelle absolue des températures[5].
En 1848, William Thomson, Lord Kelvin, propose une échelle de température absolue dans laquelle une réduction de la température mesurée correspond à une réduction équivalente dans la chaleur du corps étudié. Ce concept, en se libérant des contraintes de la loi des gaz, établit un zéro absolu comme étant la température à laquelle plus aucune chaleur ne peut être tirée du corps.
Description
Le zéro absolu est défini comme la plus petite température possible, qui d'ailleurs ne peut être atteinte qu'asymptotiquement. Elle est théorique et inaccessible. À 0 K, une substance ne contient plus à l'échelle macroscopique l'énergie thermique (ou chaleur) nécessaire à l'occupation de plusieurs niveaux énergétiques microscopiques. Les particules qui la composent (atomes, molécules) sont toutes dans le même état d'énergie minimale (état fondamental). Cela se traduit par une entropie nulle due à l'indiscernabilité de ces particules dans ce même niveau d'énergie fondamentale et par une totale immobilité au sens classique.
Cependant, selon les théories de la physique quantique, les particules possèdent toujours une quantité de mouvement non nulle d'après le principe d'incertitude (Heisenberg). En effet, en tendant vers le zéro absolu, les molécules d'un corps auraient leur quantité de mouvement de plus en plus précisément définie (proche de zéro), leurs positions auraient tendance à avoir une indétermination intrinsèque résiduelle. Mais comme elles tendent aussi vers l'arrêt, leurs positions tendraient aussi à être précisément définies. Elles tendent vers un état d'énergie minimale, aux approches du zéro absolu, respectant ainsi le principe d'indétermination quantique ; on parle d'énergie résiduelle au zéro absolu.
Les physiciens ont découvert que certaines substances développent des propriétés originales lorsqu'elles approchent cette limite. Certains fluides, les isotopes stables de l'hélium, perdent toute viscosité : c'est la superfluidité. Et certains métaux ou alliages perdent leur résistance électrique (c'est la supraconductivité) ou, au contraire, présentent une résistance électrique très élevée (c'est un état supra-isolant[6]).
Techniques
En pratique, on atteint aujourd'hui couramment 0,21 K en faisant évaporer de l'hélium, mais une autre méthode — appelée la « désaimantation adiabatique de substances paramagnétiques » — permet d'obtenir des températures encore plus basses, jusqu'à 1 × 10−6 K. Enfin, le refroidissement de gaz atomiques bosoniques jusqu'au condensat de Bose-Einstein permet d'atteindre des températures de l'ordre de 1 × 10−9 K. C'est cette technique de refroidissement d'atomes par laser qui a été utilisée par les chercheurs du MIT pour atteindre le record de 450 pK.
Très basses températures
L'univers baigne dans le fond diffus cosmologique dont la température est de 2,73 kelvins, empêchant même les régions de l'espace les plus éloignées de toute source de chaleur d'atteindre naturellement le zéro absolu[7].
Le zéro absolu ne peut être atteint, bien qu'il soit possible de s'en rapprocher avec un refroidisseur cryogénique, un réfrigérateur à dilution ou un cryostat à désaimantation nucléaire. Le refroidissement d'atomes par laser a permis d'atteindre des températures inférieures au milliardième de kelvin. À très faibles températures, autour du zéro absolu, la matière présente de nombreuses propriétés inhabituelles telles que la supraconductivité, la superfluidité et la condensation de Bose-Einstein. Pour étudier ces propriétés, les scientifiques ont essayé d'atteindre des températures encore plus basses.
En 1999, 100 pK (10−10 K) ont été atteints en refroidissant les spins nucléaires d'un morceau de rhodium.
En , des physiciens du Massachusetts Institute of Technology ont réussi à refroidir les molécules d'un gaz de sodium et potassium à une température de 500 nK (5 × 10−7 K), et ils espèrent découvrir un état exotique de la matière en descendant à une température inférieure.
Température absolue négative
Dans certaines expériences de physique quantique, les opérateurs calculent des températures thermodynamiques négatives. Ces valeurs négatives très faibles (de l'ordre de quelques picokelvins à quelques nanokelvins) apparaissent dans la mesure de certains systèmes quantiques très particuliers dont l'entropie, après avoir atteint un maximum, diminue à mesure qu'on leur ajoute encore de l'énergie[8],[9]. Les échantillons pour lesquels on mesure des températures absolues négatives ne sont donc pas à considérer comme étant « plus froids » que le zéro absolu puisqu'ils fourniraient de la chaleur à tout autre système qui viendrait à leur contact. Les températures négatives ne signifient pas non plus que la température est passée à un moment quelconque par le zéro absolu, « Ce dernier restant impossible à atteindre »[10].
En , des physiciens ont annoncé, dans la revue scientifique Nature, la première obtention d'un gaz d'atomes de potassium avec une température absolue, définie thermodynamiquement dans les degrés de liberté de mouvement, négative. La technique consiste à piéger des atomes dans une configuration qui serait instable à température absolue positive, et, le piège étant stable, le système se voit attribuer une température absolue négative. Le sens et l'importance de ces travaux restent à cerner[11].
Notes et références
- ↑ « Absolu », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales (sens I–5, consulté le 22 mai 2016).
- ↑ Informations lexicographiques et étymologiques de « absolu » (sens I, C, 2) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 22 mai 2016).
- ↑ (fr) BIPM (Bureau international des poids et mesures)
- ↑ « Qu'est-ce que le zéro absolu et comment l’atteindre ? », sur futura-sciences.com (consulté le )
- ↑ Les débuts de la thermodynamique - D.S.L Cardwell in Michel Biezunski, La Recherche en histoire des sciences, Paris, Éd. du Seuil, coll. « Points, Sciences » (no 37), , 304 p. (ISBN 978-2-02-006595-5, OCLC 463555600, BNF 35538393)
- ↑ (fr) http://www.techno-science.net/?onglet=news&news=5282
- ↑ « Question de la semaine : Quelle est la température de l'Univers ? », sur sciencesetavenir.fr
- ↑ (en) Norman F. Ramsey, Spectroscopy with coherent radiation : selected papers of Norman F. Ramsey with commentary, Singapore; River Edge, N.J., World Scientific, coll. « World Scientific series in 20th century physics, v. 21 », , 417 p. (ISBN 978-981-02-3250-4, OCLC 38753008, lire en ligne)
- ↑ (en) « Positive and negative picokelvin temperatures »
- ↑ Roger Balian. Vrai ou faux, une température absolue peut-elle être négative ? In Pour la Science, mars 2013, no 425, p. 19.
- ↑ (en) Merali, Zeeya, « Quantum gas goes below absolute zero », Nature,
Voir aussi
Articles connexes
- Chaleur

- Énergie du point zéro
- Température
- Température thermodynamique
- Température négative
Bibliographie
- Calcul d'incertitudes, 2013. Description d'une expérience simple réalisée dans un lycée qui a permis de mesurer par extrapolation le zéro absolu : lors d'une transformation à volume constant d'un gaz supposé parfait, on mesure les variations de la température et de la pression.