| Rhodium | |||||||||||
 Rhodium métal pulvérulent, compacté en cylindre plein ou en bille grâce à la métallurgie des poudres | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Rh | ||||||||||
| Nom | Rhodium | ||||||||||
| Numéro atomique | 45 | ||||||||||
| Groupe | 9 | ||||||||||
| Période | 5e période | ||||||||||
| Bloc | Bloc d | ||||||||||
| Famille d'éléments | Métal de transition | ||||||||||
| Configuration électronique | [Kr] 4d8 5s1 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 16 et 1 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 102,905 50 ± 0,000 02 u[1] | ||||||||||
| Rayon atomique (calc) | 135 pm (173 pm) | ||||||||||
| Rayon de covalence | 142 ± 7 pm[2] | ||||||||||
| État d’oxydation | 2, 3 et 4 | ||||||||||
| Électronégativité (Pauling) | 2,28 | ||||||||||
| Oxyde | Amphotère | ||||||||||
| Énergies d’ionisation[3] | |||||||||||
| 1re : 7,458 90 eV | 2e : 18,08 eV | ||||||||||
| 3e : 31,06 eV | |||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | Solide | ||||||||||
| Masse volumique | 12,41 g·cm-3 (20 °C)[1] | ||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||
| Dureté (Mohs) | 6 | ||||||||||
| Couleur | Blanc argenté métallique | ||||||||||
| Point de fusion | 1 964 °C[1] | ||||||||||
| Point d’ébullition | 3 695 °C[1] | ||||||||||
| Énergie de fusion | 21,5 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 493 kJ·mol-1 | ||||||||||
| Volume molaire | 8,28×10-3 m3·mol-1 | ||||||||||
| Pression de vapeur | 0,633 Pa à 1 965,85 °C |
||||||||||
| Vitesse du son | 4 700 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 0,242 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 21,1×106 S·m-1 | ||||||||||
| Conductivité thermique | 150 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | [4] | ||||||||||
| No ECHA | 100.028.295 | ||||||||||
| No CE | 231-125-0 | ||||||||||
| Précautions | |||||||||||
| SGH[5] | |||||||||||
État pulvérulent : Danger |
|||||||||||
| SIMDUT[6] | |||||||||||
Produit non contrôlé |
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Le rhodium est l’élément chimique de numéro atomique 45 et de symbole Rh.
Le corps simple « rhodium » est un métal dur et cassant de la catégorie des platinoïdes légers.
Généralités et histoire de l'élément
Avec le ruthénium, le palladium, l'osmium, l'iridium et le platine, il forme le groupe du platine au sens large, aussi nommé « ensemble des platinoïdes ». Le rhodium, dont le corps simple a des propriétés similaires à celles du platine, ne fait pas partie du sous-groupe du platine mais du sous-groupe de l’iridium.

En 1803, William Hyde Wollaston découvrit cet élément, de même que le palladium, à partir de minerais provenant d'un gîte de platine natif originaire d’Amérique du Sud, en particulier de minerai d’une mine de platine colombienne pour le Rh et du platine brut de Colombie pour le Pd. La « liqueur jaune » obtenue par l’addition d’eau chaude, après avoir retiré l’osmium des reliquats noirs de fabrication du platine, contient essentiellement des platinoïdes tel que l’iridium, mais aussi de manière variable (suivant les échantillons) du rhodium, du ruthénium et parfois du platine[7].
L'addition de sal ammoniac ou chlorure d'ammonium à cette liqueur permet d'y précipiter l'essentiel des platinoïdes, hormis les composés oxydés et chlorurés du rhodium solubles. Après évaporation, un traitement par réduction à l'aide de gaz dihydrogène permet d'obtenir le corps simple métal rhodium. Notons qu'un lavage à l'acide nitrique ou à l'acide chlorhydrique s'impose pour éliminer les impuretés conséquentes ou les traces de fer ou de cuivre, qui se révèlent à leur couleur rouge foncé, et obtenir des cristaux de rhodium relativement purs.
L'autre partie, minoritaire ou parfois négligeable, du rhodium a formé un chlorure double et se retrouve avec le précipité chloruré de ruthénium et d'iridium. Une réduction au rouge par le gaz dihydrogène permet d'obtenir une éponge de métal platinoïde, il faut fondre cette dernière matière avec le plomb pour obtenir de façon séparée les cristaux d'iridium et de ruthénium. Le plomb fondu dissout les reliquats de rhodium, de platine rhodié voire de platine. En attaquant le plomb par l'acide nitrique, l'opérateur reprend les composés à base de rhodium et de platine, le rhodium sera séparé par l'acide sulfurique sous forme de sulfate de rhodium et le platine par l'eau régale sous forme de complexes hexachloroplatinates.
Le nom dérive du mot grec ῥόδον / rhódon, « rose ». Ce nom a été proposé par son découvreur à cause de la couleur rose-rouge de quelques composés phares du rhodium, en particulier de l'hydroxyde. Le premier métal obtenu semble aussi avoir été légèrement impur, recelant des traces significatives de cuivre ou de fer à effet rougeoyant.
Le terme gréco-latin « rhodium » n'apparaît en français qu'en 1805 dans les rapports sur les travaux de Wollaston présentés par les « Annales de Chimie ».
Isotopes
Le rhodium possède 34 isotopes connus avec des nombres de masse variant entre 89 et 122, ainsi que 22 isomères nucléaires. Parmi ces isotopes, un seul est stable, 103Rh[8], et constitue l'intégralité du rhodium naturel, faisant du rhodium un élément monoisotopique et un élément mononucléidique. Sa masse atomique standard est donc de 102,905 50(2) u.
Occurrences dans les milieux naturels, minéralogie et géologie
Le clarke de ce platinoïde est estimé à 0,001 g/t ou 0,001 ppm dans la croûte terrestre, ce qui est très similaire à l’iridium. Il est aussi présent dans certaines météorites.
Le rhodium natif, très rare, est le minéral qui correspond au corps simple métallique, alors que la rhodite est un alliage d’or et de rhodium.
Le rhodium est un métal rare et cher, la production mondiale provenant principalement de la récupération au cours de traitement d’autres minerais. Elle n’était que de 12 tonnes par an dans les années 1990 et de 20 tonnes par an en 2010. L’Afrique du Sud, l’Oural (Russie) et l’Ontario (Canada) fournissent l’essentiel de la production mondiale de rhodium. Ils l’extraient laborieusement des gangues minérales où il se marie au palladium, à l’argent ou au platine.
.jpg.webp)

Corps simple et composés chimiques
Propriétés physiques et chimiques du corps simple métallique
L’apparence du corps simple est celle d’un métal blanc brillant et argenté, cristallin de maille CFC (cubique à faces centrées), de haute réflectivité mais toutefois moins que celle de l’argent. Il est moyennement dur et relativement inerte sur le plan thermochimique (donc grande résistance à la corrosion).
Le rhodium fondu dissout l’oxygène gazeux et lorsqu’il se solidifie, l’oxygène qu’il contient se libère avec force sous la forme de crépitements. Il se travaille facilement avec une torche à fusion propane–oxygène.

Le rhodium compact est insoluble dans les acides forts mais sous la forme d’une poudre fine, qu’on appelle noir de rhodium, il se dissout aisément dans l’acide sulfurique ou l’eau régale.
Le rhodium est soluble dans les bains de cyanures fondus et les sels alcalins fondus.
Il présente des propriétés catalytiques à l’état divisé, mais aussi en phase homogène, assez analogues à celle du platine. Le rhodium montre des propriétés bactéricides (il détruit les germes).
Alliages
Les alliages avec le platine et le palladium sont durs et résistants.
Chimie du rhodium
Les valences les plus communes sont de II à VI.
Le rhodium métallique réagit directement avec l’oxygène gazeux à partir de 600 °C en formant le sesquioxyde de rhodium Rh2O3 qui se décompose en ses composants atomiques si on le chauffe au-delà de 2 000 °C.

Le rhodium réagit avec le fluor gazeux au-delà de 300 °C :
- Rh solide cristal, en poudre + 32 F2 gaz → RhF3 gaz
Sous incandescence, le rhodium réagit avec le chlore gazeux pour former divers chlorures de rhodium dont RhCl3. On connaît aussi le bromure de rhodium RhBr3.
Le rhodium, comme les autres platinoïdes, est attaqué par le soufre ainsi que par de nombreux semi-métaux : P, Se, Te, As, Sb, etc.
Il n’existe pas de cations monoatomiques simples du rhodium, mais des oxoanions et de nombreux complexes.
Composés chimiques
Le dioxyde de rhodium RhO2 et le sesquioxyde de rhodium Rh2O3 sont les principaux oxydes stables connus.
Il existe ainsi différents fluorures avec le Rh de valence III à VI, comme le RhF3, RhF4, RhF5, RhF6, ce qui rappelle les composés analogues de Ru.
Il n'existe principalement que le trichlorure de rhodium RhCl3, le tribromure de rhodium RhBr3 et le triodure de rhodium RhI3.
_chloride.jpg.webp)
Il y a également le nitrate de rhodium Rh(NO3)3 et le sulfate de rhodium Rh2(SO4)3.
Il existe divers sulfures, tels que RhS2, Rh2S3 ou Rh2S7, ainsi que les séléniures et tellurures simples RhSe2 et RhTe2.
_acetate.jpg.webp)
Il forme des complexes, par exemple avec le monoxyde de carbone (différents carbonyles, par exemple tétrarhodium dodécacarbonyle ou hexarhodium hexadécacarbonyle, voire chloro-carbonyle ou carbonyle avec l’ion chlorure de type dichlorure de dirhodium tétracarbonyle), avec diverses oléfines ou cycle de bonne conformation (rhodocène…) avec l’acétylacétone.
Utilisations
Les catalyseurs utilisés dans les véhicules automobiles à essence contiennent souvent un alliage de platine, de palladium et de rhodium sur un support en céramique (80 % de la production totale). Plus généralement, il est utilisé comme catalyseur dans l’industrie chimique et comme élément chauffant pour les très hautes températures (il fond à 2 237 K, soit 1 963,85 °C, voire plus).
En chimie, le rhodium est présent dans un grand nombre de catalyseurs. En phase homogène, il catalyse en particulier l'hydrogénation, et notamment l'hydroformylation des alcènes.

Le rhodium est employé :
- pour les contacts électriques : en métal recouvert d'une très mince couche de rhodium (ou d'alliage de Rh) ;
- dans plusieurs appareillages scientifiques, par exemple les pyromètres de précision ou les thermocouples ;
- dans certains tubes à rayons X, sur leurs anodes, notamment dans le domaine de la spectrométrie de fluorescence des rayons X ;
- pour certains revêtements de miroir à grande réflectivité. Tirant profit de sa réverbération excellente[9] et sa grande dureté, on l’applique sur les miroirs des projecteurs. Il est ainsi présent sur les projecteurs de cinéma et sur les miroirs astronomiques ;
- pour des articles d’argenterie en couches brillante-sombre et dure et des pièces d’appareils photographiques (avant l’ère du numérique). Du fait de son inertie chimique bien supérieure à celle de l’argent ou de l’or, il est toujours utilisé sous forme de fins plaquages en joaillerie et bijouterie. Il est toujours utilisé dans l’électrogalvanisation de l'argenterie, ce qui évite le ternissement de l’argent non protégé ;
- dans la fabrication de supports de pierres en joaillerie (bijoux Swarovski et autres) ;
- exceptionnellement, dans l’industrie de la musique, remise d'un «disque de rhodium» en 1979 à l'artiste Paul McCartney ;
- en orthodontie, en partie sur certains braquets de type céramique, afin d’avoir un coefficient de friction faible (plus faible que la céramique) tout en conservant un brillant métallique limité. En effet, ce métal a la faculté, avec un certain traitement, de limiter son éclat (apparence mate). Il s’agit du rhodium noir ou black rhodium connu en joaillerie.
Ses alliages avec le platine et le palladium servent aussi pour l’outillage ou l’équipement de laboratoire (creusets), mais aussi en bijouterie (pièces de supports), également comme catalyseurs variés (convertisseurs catalytiques automobile), comme bougie de moteurs d’avion, comme électrodes, comme contacts électriques…
Toxicité
Comme pour tous les métaux du groupe du platine, la plupart des composés du rhodium sont reconnus toxiques, écotoxiques et potentiellement carcinogènes[10]. Lors du test classique de la daphnie (sur Daphnia magna) le rhodium se montre cependant nettement moins toxique que le platine, lui-même moins toxique que le palladium (la LC50 (48 h) est de 14 μg/L pour le palladium, 157 μg/L pour le platine et 56800 μg/L pour le rhodium (et dans les trois cas la durée d'exposition a un effet aggravant)[11].
Ces trois métaux sont dispersés dans l'environnement (perdus par les pots catalytiques[12],[13] et retrouvés dans les biotopes aquatiques où ils s'accumulent notamment dans les sédiments des mares, lacs et cours d'eau)[11]. Le nématode Caenorhabditis elegans a aussi été utilisé comme espèce-modèle (mais avec aussi une étude des effets (en 96 h) sur la croissance, la fertilité et la reproduction). Ce travail a confirmé la différence de toxicité des 3 métaux du groupe du platine selon le schéma Pd > Pt ⪢ Rh (évoqués plus haut)[14].
Les prospectivistes s'attendent à une large diffusion de nanoproduits au XXIe siècle, dont des nanoparticules métalliques "nobles" facile à synthétiser et présentant des propriétés catalytique, de fonctionnalisation de surface et optoélectroniques intéressantes pour l'Industrie[15]. Ces métaux se dispersent notamment dans l'air[16]. Il est donc probable que les êtres vivants (notamment) soient de plus en plus confrontés à l'inhalation ou à l'ingestion de nanoparticules d'argent, d'or, de platine, de palladium et de rhodium. De nombreuses études ont mis en évidence des effets toxicologiques préoccupants pour ces métaux quand ils sont sous forme de nanoparticules ou dissoute, dont in vitro sur des lignées cellulaires humaines[15]. Il est probable que les organismes filtreurs (moules par exemple y seront les premiers exposés, avec des risques de bioconcentration du rhodium (conjointement à d'autres métaux toxiques ou catalytiques avec lesquels il pourrait agir en synergie)[17]. En 2017, divers écotoxicologues suggèrent de travailler non pas sur le rhodium seul, mais sur les autres métaux du groupe du platine qui émanent avec lui de la pollution automobile[17].
On sait par l'étude des allergies professionnelles (et par quelques études in vitro[18],[19]) que la plupart des composés du rhodium agressent et teignent durablement la peau humaine[20],[21],[22] (surtout en présence de blessures[23] ou de sueur et d'un pH acide[24]), en s’y fixant et amenant parfois localement des nécroses. C'est aussi un irritant des muqueuses (nasale notamment[25]). Ce n’est pas le cas du corps simple métal dans sa forme massive mais sous forme dissoute, de poudre fine ou en aérosols et plus encore sous forme de nanoparticule, c'est un métal dangereux.
De plus, ces particules divisées peuvent générer des explosions en présence d’oxydants (dispersion dans l’air, l’oxygène, les gaz halogènes… en proportion adéquate avec une ignition initiale ou le contact d’un point chaud).
Évolution du cours et commerce en France
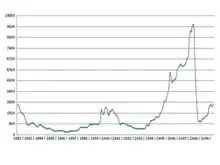
Selon le cabinet The Bullion Desk, ce métal valait 9 900 dollars l’once Troy (31,103 5 grammes) en , soit 300 000 dollars le kilogramme. Il valait dix fois moins en 2004. En , son prix avait reculé à 1 600 dollars l’once puis regrimpé à 2 600 dollars en . La demande est soutenue par la forte croissance du marché automobile, en raison de la nécessité de ce produit dans le respect de normes environnementales (les métaux du groupe du platine sont presque indispensables aux convertisseurs catalytiques des pots d’échappement de l’industrie automobile, responsable de 90 % de la consommation mondiale). Selon le type de motorisation et de carburant, des quantités diverses de ces métaux du groupe du platine seront utilisées, en particulier le platine, le palladium et le rhodium. Qui plus est, ceux-ci aident à la filtration des rejets automobiles. Or il est admis que la voiture est un marché mondial en expansion. Il nous faudra donc de plus en plus de métaux du groupe platine, dont le rhodium fait partie[26]. En 2021, son prix oscille entre 12 350 dollars et 29 800 dollars l'once[27].

D’après les douanes françaises, la France était en 2014 une importatrice nette de rhodium. Le prix moyen au gramme à l’import était de 23 €[28].
Notes et références
- 1 2 3 4 (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- ↑ Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- ↑ SIGMA-ALDRICH
- ↑ « Rhodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Il s’agit de la suite du traitement chimique des restes obtenus après l’attaque par l’eau régale de la mine de platine brute. Lire les généralités historiques sur les éléments « osmium » et « iridium ».
- ↑ (en) John W. Arblaster, « The Discoverers of the Rhodium Isotopes : The thirty-eight known rhodium isotopes found between 1934 and 2010 », Platinum Metals Review, vol. 55, , p. 124-134 (DOI 10.1595/147106711X555656).
- ↑ Nicholas Arndt, Clément Ganino, Stephen Kesler,"Ressources minérales - Cours et exercices corrigés", 2e éd., 2015, page 12
- ↑ « All rhodium compounds must be considered as very toxic and as carcinogenic factors » (Goering, 1992, cité par FS Abbas, 2017)
- 1 2 Zimmermann S, Wolff C & Sures B (2017) Toxicity of platinum, palladium and rhodium to Daphnia magna in single and binary metal exposure experiments. Environmental Pollution, 224, 368-376 |résumé.
- ↑ Merget, R, Rosner, G (2001) Evaluation of the health risk of platinum group metals emitted from automotive catalytic converters. Science of the Total Environment 270: 165–173.
- ↑ Palacios, MA, Gómez, M, Moldovan, M. (2000) Assessment of environmental contamination risk by Pt, Rh and Pd from automobile catalyst. Microchemical Journal 67: 105–113.
- ↑ Schertzinger, G., Zimmermann, S., Grabner, D., & Sures, B. (2017). Assessment of sublethal endpoints after chronic exposure of the nematode Caenorhabditis elegans to palladium, platinum and rhodium. Environmental Pollution, 230, 31-39|résumé
- 1 2 Gupta I, Ingle A, Paralikar P, Pandit R, da Silva S.S, & Rai M (2017). Bio-distribution and Toxicity of Noble Metal Nanoparticles in Humans. In Metal Nanoparticles in Pharma (pp. 469-482). Springer, Cham.
- ↑ Wiseman, CLS, Zereini, F (2009) Airborne particulate matter, platinum group elements and human health: a review of recent evidence. Science of the Total Environment 407: 2493–2500.
- 1 2 Zimmermann, S., & Sures, B. (2018). Lessons learned from studies with the freshwater mussel Dreissena polymorpha exposed to platinum, palladium and rhodium. Science of The Total Environment, 615, 1396-1405.
- ↑ Franken, A, Eloff, FC, Du Plessis, J. (2014) In vitro permeation of platinum and rhodium through Caucasian skin. Toxicology In vitro 28: 1396–1401.
- ↑ Franken, A, Eloff, FC, Du Plessis, J. (2015) In vitro permeation of platinum through African and Caucasian skin. Toxicology Letters 232: 566–572.
- ↑ Bedello, PG, Goitre, M, Roncarolo, S (1987) Contact dermatitis to rhodium. Contact Dermatitis 17: 111–112
- ↑ De La Cuadra, J, Grau-Massanés, M (1991) Occupational contact dermatitis from rhodium and cobalt. Contact Dermatitis 25: 182–184.
- ↑ Goossens, A, Cattaert, N, Nemery, B. (2011) Occupational allergic contact dermatitis caused by rhodium solutions. Contact Dermatitis 64: 158–184.
- ↑ Mauro, M, Crosera, M, Bianco, C. (2015) Permeation of platinum and rhodium nanoparticles through intact and damaged human skin. Journal of Nanoparticle Research 17: 253–264
- ↑ Jansen Van Rensburg, S., Franken, A., Du Plessis, J., & Du Plessis, J. L. (2017). The influence of pH on the in vitro permeation of rhodium through human skin. Toxicology and industrial health, 33(6), 487-494 | résumé
- ↑ Abbas F.S (2017) Rhodium Removal from Wastewater FS
- ↑ Emmanuel Gentilhomme, « Le rhodium, ce petit métal qui monte, qui monte », AGORA, .
- ↑ « Rhodium - 2022 Data - 2012-2021 Historical - 2023 Forecast - Price - Quote - Chart », sur tradingeconomics.com (consulté le )
- ↑ « Indicateur des échanges import/export », Direction générale des douanes, (consulté le ).
Voir aussi
Articles connexes
- catalyseur en catalyse hétérogène
- catalyseur en catalyse homogène
- catalyseur d'hydrogénation et de déshydrogénation
- catalyseur des procédés oxo ou d'hydroformylation
- catalyseur de carbonylation, réaction d'insertion et procédé Monsanto
- Catalyseur de Wilkinson
- Éléments de la période 5
- Éléments du bloc d
- Éléments du groupe 9
- Isotopes du rhodium
- Métal de transition
- Métal noble
- Métal précieux
- Métaux du groupe du platine
- Or blanc
- Pot catalytique (catalyse hétérogène)
- Procédé Andrussow
- Réaction de couplage
- Réarrangement de Bamberger
- Rhodocène
- Rhodium natif
- Trichlorure de rhodium
- Uranium-rhodium-germanium
Liens externes
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (fr) « Rhodium présenté par la SCF », Société Chimique de France (consulté le ).
- (fr) « Vocabulaire du rhodium sur le TLF » (consulté le ).
- (en) Jonathan Buhalis, « Rh sur le site Metal&Minerals » (consulté le )
- (en) « Rhodium (Rh) — Chemical properties, Health and Environmental effects » [« Présentation de l'élément, du corps simple et initiation à sa toxicité »], Delft, Lenntech B.V. (consulté le )
- (en) Wolfram Research inc., « Technical data for Rhodium », Avec en sous-pages les données connues pour chaque isotope., sur www.periodictable.com, (consulté le )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |