| Anhydride acétique | |||
| |||
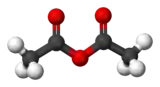 | |||
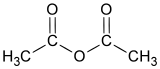
| formule semi-développée et représentation 3D de l'anhydride acétique | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Anhydride éthanoïque | ||
| No CAS | |||
| No ECHA | 100.003.241 | ||
| No CE | 203-564-8 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, très mobile, d'odeur âcre[1]. | ||
| Propriétés chimiques | |||
| Formule | C4H6O3 [Isomères] |
||
| Masse molaire[2] | 102,088 6 ± 0,004 5 g/mol C 47,06 %, H 5,92 %, O 47,02 %, |
||
| Moment dipolaire | ≈2,8 D [3] | ||
| Diamètre moléculaire | 0,554 nm [4] | ||
| Propriétés physiques | |||
| T° fusion | −73 °C[1] | ||
| T° ébullition | 139 °C[1] | ||
| Solubilité | 120 g·l-1 (eau, 20 °C)[5], soluble dans l'éthanol l'acétone, le chloroforme, l'éther diéthylique, l'acétate d'éthyle et le DMSO |
||
| Paramètre de solubilité δ | 21,1 MPa1/2 (25 °C)[6]; 22,1 J1/2·cm-3/2 (30 °C)[4] |
||
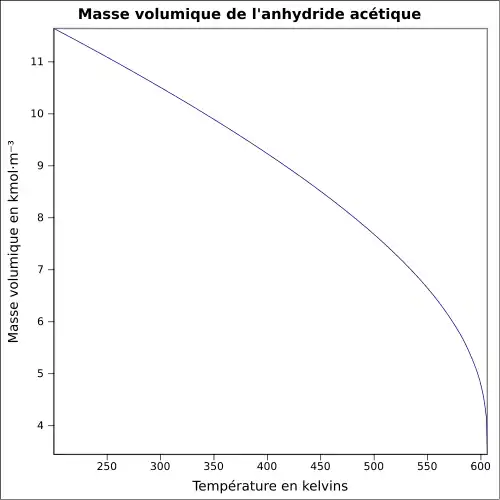
| Masse volumique | 1,08 g·cm-3[1]
|
||
| T° d'auto-inflammation | 316 °C[1] | ||
| Point d’éclair | 49 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 2,7–10,3 %vol[1] | ||
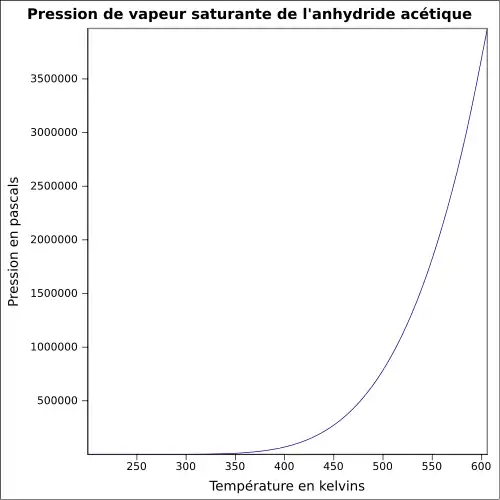
| Pression de vapeur saturante | 5 hPa (20 °C)
|
||
| Point critique | 46,8 bar, 295,85 °C [8] | ||
| Thermochimie | |||
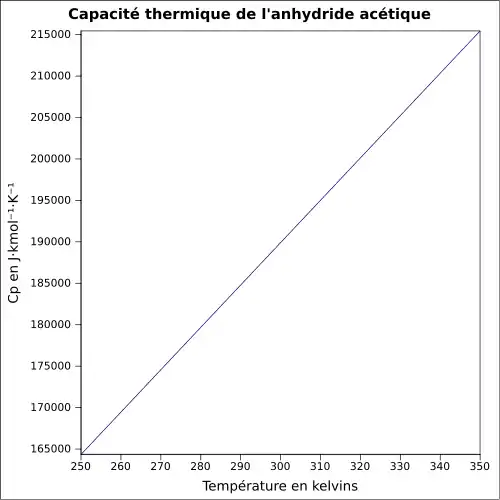
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction | 1,3904 [4] | ||
| Précautions | |||
| SGH[10] | |||
   Danger |
|||
| SIMDUT[11] | |||
   B3, D1A, E, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 1 780 mg·kg-1 (rat, oral)[5] | ||
| CL50 | 1 000 ppm/4H (rat, inhalation)[5] | ||
| Seuil de l’odorat | bas : 0,12 ppm haut : 0,36 ppm[12] |
||
| Composés apparentés | |||
| Autres composés | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
L'anhydride acétique ou anhydride éthanoïque est l'anhydride de l'acide acétique; il est obtenu en liant deux molécules d'acide acétique par condensation avec élimination d'eau (d'où le nom d'anhydride).
L'anhydride acétique dégage des vapeurs irritantes pour les muqueuses oculaires et respiratoires. Ses effets sur le corps humain sont principalement des brûlures cutanées dues à un contact avec la peau et des effets lacrymogènes dus aux gaz volatils. Il faut donc le manipuler avec du matériel de protection et sous une hotte qui aspire les gaz dangereux. Il s'hydrolyse facilement avec l'humidité de l'air et est inflammable.
Synthèse
La synthèse de l'anhydride acétique peut être menée selon trois processus[1] :
via le cétène
L'acide acétique est craqué à haute température et sous vide :
- CH3COOH → CH2=C=O + H2O
cette réaction est catalysée par des esters de l'acide phosphorique comme le phosphate de triéthyle puis le cétène réagit sur l'acide acétique :
- CH2=C=O + CH3COOH → (CH3CO)2O
Procédé Eastman
L’anhydride acétique est fabriqué industriellement par carbonylation de l’acétate de méthyle :
- CH3COOCH3 + CO → (CH3CO)2O
cette réaction est catalysée avec du rhodium.
Procédé BP Chemicals
Il s'agit comme le procédé Eastman d'une insertion de CO dans l'acétate de méthyle mais un sel d'ammonium quaternaire est utilisé comme cocatalyseur pour produire un mélange d’acide acétique et d’anhydride acétique.
Applications
Rôle dans la synthèse de l'aspirine
L'anhydride acétique est utilisé pour faire la synthèse de l'acide acétylsalicylique, plus connu sous le nom d'aspirine en réagissant avec l'acide salicylique. La réaction à reflux est rapide et totale.
Rôle dans la synthèse du paracétamol
L'acylation du p-aminophénol avec de l'anhydride acétique permet d'obtenir du paracétamol.
Rôle dans la synthèse de l'acétate de cellulose
L'anhydride acétique est utilisé pour faire de l'acétate de cellulose par réaction avec la cellulose.
Rôle dans la synthèse de la vanilline
L'anhydre acétique est employé lors de la synthèse de la vanilline pour transformer l'isoeugénol en acétate d'isoeugénol. Cette réaction est une acétylation.
Autres
En raison de son utilisation pour la synthèse de l'héroïne par la diacétylation de la morphine, l'anhydride acétique est répertorié comme précurseur dans la liste DEA II des États-Unis et son usage est limité dans de nombreux autres pays[13].
Références
- 1 2 3 4 5 6 7 8 ANHYDRIDE ACETIQUE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 978-1420066791), p. 9-50
- 1 2 3 (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 978-0-471-98369-9)
- 1 2 3 (en) « Anhydride acétique », sur ChemIDplus, consulté le 5 juin 2009
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5, présentation en ligne), p. 294
- 1 2 3 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9), p. 2-50
- ↑ « Properties of Various Gases », sur flexwareinc.com (consulté le )
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 978-0-88415-857-8)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Anhydride acétique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ « Acetic anhydride », sur hazmap.nlm.nih.gov (consulté le )
- ↑ (en) Carmen Drahl, Five Things To Know About Heroin's Curious Chemistry History, forbes.com, 12 juin 2017