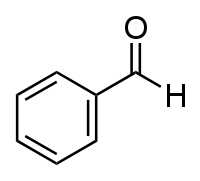
| Benzaldéhyde | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Aldéhyde benzoïque | ||
| Synonymes |
phénylméthanal |
||
| No CAS | |||
| No ECHA | 100.002.601 | ||
| No CE | 202-860-4 | ||
| FEMA | 2127 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore à jaune visqueux, d'odeur caractéristique[1] | ||
| Propriétés chimiques | |||
| Formule | C7H6O [Isomères] |
||
| Masse molaire[2] | 106,121 9 ± 0,006 3 g/mol C 79,23 %, H 5,7 %, O 15,08 %, |
||
| Moment dipolaire | 2,77 D[3] | ||
| Diamètre moléculaire | 0,607 nm[3] | ||
| Propriétés physiques | |||
| T° fusion | −26 °C[1] | ||
| T° ébullition | 179 °C[1] | ||
| Solubilité | légèrement soluble dans l'eau (4 % à 25 °C) éthanol, éther, acétone, benzène |
||
| Paramètre de solubilité δ | 19,2 MPa1/2 (25 °C)[4] | ||
| Masse volumique | vapeur : 3,66 g·cm-3 liquide : 1,046 g·cm-3 à (20 °C) solide : 1,040 1 g·cm-3 |
||
| T° d'auto-inflammation | 190 °C[1] | ||
| Point d’éclair | 62 °C[1] | ||
| Limites d’explosivité dans l’air | 1,4–13,5 %vol[1] | ||
| Pression de vapeur saturante | à 26 °C : 130 Pa[1] | ||
| Viscosité dynamique | 1,4 cP (25 °C) | ||
| Point critique | 45,4 bar, 421,65 °C[5] | ||
| Thermochimie | |||
| S0liquide, 1 bar | 221.2[6] | ||
| ΔfH0liquide | −87,1 ± 2,2 kJ mol−1[6] | ||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction | 1,5437[3] | ||
| Précautions | |||
| SGH[8] | |||
 Attention |
|||
| SIMDUT[9] | |||
  B3, D2B, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 1,48[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le benzaldéhyde est un liquide incolore à odeur d’amande amère, c'est l'aldéhyde aromatique le plus simple. Une molécule proche du benzaldéhyde, le phényléthanal, sent la jacinthe et est utilisé en parfumerie sous le nom de hyacinthine. On utilise le benzaldéhyde dans le kirsch fantaisie (note de noyau), la colle blanche et le traitement des vins. Il est présent dans les pêches, le raisin, les fraises et les framboises[10], et est responsable de l'odeur des airelles.
Historique
Faisant suite aux travaux fondateurs, mais incomplets, de Pierre Robiquet et Antoine Boutron Charlard sur l'amygdaline, qu'ils avaient obtenue en 1830 des amandes amères du fruit du Prunus dulcis, sans pouvoir interpréter complètement leurs résultats d'analyse, deux chimistes allemands, Friedrich Wöhler et Justus Liebig analysent à leur tour dans les mois qui suivirent, en 1832, l'essence d'amandes amères dans laquelle ils trouvent du benzaldéhyde C7H6O. En isolant le composé et en le faisant réagir, ils se rendent compte qu'un groupement, qu'ils nomment radical benzoyle C7H5O, reste inchangé.
Préparation
Le benzaldéhyde peut être préparé par l'oxydation du toluène, notamment par réaction avec le chlorure de chromyle (réaction d'Étard) ou par hydrolyse du (dichlorométhyl)benzène, communément appelé « chlorure de benzylidène ». Il se forme également par hydrolyse de l'amygdaline présente dans les amandes et dans les noyaux de certains fruits (abricots…).
Propriétés chimiques
La combustion complète du benzaldéhyde produit du dioxyde de carbone et de l'eau.
Le benzaldéhyde peut être oxydé en acide benzoïque C6H5-COOH dont l'odeur est désagréable. Cette réaction d'auto-oxydation survient lentement dans l'air à température ambiante, ce qui explique qu'on le conserve sous une atmosphère d'azote.
En milieu basique, il peut donner lieu à une réaction de Cannizzaro[11].
Pour caractériser le benzaldéhyde (et tous les aldéhydes en général), on le fait agir sur l'hydrazine H2N-NH2 ou ses dérivés comme la phénylhydrazine C6H5-NH-NH2.
Utilisations
- Parfumerie : produits odoriférants.
- Alimentation : préparation du cinnamaldéhyde et de ses dérivés.
- Arômes artificiels d'amande et de cerise.
- Intermédiaire industriel pour la fabrication d'acide benzoïque.
- Solvant : résines, acétate et nitrate de cellulose.
- Colorants.
- Pesticides : éphédrine.
- Répulsif des abeilles lors de la récolte du miel.
Références
- 1 2 3 4 5 6 7 8 BENZALDEHYDE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 3 (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1)
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, présentation en ligne), p. 294
- ↑ « Properties of Various Gases », sur flexwareinc.com (consulté le )
- 1 2 (en) « Benzaldehyde », sur NIST
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic compounds C5 to C7, vol. 2, Huston, Texas, Gulf Pub. Co., , 400 p. (ISBN 0-88415-858-6)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- ↑ « Benzaldéhyde » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Marie-Céline Ray, « Définition | Benzaldéhyde | Futura Santé », sur Futura (consulté le )
- ↑ Paul Depovere, Chimie organique, De Boeck Supérieur, (ISBN 978-2-8041-4796-9, lire en ligne), p. 55
Liens externes
- Oxydation du benzaldéhyde
- International Chemical Safety Card 0102
- Benzaldéhyde, ChemSub Online
- Benzaldehyde description, ChemicalLand21.com