| cyclohexane | |||
    Différentes représentations d'une molécule de cyclohexane. |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | cyclohexane | ||
| No CAS | |||
| No ECHA | 100.003.461 | ||
| No CE | 203-806-2 | ||
| DrugBank | DB03561 | ||
| PubChem | 8078 | ||
| ChEBI | 29005 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore[1] | ||
| Propriétés chimiques | |||
| Formule | C6H12 [Isomères] |
||
| Masse molaire[2] | 84,159 5 ± 0,005 6 g/mol C 85,63 %, H 14,37 %, |
||
| Susceptibilité magnétique | 68,1×10-6 cm3·mol-1[3] | ||
| Propriétés physiques | |||
| T° fusion | 6,47 °C[4] | ||
| T° ébullition | 80,75 °C[5] | ||
| Solubilité | dans l'eau : nulle[1] ; sol. dans l'alcool, l'éther, l'acétone ; |
||
| Paramètre de solubilité δ | 16,8 MPa1/2 (25 °C)[6] | ||
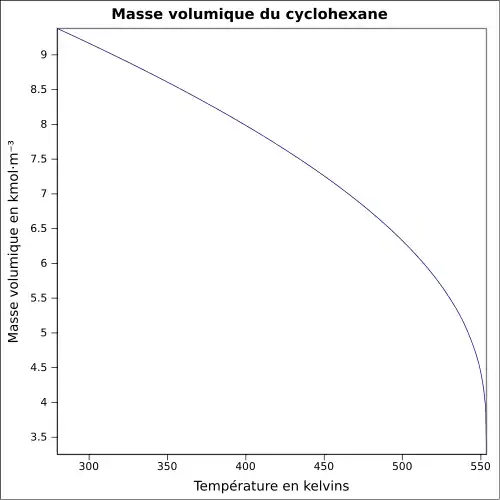
| Masse volumique | 0,778 6 g·cm-3 (25 °C) [7]
|
||
| T° d'auto-inflammation | 260 °C[1] | ||
| Point d’éclair | −18 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 1,3–8,4 %vol[1] | ||
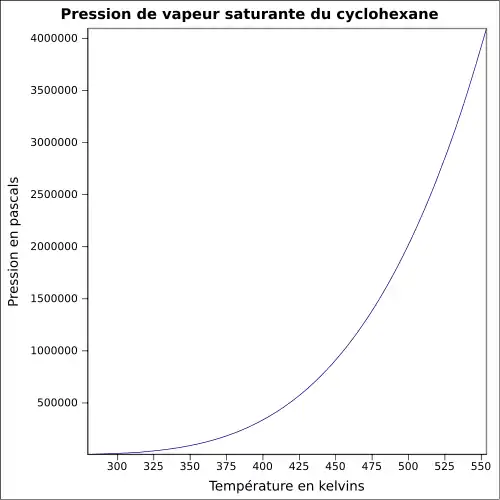
| Pression de vapeur saturante | à 20 °C : 12,7 kPa[1]
|
||
| Viscosité dynamique | 0,98 mPa·s à 20 °C[4] | ||
| Point critique | 280,3 °C[5], 40,7 bar[9] | ||
| Vitesse du son | 1 280 m·s-1 à 19 °C[10] | ||
| Thermochimie | |||
| ΔvapH° | 3,6×105 J·kg-1[4] | ||
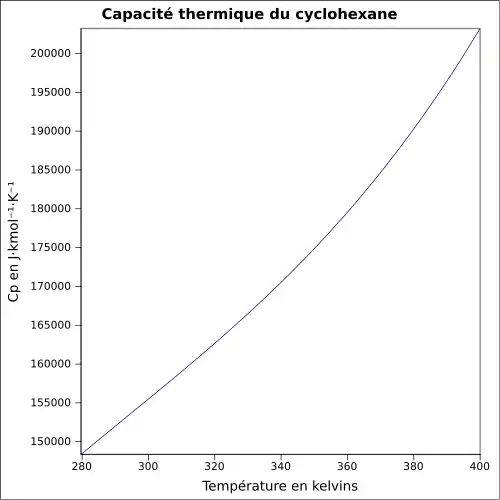
| Cp | |||
| PCS | 3 919,6 kJ·mol-1[4] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,426 62[4] | ||
| Précautions | |||
| SGH[12] | |||
    Danger |
|||
| SIMDUT[13] | |||
  B2, D2B, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 930–1 360 mg·kg-1 (rats, oral)[14] | ||
| LogP | 3,44[4] | ||
| Seuil de l’odorat | bas : 0,52 ppm haut : 784 ppm[15] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le cyclohexane est un hydrocarbure alicyclique non éthylénique de la famille des (mono)cycloalcanes[16] de formule brute C6H12. Le cyclohexane est utilisé comme solvant apolaire dans l'industrie chimique, mais aussi comme réactif pour la production industrielle de l'acide adipique et du caprolactame, intermédiaires utilisés dans la production du nylon. La formule topologique du cyclohexane est présentée ci-contre.
Production
Synthèses historiques
Contrairement à d'autres hydrocarbures, le cyclohexane n'est pas trouvable dans la nature. Plusieurs chimistes ont donc cherché à le synthétiser[17]:
- En 1867, Marcelin Berthelot procède à la réduction du benzène par l'acide iodhydrique à température élevée. Il nomme son produit hexahydrobenzène, pensant en avoir synthétisé[18],[19]. En 1870, Adolf von Baeyer réitère cette réaction[20] et obtient le même produit.
- En 1890, Vladimir Markovnikov pense pouvoir obtenir le même produit par distillation de pétrole du Caucase. Il nomme son produit final hexanaphtène.
Cependant, les deux produits ont une température d'ébullition supérieure d'environ 10 °C à celles de l'hexahydrobenzène et de l'hexanaphtène tabulées. L'incohérence est levée en 1895 par V. Markovnikov, N. Kischner (en) et N. Zelinsky qui montrent que les produits obtenus ont une structure de type méthylcyclopentane, obtenue par une réaction inattendue de réarrangement.
Il faut attendre 1894 pour que Baeyer synthétise pour la première fois du cyclohexane par condensation de Dieckmann de l'acide pimélique, suivi de multiples étapes de réduction.
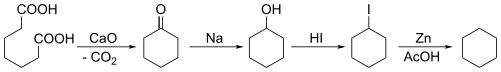
La même année, E. Haworth et W. H. Perkin Jr. synthétise du cyclohexane en réalisant une réaction de Wurtz avec le 1,6-dibromohexane.

Synthèse actuelle
De nos jours, le cyclohexane est produit à échelle industrielle par hydrogénation du benzène catalysée par le nickel de Raney[21]. La production de cyclohexane correspond à environ 10 % des besoins mondiaux annuels en benzène[22]. La réaction réalisée à haute température, elle est alors hautement exothermique avec ΔH(500 K) = -216,37 kJ/mol. La réaction de déshydrogénation n'est significative qu'à partir de 300 °C, reflétant une entropie de réaction négative pour la réaction d'hydrogénation[23].

Utilisations
En tant qu'hydrocarbure, le cyclohexane est une molécule peu réactive. Cependant, la très grande majorité du cyclohexane est utilisée pour être catalytiquement oxydée en cyclohexanol et en cyclohexanone. Ces deux composés servent respectivement à la production d'acide adipique, utilisé comme matière première pour la fabrication nylon-6,6, et à la production de caprolactame, un précurseur du nylon-6. Plusieurs milliers de tonnes de cyclohexanol et de cyclohexanone sont produits chaque année[23].
Le cyclohexane est également utilisé comme solvant organique apolaire, bien que le n-hexane tende aujourd'hui à lui être préféré. Il est souvent utilisé comme solvant de recristallisation car de nombreux composés organiques sont solubles à chaud dans le cyclohexane mais pas à froid.
Le cyclohexane est également utilisé pour calibrer les instruments de calorimétrie différentielle à balayage en raison de son changement de phase cristalline net à 186 K[24]. Les vapeurs de cyclohexane sont également utilisées dans les usines de traitement thermique des équipements.
Géométrie
Approche historique
En 1890, Hermann Sachse (de), un assistant berlinois de 28 ans, publie des instructions pour plier une feuille de papier pour représenter deux formes du cyclohexane, qu'il appelle "symétrique" et "antisymétrique" (aujourd'hui appelées chaise et bateau). Il comprend que pour chaque forme, il existe deux positions distinctes pour les atomes d'hydrogène (aujourd'hui appelées axial et équatorial), que deux formes "symétriques" peuvent s'interconvertir et même comment certains substituants peuvent favoriser une forme ou l'autre (théorie de Sachse-Mohr (de)). Malheureusement, il exprime toutes ses découvertes en langage mathématique et peu de chimistes le comprennent. Il mourra en 1893 sans que ses idées aient pu se développer.
En 1918, Ernst Mohr (de) reprend les travaux de Sachse. Il étudie tous les cycloalcanes pour élargir sa théorie. Il prédit notamment qu'il existe deux formes stables de même énergie pour la décaline, ce qui sera confirmé par Walter Hückel (de) en 1925. Mohr aura également l'idée que la diffraction des rayons X pourrait permettre de valider sa théorie, mais la technique est trop nouvelle pour qu'elle puisse être utilisée de manière fiable[25].
Il faudra attendre 1943 pour que Odd Hassel puisse démontrer l'existence de ces deux conformations et des deux positions non équivalents pour les atomes d'hydrogène en étudiant les vapeurs de cyclohexane par diffraction des électrons[26].
Principales conformations du cyclohexane
Comme beaucoup de composés possèdent une structure cyclique à 6 chaînons, la structure et la dynamique du cyclohexane sont des prototypes importants. Les angles d'un hexagone régulier plan mesurent 120°. Cependant, l'angle formé par deux liaisons successives dans une chaîne carbonée est d'environ 109° d'après la théorie VSEPR. Par conséquent, la molécule de cyclohexane n'est pas plane pour minimiser la tension du cycle.
La conformation majoritaire du cyclohexane à température ambiante est appelée la conformation chaise. Plus de 99 % des molécules de cyclohexane en solution adoptent cette conformation à 25 °C. Tous les atomes de carbone y sont équivalents et il existe deux positions distinctes pour les atomes d'hydrogène: un atome d'hydrogène qui appartient au plan médian du cycle est dit en position équatoriale, tandis qu'un atome d'hydrogène n'appartenant pas à ce plan est dit en position axiale. Chaque atome de carbone est donc relié à un atome d'hydrogène en position axiale et à un autre en position équatoriale. Les liaisons carbone-hydrogène successives sont décalées, ce qui minimise la contrainte de torsion du cycle.
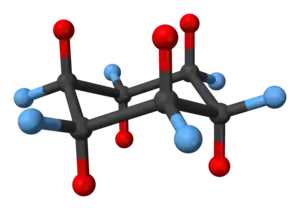
La seconde conformation stable de la molécule de cyclohexane est la conformation bateau tordu (twist-boat en anglais). Si la proportion de molécules de cyclohexane dans cette conformation n'est que d'environ 0,1 % à 25 °C, elle atteint 30 % à 800 °C. Un refroidissement brutal de l'échantillon permet alors de "geler" la conformation des différentes molécules. La conformation bateau tordu est moins stable que la conformation chaise et est de fait peu courante dans la nature. On peut noter le cas du twistane, un isomère synthétique de l'adamantane, dont tous les cyclohexanes sont en conformation bateau tordu.
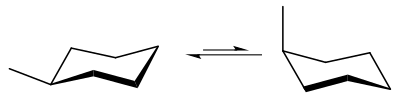
Inversion de conformation chaise
Il existe en réalité deux conformations chaise différentes, et la molécule de cyclohexane peut changer sa conformation d'équilibre entre ces deux formes. Les atomes d'hydrogène en position axiale dans une conformation chaise se retrouvent en position équatoriale dans l'autre, et vice-versa. Ces deux conformations chaise sont en équilibre rapide à température ambiante et sont donc indiscernables par RMN du proton à 25 °C. Le mécanisme détaillé de l'inversion de conformation chaise a été sujet à beaucoup d'études et de débats, mais il est aujourd'hui connu.
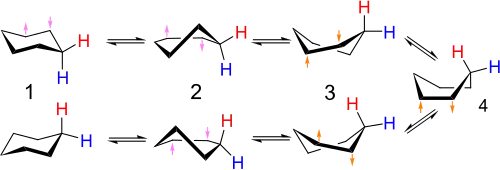
Le profil énergétique de l'inversion de conformation chaise est également connu. La conformation demi-chaise est l'état de transition permettant d'atteindre la première conformation bateau tordu, et la conformation bateau est l'état de transition entre les deux conformations bateau tordu. L'énergie d'activation de l'inversion de conformation chaise est de 43 kJ/mol, ce qui est inférieur à l'énergie d'agitation thermique à 25 °C: c'est pourquoi les deux conformations chaise sont en équilibre à température ambiante.

Conformation majoritaire des dérivés substitués du cyclohexane
Dérivés monosubstitués
Les deux conformations chaise du cyclohexane sont de même énergie. En revanche, si un atome d'hydrogène est remplacé par un substituant, ces deux conformations n'ont plus la même énergie. Dans une conformation chaise, le substituant se trouve en position axiale, tandis qu'il se trouve en position équatoriale dans l'autre. En position axiale, le substituant provoque une gêne stérique avec les deux autres atomes d'hydrogène en position axiale: ces interactions sont appelées interactions 1,3-diaxiales. En position équatoriale, ces interactions n'existent pas: c'est donc la conformation chaise pour laquelle le substituant est en position équatoriale qui est de plus basse énergie. La différence d'enthalpie libre entre ces deux conformations chaise est appelée facteur A, et dépend fortement du substituant. La valeur de A varie entre presque zéro pour de petits substituants comme le deutérium et environ 21 kJ/mol pour des substituants volumineux comme le groupement tert-butyle.
Dérivés disubstitués
Considérons que les deux substituants sont en position relative 1,2 ou 1,4. S'ils sont en configuration cis, les deux conformations chaise possèdent toutes les deux un groupement en position axiale et un autre en position équatoriale: les deux conformations chaise sont alors de même énergie. En revanche, si les deux substituants sont en configuration trans, seule la conformation chaise possédant les deux groupements en position équatoriale peut exister significativement, car les interactions 1,3-diaxiales fortes empêchent les deux groupements d'être en position axiale simultanément.
Considérons que les deux substituants sont à présent en position relative 1,3. S'ils sont en configuration cis, le cas est semblable à la configuration trans pour des substituants en position relative 1,2 ou 1,4. À l'inverse, s'ils sont en configuration trans, le cas est semblable à la configuration cis pour des substituants en position relative 1,2 ou 1,4.
Si les substituants sont très encombrants, la conformation chaise peut ne pas être la plus stable: dans le cas du cis-1,4-di-tert-butylcyclohexane[27], la conformation bateau tordu permet de placer les deux groupements en position plus favorable que pour la conformation chaise, pour laquelle une groupement tert-butyle se trouve en position axiale. Il a ainsi été mesuré par RMN que la conformation bateau tordu était plus stable de 0,47 kJ/mol à 125 K que la conformation chaise.
Analogues hétérocycliques
Les analogues hétérocycliques du cyclohexane sont omniprésents dans le domaine des sucres, des pipéridines ou des dioxanes entre autres. La conformation chaise est généralement la plus stable, mais les valeurs du facteur A varient fortement lorsque l'on remplace un groupement méthylène par un atome d'oxygène ou d'azote, comme en témoigne l'effet anomérique. On peut aussi noter certains analogues hétérocycliques comme le 1,2,4,5-tétrathiane (SCH2S)2 pour lesquels les interactions 1,3-diaxiales n'existent pas: beaucoup plus de molécules sont alors en conformation bateau tordu. Pour son analogue tétraméthylé, le 3,3,6,6-tétraméthyl-1,2,4,5-tétrathiane, la conformation bateau tordu est la conformation majoritaire.
Toxicité et risques
Toxicité
Du fait de la toxicité du cyclohexane, il existe des valeurs limite d'exposition pour protéger les personnes qui travaillent avec ce composé :
- entre 300 et 375 ppm en France, selon la durée de l'exposition,
- 200 ppm en Allemagne,
- 100 ppm aux États-Unis[28].
Inflammabilité
Le cyclohexane est très inflammable. Une fuite de cyclohexane dans une usine britannique située à Flixborough a provoqué une explosion en 1974, entraînant la mort de 28 personnes travaillant sur le site[29].
Notes et références
- 1 2 3 4 5 6 CYCLOHEXANE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », Journal of the American Chemical Society, vol. 91, no 8, , p. 1991-1998
- 1 2 3 4 5 6 7 « Cyclohexane » dans la base de données Hazardous Substances Data Bank, consulté le 5 mai 2010
- 1 2 (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part II. Aromatic and Cyclic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 33, no 2, , p. 541 (DOI 10.1063/1.1647147)
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- ↑ (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7, LCCN 84643191), p. 2.289
- 1 2 3 (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9, LCCN 96051648), p. 2-50
- ↑ « Properties of Various Gases », sur flexwareinc.com (consulté le )
- ↑ (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic compounds C5 to C7, vol. 2, Huston, Texas, Gulf Pub. Co., , 400 p. (ISBN 978-0-88415-858-5, LCCN 96036328)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Cyclohexane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Cyclohexane sur ChemIDplus
- ↑ « Cyclohexane », sur hazmap.nlm.nih.gov (consulté le )
- ↑ M. Piraux, Chimie organique statique, Office international de librairie, Bruxelles, p. 35 (ISBN 978-2-87343-001-6)
- ↑ (en) E. W. Warnhoff, « The Curiously Intertwined Histories of Benzene and Cyclohexane », Journal of Chemical Education, vol. 73, no 6, , p. 494 (ISSN 0021-9584 et 1938-1328, DOI 10.1021/ed073p494, lire en ligne, consulté le )
- ↑ Bertholet (1867) "Nouvelles applications des méthodes de réduction en chimie organique", Bulletin de la Société chimique de Paris, series 2, 7 : 53-65.
- ↑ Bertholet (1868) "Méthode universelle pour réduire et saturer d'hydrogène les composés organiques", Bulletin de la Société chimique de Paris, series 2, 9 : 8-31
- ↑ Adolf Baeyer (1870) "Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium" (Sur la réduction de composés aromatiques par l'iodure de phosphonium [H4IP]), Annalen der Chemie und Pharmacie, 155 : 266-281
- ↑ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng "On Present Methods of Hydrogenation of Aromatic Compounds, 1945 to Present Day" Lunds Tekniska Högskola 2008
- ↑ Ceresana, « Benzene - Study: Market, Analysis, Trends 2021 - Ceresana » [archive du ], sur www.ceresana.com (consulté le )
- 1 2 (en) Michael Tuttle Musser, « Cyclohexanol and Cyclohexanone », dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, (ISBN 978-3-527-30673-2, DOI 10.1002/14356007.a08_217, lire en ligne), a08_217
- ↑ (en) D. M. Price, « Temperature Calibration of Differential Scanning Calorimeters », Journal of Thermal Analysis, vol. 45, no 6, , p. 1285–1296 (DOI 10.1007/BF02547423)
- ↑ Cette histoire est résumée ici: https://web.archive.org/web/20120228222221/https://webspace.yale.edu/chem125/125/history99/6Stereochemistry/Baeyer/Sachse.html Archivé le 28/02/2012 sur Wayback Machine
- ↑ (en) « Odd Hassel - Biographical », sur nobelprize.org (consulté le )
- ↑ (en) Gurvinder Gill, Diwakar M. Pawar et Eric A. Noe, « Conformational Study of cis -1,4-Di- tert -butylcyclohexane by Dynamic NMR Spectroscopy and Computational Methods. Observation of Chair and Twist-Boat Conformations », The Journal of Organic Chemistry, vol. 70, no 26, , p. 10726–10731 (ISSN 0022-3263 et 1520-6904, DOI 10.1021/jo051654z, lire en ligne, consulté le )
- ↑ INRS, fiche toxicologique n°17, Cahiers de notes documentaires - Hygiène et sécurité du travail - No 190, 1er trimestre 2003
- ↑ Ministère chargé de l’environnement - DPPR / SEI / BARPI No 5611
Voir aussi
Articles connexes
- Alcane
- Hexane
- p-menthane
Lien externe
- Fiche toxicologique de l'INRS