| Causes | Virus de la fièvre jaune |
|---|---|
| Transmission | Transmission par les moustiques (d) |
| Incubation min | 3 j |
| Incubation max | 6 j |
| Symptômes | Fièvre, bradycardie, fatigue, céphalée, vomissement, cyanose, ictère, signe de Faget (en), frissonnement (en), arthralgie, anorexie, hyperémie, tuméfaction, tachycardie, signe de Ferrari (d), melæna, hypotension artérielle, hépatomégalie, splénomégalie, oligurie, anurie, encéphalite, hémorragie, mal de dos, nausée, douleur générale (d), asthénie, choc circulatoire, urines sombres (d), douleur abdominale et myalgie |
| Traitement | Traitement symptomatique, inactivation métabolique, arrêt d'une hémorragie, hémodialyse, transplantation hépatique et remplacement de fluide intraveineux (d) |
|---|---|
| Spécialité | Infectiologie |
| CISP-2 | A77 |
|---|---|
| CIM-10 | A95 |
| CIM-9 | 060 |
| DiseasesDB | 14203 |
| MedlinePlus | 001365 |
| eMedicine | 232244 |
| MeSH | D015004 |
![]() Mise en garde médicale
Mise en garde médicale
La fièvre jaune, anciennement appelée fièvre amarile, typhus amaril, ou vomito negro (vomi noir), est une zoonose due à un flavivirus, le virus de la fièvre jaune. C'est une arbovirose des singes de la forêt équatoriale et elle est transmise de singe à singe par divers moustiques du genre Aedes. Le moustique jouant le rôle de réservoir et de vecteur, le singe celui d'hôte amplificateur.
L'homme traversant ces foyers sauvages d'endémie est sporadiquement piqué par les moustiques infectés et fait alors une fièvre jaune humaine dite forme sylvatique. Revenu vers les centres habités, il joue le rôle de réservoir de virus et, piqué par le moustique commensal qu'est Aedes aegypti, hôte vicariant très efficace, il est à l'origine d'une fièvre jaune purement humaine et épidémique : la forme urbaine.
La fièvre jaune demeure toujours une cause importante de maladies hémorragiques dans plusieurs pays africains et sud-américains, malgré l'existence d'un vaccin efficace. Vers 2010, elle tuait environ 29 000 à 60 000 personnes par an en Afrique et Amérique du Sud[1] et elle est la maladie la plus sévère portée par les moustiques sous les tropiques[2]. Elle n'est pas éradicable, à cause de la présence d'un réservoir naturel permanent (moustiques-singes) en forêt tropicale.
Histoire
La phylogénétique des flavivirus indique que le virus de la fièvre jaune aurait divergé d'un flavivirus ancestral, il y a 1 500 à 3 000 ans[3] en Afrique de l'Est. Une nouvelle divergence se produit en Afrique de l'Ouest, 300 ans avant la découverte de l'Amérique, pour y être introduite, avec l'insecte vecteur, par le commerce des esclaves[4].
Une ancienne hypothèse suggérant une origine américaine de la fièvre jaune américaine est restée longtemps minoritaire jusqu'aux années 1990[5]. Elle a été invalidée depuis par les études de génétique moléculaire[6].
Épidémies historiques
Les marins européens rencontrent la fièvre jaune au XVIe siècle aux îles Canaries, du Cap Vert, de Sao Tomé, et dans le golfe du Bénin[6].
La première épidémie connue semble dater de 1648 et eut lieu au Yucatan[7], en étant mentionnée sous le terme de vomito negro (vomissements de sang - noir - ou hématémèse)[3]. Le virus et son insecte vecteur auraient été introduits aux Amériques par le commerce des esclaves à partir de l'Afrique de l'Ouest.
Depuis, de nombreuses épidémies ont été décrites. Le terme de « fièvre jaune » est utilisé pour la première fois lors d'une épidémie à la Barbade en 1750[3]. Au XVIIIe siècle, la fièvre jaune est un obstacle lors de la colonisation en Amérique centrale et du Sud, et en Afrique de l'Ouest. Elle frappe préférentiellement les Européens nouveaux arrivants, en particulier les troupes militaires (arrivée massive de non-immunisés). Au XIXe siècle, c'est l'une des raisons principales de l'échec français du percement du Canal de Panama (de 1881 à 1889, parmi les ouvriers, plus de 5 600 décès selon les Français, plus de 22 000 selon les Américains)[8].

Théodore Géricault, vers 1819
Musée des Beaux-Arts de Virginie, Richmond[9]
La fièvre jaune est introduite de façon répétée dans les ports par les navires infestés de moustiques vecteurs jusqu'au début du XXe siècle. Les épidémies les plus marquantes furent :
- 1793, à Philadelphie, environ 5 000 morts, soit 10 % de la population[3] ;
- 1802, parmi les troupes françaises envoyées à Saint-Domingue durant la Révolution haïtienne ;
- 1805, un tiers de la population de Gibraltar ;
- 1821, à Barcelone, 20 000 morts selon certaines estimations[10],[11] ;
- 1878, dans la basse vallée du Mississippi, 13 000 morts[3] ;
- 1905, à la Nouvelle-Orléans, dernière épidémie aux États-Unis, 8 399 cas dont 908 décès[3] ;
- 1960-1962, en Éthiopie, la plus grande épidémie de fièvre jaune connue, 30 000 morts ;
- 1965, au Sénégal (plusieurs milliers de cas causant plusieurs centaines de morts).
En Europe, la première apparition de la fièvre jaune eut lieu à Lisbonne en 1723. L'Espagne est régulièrement touchée durant les XVIIIe siècle et XIXe siècle (Cadix, Barcelone) ; la Grande-Bretagne à partir de 1777 (Falmouth, Southampton, Swansea) ; la France en 1802 (Brest, Marseille) et en 1861 (Saint-Nazaire). La dernière apparition de la fièvre jaune eut lieu à Saint-Nazaire en 1908 (11 cas dont 7 décès)[12],[13].
Découverte du vecteur
Des médecins français au début du XIXe siècle, et en particulier Pierre Lefort et Jean Guyon à la Martinique dès 1818, ou Nicolas-Pierre Gilbert et Antoine Dalmas à Saint-Domingue, cherchent l'origine de cette maladie, alors appelée « mal de Siam »[14], dans la transmission aérienne de miasmes provenant d'eaux sales et usées, ou de matières organiques en décomposition, sans faire de liens direct avec les moustiques[3].
L'hypothèse de la transmission par moustiques a été émise dès 1881[7] par Carlos Finlay, à Cuba. Cette hypothèse est démontrée par Walter Reed en 1901[15] qui précise également le rôle du moustique Aedes aegypti, agent de transmission d'un virus filtrant[16]. Les campagnes d'éradication de ce vecteur en Amérique centrale (suppression des gîtes larvaires en zone urbaine) permettent la quasi-disparition de la maladie dans ces zones (La Havane, Panama)[17].
Toutefois, dans les années 1920, les mêmes campagnes menées par la fondation Rockfeller échouent dans le nord du Brésil, ainsi que dans les pays partageant des portions de la grande forêt amazonienne, ce qui amène l'épidémiologiste Fred Soper (en) à découvrir, en 1933, l'existence d'une fièvre jaune forestière ou sylvatique[18].
Découverte du virus
En 1925, la Fondation Rockefeller crée un centre d'étude sur la fièvre jaune à Lagos, Nigeria. Le virus est isolé en 1927 par Adrian Stokes (1887-1927), la souche isolée est dite souche Asibi du nom du malade ghanéen originaire[3]. En établissant cette souche par passages sur des singes de laboratoire, Stockes contracte la maladie et en décède la même année[19]. L'Institut Pasteur de Dakar isole aussi une souche, la même année, dite souche française[3].
Dans les années 1925-1930, la recherche se porte, entre autres, vers l'atténuation de ces deux souches pour l'obtention d'un vaccin vivant atténué. Les accidents de contamination en laboratoire causeront 32 cas de fièvre jaune, dont 6 décès, parmi les chercheurs[3] : outre Stockes, on trouve parmi les victimes connues : Lazear et Noguchi[5].
À partir des années 1930, Max Theiler parvient à atténuer la souche Asibi qui conserve un pouvoir immunogène, ouvrant la voie au vaccin en 1936. Celui-ci recevra en 1951 le prix Nobel de médecine pour ses travaux. L'autre souche française atténuée conduit à un second vaccin, mis au point et introduit en 1934 par Jean Laigret, de l'Institut Pasteur, et largement utilisé en Afrique jusqu'en 1982, où les complications neurologiques (encéphalites chez l'enfant) le font abandonner.
Le virus est séquencé en 1985[20]. Des études ultérieures montrent que les souches Asibi et Française sont de séquence identiques à 99,8 %[3].
Épidémiologie

La maladie est provoquée par un arbovirus de la famille Flaviviridae (qui comprend également les virus à l'origine de la dengue, l'encéphalite de Saint-Louis et de la fièvre du Nil occidental). C'est un des plus petits virus à ARN que l'on ait réussi à isoler chez l'homme.
Chez l'animal
Le cycle de transmission implique des singes arboricoles (colobe, cercopithèque, babouin… en Afrique) et des moustiques simiophiles (piquant préférentiellement le singe) comme Aedes africanus en Afrique, ou Hæmagogus en Amérique du Sud. Ces moustiques se développent dans les creux d'arbres de la canopée de la forêt tropicale humide.
La majorité des singes africains peuvent présenter une virémie transitoire (présence de virus dans le sang), suffisante pour être transmise de singe à singe par les moustiques, mais sans avoir de maladie grave (infection inapparente). Cela indique une adaptation africaine très ancienne du virus dans le cadre d'une coévolution entre singe, moustique et virus[21].
Il n'en est pas de même des singes sud-américains (singe hurleur, atèle, capucin…) qui peuvent présenter des infections mortelles, comme chez l'homme[22]. Aussi en Amérique tropicale, les épidémies humaines sont toujours précédées par une forte mortalité des singes forestiers, indiquant une mauvaise adaptation du virus à son hôte[21].
Durant la saison humide, la densité des moustiques s'accroit, et ceux-ci peuvent s'étendre à des zones de savanes en dehors du bloc forestier (forêts-galeries, mosaïques de forêt-savane). Les moyens de survie du virus durant la saison sèche ne sont pas entièrement élucidés. Il existe une transmission des moustiques femelles infestées à leurs œufs (transmission trans-ovarienne). Ces œufs peuvent résister longtemps à la dessication dans les trous d'arbres, en attendant le retour des pluies. Le véritable réservoir naturel du virus serait alors le moustique. Une hypothèse secondaire implique le rôle de tiques dans le maintien du cycle, durant la saison sèche[22].
Les virus de la fièvre jaune se maintiennent ainsi dans un système naturel tropical, constitué d'un chaînon long de moustiques, d'une année à l'autre, jouant le double rôle de vecteur et de réservoir, et d'un chaînon court de singes, de quelques jours, jouant le rôle d'amplificateur (le virus se multiplie dans le sang — virémie —, durant la phase d'infestation)[23].
Il y a peu d'éléments qui permettent de penser que d'autres mammifères, autres que les primates, pourraient jouer un rôle dans le cycle naturel de transmission[22]. En laboratoire, dans des conditions expérimentales, les rongeurs (souris, hamsters, cobayes...) sont des espèces sensibles développant des complications cérébrales (encéphalites), alors que le hérisson européen présente plutôt des complications viscérales (hépatiques et rénales). Les singes asiatiques comme le macaque rhésus sont très sensibles et ils ont été utilisés comme modèles d'études[24].
Chez l'homme
Modalités
On distingue deux grands cycles de transmission chez l'homme : le cycle de la fièvre jaune sylvatique (singe — moustique — homme) où l'homme entre accidentellement dans le cycle (cas isolés ou sporadiques), et le cycle de la fièvre jaune urbaine (homme - moustique - homme) où l'épidémie humaine évolue pour son propre compte.
La fièvre jaune sylvatique survient chez les personnes vivant ou travaillant en forêt : la chasse intensive ou la déforestation peuvent réduire la population de singes, et les hommes servir d'hôtes de remplacement. Elle peut aussi exister en lisière de forêt, où les singes vivent à proximité d'exploitations agricoles[22]. Les souches virales issus de moustiques vivant en forêt sont beaucoup moins virulentes pour l'homme que celles issues de zone rurale, évoluant loin de la forêt[21] (fièvre jaune rurale, intermédiaire entre la sylvatique et l'urbaine).
La fièvre jaune urbaine implique une transmission par des moustiques diurnes qui piquent préférentiellement l'homme (moustiques « domestiques »), comme Aedes aegypti en Afrique, ainsi que les Hæmagogus et Sabethes en Amérique du Sud. Aedes aegypti se développe dans les récipients et tout objet pouvant retenir de l'eau stagnante. La fièvre jaune dépend alors de plusieurs variables : la densité humaine (urbanisation croissante), les déplacements humains (personnes non immunisées, moyens de transport emportant des moustiques), les zones péri-urbaines dégradées (favorisant le lien entre zones sylvatique et urbaine), le relâchement des précautions d'hygiène et de vaccination, le réchauffement climatique et les pluies excessives. Il s'agit d'autant de facteurs qui peuvent augmenter la transmission de la fièvre jaune[22].
Distribution géographique
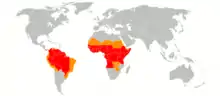
En 2016, la fièvre jaune est endémique dans 47 pays tropicaux d'Afrique et d'Amérique du Sud[25] représentant 900 millions d'habitants[26]. 90 % des cas surviennent en Afrique subsaharienne. Il existe des pays où la fièvre jaune est absente, mais susceptible de se propager à cause de la présence du moustique Ædes ægypti, ces pays peuvent exiger un certificat international de vaccination.
La fièvre jaune n'a jamais été observée dans les zones tropicales humides d'Asie (Inde, Asie du Sud-Est) et du Pacifique, où le virus reste absent (population originelle séro-négative). Pourtant toutes les conditions sont réunies pour que le virus s'y implante : présence du vecteur, urbanisation croissante, voyages aériens... Cette absence de la fièvre jaune en Asie est toujours inexpliquée. Au moins trois hypothèses ont été suggérées[4] :
- La fièvre jaune survient dans des zones éloignées, chez des personnes non coutumières de voyages internationaux ;
- Il existerait une protection croisée par la dengue, très fréquente en Asie (les personnes développant des anticorps contre la dengue seraient relativement protégées contre la fièvre jaune) ;
- Les souches asiatiques de moustiques Ædes ægypti seraient de mauvais vecteurs pour le virus.
Selon T.P. Monath, « il est probable que les trois mécanismes se combinent pour réduire le risque ». Une quatrième hypothèse est celle de l'absence de singes amplificateurs[27]. Pour l'OMS, et les autorités sanitaires des pays concernés, le risque d'introduction de fièvre jaune reste réel et potentiel[28].
Données récentes
- En 2005, 206 000 cas de fièvre jaune ont été recensés dans douze pays africains (Bénin, Burkina Faso, Cameroun, Côte d'Ivoire, Ghana, Guinée, Liberia, Mali, Nigeria, Sénégal, Sierra Leone et Togo), provoquant 52 000 décès. L’Organisation mondiale de la santé a estimé alors que l’épidémie pourrait faire entre 1,5 et 2,7 millions de morts, si aucune action n'était menée en matière de prévention vaccinale[29],[30].
- En 2006, l’Initiative Fièvre jaune a été lancée pour garantir l’approvisionnement mondial en vaccin antiamaril et renforcer l’immunité dans les populations. De 2007 à 2016, 14 pays ont terminé des campagnes de vaccination préventive contre la fièvre jaune, plus de 105 millions de personnes ont été vaccinées[31].
- En 2015, en Amérique du Sud, 73 cas de fièvre jaune, dont 9 mortels ont été notifiés à l’OMS par le Brésil (9 cas) et le Pérou (64 cas)[32] mais il existe une importante sous-notification, et l'OMS estime que le véritable nombre des cas est de 10 à 250 fois supérieur à celui des cas actuellement notifiés[31].
Toujours en 2015, aucune flambée épidémique n'est survenue en Afrique. 7299 cas suspects ont été rapportés, dont 53 ont été confirmés. Ce qui indiquerait une transmission sylvatique limitée, avec absence d'une transmission urbaine à grande échelle[32].
- En 2016 en début d'année une flambée épidémique touche l'Angola et la République Démocratique du Congo. En août 2016, l'OMS juge la situation préoccupante, sans en faire une urgence de santé publique de portée internationale[33].
- 2016-2018. En juillet 2016 le Brésil déclare une épidémie dans le sud du pays, probablement issue de la jungle, via des singes et des moustiques (des genres Haemagogus et Sabethes dans ce pays)[34]. Le virus progresse de 3,3 km par jour vers les mégapoles de Sao Paulo et de Rio de Janeiro, d'où il était absent depuis des décennies, et où plus de 35 millions de personnes n'étaient pas vaccinées (792 cas confirmés en 2017, dont beaucoup mourront). En , la découverte d'un singe mort dans le parc de São Paulo, cause un état d'alerte au Brésil et engendre la fermeture du parc[35].
En aout 2018, on estime que 676 personnes sont mortes du virus lors de cette épidémie, ce qui en fait la pire du pays depuis un siècle. Une pénurie de vaccins qui a fait craindre une situation plus dure encore, incitant les scientifiques à mieux comprendre l'écologie de ce virus pour mieux prédire et contrôler ses futures flambées[36]. En aout 2018 ils publient dans la revue Science[37] une reconstitution du chemin suivi par le virus, qui montre que la déforestation est en cause, mais aussi le transport de moustiques par des véhicules et par le commerce illégal de singes prélevés dans la jungle, qui ont accéléré la propagation virale[34]. 85 % des infectés étaient des hommes de 35 à 54 ans vivant souvent à moins de 5 kilomètres de la jungle et/ou plus à risques de fréquenter la jungle et ses abords (dont chauffeurs routiers et ouvriers agricoles) ; « c'est cette population la plus à risque qu'il faudrait vacciner prioritairement » conclut notamment l'étude[34].
Physiopathologie
Après infection lors d'une piqûre de moustique, le virus se réplique dans les ganglions lymphatiques et infecte en particulier les cellules dendritiques.
Le virus possède deux grandes propriétés biologiques, le « viscérotropisme » avec atteintes sanguines et viscérales préférentielles (hémorragiques, hépato-rénales...) et le « neurotropisme » avec atteintes cérébrales (encéphalites). L'une ou l'autre de ces deux propriétés peut être prédominante selon la souche virale, l'espèce-hôte en cause, et l'âge de l'individu-hôte.
Dans les atteintes hépatiques, probablement indirectement par le biais des cellules de Küpffer, on constate une dégradation des granulocytes éosinophiles et une libération de cytokines, avec apparition de Corps de Councilman (en)[38] dans le cytoplasme des hépatocytes[39],[40].
L'évolution fatale de la maladie entraîne une insuffisance cardiaque ou une défaillance multiviscérale associée à un fort accroissement des niveaux de cytokine (choc cytokinique)[41].
Clinique
La fièvre jaune peut être asymptomatique ou de gravité variable. Dans la forme complète et sévère, le tableau est celui d'une fièvre hémorragique virale.
Après la piqûre infestante, l'incubation muette, très courte de 3 à 6 jours, est suivie d'une invasion brutale avec malaise, maux de tête violents, sensation de « coup de barre » dorsal et poussée fébrile à 39 °C.
Classiquement dans la forme complète (environ 15 % des personnes infectées), la période d'état comporte 2 phases fébriles séparées par une défervescence en V de 24 heures :
- Une phase rouge, virémique, de 3 jours (faciès vultueux — visage rouge et gonflé —, conjonctivite, langue petite avec pointe et bords rouge vif avec enduit blanc au centre), polyalgique, avec hyperthermie à 40 °C et plus, au cours de laquelle se produit une dissociation pouls — température (le pouls est relativement lent alors que la température est très élevée) ou signe de Faget[42] ;
- Une phase de rémission de quelques heures à 2 jours (chute de la fièvre et baisse des symptômes). La guérison peut survenir à ce stade (formes abortives ou non-ictériques), dans un tel cas, le diagnostic clinique n'est guère possible, sauf dans un contexte épidémique connu ;
- Une phase jaune, « toxique », de 3 jours, consistant en une rechute avec ictère généralisé (jaunisse), atteinte hépatique et rénale, troubles hémorragiques, dont les hémorragies digestives aboutissant aux vomissements noirs, d'où le nom de vomito negro.
Le bilan biologique est très perturbé : leucopénie, transaminases hépatiques élevées, protéinurie régulièrement croissante.
La phase critique de la maladie survient entre le 5e et le 10e jour après son début, où le patient meurt ou guérit. En cas d'évolution favorable, une défervescence en lysis (baisse lente de la température) sur 48 heures, accompagnée d'une reprise de la diurèse, amène la guérison après 10 jours de maladie, durée maximale pathognomonique de la fièvre jaune. Cette guérison est habituellement complète : les patients qui survivent à la fièvre jaune ne présentent pas de séquelles hépatiques, rénales ou autres complications chroniques[28].
Dans 20 à 50 % des cas, la mort survient par insuffisance aiguë hépatique et rénale, en hypothermie, après rémission brutale ou au début de la reprise, ou en hyperthermie vers le 8e jour, sans rémission. Ce tableau s'apparente à un syndrome de réponse inflammatoire systémique avec défaillance multiviscérale[3].
Diagnostic
Le diagnostic est clinique, mais les formes très variables de la maladie peuvent le rendre difficile, surtout au début de la maladie, devant un cas isolé. Cette difficulté entraîne une sous-estimation de la morbidité (taux de malades dans une population) et une surestimation de la mortalité (taux de décès) par la prise en compte des seules formes complètes et abouties de la fièvre jaune.
Le diagnostic est orienté par l'aspect de la courbe de température (bi- ou triphasique), la conjonctivite, la langue rouge vif, l'ictère et la dissociation pouls-température, chez un sujet non-vacciné résidant ou ayant voyagé récemment en zone endémique de fièvre jaune.
Il faudra éliminer :
- le paludisme par recherche de plasmodiums dans la goutte épaisse ;
- une fièvre bilieuse hémoglobinurique mais on aurait alors des urines acajou ;
- une fièvre récurrente mais on verrait les borrelias entre les globules rouges sur étalement de sang coloré au Giemsa ;
- une leptospirose ictéro-hémorragique ou une hépatite virale mais elles auraient continué à évoluer après le 10e jour ;
- une fièvre typhoïde ;
- d'autres fièvres hémorragiques et arboviroses.
La confirmation pourra être obtenue d'un laboratoire spécialisé ou d'un centre de référence de l'OMS :
- à partir du sang du malade, dès le 3e ou 4e jour, par PCR ; par inoculation à la souris (résultats plus longs) ;
- à partir de son sérum sanguin par sérodiagnostic (détection des anticorps) ; par test de protection de la souris.
Traitement
Il n'existe aucun traitement spécifique de la fièvre jaune, c'est pourquoi la vaccination préventive est si importante.
Le malade devra être isolé sous moustiquaire pendant au moins 5 à 6 jours.
Seul un traitement symptomatique est possible, notamment contre la fièvre et la déshydratation. Il permet d'améliorer l'évolution de la maladie. Dans les cas les plus graves, des actions plus lourdes sont nécessaires, comme des transfusions sanguines ou des dialyses, mais elles ne sont guère disponibles dans les zones défavorisées.
Prévention
Risques du voyageur
Le risque d'un voyageur non vacciné de contracter la fièvre jaune dépend de la zone géographique, de la saison, de la durée du séjour, des activités exposant à des piqûres de moustique, et de l'intensité de la transmission virale.
- En situation épidémique (risque maximum), pour un séjour de 2 semaines, ce risque a été estimé à 1 sur 267, et celui de décès à 1 sur 1333[43].
- En situation endémique (inter-épidémique), pour un séjour de deux semaines, le risque pour un voyageur non vacciné de contracter et de décéder de fièvre jaune a été estimé à respectivement 50/100 000 et 10/100 000 en Afrique de l’Ouest et 5/100 000 et 1/100 000 pour un voyage en Amérique du Sud[44].
Lutte contre les moustiques
Les insecticides, les vêtements de protection et l'installation de moustiquaires aux fenêtres sont des mesures individuelles utiles, mais pas toujours suffisantes, contre cette maladie. Des campagnes de lutte contre les moustiques dans les zones touchées font également baisser le nombre de cas.
Vaccination
Vaccins historiques abandonnés
Après l'isolement du virus en 1927, trois pays (États-Unis, France, Brésil) se lancent dans la recherche d'un vaccin inactivé, ces recherches n'aboutissent pas.
À partir de 1932, l'Institut Pasteur met au point un vaccin à virus vivant atténué par passages sur cerveau de souris (dit vaccin neurotropique). Ce vaccin est largement utilisé en Afrique francophone (au total 14 millions de personnes vaccinées, en 1947). En 1948, ce vaccin est homologué par l'OMS. En 1953, 56 millions de doses sont administrées entrainant un déclin de la fièvre jaune dans les pays francophones, contrairement au Nigéria et au Ghana, pays non vaccinateurs[45].
Toutefois, ce vaccin s'accompagne de graves effets secondaires, comme l'encéphalite post-vaccinale, dont le risque est estimé dans les années 1950 à 1 sur dix mille, risque d'abord considéré comme acceptable, l'encéphalite étant le plus souvent réversible. Dans les années 1960, le risque d'encéphalite est évalué entre 1 et 2 sur mille avec une mortalité de 9 %. L'utilisation du vaccin neurotropique se restreint, et sa production est définitivement arrêtée en 1982[45].
Les causes de cette encéphalite n'ont pas été éclaircies : à l'origine, une contamination par un virus murin (provenant de la souris) a été envisagée, il est apparu par la suite qu'une instabilité génétique de la souche vaccinale était plus probable[45].
Vaccins actuels
Les vaccins actuels contre la fièvre jaune - vaccin anti-amarile - sont des vaccins vivants issus d'une souche virale atténuée par passage sur embryon de poulet, dite 17D. Ce vaccin 17D a été découvert en 1936 par Max Theiler et Smith[46], pour lequel Theiler reçoit le prix Nobel en 1951. Le médecin allemand Eugen Haagen fut le collaborateur de Theiler en 1932, pour la mise au point de la culture du virus[47].
Il apporte en une semaine une protection immunitaire efficace chez 95 % des sujets vaccinés[48]. Certaines sources avancent une protection de 85 % à 95 %, et un délai de dix jours pour que la protection soit efficace[49].
Classiquement, la durée de protection était évaluée à dix ans, mais une seule dose vaccinale donnerait une protection durable au moins trente à trente-cinq ans, voire à vie[48].
Les effets secondaires sont assez courants : douleur au point d'injection, fièvre ou céphalées dans un peu moins d'un tiers des cas[50]. Les manifestations postvaccinales indésirables (MAPI) graves (maladie viscérotrope, maladie neurologique, réactions d’hypersensibilité) sont rares selon les estimations de l'OMS publiées en 2008[51]. De manière exceptionnelle (moins d'un cas pour cent mille vaccinations[52]) survient un effet « viscerotropique » avec des symptômes proches de ceux d'une fièvre jaune et pouvant aboutir au décès dans environ la moitié des cas. Un vaccin inactivé, et donc ne comportant pas théoriquement ce risque, est en cours de test[53].
Politiques vaccinales
La vaccination peut être rendue obligatoire par les pays concernés, pour les voyageurs entrant dans les pays où sévit la fièvre jaune, et ceux où la fièvre jaune risque de s'y propager. En effet, le RSI (Règlement Sanitaire International) autorise tout État se trouvant en zone de réceptivité à exiger de toute personne âgée de 1 an au moins pénétrant sur son territoire un certificat de vaccination international à jour.
Un pays peut demander la mise en quarantaine d'un voyageur venant d'un pays où le risque de transmission existe, s'il ne peut produire un certificat valable de vaccination, ou de contre-indication à la vaccination. La durée maximale de cette quarantaine est de 6 jours[54].
Les politiques de rappel vaccinal sont en cours de réévaluation, à la suite d'un amendement du RSI, adopté en mai 2014 par l'Assemblée mondiale de la santé. Cet amendement déclare que la durée de protection des vaccins de la fièvre jaune est étendue à la vie entière et que la durée de validité du certificat international devait être prolongée en conséquence. Cette modification est en principe applicable à l’ensemble des pays à partir de juin 2016[44].
En France, le Haut Conseil de la santé publique prend acte de cette décision de l'OMS, et recommande une seconde dose de vaccin (un seul rappel dix ans après la vaccination) dans des cas particuliers[44]. D'autres pays ont pris des positions analogues comme les États-Unis[55].
Déclaration obligatoire
En France, en Belgique, en Suisse[56], en Allemagne et au Québec[57], cette maladie est sur la liste des maladies infectieuses à déclaration obligatoire (MADO).
Notes et références
- ↑ T. Garske, M. D. Van Kerkhove, S. Yactayo, O. Ronveaux, R. F. Lewis, J. E. Staples, W. Perea, N. M. Ferguson; Yellow Fever Expert Committee, Yellow Fever in Africa: Estimating the burden of disease and impact of mass vaccination from outbreak and serological data. PLOS Med. 11, e1001638 (2014). doi:10.1371/journal.pmed.1001638
- ↑ C. I. Paules, A. S. Fauci, Yellow Fever - Once Again on the Radar Screen in the Americas. N. Engl. J. Med. 376, 1397–1399 (2017). doi:10.1056/NEJMp1702172
- 1 2 3 4 5 6 7 8 9 10 11 12 (en) T.P. Monath et M.S. Cetron, Yellow fever vaccine, Philadelphie, Saunders Elsevier, , 1725 p. (ISBN 978-1-4160-3611-1, lire en ligne), p. 959-961dans S. Plotkin, Vaccines, 5e edition.
- 1 2 T.P. Monath et C.S. Cetron 2008, op.cit, p. 976.
- 1 2 C. Chastel, Histoire des virus, de la variole au sida., Paris, Boubée, , 413 p. (ISBN 2-85004-068-1), p. 218
- 1 2 C. Chastel, Virus émergents, vers de nouvelles pandémies ?, Vuibert Adapt, (ISBN 978-2-7117-7198-1), p. 27-31
- 1 2 (en) Staples JE, Monath TP, Yellow fever: 100 years of discovery, JAMA, 2008;300:960-962
- ↑ C. Chastel 1992, op. cit, p.222.
- ↑ Tableau de Géricault
- ↑ Robert Delort, Les animaux ont une histoire, Éditions du Seuil, 1984.
- ↑ La fièvre jaune, ou Les malheurs et les désastres causés par cette effroyable maladie en Catalogne en Andalousie et autres provinces d'Espagne, monographie publiée à Paris par Tiger, probablement fin 1821.
- ↑ G. Lavier et G.J. Stefanopoulo, « Fièvre jaune, étude clinique », Encyclopédie médico-chirurgicale, Maladies infectieuses, no 8099, , p. 1-16
- ↑ B. Hillemand, « L'épidémie de fièvre jaune de Saint-Nazaire en 1861 », Histoire des Sciences Médicales, vol. XL, no 1, , p. 23-36 (lire en ligne)
- ↑ Voir : J. B. Labat : Voyage aux Isles -1720; Nicolas Pierre Gilbert : Histoire médicale de l'armée française à Saint Domingue, l'an 10 - 1803
- ↑ (en) Reed W, Carroll J, Agramonte A « The etiology of yellow fever: an additional note » JAMA 1901;36:431-440
- ↑ agent indétectable à l'époque, mais capable de traverser un filtre de porcelaine (retenant les bactéries), le filtrat provoquant la maladie.
- ↑ Claude Chastel 1994, op. cit., p. 223-224.
- ↑ Claude Chastel 1992, op. cit., p. 228-229.
- ↑ « Biographie Stockes »
- ↑ (en) Rice CM, Lenches EM, Eddy SR et al. « Nucleotide sequence of yellow fever virus: implications for flavivirus gene expression and evolution », Science, no 229, 1985, pp. 726-730
- 1 2 3 C. Chastel 1992, op. cit, p. 220-221.
- 1 2 3 4 5 T.P. Monath et M.S. Cetron, 2008, op. cit, p. 986-987.
- ↑ F. Rodhain, Précis d'entomologie médicale et vétérinaire, Paris, Maloine, , 458 p. (ISBN 2-224-01041-9), p. 146-148
- ↑ T.P. Monath et M.S. Cetron 2008, op. cit, p. 968.
- ↑ « Fièvre jaune - questions-réponses », sur Organisation mondiale de la Santé (consulté le )
- ↑ J-P. Leroy, « Vaccin contre la fièvre jaune : une protection à vie ? », La Revue du Praticien, , p. 1015-1017
- ↑ « Risque d’introduction de la fièvre jaune à Mayotte », voir Annexe, sur www.hcsp.fr (consulté le )
- 1 2 OMS, « Vaccins et vaccination contre la fièvre jaune », Relevé épidémiologique hebdomadaire, , p. 270-283 (lire en ligne)
- ↑ « Fièvre jaune : Une menace pour l'Afrique », Les Échos (Mali) 6 décembre 2006.
- ↑ Jean-Miche Bader, « La fièvre jaune menace désormais l’Asie », Le Figaro, (lire en ligne)
- 1 2 « Fièvre jaune », sur Organisation mondiale de la Santé (consulté le )
- 1 2 « fièvre jaune : épidémiologie 2015 »
- ↑ « Des progrès dans la lutte pour juguler l’épidémie de fièvre jaune, mais il faut maintenir la riposte », sur Organisation mondiale de la Santé (consulté le )
- 1 2 3 Science et avenir & AFP (2018) [SEAActu17h-20180824 L'itinéraire du virus de la fièvre jaune qui a sévi dès 2016 au Brésil a été reconstitué ], Science et Avenir & AFP, 24 aout 2018
- ↑ « Fièvre jaune: Des singes meurent, le Brésil panique », parismatch.com, (lire en ligne, consulté le )
- ↑ Kean S (2017), On the trail of yellow fever | Science | 18 aout 2017 |Vol. 357, Issue 6352, pp. 637-641 | DOI: 10.1126/science.357.6352.637 résumé
- ↑ N. R. Faria & al. (2018) Genomic and epidemiological monitoring of yellow fever virus transmission potential, Science, 23 aout |DOI: 10.1126/science.aat7115
- ↑ condensations du cytoplasme associées ou non à des condensations de la chromatine du noyau : phénomène de dégénérescence ou d'aptotose vers la mort cellulaire.
- ↑ (en) Ryan KJ; Ray CG (editors), Sherris Medical Microbiology, New York, McGraw Hill, , 4e éd. (ISBN 978-0-8385-8529-0, LCCN 2003054180)
- ↑ (en) Quaresma JA, Barros VL, Pagliari C, Fernandes ER, Guedes F, Takakura CF, Andrade HF Jr, Vasconcelos PF, Duarte MI, « Revisiting the liver in human yellow fever: virus-induced apoptosis in hepatocytes associated with TGF-beta, TNF-alpha and NK cells activity », Virology, vol. 345, no 1, , p. 22–30 (PMID 16278000, DOI 10.1016/j.virol.2005.09.058)
- ↑ (en) Monath TP, « Treatment of yellow fever », Antiviral Res., vol. 78, no 1, , p. 116–24 (PMID 18061688, DOI 10.1016/j.antiviral.2007.10.009)
- ↑ Jean-Charles Faget (1818-1884), médecin américain, originaire de la Louisiane.
- ↑ T.P. Monath et M.S. Cetron 2008, op. cit, p.983.
- 1 2 3 « Vaccination de rappel contre la fièvre jaune pour la Guyane. Nouvelles recommandations », sur www.hcsp.fr (consulté le )
- 1 2 3 T.P Monath et M.S. Cetron, 2008, op.cit, p.989-992
- ↑ Theiler M, Smith HH, The use of yellow fever virus modified by in vitro cultivation for human immunization, J Exp Med, 1937;65:787–800
- ↑ (en) Erling Norrby, « Yellow fever and Max Theiler: the only Nobel Prize for a virus vaccine », The Journal of Experimental Medicine, vol. 204, , p. 2779–2784 (ISSN 0022-1007 et 1540-9538, PMID 18039952, PMCID 2118520, DOI 10.1084/jem.20072290, lire en ligne, consulté le )
- 1 2 (fr) Fièvre jaune, Aide-mémoire sur le site de l'OMS en français
- ↑ (fr) Fièvre jaune - Aide-mémoire sur http://www.invs.sante.fr, le site de l'Institut de veille sanitaire. Source : Numéro thématique : Santé des voyageurs 2007. Bull Epidemiol Hebd 2007; 25-26.
- ↑ Monath TP, Nichols R, Archambault WT et al. Comparative safety and immunogenicity of two yellow fever 17D vaccines (ARILVAX and YF-VAX) in a phase III multicenter, double-blind clinical trial, Am J Trop Med Hyg, 2002;66:533–541
- ↑ http://whqlibdoc.who.int/hq/2010/WHO_HSE_GAR_ERI_2010.2_fre.pdf
- ↑ Lindsey NP, Schroeder BA, Miller ER et al. Adverse event reports following yellow fever vaccination, Vaccine, 2008;26:6077–6082
- ↑ Monath TP, Fowler E, Johnson CT et Als. An inactivated cell-culture vaccine against yellow fever, N Engl J Med, 2011;364:1326-1333
- ↑ OMS, « Fièvre jaune en Afrique et en Amérique du Sud », Relevé épidémiologique hebdomadaire, , p. 69 (lire en ligne)
- ↑ (en) Mark Gershman, Betsy Schroeder, J. Erin Staples. Travelers' Health - Yellow Book - Chapter 2 - Yellow Fever sur http://wwwnc.cdc.gov.
- ↑ admin.ch site de l'administration fédérale
- ↑ Liste des maladies, infections et intoxication à déclaration obligatoire (MSSS)
Bibliographie
Voir aussi
Liens externes
- Ressources relatives à la santé :
- Orphanet
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) « Présentation des travaux sur la fièvre jaune, Prix Nobel de médecine 1951 », sur nobelprize.org.
- (en) Yellow fever - Ressources sur la fièvre jaune sur https://www.cdc.gov, le site internet des CDC (Centres pour le contrôle et la prévention des maladies).
Articles connexes
- Stubbins Ffirth
- André Mazet