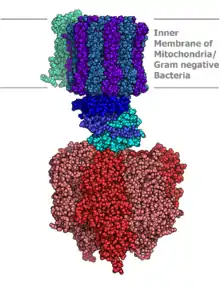
En biologie moléculaire, la phosphorylation oxydative est le processus permettant la phosphorylation de l'ADP en ATP grâce à l'énergie libérée par l'oxydation de donneurs d'électrons par la chaîne respiratoire. Ce processus est commun à presque tous les organismes aérobies malgré le fait que ces derniers se nourrissent d'une grande variété de nutriments différents qui sont oxydés à travers des voies métaboliques très diverses. Il permet aux cellules de régénérer leurs coenzymes réduites par les réactions du catabolisme telles que le cycle de Krebs et la β-oxydation des acides gras, et permet de récupérer sous forme d'ATP l'énergie libérée par la respiration cellulaire. Son rendement énergétique est sensiblement meilleur que celui de la glycolyse ou de la fermentation anaérobie.
Au cours du processus de phosphorylation oxydative, des électrons sont transférés de molécules réductrices à des oxydants le long d'une chaîne de transport d'électrons réalisant une cascade de réactions d'oxydoréduction successives qui libèrent progressivement l'énergie des électrons à haut potentiel de transfert des réducteurs oxydés. Cette énergie est utilisée par des pompes à protons pour générer un gradient électrochimique à travers une membrane biologique : membrane plasmique chez les procaryotes, membrane mitochondriale interne chez les eucaryotes. Les protons s'accumulent d'un côté de la membrane, et leur reflux vers l'autre côté pour équilibrer le gradient de concentration entraîne un rotor moléculaire dans l'ATP synthase qui fournit l'énergie nécessaire à la conversion de l'ADP en ATP.
La phosphorylation oxydative est une fonction vitale du métabolisme. Elle génère cependant des dérivés réactifs de l'oxygène tels que l'anion superoxyde O2•− ou le peroxyde d'hydrogène H2O2 lesquels produisent à leur tour des radicaux libres nocifs.
Introduction au couplage énergétique par chimiosmose
La phosphorylation oxydative fait intervenir des réactions qui libèrent de l'énergie pour réaliser des réactions qui consomment de l'énergie : on dit que ces deux groupes de réactions sont couplées. Cela signifie que les unes ne peuvent se produire sans les autres. La circulation des électrons à travers une chaîne de transport d'électrons — de la chaîne respiratoire ou de la photosynthèse — est un processus exergonique, c'est-à-dire qu'elle libère de l'énergie ; la biosynthèse de l'ATP par l'ATP synthase, quant à elle, est une réaction endergonique, c'est-à-dire qu'elle a besoin d'un apport d'énergie pour se produire.
Aussi bien la chaîne de transport d'électrons que la biosynthèse de l'ATP se déroulent dans une membrane biologique, l'énergie libérée par la première étant transmise à la seconde par un flux de protons à travers cette membrane. C'est ce couplage qu'on appelle chimiosmose[1]. Le principe est semblable à celui d'un circuit électrique avec un courant de protons traversant la membrane de sa face chargée négativement vers sa face chargée positivement sous l'effet d'enzymes de pompage alimentées par l'énergie libérée par la chaîne de transport d'électrons. L'accumulation des protons du côté chargé positivement de la membrane crée un gradient électrochimique à travers cette membrane. Ce gradient électrochimique correspond à la force proton-motrice de la phosphorylation oxydative ; il est formé à la fois d'une différence de concentration en protons entre les deux faces de la membrane (on parle de gradient de concentration en ions H+, ou ΔpH), et d'une différence de potentiel électrique entre ces mêmes faces[2].
Les ATP synthases ferment le circuit en permettant aux protons de circuler le long du gradient électrochimique et donc de traverser la membrane du côté chargé positivement vers le côté chargé négativement[3]. Cette force proton-motrice actionne certaines sous-unités de l'ATP synthase qui fonctionnent comme un rotor permettant la phosphorylation de l'ADP en ATP.
Les deux composantes de la force proton-motrice sont thermodynamiquement équivalentes : dans les mitochondries, la plus grande partie de l'énergie provient de la différence de potentiel électrique à travers la membrane, tandis que les chloroplastes fonctionnent essentiellement à partir de la différence de pH tout en requérant un faible potentiel de membrane pour la cinétique de la biosynthèse de l'ATP. Chez la fusobactérie P. modestum (en) par exemple, ce dernier actionne la rotation des sous-unités a et c du rotor FO de l'ATP synthase[2].
La quantité d'énergie libérée par la phosphorylation oxydative est comparativement bien plus élevée que celle libérée par la fermentation anaérobie. Une molécule de glucose ne permet de produire que deux molécules d'ATP par la glycolyse, mais de 30 à 36 molécules d'ATP par oxydation complète, à travers la chaîne respiratoire, des coenzymes réduites issues du cycle de Krebs[4] tandis que chaque cycle de β-oxydation d'un acide gras libère 14 molécules d'ATP. Ces valeurs sont cependant théoriques : en pratique, il existe des pertes dues à la dissipation du gradient électrochimique par diffusion passive des protons à travers la membrane, ce qui abaisse le rendement effectif de la phosphorylation oxydative[5].
Chaînes respiratoires
Chez les eucaryotes
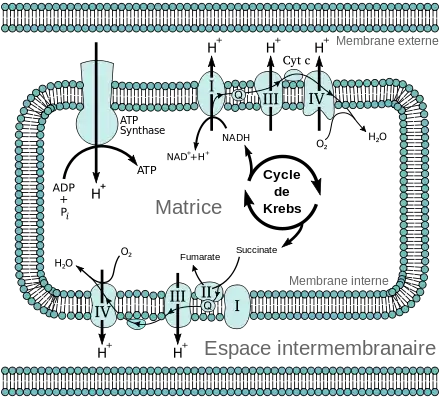
Un grand nombre de processus biochimiques produisent des coenzymes réduites, essentiellement du NADH : c'est le cas de la glycolyse, du cycle de Krebs et de la β-oxydation. Cette coenzyme porte deux électrons à haut potentiel de transfert, c'est-à-dire des électrons susceptibles de libérer une quantité significative d'énergie par oxydation. Cette énergie n'est cependant pas libérée en une seule fois mais en une série d'étapes mettant en jeu à chaque fois de petites quantités d'énergie lorsque les électrons passent d'une coenzyme à une autre, le potentiel standard croissant au fur et à mesure que les électrons avancent dans la chaîne. Cette suite d'enzymes, formée des complexes I à IV, constitue la chaîne respiratoire. Elle se trouve dans la membrane mitochondriale interne. Le succinate est également oxydé par la chaîne de transport d'électrons mais entre dans cette voie métabolique d'une manière différente.
Chez les eucaryotes, les enzymes de la chaîne respiratoire utilisent l'énergie libérée par l'oxydation du NADH pour pomper des protons à travers la membrane mitochondriale interne. Les protons s'accumulent ainsi dans l'espace intermembranaire mitochondrial et génèrent un gradient électrochimique à travers la membrane. L'énergie stockée par ce potentiel est ensuite utilisée par l'ATP synthase pour phosphoryler l'ADP en ATP. C'est dans les mitochondries des eucaryotes que la phosphorylation oxydative est la mieux comprise. Les mitochondries sont présentes chez pratiquement tous les eucaryotes, à l'exception de protozoaires anaérobies tels que Trichomonas vaginalis qui réduisent les protons en hydrogène dans un organite appelé hydrogénosome[6].
| Complexe | Enzyme respiratoire | Couple rédox | Potentiel standard |
|---|---|---|---|
| I | NADH déshydrogénase | NAD+ / NADH | −0,32 V |
| II | Succinate déshydrogénase | FMN ou FAD / FMNH2 ou FADH2 | −0,20 V |
| III | Cytochrome c réductase | Coenzyme Q10 ox / Q10H2 | +0,06 V |
| Cytochrome b ox / Cytochrome b réd | +0,12 V | ||
| IV | Cytochrome c oxydase | Cytochrome c ox / Cytochrome c réd | +0,22 V |
| Cytochrome a ox / Cytochrome a réd | +0,29 V | ||
| O2 / HO− | +0,82 V | ||
| Conditions : pH = 7 | |||
Chez les procaryotes
Contrairement aux eucaryotes, dont les chaînes respiratoires sont très semblables, les procaryotes — bactéries et archées — possèdent une grande variété d'enzymes de transfert d'électrons, qui utilisent également une tout aussi grande variété de substrats[8]. En revanche, le transport d'électrons des procaryotes a en commun avec celui des eucaryotes d'utiliser l'énergie libérée au cours de l'oxydation des substrats pour pomper des ions à travers une membrane et produire un gradient électrochimique à travers cette membrane. Chez les bactéries, la phosphorylation oxydative d’Escherichia coli est la mieux comprise, tandis que celle des archées demeure mal connue[9].
La principale différence entre la phosphorylation oxydative des procaryotes et celle des eucaryotes est que les bactéries et les archées utilisent des substances diversifiées comme donneurs et accepteurs d'électrons. Ceci permet aux procaryotes de croître dans des conditions environnementales très diverses[10]. Chez Escherichia coli, par exemple, la phosphorylation oxydative peut être le fait d'un grand nombre de couples rédox, dont le tableau ci-dessous donne une liste. Le potentiel standard d'une substance chimique mesure l'énergie libérée lorsque cette substance est oxydée ou réduite, les réducteurs ayant un potentiel négatif tandis que les oxydants ont un potentiel positif.
| Enzyme respiratoire | Couple rédox | Potentiel standard |
|---|---|---|
| Formiate déshydrogénase | HOCOO− / HCOO− | −0,43 V |
| Hydrogénase | H+ / H2 | −0,42 V |
| NADH déshydrogénase | NAD+ / NADH | −0,32 V |
| Glycérol-3-phosphate déshydrogénase | DHAP / Gly-3-P | −0,19 V |
| Pyruvate oxydase | Acétate + CO2 / Pyruvate | ? |
| Lactate déshydrogénase | Pyruvate / Lactate | −0,19 V |
| D-Aminoacide déshydrogénase | α-Cétoacide + NH3 / Acide aminé D | ? |
| Glucose déshydrogénase | Gluconate / Glucose | −0,14 V |
| Succinate déshydrogénase Fumarate réductase (sens inverse) |
Fumarate / Succinate | +0,03 V |
| Triméthylamine N-oxyde réductase | TMAO / TMA | +0,13 V |
| DMSO réductase | (CH3)2S=O / (CH3)2S | +0,16 V |
| Nitrite réductase | NO2− / NH3 | +0,36 V |
| Nitrate réductase | NO3− / NO2− | +0,42 V |
| Ubiquinol oxydase | O2 / H2O | +0,82 V |
ATP synthase
L'ATP synthase, parfois appelée complexe V, est l'enzyme qui clôt la phosphorylation oxydative. Elle est présente chez tous les êtres vivants et fonctionne de la même façon que ce soit chez les eucaryotes ou chez les procaryotes[12]. Elle utilise l'énergie potentielle stockée sous forme de gradient de concentration de protons à travers une membrane pour actionner la phosphorylation de l'ADP en ATP. Le nombre estimé de protons requis par molécule d'ATP synthétisée varie selon les sources entre trois et quatre[13],[14], certaines expériences laissant penser que les cellules sont susceptibles de faire varier ce ratio pour s'adapter aux variations des conditions environnementales dans lesquelles elles évoluent.
Cette réaction de phosphorylation est un équilibre susceptible d'être déplacé en faisant varier la force proton-motrice. En l'absence de cette dernière, la réaction se déroule de droite à gauche et consiste à hydrolyser de l'ATP pour pomper des protons hors de la matrice mitochondriale à travers la membrane mitochondriale interne. Cependant, lorsque la force proton-motrice est suffisante, la réaction est forcée dans l'autre sens, de gauche à droite, et permet aux protons de franchir la membrane en direction de la matrice mitochondriale tout en actionnant l'ATP synthase pour convertir l'ADP en ATP[12]. De fait, la V-ATPase, ou ATPase vacuolaire, catalyse l'hydrolyse de l'ATP pour acidifier des compartiments cellulaires en y injectant des protons[15].
L'ATP synthase est un gros complexe protéique en forme de champignon. Chez les mammifères, ce complexe contient 16 sous-unités pour une masse totale d'environ 600 kDa[16]. La région incluse dans la membrane est appelée FO — le « O » fait référence à l'oligomycine ; il ne s'agit pas du chiffre 0 — et renferme un anneau de sous-unités c ainsi que le canal à protons. La tige et la tête sphéroïdale forment la région F1 et sont le lieu de production de l'ATP. La tête sphéroïdale à l'extrémité de la région F1 est formée de six protéines de deux types différents — trois sous-unités α et trois sous-unités β — tandis que la tige est constituée d'une seule protéine, la sous-unité γ, qui se prolonge partiellement dans la tête[17]. Les sous-unités α et β se lient aux nucléotides mais seules les sous-unités β catalysent la biosynthèse de l'ATP.
Lorsque les protons traversent la membrane en empruntant le canal de la région FO, ils y actionnent un rotor moléculaire sous l'effet de la force proton-motrice[18]. La mise en rotation du rotor est vraisemblablement provoquée par des changements dans l'état d'ionisation de résidus d'acides aminés dans l'anneau de sous-unités c, ce qui provoquerait des interactions électrostatiques mettant cet anneau en mouvement[19]. La rotation de cet anneau est transmise à la tige γ jusqu'à l'intérieur de la tête α3β3. Cette dernière, en revanche, demeure fixe par rapport à la membrane en raison de son bras latéral et fonctionne comme un stator. L'énergie chimique nécessaire à la phosphorylation de l'ADP en ATP provient donc de l'énergie mécanique issue de la force proton-motrice et transmise par la rotation de la sous-unité γ jusqu'au complexe α3β3 ; dans ce dernier se déroulent des changements conformationnels cycliques au cours desquels l'ADP est converti en ATP[20].

Ce mode de biosynthèse de l'ATP, connu à la fin du XXe siècle comme « mécanisme par changement de liaisons » (binding change mechanism en anglais), fait intervenir de façon cyclique trois états distincts du site actif de la sous-unité β[21]. Dans l’état O (open), l'ADP et le phosphate entrent dans le site actif, qui présente alors une assez faible affinité pour ces substrats. La protéine se referme alors autour d'elles et les emprisonne en formant avec ces molécules des liaisons lâches : c'est l’état L (loose). Enfin, le site actif se referme encore davantage et passe à l’état T (tight), à forte affinité pour ces substrats et à forte activité enzymatique, qui catalyse la condensation de l'ADP et du phosphate pour former de l'ATP et de l'eau. Le site actif repasse alors à l’état O et libère l'ATP formé, en attendant que de nouvelles molécules d'ADP et de phosphate viennent y entrer.
Chez certaines bactéries, l'énergie nécessaire à la phosphorylation de l'ADP en ATP est issue non pas d'un flux transmembranaire de protons, mais d'un flux transmembranaire d'ions sodium Na+[22],[23]. Les archées telles que Methanococcus contiennent également la synthase A1A0, forme d'ATP synthase qui contient des protéines supplémentaires dont la séquence peptidique ne présente qu'une faible similitude avec celle des sous-unités d'ATP synthases d'eucaryotes et de bactéries. Il est possible que, chez certaines espèces, la forme A1A0 soit une ATP synthase spécialisée pour les ions sodium[24], mais il n'est pas certain que ce soit toujours le cas[23].
Formes réactives de l'oxygène
L'oxygène moléculaire O2 est un oxydant fort, ce qui en fait un excellent accepteur final d'électrons. Cependant, la réduction de l'oxygène fait intervenir des intermédiaires potentiellement dangereux[25]. Même si le transfert de quatre protons et quatre électrons à une molécule d'O2 produit une molécule d'eau H2O, laquelle est sans danger et même bénéfique à toutes les formes de vies connues, le transfert d'un ou deux électrons produit respectivement l'ion superoxyde O2•− et l'ion peroxyde O22−, qui sont très réactifs et par conséquent dangereux pour la plupart des êtres vivants. Ces formes réactives de l'oxygène, ainsi que leurs dérivés tels que le radical hydroxyle HO•, sont très nocifs pour les cellules car ils oxydent les protéines et provoquent des mutations génétiques en altérant l'ADN. L'accumulation de telles dégradations dans les cellules pourrait contribuer à l'apparition de maladies et serait l'une des causes de la sénescence[26],[27] (vieillissement).
Inhibiteurs
Plusieurs médicaments et toxines bien connus sont des inhibiteurs de la phosphorylation oxydative. Bien que chacune de toxines n'inhibe qu'une seule enzyme de la chaîne respiratoire, l'inhibition d'une étape quelconque de cette chaîne bloque l'ensemble du processus. Par exemple, lorsque l'ATP synthase est inhibée par l'oligomycine, les protons ne peuvent plus regagner la matrice mitochondriale à travers la membrane interne[28]. Les pompes à protons deviennent ainsi incapables d'expulser des protons hors de la matrice lorsque les électrons circulent à travers la chaîne respiratoire car le gradient de concentration en protons devient trop élevé à travers la membrane. Le NADH n'est plus oxydé en NAD+ et le cycle de Krebs cesse à son tour de fonctionner faute d'une concentration suffisante en NAD+.
| Cible | Composé | Utilisation | Mode d'action sur la phosphorylation oxydative |
|---|---|---|---|
| Complexe I | Roténone | Pesticide | Bloque le transfert d'électrons du complexe I vers la coenzyme Q10 en bloquant le site de liaions à l'ubiquinone[29]. |
| Complexe II | Malonate Oxaloacétate |
Poisons | Ce sont des inhibiteurs compétitifs de la succinate déshydrogénase (complexe II)[30]. |
| Complexe III | Antimycine A | Piscicide | Elle se lie au site Qi de la coenzyme Q-cytochrome c réductase, ce qui bloque l'oxydation de l'ubiquinol. |
| Complexe IV | CN− CO N3− H2S |
Poisons | Inhibent la chaîne respiratoire en se liant plus fortement que l'oxygène O2 au centre Fe–Cu de la cytochrome c oxydase, ce qui empêche la réduction de l'oxygène[31]. |
| Complexe V | Oligomycine | Antibiotique | Inhibe l'ATP synthase en bloquant le flux de protons à travers la région FO[28]. |
| Membrane interne | Carbonylcyanure m-chlorophénylhydrazone 2,4-Dinitrophénol |
Poisons, amaigrissement[32] | Il s'agit d'ionophores qui brisent le gradient de concentration en laissant les protons diffuser librement à la travers la membrane mitochondriale interne[33]. |
Tous les inhibiteurs de la phosphorylation oxydative ne sont cependant pas des toxines. Dans le tissu adipeux brun, des protéines découplantes permettent de réguler la diffusion des protons à travers la membrane mitochondriale interne, ce qui a pour effet de découpler la chaîne respiratoire de la production d'ATP[34]. Cette respiration découplée a pour effet de produire de la chaleur au lieu de l'ATP, ce qui joue un rôle vital dans la thermorégulation notamment des animaux en hibernation, bien que ces protéines puissent également avoir une fonction plus générale de réponse cellulaire au stress[35].
Notes et références
- ↑ (en) Peter Mitchell et Jennifer Moyle, « Chemiosmotic Hypothesis of Oxidative Phosphorylation », Nature, vol. 213, no 5072, , p. 137-139 (PMID 4291593, DOI 10.1038/213137a0, Bibcode 1967Natur.213..137M, lire en ligne)
- 1 2 (en) P. Dimroth, G. Kaim et U. Matthey, « Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases », Journal of Experimental Biology, vol. 203, no Pt 1, , p. 51-59 (PMID 10600673, lire en ligne)
- ↑ (en) Brian E. Schultz et Sunney I. Chan, « Structures and Proton-Pumping Strategies of Mitochondrial Respiratory Enzymes », Annual Review of Biophysics and Biomolecular Structure, vol. 30, , p. 23-65 (PMID 11340051, DOI 10.1146/annurev.biophys.30.1.23, lire en ligne)
- ↑ (en) P.R. Rich, « The molecular machinery of Keilin's respiratory chain », Biochemical Society Transactions, vol. 31, no 6, , p. 1095-1105 (PMID 14641005, DOI 10.1042/bst0311095, lire en ligne)
- ↑ (en) R. K. Porter et M. D. Brand, « Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes », The Biochemical Journal, vol. 310, no Pt 2, , p. 379-382 (PMID 7654171, PMCID 1135905)
- ↑ (en) Brigitte Boxma, Rob M. de Graaf, Georg W. M. van der Staay, Theo A. van Alen, Guenola Ricard, Toni Gabaldón, Angela H. A. M. van Hoek, Seung Yeo Moon-van der Staay, Werner J. H. Koopman, Jaap J. van Hellemond, Aloysius G. M. Tielens, Thorsten Friedrich, Marten Veenhuis, Martijn A. Huynen et Johannes H. P. Hackstein, « An anaerobic mitochondrion that produces hydrogen », Nature, vol. 434, no 7029, , p. 74-79 (PMID 15744302, DOI 10.1038/nature03343, Bibcode 2005Natur.434...74B, lire en ligne)
- ↑ Anders Overgaard Pedersen et Henning Nielsen, « Medical CHEMISTRY Compendium », Aarhus University, 2008.
- ↑ (en) Kenneth H. Nealson, « Post-Viking Microbiology: New Approaches, New Data, New Insights », Origins of life and evolution of the biosphere, vol. 29, no 1, , p. 73-93 (PMID 11536899, DOI 10.1023/A:1006515817767, lire en ligne)
- ↑ (en) Günter Schäfer, Martin Engelhard et Volker Müller, « Bioenergetics of the Archaea », Microbiology and Molecular Biology Reviews, vol. 63, no 3, , p. 570-620 (PMID 10477309, PMCID 103747, lire en ligne)
- ↑ (en) W. John Ingledew et Robert K. Poole, « The respiratory chains of Escherichia coli », Microbiology and Molecular Biology Reviews, vol. 48, no 3, , p. 222-271 (PMID 6387427, PMCID 373010, lire en ligne)
- ↑ (en) G. Unden et J. Bongaerts, « Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors », Biochimica et Biophysica Acta (BBA) - Bioenergetics, vol. 1320, no 3, , p. 217-234 (PMID 9230919, DOI 10.1016/S0005-2728(97)00034-0, lire en ligne)
- 1 2 (en) Paul D. Boyer, « The ATP synthase — a splendid molecular machine », Annual Review of Biochemistry, vol. 66, , p. 717-749 (PMID 9242922, DOI 10.1146/annurev.biochem.66.1.717, lire en ligne)
- ↑ (en) Hendrika S. Van Walraven, Heinrich Strotmann, Oliver Schwarz et Bernd Rumberg, « The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four », FEBS Letters, vol. 379, no 3, , p. 309-313 (PMID 8603713, DOI 10.1016/0014-5793(95)01536-1, lire en ligne)
- ↑ (en) Masasuke Yoshida, Eiro Muneyuki et Toru Hisabori, « ATP synthase — a marvellous rotary engine of the cell », Nature Reviews Molecular Cell Biology, vol. 2, no 9, , p. 669-677 (PMID 11533724, DOI 10.1038/35089509, lire en ligne)
- ↑ (en) N. Nelson, N. Perzov, A. Cohen, K. Hagai, V. Padler et H. Nelson, « The cellular biology of proton-motive force generation by V-ATPases », Journal of Experimental Biology, vol. 203, no Pt 1, , p. 89-95 (PMID 10600677, lire en ligne)
- ↑ (en) John L. Rubinstein, John E. Walker et Richard Henderson, « Structure of the mitochondrial ATP synthase by electron cryomicroscopy », The EMBO Journal, vol. 22, no 23, , p. 6182-6192 (PMID 14633978, PMCID 291849, DOI 10.1093/emboj/cdg608, lire en ligne)
- ↑ (en) A. G. W. Leslie et J. E. Walker, « Structural model of F1–ATPase and the implications for rotary catalysis », Philosophical Transactions B, vol. 355, no 1396, , p. 465-471 (PMID 10836500, PMCID 1692760, DOI 10.1098/rstb.2000.0588, lire en ligne)
- ↑ (en) Hiroyuki Noji et Masasuke Yoshida, « The Rotary Machine in the Cell, ATP Synthase », Journal of Biological Chemistry, vol. 276, no 3, , p. 1665-1668 (PMID 11080505, DOI 10.1074/jbc.R000021200, lire en ligne)
- ↑ (en) Roderick A Capaldi et Robert Aggeler, « Mechanism of the F1F0-type ATP synthase, a biological rotary motor », Trends in Biochemical Science, vol. 27, no 3, , p. 154-160 (PMID 11893513, DOI 10.1016/S0968-0004(01)02051-5, lire en ligne)
- ↑ (en) Peter Dimroth, Christoph von Ballmoos et T Meier, « Catalytic and mechanical cycles in F‐ATP synthases », EMBO Reports, vol. 7, no 3, , p. 276-282 (PMID 16607397, PMCID 1456893, DOI 10.1038/sj.embor.7400646, lire en ligne)
- ↑ (en) Michael J. Gresser, Jill A. Myers et Paul D. Boyer, « Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model », Journal of Biological Chemistry, vol. 257, no 20, , p. 12030-12038 (PMID 6214554, lire en ligne)
- ↑ (en) P. Dimroth, « Bacterial sodium ion-coupled energetics », Antonie Van Leeuwenhoek, vol. 65, no 4, , p. 381-395 (PMID 7832594, DOI 10.1007/BF00872221, lire en ligne)
- 1 2 (en) B. Becher et V. Müller, « ΔμNa+ drives the synthesis of ATP via an ΔμNa+-translocating F1F0-ATP synthase in membrane vesicles of the archaeon Methanosarcina mazei Gö1 », Journal of bacteriology, vol. 176, no 9, , p. 2543-2550 (PMID 8169202, PMCID 205391, lire en ligne)
- ↑ (en) Volker Müller, « An exceptional variability in the motor of archael A1A0 ATPases: from multimeric to monomeric rotors comprising 6-13 ion binding sites », Journal of Bioenergetics and Biomembranes, vol. 36, no 1, , p. 115-125 (PMID 15168615, DOI 10.1023/B:JOBB.0000019603.68282.04, lire en ligne)
- ↑ (en) Kelvin J.A. Davies, « Oxidative stress: the paradox of aerobic life », Biochemical Society Symposium, vol. 61, , p. 1-31 (PMID 8660387, DOI 10.1042/bss0610001, lire en ligne)
- ↑ (en) Suresh I.S. Rattana, « Theories of biological aging: Genes, proteins, and free radicals », Free Radical Research, vol. 40, no 12, , p. 1230-1238 (PMID 17090411, DOI 10.1080/10715760600911303, lire en ligne)
- ↑ (en) Marian Valko, Dieter Leibfritz, Jan Moncol, Mark T.D. Cronin, Milan Mazur et Joshua Telser, « Free radicals and antioxidants in normal physiological functions and human disease », The International Journal of Biochemistry & Cell Biology, vol. 39, no 1, , p. 44-84 (PMID 16978905, DOI 10.1016/j.biocel.2006.07.001, lire en ligne)
- 1 2 (en) Saroj Joshi et Yougou Huang, « ATP synthase complex from bovine heart mitochondria: The oligomycin sensitivity conferring protein is essential for dicyclohexyl carbodiimide-sensitive ATPase », Biochimica et Biophysica Acta (BBA) - Biomembranes, vol. 1067, no 2, , p. 255-258 (PMID 1831660, DOI 10.1016/0005-2736(91)90051-9, lire en ligne)
- ↑ (en) Adrian J. Lambert et Martin D. Brand, « Inhibitors of the quinone-binding site allow rapid superoxide production from mitochondrial NADH:ubiquinone oxidoreductase (complex I) », Journal of Biological Chemistry, vol. 279, no 38, , p. 39414-39420 (PMID 15262965, DOI 10.1074/jbc.M406576200, lire en ligne)
- ↑ (en) D. V. Dervartanian et C. Veeger, « Studies on succinate dehydrogenase: I. Spectral properties of the purified enzyme and formation of enzyme-competitive inhibitor complexes », Biochimica et Biophysica Acta (BBA) - Specialized Section on Enzymological Subjects, vol. 92, no 2, , p. 233-247 (PMID 14249115, DOI 10.1016/0926-6569(64)90182-8, lire en ligne)
- ↑ (en) Motonari Tsubaki et Shinya Yoshikawa, « Fourier-transform infrared study of cyanide binding to the Fea3-CuB binuclear site of bovine heart cytochrome c oxidase: implication of the redox-linked conformational change at the binuclear site », Biochemistry, vol. 32, no 1, , p. 164-173 (PMID 8380331, DOI 10.1021/bi00052a022, lire en ligne)
- ↑ Le DNP a été largement prescrit contre l'obésité dans les années 1930 mais a par la suite été abandonné en raison de ses effets secondaires dangereux. Son utilisation illégale se poursuit cependant de nos jours.
- ↑ (en) Peter G. Heytler, « Uncouplers of oxidative phosphorylation », Methods in Enzymology, vol. 55, , p. 462-472 (PMID 156853, DOI 10.1016/0076-6879(79)55060-5, lire en ligne)
- ↑ (en) Daniel Ricquier et Frédéric Bouillaud, « The uncoupling protein homologues: UCP1, UCP2, UCP3, StUCP and AtUCP », Biochemical Journal, vol. 345, no Pt é, , p. 161-179 (PMID 10620491, PMCID 1220743, DOI 10.1042/bj3450161, lire en ligne)
- ↑ (en) Jiří Borecký et Aníbal E. Vercesi, « Plant uncoupling mitochondrial protein and alternative oxidase: energy metabolism and stress », Bioscience Reports, vol. 3, no 4, , p. 271-286 (PMID 16283557, DOI 10.1007/s10540-005-2889-2, lire en ligne)