| Thiamine | |
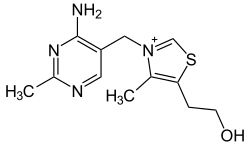  Structure de la thiamine |
|
| Identification | |
|---|---|
| Nom UICPA | 3-[3-[(4-amino- 2-methyl- pyrimidin- 5-yl) methyl]- 4-methyl- thiazol- 5-yl] ethanol |
| Synonymes |
vitamine B1, aneurine |
| No CAS | |
| No CE | 200-425-3 |
| Code ATC | A11 |
| DrugBank | DB00152 |
| PubChem | 6042 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C12H17N4OS |
| Masse molaire[1] | 265,355 ± 0,017 g/mol C 54,32 %, H 6,46 %, N 21,11 %, O 6,03 %, S 12,08 %, |
| Propriétés physiques | |
| T° fusion | 248 °C (décomposition)[2] |
| Solubilité | 1 g·mL-1 (eau); 1 g·100 mL-1 (alcool) ; |
| Écotoxicologie | |
| DL50 | 301 mg·kg-1 (souris, s.c.)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
La thiamine ou vitamine B1 (ou encore aneurine) est un précurseur métabolique de la thiamine pyrophosphate (TPP), une coenzyme essentielle à certaines décarboxylases. Chez les animaux, la thiamine est une vitamine hydrosoluble de la famille des vitamines B qu'ils doivent trouver dans leur alimentation. Elle est en revanche synthétisée par les bactéries, les plantes et les champignons. Elle est indispensable à la transformation des glucides en énergie par le cycle de Krebs et est nécessaire au bon fonctionnement du système nerveux et des muscles. Elle est en effet indispensable à la transformation du pyruvate produit par la glycolyse et toxique pour le système nerveux.
Chez l'être humain, une carence alimentaire en vitamine B1 cause le béribéri et peut aussi causer une encéphalopathie de Gayet-Wernicke.
Découverte par le Japonais Umetarō Suzuki qui cherchait à soigner cette maladie et la nomma acide abérique[4], c'est la première vitamine à avoir été isolée par Kazimierz Funk[5] en 1912. Sa formule chimique a été établie en 1931 par Robert R. Williams et Adolf Otto Reinhold Windaus, et sa synthèse réalisée par Hans Andersag (en) en 1936.
La vitamine B1 est citée comme pouvant empêcher les piqûres de moustiques, mais cela n'a pas été établi scientifiquement, au contraire[6].
Besoins en vitamine B1
Chez l'être humain, les besoins estimés[7] sont de 1,3 mg à 1,5 mg par jour. Chez l'adulte en bonne santé, l'absorption digestive est de 4,5 % de la dose ingérée, et baisse à 1,5 % en cas d'alcoolo-dépendance.
Sources
| Aliment | Teneur (mg/100 g) |
|---|---|
| Graine de tournesol séchée | 2,2964[8] |
| Germe de blé | 2,05[9] |
| Levure de bière sèche | 1,82[9] |
| Graines de soja | 1,3[9] |
| Levure de boulanger (à ne pas confondre avec la levure chimique) | 1 - 2 |
| Œufs de poisson | 1 - 1,2 |
| Noix de macadamia | 1,195[8] |
| Salami sec | 0,93[8] |
| Graine de pavot | 0,849[8] |
| Pistache | 0,84[8] |
| Bacon cru | 0,751[8] |
| Chipolata | 0,741[8] |
| Jambon | 0,741[8] |
| haricots secs et petits pois | 0,68[9] |
| Noix de pécan | 0,66[8] |
| Paprika | 0,645[8] |
| Chorizo | 0,63 [8] |
| Graine de cumin | 0,628[8] |
| Noix du Brésil | 0,617[8] |
| Porc | 0,6 - 0,95[9] |
| Petit lait séché | 0,5[9] |
| Noix, noisettes | 0,5 |
| Lentilles sèches | 0,43 |
| Rognons | 0,37 |
| Riz complet | 0,3[9] |
| Foie de bœuf | 0,3[9] |
| Châtaignes | 0,2 - 0,3 |
| Amandes, cacahuètes | 0,2 - 0,3 |
| Pain complet | 0,25 |
| Huîtres | 0,25 |
| Poisson | 0,05 - 0,09[9] |
| Asperge | 0,143 |
| Pomme de terre | 0,17[9] |
| Œufs | 0,07[9] |
| Végétaux (fruits, feuilles, tiges, racines) | 0,06 - 0,07[9] |
| Chou-fleur | 0,057 |
| Chou frisé | 0,053 |
| Lait entier | 0,03 - 0,07[9] |
| Riz blanc | 0,05[9] |
Mode d'action de la thiamine
Généralités
La thiamine pyrophosphate, comme coenzyme[10], est partie intégrante du site actif de l'enzyme qui l'utilise. La réaction globale peut s'écrire de la façon suivante :

Comment agit la thiamine ? La liaison carbonyle (oxo) est électriquement déséquilibrée, l'oxygène attirant les électrons. Ces carbones ont donc tendance à être positifs.
La thiamine va stabiliser une forme où le carbone qui va perdre le groupe R2 devient négatif (carbanion voir thiamine paragraphe Chimie) : il pourra y avoir alors une réaction entre le carbone + du carbonyle et le carbone - stabilisé par la thiamine. Le schéma réactionnel peut être le suivant :
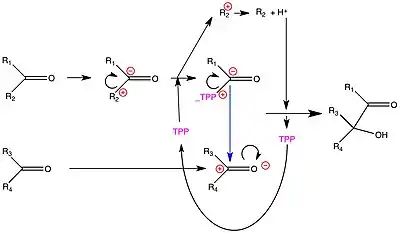

Le mécanisme précis est bien décrit de la façon suivante (source Wikipedia in english):
Dans plusieurs réactions, y compris celle de la pyruvate déshydrogénase, de l'alpha-cétoglutarate déshydrogénase et de la transcétolase, le TPP catalyse la réaction de décarboxylation réversible (alias clivage d'un composé substrat au niveau d'une liaison carbone-carbone reliant un groupe carbonyle à un groupe réactif adjacent - généralement un groupe carboxylique acide ou un alcool). Il y parvient en quatre étapes de base :
- Le carbanion de l'ylure de TPP attaque de manière nucléophile le groupe carbonyle sur le substrat. (Cela forme une liaison simple entre le TPP et le substrat.)
- La liaison cible sur le substrat est rompue et ses électrons sont poussés vers le TPP. Cela crée une double liaison entre le carbone du substrat et le carbone TPP et pousse les électrons de la double liaison N-C dans le TPP entièrement sur l'atome d'azote, le réduisant d'une forme positive à une forme neutre.
- Dans ce qui est essentiellement l'inverse de la deuxième étape, les électrons repoussent dans la direction opposée formant une nouvelle liaison entre le carbone du substrat et un autre atome. (Dans le cas des décarboxylases, cela crée une nouvelle liaison carbone-hydrogène. Dans le cas de la transcétolase, cela attaque une nouvelle molécule de substrat pour former une nouvelle liaison carbone-carbone.)
- Dans ce qui est essentiellement l'inverse de la première étape, la liaison TPP-substrat est rompue, reformant l'ylure TPP et le substrat carbonyle.

Exemples d'enzymes à thiamine pyrophosphate
Les transcétolases
Ces enzymes appartiennent notamment à la voie des pentoses-phosphate et au cycle de Calvin. Il ne s'agit en aucun cas de cétolases malgré le nom consacré car, dans une cétolisation, c'est le carbone en alpha de la fonction oxo qui agit sur une autre fonction oxo.
Un exemple :

Le complexe pyruvate décarboxylase
Ce complexe enzymatique est composé de plusieurs enzymes. La première, enzyme à thiamine pyrophosphate, réalise la décarboxylation du pyruvate en éthanal (acétaldéhyde) qui est ensuite oxydé. Cette même réaction est réalisée dans la fermentation éthanolique, l'éthanal étant alors réduit en éthanol.
Le schéma général présenté ci-dessus n'est pas facile à appliquer. En voici une présentation qui le reprend en inversant le sens :
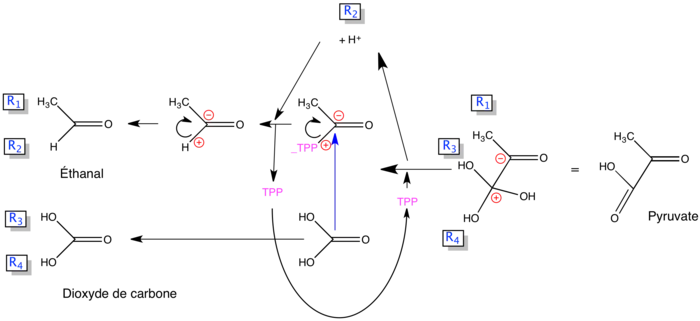
Note : Les fonctions oxo sont développées par deux OH portés par le même carbone pour pouvoir expliquer la réaction.
L'α-acétolactate synthase
Dans la fermentation butanediolique, une grande partie de l'acide pyruvique est transformé en 2,3-butanediol par l'intermédiaire de la 3-hydroxybutanone. La condensation de deux acides pyruvique (pyruvate) est nécessaire, le composé obtenu étant décarboxylé deux fois. La première étape met en jeu une enzyme à TPP donnant l'α-acétolactate (2-hydroxy-2-méthyl-3-céto-butanoïque) dont la décarboxylation simple, en raison de la déstabilisation de la fonction carboxylique en β d'une fonction cétone, donne la 3-hydroxybutanone.
La réaction, toujours selon le même schéma, est la suivante.
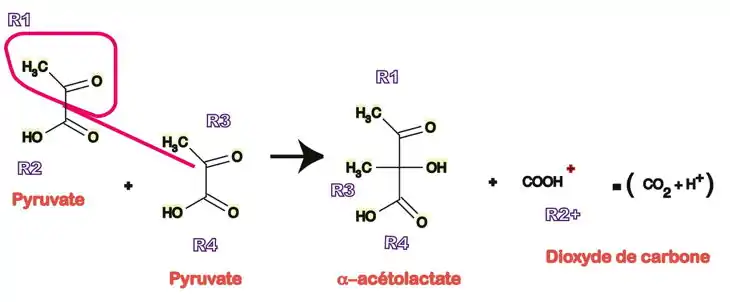
Synthèse
Il existe plusieurs voies de synthèse pour la vitamine B1. La première synthèse totale date de 1936.
Biosynthèse
La thiamine est biosynthétisée par les bactéries, certains protozoaires, des plantes, et des champignons[11],[12]. Les groupes thiazole et pyrimidine sont synthétisés séparément in vivo, puis combinés pour former du monophosphate de thiamine via l'enzyme thiamine-phosphate synthase.
Le système d'anneaux pyrimidine se forme au cours d'une réaction catalysée par la phosphométhylpyrimidine synthase (ThiC), une enzyme de la famille radical SAM (une métalloprotéine fer-soufre) qui utilise la S-Adénosylméthionine comme cofacteur[13],[14].
Synthèse en laboratoire
Dans la première synthèse totale proposée pour la thiamine en 1936, du 3-éthoxypropanoate d'éthyle est traité avec du formiate d'éthyle pour donner comme intermédiaire réactionnel un composé dicarbonylé qui, lorsqu'il réagit avec de l'acétamidine (la plus simple des amidines), forme une pyrimidine substituée. La conversion de son groupe hydroxyle vers un groupe amino se fait par substituion nucléophile aromatique, d'abord vers le dérivé chloré en utilisant de l'oxychlorure de phosphore, suivi d'un traitement à l'ammoniaque. Le groupe éthoxy est alors converti en dérivé bromé par de l'acide bromhydrique. Dans la dernière étape, la thiamine (sous forme de dibromure) se forme par une réaction d'alkylation utilisant du 4-méthyl-5-(2-hydroxyéthyl)thiazole[15],[16].
Synthèse industrielle

Merck & Co. adapte en 1936 à l'échelle industrielle la synthèse en laboratoire. Ils peuvent ainsi synthétiser la thiamine à Rahway an 1937[16]. Une voie de synthèse alternative est cependant découverte[17] dès 1937, utilisant de la diamine de Grewe (c'est-à-dire de la 4-amino-2-méthyl-5-pyrimidineméthanamine). Hoffman La Roche étudie cette synthèse et des procédés de fabrication compétitifs voient le jour. L'optimisation de cette synthèse par divers procédés reste d'intérêt[16],[18].
Dans l'espace économique européen, la thiamine est enregistrée selon le règlement REACH et entre 100 et 1000 tonnes en sont produites ou importées annuellement[19].
Divers
La vitamine B1 fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[20].
Autres animaux
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 1 2 (en) « Vitamine B1 », sur ChemIDplus, consulté le 9 août 2009
- ↑ « VITAMIN B1 » dans la base de données Hazardous Substances Data Bank, consulté le 18 septembre 2009
- ↑ (ja) Suzuki Umetarō et Shimamura Tora, « 糠中の一有効成分に就て » [« Sur un ingrédient actif du son »], Tokyo Kagaku Kaishi, vol. XXXII, no 1, , p. 4–17, 144–146, 335–358 (ISSN 0371-8409, e-ISSN 1881-1116, DOI 10.1246/nikkashi1880.32.4, lire en ligne, consulté le ).
- ↑ (de) Casimir Funk, Die Vitamine : Ihre Bedeutung für die Physiologie und Pathologie, Munich, J.F. Bergmann, , 2e éd., VII-448 p. (OCLC 1068465504).
- ↑ (en) Fradin MS, Day JF, « Comparative efficacy of insect repellents against mosquito bites », N Engl J Med, vol. 347, no 1, , p. 13-8. (PMID 12097535, DOI 10.1056/NEJMoa011699, lire en ligne [html])
- ↑ Diététique et nutrition, Masson, 7e édition
- 1 2 3 4 5 6 7 8 9 10 11 12 13 LaNutrition.fr, 15 novembre 2008
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 (en) David Burdick, Kirk-Othmer encyclopedia of chemical technology 4th ed. : Thiamine (B1), vol. 25, John Wiley & Sons.
- ↑ Jean-Noël Joffin, « Définir et classer les coenzymes », L'Opéron, Lyon, UPBM, no 44, .
- ↑ Webb ME, Marquet A, Mendel RR, Rébeillé F, Smith AG, « Elucidating biosynthetic pathways for vitamins and cofactors », Natural Product Reports, vol. 24, no 5, , p. 988–1008 (PMID 17898894, DOI 10.1039/b703105j)
- ↑ Begley TP, Chatterjee A, Hanes JW, Hazra A, Ealick SE, « Cofactor biosynthesis--still yielding fascinating new biological chemistry », Current Opinion in Chemical Biology, vol. 12, no 2, , p. 118–25 (PMID 18314013, PMCID 2677635, DOI 10.1016/j.cbpa.2008.02.006)
- ↑ Caspi R, « Pathway: superpathway of thiamine diphosphate biosynthesis I », MetaCyc Metabolic Pathway Database, (consulté le )
- ↑ Holliday GL, Akiva E, Meng EC, Brown SD, Calhoun S, Pieper U, Sali A, Booker SJ, Babbitt PC, Radical SAM Enzymes, vol. 606, coll. « Methods in Enzymology », , 1–71 p. (ISBN 9780128127940, PMID 30097089, PMCID 6445391, DOI 10.1016/bs.mie.2018.06.004), « Atlas of the Radical SAM Superfamily: Divergent Evolution of Function Using a "Plug and Play" Domain »
- ↑ Tylicki A, Łotowski Z, Siemieniuk M, Ratkiewicz A, « Thiamine and selected thiamine antivitamins - biological activity and methods of synthesis », Bioscience Reports, vol. 38, no 1, (PMID 29208764, PMCID 6435462, DOI 10.1042/BSR20171148
 )
) - 1 2 3 Eggersdorfer M, Laudert D, Létinois U, McClymont T, Medlock J, Netscher T, Bonrath W, « One hundred years of vitamins-a success story of the natural sciences », Angewandte Chemie, vol. 51, no 52, , p. 12960–90 (PMID 23208776, DOI 10.1002/anie.201205886)
- ↑ Todd AR, Bergel F, « 73. Aneurin. Part VII. A synthesis of aneurin », Journal of the Chemical Society (Resumed), , p. 364 (DOI 10.1039/JR9370000364)
- ↑ Jiang M, Liu M, Huang H, Chen F, « Fully Continuous Flow Synthesis of 5-(Aminomethyl)-2-methylpyrimidin-4-amine: A Key Intermediate of Vitamin B1 », Organic Process Research & Development, vol. 25, no 10, , p. 2331–7 (DOI 10.1021/acs.oprd.1c00253, S2CID 242772232)
- ↑ « Substance Infocard », sur echa.europa.eu (consulté le )
- ↑ (en) WHO Model List of Essential Medicines, 18th list, avril 2013
Voir aussi
- Béribéri
- Encéphalopathie de Wernicke

