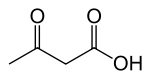
النظام الغذائي الكيتوني أو الحمية الكيتونية أو كيتو دايت هي نظام غذائي عالي الدهون، معتدل البروتين، منخفض الكربوهيدرات. هذا النظام كان يستخدم في الطب في المقام الأول لعلاج حالات الصرع التي يصعب السيطرة عليها عند الأطفال. يجبر هذا النظام الغذائي الجسم على حرق الدهون بدلاً من الكربوهيدرات. عادة، يتم تحويل الكربوهيدرات الموجودة في الغذاء إلى الجلوكوز، والتي يتم بعد ذلك نقله إلي جميع أجزاء الجسم والذي له أهمية خاصة في تزويد الدماغ بالطاقة[1] ، إذ تعتمد الدماغ (المخ) على الجلوكوز لمدها بالطاقة. ومع ذلك، إذا كان هناك القليل من الكربوهيدرات في النظام الغذائي، فإن الكبد يحول الدهون إلى أحماض دهنية وأجسام كيتونية.[2] ، لمد الجسم بالطاقة وإنتاج ATP في خلايا الجسم. تمر أجسام الكيتون في الدماغ وتحل محل الجلوكوز كمصدر للطاقة.
ارتفاع مستوى أجسام الكيتون في الدم، هي حالة تعرف باسم فرط كيتون الجسم، تؤدي إلى انخفاض في تواتر نوبة الصرع.[3] ما يقرب من نصف الأطفال، والشباب، الذين يعانون من الصرع والذين جربوا شكلاً من أشكال هذا النظام الغذائي، شاهدوا انخفاضا في عدد النوبات بنسبة لا تقل عن النصف، ويستمر التأثير حتى بعد إيقاف النظام الغذائي.[3][4] التأثير السلبي الأكثر شيوعًا لهذا النظام هو الإمساك، حيث يؤثر على حوالي 30٪ من المرضى - وهذا يرجع إلى تقليل حجم السوائل، والذي كان في السابق سمة من سمات هذا النظام الغذائي، ولكن هذا أدى إلى زيادة خطر تكون حصوات الكلى، ولم يعد يعتبر مفيداً.[4][5]
النظام الغذائي العلاجي الأصلي للصرع عند الأطفال يوفر بروتينًا كافيًا لنمو الجسم وإصلاحه، وكميات كافية من السعرات الحرارية[Note 1] للحفاظ على الوزن الصحيح المناسب للعمر والطول. تم تطوير النظام الغذائي الكيتوني التقليدي لعلاج الصرع عند الأطفال في عشرينيات القرن العشرين، وكان يستخدم على نطاق واسع في العقد التالي، لكن شعبيته تضاءلت مع إدخال الأدوية الفعالة لعلاج الصرع. هذا النظام الغذائي الكيتوني يحتوي على نسبة 4: 1 حسب وزن الدهون إلى البروتينات والكربوهيدرات.[2] ويتحقق ذلك من خلال استبعاد الأطعمة الغنية بالكربوهيدرات مثل الفواكه والخضروات والنشويات مثل الخبز والمعكرونة والحبوب والسكر، مع زيادة استهلاك الأطعمة الغنية بالدهون مثل المكسرات والقشدة والزبدة.[3][6][7]
في منتصف التسعينات، قام منتج هوليوود (جيم أبراهامز) بالترويج للنظام الغذائي الكيتوني، والذي تم ابتكاره من قبل مؤسسة تشارلي، حيث كان ابنه يعاني من الصرع الشديد والذي تم التحكم به بفعالية من خلال هذا النظام. اشتملت الدعاية على الظهور في برنامج علي قناة NBC وعمل فيلم تلفزيوني بطولة ميريل ستريب. رعت المؤسسة دراسة بحثية متعددة المراكز، والتي كانت نتائجها - التي أعلن عنها في عام 1996 - هي بداية الاهتمام العلمي المتجدد بهذا النظام الغذائي.[3]
وقد تم دراسة الاستخدامات العلاجية المحتملة للنظام الغذائي الكيتونى لاضطرابات عصبية مختلفة بالإضافة إلى الصرع مثل: مرض الزهايمر (AD)، والتصلب الجانبي الضموري (ALS)، والتوحد، وسرطان الدماغ، والصداع، ومرض باركنسون (PD)، واضطرابات النوم.[8]
الصرع
الصرع هو واحد من أكثر الاضطرابات شيوعاً في علم الأعصاب بعد السكتة الدماغية،[9] والذي يؤثر علي حوالي 50 مليون انسان علي الإقل علي مستوي العالم[10] يتم تشخيصه في الأشخاص الذين لديهم نوبات متكررة غير مبررة من التشنجات. يحدث هذا عندما يتم استثارة الخلايا العصبية في القشرة الدماغية بشكل مفرط، مما يؤدي إلى تعطيل مؤقت لوظيفة الدماغ الطبيعية. قد يؤثر هذا، على سبيل المثال، على العضلات، والحواس، والوعي. يمكن للنوبة أن تكون صرع جزئي (محصورة في جزء واحد من الدماغ) أو تكون عامة(منتشرة على نطاق واسع في جميع أنحاء الدماغ وتؤدي إلى فقدان الوعي). قد يحدث الصرع لمجموعة متنوعة من الأسباب؛ ومعظمها يبدأ في مرحلة الطفولة.[11] يعتبر الصرع مقاومًا وغير قابل للعلاج (لا يستسلم للعلاج) عندما يخفق اثنان أو ثلاثة من مضادات الاختلاج في السيطرة عليه. حوالي 60٪ من المرضى يتمكنون من السيطرة على صرعهم باستخدام أول دواء يستخدمونه، في حين أن 30٪ منهم لا يحققون السيطرة باستخدام الأدوية. عندما تفشل الأدوية، فإن الخيارات الأخرى تشمل الجراحة، والنظام الغذائي الكيتوني.[9]
التاريخ
النظام الغذائي الكيتوني هو نظام علاجي تم ابتكاره لاستبدال النظام التقليدي القديم في علاج الصرع عن طريق الصرع.[Note 2] وبالرغم من شهرته في عشرينات وثلاثينات القرن الماضي، إلا أنه تم منعه وحجبه لإتاحة الفرصة لأدوية الصرع الجديدة لتغزو الأسواق.[3] معظم الأفراد يستطيعون التحكم في نوبات الصرع لديهم باستخدام الأدوية، إلا أن حوالي 20-30% يفشلون في التحكم باستخدام العديد من الأدوية.[12] ولذلك من أجل هذه النسبة وخاصة الأطفال، استطاع النظام الغذائي أن يجد لنفسه دوراً مرة ثانية في علاج الصرع[3][13]
الصيام والامتناع عن الأكل

كان المعالجيين اليونانيين القدماء يعالجون الأمراض، ومنها الصرع، عن طريق تغيير النظام الغذائي للمرضي. دراسة مبكرة في عهد أبوقراط، أكدت أن المرض يعود تاريخه إلى ح. 400 قبل الميلاد. تجادل الباحثين ضد الرأي السائد بأن الصرع كان خارقا للطبيعة في الأصل والعلاج، واقترحوا أن العلاج له أساس عقلاني وجسدي.[Note 3] ويصف الباحثون حالة رجل يتم علاج نوبة الصرع لديه من خلال الامتناع التام عن الطعام والشراب.[Note 4] وأعلن الطبيب الملكي إيراسيستاتوس، "يجب أن يخضع الشخص الذي يعاني إلى الصرع إلي صيام بدون رحمة ويوضع له برنامج ذو حصص غذائية قصيرة".[Note 5][Note 6][14]
أول دراسة حديثة عن الصيام كعلاج للصرع كانت في فرنسا في عام 1911.[15] حيث خضع عشرون مريضاً بالصرع من جميع الأعمار لبرنامج علاجي عن طريق اتباع حمية نباتية منخفضة السعرات الحرارية، جنبا إلى جنب مع فترات صيام. استفاد اثنان بشكل كبير، لكن معظمهم فشل في الامتثال للقيود المفروضة. ووجد أن النظام الغذائي يحسن القدرات العقلية للمرضى، على النقيض من أدوية البوتاسيوم بروميد، التي تؤثر على العقل بالسلب.[2][16] خلال هذا الوقت، أشاع بيرنار ماكفادن، وهو أحد الخبراء الأمريكيين في الثقافة البدنية، استخدام الصيام لاستعادة الصحة. بدأ تلميذه، هيو كونكلين، بمعالجة مرضى الصرع من خلال التوصية بالصيام. كان كونكلين يتصور أن نوبات الصرع كانت ناجمة عن بعض السموم، التي يتم إفرازها في الأمعاء، والتي تنتقل إلي مجرى الدم. حيث أوصى بفترة صيام تتراوح من 18 إلى 25 يومًا لإتاحة الفرصة لتبديد هذا السم. ربما عالج كونكلين المئات من مرضى الصرع بـ "حمية الماء" الخاصة به واستطاع أن يحقق نسبة شفاء 90٪ لدى الأطفال، و 50٪ لدى البالغين. أظهر تحليل لاحق لسجلات حالة كونكلين أن 20٪ من مرضاه استطاعوا التخلص تماماً من نوبات الصرع و 50٪ أظهروا بعض التحسن.[1][1][5][13][17][17] تم اعتماد علاج كونكلين بالصوم من قبل علماء الأعصاب. في عام 1916، كتب الدكتور ماكموراي إلى مجلة "نيويورك الطبية" زاعماً أنه نجح في علاج مرضى الصرع بالصيام، واتباع نظام غذائي خالٍ من النشا وخال من السكر، منذ عام 1912.[13]
النظام الغذائي
في عام 1921 ، استكمل "رولين ووديات" البحث في النظام الغذائي ومرض السكري. وذكر أن ثلاثة مركبات قابلة للذوبان في الماء، وهي بيتا هيدروكسي بيوتيرك أسيد، وحمض أسيتو الأسيتيك، وأسيتون (المعروفة بشكل جماعي باسم الأجسام الكيتونية، يتم إنتاجها بواسطة الكبد في الأشخاص الأصحاء عندما يعانون من الجوع أو إذا كانوا يستهلكون نظامًا غذائيًا قليل الكربوهيدرات منخفض الدهون ( وهذا هو سبب رائحة الفم الكريهة أثناء الصيام بسبب خروج غاز الأسيتون مع التنفس).
بنى روسيل وايلدر، في مايو كلينيك، دراسته على هذا البحث وصاغ مصطلح "الحمية الكيتونية" لوصف نظام غذائي ينتج عنه مستوى عال من أجسام كيتون في الدم (فرط كيتون الجسم) من خلال زيادة الدهون ونقص الكربوهيدرات.[2][2] كان وايلدر يأمل في الحصول على فوائد الصيام في العلاج الغذائي الذي يمكن الحفاظ عليه لأجل غير مسمى. كانت تجربته على عدد قليل من مرضى الصرع في عام 1921، وكان هذا أول استخدام للنظام الغذائي الكيتوني كعلاج للصرع.[13]
وقد صاغ زميل وايلدر، طبيب الأطفال مياني بيترمان، النظام الغذائي التقليدي الذي يتكون من غرام واحد من البروتين لكل كيلوغرام من وزن الجسم لدى الأطفال في اليوم، و10-15 غرام فقط من الكربوهيدرات في اليوم، وباقي السعرات الحرارية من الدهون. قام بتيرمان بتوثيق الآثار الإيجابية مثل (تحسين اليقظة والسلوك والنوم) والتأثيرات الضائرة مثل (الغثيان والقيء).[2] أثبت النظام الغذائي نجاحًا كبيرًا في الأطفال: أعلن بيترمان في عام 1925 أن 95٪ من 37 مريضًا شابًا قد تمكنوا من التحكم في النوبات باستخدام النظام الغذائي وأصبح 60٪ منهم بلا نوبات. بحلول عام 1930، تمت دراسة النظام الغذائي أيضًا على 100 مراهق وبالغ. أفاد كليفورد باربركا، من عيادة مايو كلينيك أيضًا، أن 56٪ من هؤلاء المرضى الأكبر سناً قد تحسنوا على النظام الغذائي وأصبح 12٪ منهم لا يعاني من النوبات.[2] على الرغم من أن نتائج البالغين مشابهة للدراسات الحديثة للأطفال، إلا أنها لم تقارن كذلك بالدراسات المعاصرة. وخلص "باربوركا" إلى أنه من غير المحتمل أن يستفيد الكبار من النظام الغذائي، ولم يتم دراسة استخدام النظام الغذائي الكيتوني في البالغين مرة أخرى حتى عام 1999.[13][18][19]
مضادات الاختلاج
خلال عشرينيات وثلاثينيات القرن العشرين، عندما كانت العقاقير المضادة للاختلاج الوحيدة هي البروميد (تم اكتشافه عام 1857) والفينوباربيتال (1912)، كان النظام الغذائي الكيتوني يستخدم على نطاق واسع وتدرس آثاره بحرية. تغير هذا في عام 1938 عندما اكتشف هيوستن ميريت، وتريسي بوتنام عقار الفينيتوين (Dilantin)، وتحول تركيز البحث إلى اكتشاف أدوية جديدة. مع إدخال عقار (فالبروسيت الصوديوم) في السبعينيات، أصبحت الأدوية متاحة لأطباء الأعصاب والتي كانت فعالة علي مجموعة واسعة من متلازمات الصرع وأنواع التشنجات المختلفة.[5] تراجع استخدام النظام الغذائي الكيتوني في هذا الوقت واقتصر علي الحالات الصعبة مثل متلازمة لينوكس-غاستو.[13]
حمية جليسريدات ثلاثية متوسطة الحلقات
في الستينات من القرن العشرين، تم اكتشاف أن جليسريدات ثلاثية متوسطة الحلقات تنتج الكثير من جسيمات كيتون لكل وحدة طاقة من الدهون الغذائية العادية.[20] يتم امتصاص هذه الجليسريدات بشكل أكثر كفاءة ويتم نقلها بسرعة إلى الكبد عبر نظام البوابة الكبدية بدلاً من الجهاز اللمفاوي.[21] جعلت قيود استخدام الكربوهيدرات في النظام الغذائي الكيتوني الكلاسيكي من الصعب على الآباء تقديم وجبات مستساغة يمكن لأطفالهم تحملها. في عام 1971، ابتكر Peter Huttenlocher نظام غذائي كيتوني جديد، حيث يكون مصدر 60 ٪ من السعرات الحرارية من الجليسريدات الثلاثية متوسطة الحلقات، وهذا سمح بالمزيد من البروتين وزيادة نسبة الكربوهيدرات إلى ثلاثة أضعاف نسبتها في النظام الكلاسيكي. يتم خلط مستحضر الزيت مع ضعف حجمه من الحليب منزوع الدسم على الأقل، ويتم تبريده، وشربه خلال الوجبة أو دمجه في الطعام.[22] تم اختباره على اثني عشر من الأطفال والمراهقين الذين يعانون مننوبات مستعصية. تحسن معظم الأطفال في كل من التحكم في النوبة واليقظة، وكانت النتائج مشابهة للحمية الكيتونية الكلاسيكية. كان اضطراب الجهاز الهضمي مشكلة، مما دفع مريض واحد للتخلي عن النظام الغذائي، ولكن وجبات الطعام كانت أسهل للتحضير ومقبولة بشكل أفضل من قبل الأطفال.[13][20]
إحياء النظام الغذائي من جديد
حقق النظام الغذائي الكيتوني انتشاراً واسعاً في وسائل الإعلام الوطنية في الولايات المتحدة في أكتوبر 1994، عندما أبلغ برنامج NBC's Dateline التلفزيوني عن حالة تشارلي أبراهامز، ابن منتج هوليود جيم ابراهام. عانى الطفل البالغ من العمر سنتين من الصرع الذي بقي خارج نطاق السيطرة بالرغم من تناول جميع العلاجات المنتشرة وبدائلها. أحضر ابراهام ابنه تشارلي إلى طبيب الأعصاب جون م. فريمان في مستشفى جونز هوبكنز، والذي بدأ معه بالعلاج الكيتوني. في ظل النظام الغذائي، تم التحكم بسرعة بصرع تشارلي واستؤنف نموه. وقد ألهم هذا أبراهامز لإنشاء مؤسسة تشارلي لتعزيز النظام الغذائي وتمويل الأبحاث.[13] بدأت دراسة استطلاعية متعددة المراكز في عام 1994، وقدمت النتائج إلى جمعية الصرع الأمريكية في عام 1996 ونشرت[23] في عام 1998. تبع ذلك انفجار الاهتمام العلمي بالنظام الغذائي. في عام 1997، أنتج أبراهامز فيلمًا تلفزيونيًا من بطولة ميريل ستريب، حيث يعالج طفل يعاني من صرع مستعصي بنجاح من خلال علاج الصرع الكيتوني.[3]
بحلول عام 2007 ، كان النظام الغذائي الكيتون متاحًا في 75 مركز في 45 بلد، وكانت هناك أشكال أخرى أقل قيودًا، مثل حمية نظام أتكينز المعدَّلة، قيد الاستخدام، خاصةً بين الأطفال الأكبر سنًا والبالغين.[3]
الفعالية
يقلل النظام الغذائي الكيتون من تكرار النوبات بأكثر من 50٪ في نصف المرضى الذين يتبعونه وبأكثر من 90٪ في ثلث المرضى.[5] ثلاثة أرباع الأطفال الذين يستجيبون للنظام الغذائي يبدأون في التحسن خلال أسبوعين على الرغم من أن الخبراء ينصحون بإجراء تجربة لمدة ثلاثة أشهر على الأقل قبل افتراض أنها غير فعالة.[12] من المرجح أن يستفيد الأطفال الذين يعانون من الصرع الحرارى من النظام الغذائي الكيتونى أكثر من تجربة الأدوية المضادة للاختلاج.[3] هناك بعض الأدلة على أن المراهقين والبالغين قد يستفيدون أيضًا من النظام الغذائي.[12]
تصميم تجريبي
أفادت الدراسات المبكرة عن معدلات نجاح عالية: في إحدى الدراسات التي أجريت عام 1925، أصبح 60٪ من المرضى خاليين من نوبات الصرع، و 35٪ من المرضى الآخرين انخفض تردد النوبات لديهم بنسبة 50٪. فحصت هذه الدراسات بشكل عام خلال دراسة علي المرضى الذين عولجوا مؤخراً من قبل الطبيب (ما يعرف باسم الدراسة الاستعادية) وبعض المرضى الذين نجحوا في الحفاظ على القيود الغذائية. ومع ذلك، يصعب مقارنة هذه الدراسات بالتجارب الحديثة. أحد الأسباب هو أن هذه التجارب القديمة عانت التحيز في الاختيار، لأنها استبعدت المرضى الذين لم يتمكنوا من بدء النظام الغذائي أو الحفاظ عليه، وبالتالي تم اختيارهم من المرضى الذين سيحققون نتائج أفضل. في محاولة للتحكم في هذا التحيز، يفضل اختيار المرضى في الدراسة قبل بدء العلاج، حيث يتم تقديم النتائج لجميع المرضى بغض النظر عما إذا كانوا قد بدأوا وأكملوا العلاج أو لا.[24]
هناك فرق آخر بين الدراسات الأقدم والأحدث هو أن نوع المرضى الذين عولجوا بنظام الحمية الكيتونية تغير مع مرور الوقت. عند تطويرها واستخدامها لأول مرة، لم يكن النظام الغذائي الكيتوني هو الملاذ الأخير. في المقابل، فإن الأطفال في الدراسات الحديثة قد حاولوا بالفعل وفشلوا في عدد من الأدوية المضادة للاختلاج، لذا يمكن الافتراض بأن لديهم صرعًا أكثر صعوبة في العلاج. كما تختلف الدراسات المبكرة والحديثة لأن بروتوكول العلاج قد تغير.[12][25] في البروتوكولات القديمة، بدأ النظام الغذائي بالصيام لفترات طويلة، والمصمّم لخسارة 5-10٪ من وزن الجسم، وقيّد بشدة السعرات الحرارية. أدت المخاوف بشأن صحة الأطفال والنمو إلى تخفيف القيود المفروضة على النظام الغذائي.[24] كان التقييد بالسوائل سمة من سمات النظام الغذائي، ولكن هذا أدى إلى زيادة خطر الإمساك وحصى الكلى، ولم يعد يعتبر مفيدًا.[5]
النتائج
تم نشر دراسة ذات تصميم مستقبلي يهدف إلى علاج في عام 1998 من قبل فريق من مستشفى جونز هوبكنز [26] ومتابعتها بتقرير نشر في عام 2001.[27] كما هو الحال مع معظم دراسات النظام الغذائي الكيتوني، لم يكن هناك مجموعة مراقبة (المرضى الذين لم يتلقوا العلاج). التحقت بالدراسة 150 طفلاً. بعد ثلاثة أشهر، كان 83٪ منهم لا يزالون يتبعون النظام الغذائي؛ 26٪ قد أظهروا انخفاض جيد في النوبات، و 31٪ لديهم انخفاض ممتاز و 3٪ اختفت النوبات لديهم. بعد اثنا عشر شهراً، 55٪ كانوا لا يزالون على النظام الغذائي؛ 23٪ لديهم استجابة جيدة، و 20٪ لديهم استجابة ممتازة، و 7٪ اهتفت النوبات لديهم.[21] أولئك الذين توقفوا عن اتباع نظام غذائي في هذه المرحلة فعلوا ذلك لأنها كانت غير فعالة ومقيدة للغاية، ومعظم الذين بقوا استفادوا من هذا النظام. كانت نسبة الذين ما زالوا على النظام الغذائي في سنتين وثلاث وأربع سنوات 39 ٪، و20 ٪ و 12 ٪ على التوالي. خلال هذه الفترة كان السبب الأكثر شيوعا لوقف النظام الغذائي هو أن الأطفال أصبحوا لا يعانون من نوبات صرع أو أصبحوا أفضل بكثير. في أربع سنوات، كان 16٪ من الأطفال الأصليين البالغ عددهم 150 طفلاً قد أظهروا انخفاضاً جيدًا في معدل النوبات، و 14٪ لديهم انخفاضاً ممتازاً و 13٪ بلا نوبات، على الرغم من أن هذه الأرقام تشمل العديد ممن لم يستكملوا النظام الغذائي. أولئك الذين بقوا على النظام الغذائي بعد هذه المدة لم يصبحوا خاليين من النوبات ولكنهم تلقوا استجابة ممتازة.[27][28]
من الممكن الجمع بين نتائج العديد من الدراسات الصغيرة لإنتاج أدلة أقوى من تلك المتاحة من كل دراسة بمفردها - وهي طريقة إحصائية تُعرف باسم التحليل التلوي. واحد من أربعة تحليلات من هذا القبيل، أجريت في عام 2006، نظرت في 19 دراسة على ما مجموعه 1084 مريضاً.[29] خلصت إلى أن الثلث حقق انخفاضاً ممتازاً في وتيرة النوبات ونجح نصف المرضى في تحقيق نتيجة مقبولة.[4][5]
نظرت مراجعة منهجية في 2018 في ستة عشر دراسات حول النظام الغذائي الكيتون في البالغين. وخلصت إلى أن العلاج أصبح أكثر شعبية بالنسبة لهذه المجموعة من المرضى، وأن فعالية البالغين كانت مشابهة للأطفال، وكانت الآثار الجانبية خفيفة نسبياً.[5][30]
مؤشرات وموانع الاستخدم
يستخدم النظام الغذائي الكيتوني كعلاج مساعد (إضافي) في الأطفال والشباب الذين يعانون من الصرع المقاوم للأدوية.[32][33] تمت الموافقة عليه من قبل الدليل الإرشادي السريري، والهيئة العامة للتوجيه الطبي في اسكتلندا، [33] وإنجلترا، وويلز [32] وتبنته جميع شركات التأمين الأمريكية تقريباً.[17] الأطفال الذين يعانون من بؤرة صرع واحدة (نقطة واحدة فيها خلل في الدماغ تسبب الصرع)، من المرجح أن تكون جراحة الصرع لديهم أكثر نجاحاً في خفض لتشنجات من النظام الغذائي الكيتوني.[12][34] حوالي ثلث مراكز الصرع التي تقدم النظام الغذائي الكيتوني تقدم أيضاً العلاج الغذائي للبالغين. يعتبر بعض الأطباء أن النظاميين الغذائيين الأقل تقييداً - علاج خفض نسبة السكر في الدم واتباع حمية أتكينز المعدلة - أكثر ملاءمة للمراهقين والبالغين.[7][12][35]
يوصي المؤيدون للحمية بوجوب أخذها في الاعتبار بشكل جدي بعد فشل عقارين، حيث أن فرصة نجاح الأدوية الأخرى هي 10٪ فقط.[12][36][37] ويمكن النظر في النظام الغذائي في وقت سابق لبعض متلازمات الصرع والمتلازمات الجينية حيث أظهرت فائدة معينة. وتشمل هذه، التشنجات الطفلية، والصرع العضلي الاستوائي، ومرض التصلب الجلدي.[12][38]
وجد مسح عام 2005 لـ 88 طبيب أعصاب للأطفال في الولايات المتحدة أن 36٪ يصفون النظام الغذائي بانتظام بعد فشل ثلاثة أدوية أو أكثر؛ 24٪ يصفون النظام الغذائي أحيانًا كحل أخير. 24٪ فقط وصفوا النظام الغذائي في بعض الحالات النادرة. و 16 ٪ لم يشرع في بدء النظام الغذائي. هناك عدة تفسيرات محتملة لهذه الفجوة بين الطب المبني على الأدلة والممارسة السريرية.[39] قد يكون أحد العوامل الرئيسية هو عدم وجود أخصائي التغذية المدرب بشكل كاف، لإدارة برنامج غذائي كيتوني.[36][40] من ناحية أخرى، فإنه يمنع على الإطلاق استخدامه في علاج أمراض أخرى مثل نقص البيروفات كربوكسيلاز، وبورفيريا وغيرها من الأمراض النادرة التي تنتج عن أخطاء في التمثيل الغذائي للدهون والاضطرابات الوراثية في التمثيل الغذائي للدهون.[5][12][41]
تطبيق النظام
النظام الغذائي الكيتون هو برنامج علاج طبي غذائي يحتاج أعضاء من مختلف التخصصات. يشمل أعضاء الفريق طبيب الأطفال، وأخصائي التغذية؛ الذي يقوم بتنسيق برنامج الحمية الغذائية، وطبيب الأعصاب؛ الذي هو من ذوي الخبرة في تقديم النظام الغذائي الكيتوني، وممرضة على دراية بالصرع في مرحلة الطفولة. قد تأتي مساعدة إضافية من أخصائي اجتماعي طبي؛ والذي يعمل مع العائلة، وصيدلي؛ يمكنه تقديم المشورة بشأن محتوى الكربوهيدرات في الأدوية. وأخيراً، يجب تثقيف الوالدين ومقدمي الرعاية الآخرين في العديد من جوانب النظام الغذائي حتى يتم تنفيذه بأمان.[7]
يمكن أن يؤدي تطبيق النظام الغذائي إلى صعوبات بالنسبة لمقدمي الرعاية والمريض بسبب الالتزام بالوقت في قياس وتخطيط الوجبات. بما أن أي طعام غير مخطط له يمكن أن يحطم التوازن الغذائي المطلوب، فإن بعض الناس يجدون الانضباط اللازم للحفاظ على النظام الغذائي صعب وغير محبب. يقوم بعض الأشخاص بإنهاء النظام الغذائي أو التحول إلى نظام غذائي أقل قيوداً، مثل حمية نظام أتكينز المعدلة (MAD) أو النظام الغذائي المعتمد على تقليل نسبة السكر في الدم (LGIT).[42]
البداية والتحفيز
تم اعتماد بروتوكول مستشفى جونز هوبكنز لبدء النظام الغذائي الكيتوني على نطاق واسع.[43] إنه ينطوي على استشارة مع المريض والقائمين على رعايته، وبعد ذلك دخول المستشفى لفترة قصيرة [24] بسبب خطر حدوث مضاعفات خلال بدء النظام الغذائي الكيتون، تبدأ معظم المراكز في النظام الغذائي تحت إشراف طبي وثيق في المستشفى.[12]
في الاستشارة الأولية، يتم فحص المرضى لتجنب الحالات التي يمنع فيها استخدام النظام الغذائي. يتم الحصول على التاريخ الطبي، ومعلومات النظام الغذائي المحدد: نسبة الكيتون في الدهون إلى البروتينات والكربوهيدرات، ومتطلبات السعرات الحرارية والسوائل.[24]
قبل يوم من الدخول إلى المستشفى، قد تنخفض نسبة الكربوهيدرات في النظام الغذائي ويبدأ المريض في الصيام بعد تناول وجبة المساء.[24] عند الدخول، يسمح فقط بال السوائل الخالية من السعرات الحرارية والكافيين فقط [41] حتى العشاء، والذي يتكون من "مخفوق البيض"، والذي يحتوي على ثلث السعرات الحرارية المعتادة لتناول وجبة.[12] وتتشابه وجبات الإفطار والغداء التالية، وفي اليوم الثاني، يزداد عشاء "البيض" إلى ثلثي المحتوى الحراري للوجبة العادية. في اليوم الثالث، يحتوي العشاء على حصص كاملة من السعرات الحرارية، وهو عبارة عن وجبة عادية من الكيتونات. بعد تناول وجبة إفطار الكيتون في اليوم الرابع، يتم منح المريض الإذن لمغادرة المستشفى. حيثما أمكن، يتم تغيير الأدوية الحالية للمريض إلى تركيبات خالية من الكربوهيدرات.[24]
في المستشفى ، يتم فحص مستويات السكر في الدم عدة مرات في اليوم ويتم مراقبة المريض بحثًا عن علامات أعراض زيادة نسبة الكيتونات في الدم (والتي يمكن معالجتها بكمية صغيرة من عصير البرتقال). إن نقص الطاقة والخمول أمر شائع ولكنه يزول في غضون أسبوعين.[23][24][25]
المداومة على النظام
بعد البدء في العلاج، يقوم الطفل بزيارات منتظمة إلى العيادة الخارجية للمستشفى حيث يراه اختصاصي التغذية والأعصاب، ويتم إجراء العديد من الاختبارات. وتعقد هذه الجلسة كل ثلاثة أشهر للسنة الأولى وبعد ذلك كل ستة أشهر بعد ذلك. الأطفال الرضع الذين تقل أعمارهم عن سنة واحدة تكون زيارتهم بشكل متكرر أكثر، مع الزيارة الأولية التي تعقد بعد أسبوعين إلى أربعة أسابيع فقط.[12] تعد فترة التعديلات الطفيفة ضرورية لضمان الحفاظ على نسبة الكيتونات في الجسم ولتكييف خطط الوجبات بشكل أفضل. المريض. عادة ما يتم هذه التغيرات الطفيفة عبر الهاتف مع أخصائي التغذية في المستشفى [24] ويتضمن تغيير عدد السعرات الحرارية أو تغيير نسبة الكيتون أو إضافة بعض أنواع لجليسريدات أو زيوت جوز الهند إلى الحمية التقليدية. يتم فحص [5] مستويات الكيتون في البول يومياً للكشف عما إذا كان هناك ارتفاع في نسبة الكيتون في الدم، والتأكد من أن المريض يتبع النظام الغذائي، على الرغم من أن مستوى الكيتونات لا يرتبط بتأثير مضاد الاختلاج.[24] يتم إجراء ذلك باستخدام شرائط اختبار الكيتون، والتي تغير لونها من اللون الوردي اللامع إلى المارون في وجود acetoacetate (واحد من أجسام الكيتون الثلاثة).[19]
قد تحدث زيادة قصيرة الأجل في وتيرة النوبات أثناء المرض أو إذا تقلبت مستويات الكيتون. قد يتم تعديل النظام الغذائي إذا بقيت نوبات التشنج عالية، أو كان الطفل يفقد الوزن.[24] قد يأتي فقدان السيطرة على النوبات من مصادر غير متوقعة. حتى الطعام "الخالي من السكر" يمكن أن يحتوي على كربوهيدرات مثل مالتوديكسترين، وسوربيتول، والنشا، واالفركتوز. قد يكون محتوى السوربيتول في منتجات العناية بالبشرة مرتفعًا بما يكفي ليتم امتصاص بعضه من خلال الجلد.[36]
التوقف
حوالي 20 ٪ من الأطفال على النظام الغذائي الكيتوني ينجحون في التحرر من النوبات، وكثير منهم قادرون على الحد من استخدام الأدوية المضادة للاختلاج أو وقفها تماماً.[5] عادة، خلال حوالي عامين على النظام الغذائي، أو بعد ستة أشهر من كون المريض بلا نوبات، قد يتوقف النظام الغذائي تدريجياً على مدى شهرين أو ثلاثة أشهر. ويتم ذلك عن طريق خفض نسبة الكيتون حتى تكون غير موجودة عند الكشف عنها في البول، ومن ثم رفع جميع قيود السعرات الحرارية.[44] عندما يكون النظام الغذائي مطلوبًا لعلاج بعض الأمراض الأيضية، فستكون المدة أطول. تمت دراسة الفترات الزمنية التي تصل إلى 12 عامًا ووجدت أنها مفيدة.[12]
في الأطفال الذين يتوقفون عن اتباع النظام بعد اختفاء نوبات الصرع لديهم، حوالي 20٪ يكون لديهم خطر حدوث نوبة مرضية مرة أخرى. هذا الخطر من تكرار النوبات بعد العلاج يحدث أيضاً في العلاجات الأخرى، حبث يحدث بنسبة 10 ٪ في الجراحة (حيث يتم إزالة جزء من الدماغ) و30-50 ٪ في مضادات الاختلاج.[44]
الأنواع المختلفة من النظام الغذائي
النظام التقليدي
يتم حساب النظام الغذائي الكيتونى بواسطة أخصائي تغذية لكل طفل. يؤثر العمر والوزن ومستويات النشاط والثقافة والتفضيلات الغذائية على خطة الوجبات. أولاً، يتم تعيين متطلبات الطاقة على 80-90 ٪ من الكميات اليومية الموصى بها لعمر الطفل (النظام الغذائي عالي الدهون يتطلب طاقة أقل لعملية من نظام غذائي نموذجي عالي الكربوهيدرات). الأطفال النشيطون للغاية أو الذين لديهم تشنج في العضلات عضلات يتطلبون سعرات حرارية أكثر من هذا؛ الأطفال الساكنين يتطلبون أقل. نسبة الكيتون في الحمية تقارن وزن الدهون بالوزن المركب للكربوهيدرات والبروتين. عادة ما تكون هذه النسبة 4: 1 ، ولكن قد يبدأ الأطفال الذين تقل أعمارهم عن 18 عامًا والذين تزيد أعمارهم عن 12 عامًا أو الذين يعانون من السمنة بنسبة 3: 1. الدهون غنية بالطاقة، حيث 9 كيلو كالوري/جرام مقارنة بـ 4 كيلو كالوري/ جرام للكربوهيدرات أو البروتين، لذلك تكون الأجزاء على النظام الغذائي الكيتون أصغر من المعتاد.[45][47][47] يمكن حساب كمية الدهون في النظام الغذائي من متطلبات الطاقة الإجمالية ونسبة الكيتون المختارة. بعد ذلك، يتم تعيين مستويات البروتين للسماح للنمو وتكوين الجسم، وهي حوالي 1 جرام من البروتين لكل كيلوغرام من وزن الجسم. وأخيراً، يتم تعيين كمية من الكربوهيدرات وفقاً لما تبقى مع الحفاظ على النسبة المختارة. يجب طرح أي كربوهيدرات في الأدوية أو المكملات الغذائية من هذه النسبة. ثم يتم تقسيم الناتج الإجمالي اليومي من الدهون والبروتين والكربوهيدرات بالتساوي عبر وجبات الطعام.[41][41][48]
النظام الغذائي الكيتوني الكلاسيكي ليس نظام غذائي متوازن ويحتوي فقط على أجزاء صغيرة من الفواكه والخضروات الطازجة، والحبوب، والأطعمة الغنية بالكالسيوم. على وجه الخصوص، يجب استكمال الغذاء بمكملات من فيتامين ب، والكالسيوم، وفيتامين د. ويتحقق ذلك من خلال تناول نوعين من المكملات الخالية من السكر مصممة لعمر المريض: فيتامينات متعددة مع أملاح معدنية والكالسيوم مع فيتامين د.[5] اليوم النموذجي للطعام لطفل على نسبة 4: 1، و1500 كيلو كالوري يتكون من:[17]
- الإفطار: البيض مع السجق أو اللحم المقدد
28 جرام بيض، 11 جرام لحم، 37 جرام من 36٪ الكريمة الثقية، 23 جرام زبدة، و 9 جرام تفاح.[49]
- وجبة خفيفة: زبدة الفول السوداني أو اللوز
6 جرام زبدة الفول السوداني و 9 جرام من الزبدة.
- الغداء: سلطة التونة
28 جرام من أسماك التونا، 30 جرام مايونيز، و10 حبات زعفران، 36 جرام من كريمة الخفق الثقيلة بنسبة 36 ٪ و 15 جرام من الخس.[50]
- وجبة خفيفة: زبادي كيتوني
18 جرام من كريمة الخفق الثقيلة بنسبة 36٪، و 17 جرامًا من الكريمة الحامضة، و4 جرام من الفراولة.[5]
- العشاء: تشيز برجر (بدون كعكة)
22 جرام من لحم البقر المفروم (المطحون)، و10 جرام جبن أمريكي، و26 جرام زبدة، و38 جرام كريمة، و10 جرام خس، و11 جرام من الفاصوليا الخضراء.[24]
- وجبة خفيفة: كيتو كاسترد
25 جرام من كريمة الخفق الثقيلة بنسبة 36٪، و9 جرام من البيض، ونكهة الفانيليا الخالصة.[36]
نظام الجليسريدات الثلاثية (MCT)
تحتوي الدهون الغذائية العادية في الغالب على جليسريدات طويلة السلسلة (LCT). بينما الجليسريدات الثلاثية متوسطة الحلقات تكون أكثر كيتونية لأنّها تنتج كيتونات أمثر لكلّ وحدة من الطاقة عند التمثيل الغذائي. استخدامهم يسمح بنظام غذائي مع نسبة أقل من الدهون ونسبة أكبر من البروتين والكربوهيدرات ، [5] مما يؤدي إلى المزيد من الخيارات الغذائية.[6] وضعت هذا النظام الغذائي الأصلي من قبل بيتر هوتينلوشير في سبعينات القرن الماضي، حيث يكون 60 ٪ من السعرات الحرارية من زيت الجليسريدات الثلاثية.[20] استهلاك كميات كبيرة من الزيت تسبب تشنجات البطن والإسهال والقيء لدى بعض الأطفال. يعتبر الرقم 45 ٪ بمثابة توازن بين تحقيق الكيتوزيه الجيد والتقليل من الشكاوى المعدية المعوية.[12] إن النظام الغذائي (MCT) أقل شعبية في الولايات المتحدة، حيث أن زيت MCT هو أكثر تكلفة من الدهون الغذائية الأخرى ولا يتم تغطيته من قبل شركات التأمين.[5][8][12][51][52][53]
حمية نظام أتكينز المعدلة (MAD)
أول مرة في عام 2003، جاءت فكرة استخدام شكل من أشكال حمية نظام أتكينز لعلاج الصرع بعد أن اكتشف الآباء والأمهات والمرضى أن مرحلة البداية لحمية نظام أتكينز تسيطر علي النوبات. قام فريق الحمية الكيتوجينية في مستشفى جونز هوبكنز بتعديل نظام حمية آتكنز عن طريق إزالة الهدف المتمثل في تحقيق فقدان الوزن، وتمديد مرحلة الحث إلى أجل غير مسمى، وعلى وجه التحديد تشجيع استهلاك الدهون. بالمقارنة مع النظام الغذائي الكيتوني، فإن حمية أتكينز المعدلة (MAD) لا تضع أي حد على السعرات الحرارية أو البروتينات، ولا تحتاج نسبة الكيتون الإجمالية المنخفضة (1: 1 تقريبًا) إلى الحفاظ عليها بشكل مستمر من خلال جميع وجبات الطعام اليومية. لا يبدأ الـ MAD بسرعة ولا يحتاج الإقامة في المستشفى ويتطلب دعماً أقل من النظام الغذائي الكيتوني. تقتصر الكربوهيدرات في البداية على 10 & nbsp؛ جرام يوميًا لدى الأطفال أو 20 جرام يوميًا في البالغين، وتزداد إلى 20-30 جرامًا يوميًا بعد شهر أو نحو ذلك، اعتمادًا على التأثير على التحكم في النوبات أو تحمل القيود. مثل النظام الغذائي الكيتوني، يتطلب MAD مكملات من الفيتامينات والمعادن ويتم مراقبة الأطفال بعناية ودقة في العيادات الخارجية.[5][5][54][54]
حمية انخفاض معامل نسبة السكر في الدم
علاج انخفاض نسبة السكر في الدم (LGIT) [55] هو محاولة لتحقيق مستويات مستقرة من جلوكوز في الدم والتي شوهدت في الأطفال على النظام الغذائي الكيتوني الكلاسيكي أثناء استخدام نظام أقل تقييدًا بكثير. والفرضية هي أن مستوي جلوكوز الدم المستقر قد يكون أحد آليات العمل المتضمنة في النظام الغذائي الكيتوني، [12] الذي يحدث بسبب إبطاء امتصاص الكربوهيدرات المحدودة بسبب المحتوى العالي من الدهون. على الرغم من أنه نظام غذائي غني بالدهون (60٪ من السعرات الحرارية تقريبا من الدهون) ، [7] فإن الـ LGIT يسمح بالكربوهيدرات أكثر من النظام الغذائي التقليدي للكيتونات أو حمية أتكينز المعدلة، تقريبًا 40-60 & nbsp؛ جرام في اليوم.[5] ومع ذلك، فإن أنواع الكربوهيدرات المستهلكة تقتصر على تلك التي تحتوي على مؤشر نسبة السكر في الدم أقل من 50.[56] مثل نظام حمية أتكينز المعدل، يتم البدء في الـ LGIT والحفاظ عليه في العيادات الخارجية ولا يتطلب وزناً دقيقاً من الطعام أو دعم اختصاصي تغذية مكثف. يتم تقديم كلا النوعين في معظم المراكز التي تدير برامج النظام الغذائي الكيتوني.[5][12][57]
طريقة العمل والتحكم في النوبات
على الرغم من أن العديد من الفرضيات قد تم تقديمها لشرح كيفية عمل النظام الغذائي الكيتوني، إلا أنه يبقى لغزاً. تتضمن الفرضيات غير المتحققة الحماض الأيضي (مستويات عالية من الحمض في الدم)، واضطرابات الإلكتروليت، ونقص السكر في الدم (انخفاض سكر الدم).[24] على الرغم من أنه من المعروف أن العديد من التغيرات البيوكيميائية تحدث في دماغ المريض على النظام الغذائي الكيتوني، فمن غير المعروف أي منها له تأثير مضاد للاختلاج. يشبه عدم الفهم في هذا المجال الوضع مع العديد من الأدوية المضادة للاختلالات.[58]
على النظام الغذائي الكيتوني، يتم تقييد الكربوهيدرات، وبالتالي لا يمكن أن توفر طاقة لجميع الاحتياجات الأيضية في الجسم. بدلاً من ذلك، يتم استخدام الأحماض الدهنية كمصدر رئيسي للطاقة. يتم استخدام هذه من خلال (التمثيل الغذائي الأحماض الدهنية) في الخلية في الميتوكوندريا (الأجزاء المنتجة للطاقة في الخلية). يستطيع البشر تحويل بعض الأحماض الأمينية إلى الجلوكوز، ولكن لا يمكن القيام بذلك باستخدام الأحماض الدهنية.[59] بما أن الأحماض الأمينية مطلوبة لإنتاج البروتينات، الضرورية لنمو وإصلاح أنسجة الجسم، وهذه لا يمكن استخدامها إلا لإنتاج الجلوكوز. وهذا يمكن أن يشكل مشكلة بالنسبة للدماغ، حيث أنه عادة ما يغذيه الجلوكوز فقط، ومعظم الأحماض الدهنية لا تعبر الحاجز الدموي الدماغي. ومع ذلك، يمكن للكبد استخدام الأحماض الدهنية طويلة السلسلة لتخليق ثلاثة أجسام كيتونية (بيتا هيدروكسي بيوتيرك أسيد، وحمض أسيتو الأسيتيك، وأستون). تدخل هذه الأجسام الكيتونية الدماغ كبديلاً جزئياً عن جلوكوز الدم كمصدر للطاقة.[58][58][58][58][60]
مقالات ذات صلة
ملاحظات
- In this article, kcal stands for سعرةs as a unit of measure (4.1868 kJ), and calories stands for "energy" from food.
- Unless otherwise stated, the term fasting in this article refers to going without food while maintaining calorie-free fluid intake.
- Hippocrates, On the Sacred Disease, ch. 18; vol. 6.
- Hippocrates, Epidemics, VII, 46; vol. 5.
- Galen, De venae sect. adv. Erasistrateos Romae degentes, c. 8; vol. 11.
- Galen, De victu attenuante, c. 1.
مراجع
- Bergqvist AG. Long-term monitoring of the ketogenic diet: Do's and Don'ts. Epilepsy Res. 2011 Aug 18;100(3):261–6. doi:10.1016/j.eplepsyres.2011.05.020. PMID 21855296.
- Sampath A, Kossoff EH, Furth SL, Pyzik PL, Vining EP. Kidney stones and the ketogenic diet: risk factors and prevention (PDF). J Child Neurol. 2007 Apr;22(4):375–8. doi:10.1177/0883073807301926. PMID 17621514 نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- Freeman JM, Kossoff EH, Hartman AL. The ketogenic diet: one decade later. Pediatrics. 2007 Mar;119(3):535–43. doi:10.1542/peds.2006-2447. PMID 17332207
- Martin K, Jackson CF, Levy RG, Cooper PN. Ketogenic diet and other dietary treatments for epilepsy. Cochrane Database Syst Rev. 2016 Feb 9;2:CD001903. doi:10.1002/14651858.CD001903.pub3. PMID 22419282. نسخة محفوظة 10 يونيو 2018 على موقع واي باك مشين.
- Kossoff EH, Zupec-Kania BA, Rho JM. Ketogenic diets: an update for child neurologists. J Child Neurol. 2009 Aug;24(8):979–88. doi:10.1177/0883073809337162. PMID 19535814
- Liu YM. Medium-chain triglyceride (MCT) ketogenic therapy. Epilepsia. 2008 Nov;49 Suppl 8:33–6. doi:10.1111/j.1528-1167.2008.01830.x. PMID 19049583 نسخة محفوظة 22 أغسطس 2017 على موقع واي باك مشين.
- Zupec-Kania BA, Spellman E. An overview of the ketogenic diet for pediatric epilepsy. Nutr Clin Pract. 2008 Dec–2009 Jan;23(6):589–96. doi:10.1177/0884533608326138. PMID 19033218
- Gano LB, Patel M, Rho JM. Ketogenic diets, mitochondria, and neurological diseases. J Lipid Res. 2014 Nov;55(11):2211-28. doi:10.1194/jlr.R048975. PMID 24847102. نسخة محفوظة 19 مايو 2019 على موقع واي باك مشين.
- Stafstrom CE. An introduction to seizures and epilepsy. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. .
- de Boer HM, Mula M, Sander JW. The global burden and stigma of epilepsy. Epilepsy Behav. 2008 May;12(4):540–6. doi:10.1016/j.yebeh.2007.12.019. PMID 18280210
- McNally MA, Pyzik PL, Rubenstein JE, Hamdy RF, Kossoff EH. Empiric use of potassium citrate reduces kidney-stone incidence with the ketogenic diet. Pediatrics. 2009 Aug;124(2):e300–4. doi:10.1542/peds.2009-0217. PMID 19596731
- Kossoff EH, Zupec-Kania BA, Amark PE, Ballaban-Gil KR, Bergqvist AG, Blackford R, et al. Optimal clinical management of children receiving the ketogenic diet: recommendations of the International Ketogenic Diet Study Group. Epilepsia. 2009 Feb;50(2):304–17. doi:10.1111/j.1528-1167.2008.01765.x. PMID 18823325 نسخة محفوظة 13 فبراير 2018 على موقع واي باك مشين.
- Wheless JW. History and origin of the ketogenic diet (PDF). In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. . نسخة محفوظة 05 يونيو 2011 على موقع واي باك مشين.
- Temkin O. The falling sickness: a history of epilepsy from the Greeks to the beginnings of modern neurology. 2nd ed. Baltimore: Johns Hopkins University Press; 1971. p. 33, 57, 66, 67, 71, 78. .
- Guelpa G, Marie A. La lutte contre l'epilepsie par la desintoxication et par la reeducation alimentaire. Rev Ther med-Chirurg. 1911; 78: 8–13. As cited by Bailey (2005).
- Bailey EE, Pfeifer HH, Thiele EA. The use of diet in the treatment of epilepsy. Epilepsy Behav. 2005 Feb;6(1):4–8. doi:10.1016/j.yebeh.2004.10.006. PMID 15652725
- Turner Z, Kossoff EH. The ketogenic and Atkins diets: recipes for seizure control (PDF). Pract Gastroenterol. 2006 Jun;29(6):53, 56, 58, 61–2, 64. نسخة محفوظة 31 أغسطس 2016 على موقع واي باك مشين.
- Kossoff EH. Do ketogenic diets work for adults with epilepsy? Yes! epilepsy.com. 2007, March. Cited 24 October 2009. نسخة محفوظة 27 أبريل 2018 على موقع واي باك مشين.
- Musa-Veloso K, Cunnane SC. Measuring and interpreting ketosis and fatty acid profiles in patients on a high-fat ketogenic diet. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 129–41. .
- Huttenlocher PR, Wilbourn AJ, Signore JM. Medium-chain triglycerides as a therapy for intractable childhood epilepsy. Neurology. 1971 Nov;21(11):1097–103. doi:10.1212/wnl.21.11.1097. PMID 5166216
- Neal EG, Chaffe H, Schwartz RH, Lawson MS, Edwards N, Fitzsimmons G, et al. The ketogenic diet for the treatment of childhood epilepsy: a randomised controlled trial. Lancet Neurol. 2008 Jun;7(6):500–6. doi:10.1016/S1474-4422(08)70092-9. PMID 18456557
- Kossoff E. Is there a role for the ketogenic diet beyond childhood? In: Freeman J, Veggiotti P, Lanzi G, Tagliabue A, Perucca E. The ketogenic diet: from molecular mechanisms to clinical effects. Epilepsy Res. 2006 Feb;68(2):145–80. doi:10.1016/j.eplepsyres.2005.10.003. PMID 16523530 نسخة محفوظة 01 أبريل 2018 على موقع واي باك مشين.
- Vining EP, Freeman JM, Ballaban-Gil K, Camfield CS, Camfield PR, Holmes GL, et al. A multicenter study of the efficacy of the ketogenic diet. Arch Neurol. 1998 Nov;55(11):1433–7. doi:10.1001/archneur.55.11.1433. PMID 9823827 نسخة محفوظة 08 فبراير 2012 على موقع واي باك مشين.
- Hartman AL, Vining EP. Clinical aspects of the ketogenic diet. Epilepsia. 2007 Jan;48(1):31–42. doi:10.1111/j.1528-1167.2007.00914.x PMID 17241206 نسخة محفوظة 13 أغسطس 2017 على موقع واي باك مشين.
- Kossoff EH, Laux LC, Blackford R, Morrison PF, Pyzik PL, Hamdy RM, et al. When do seizures usually improve with the ketogenic diet? (PDF). Epilepsia. 2008 Feb;49(2):329–33. doi:10.1111/j.1528-1167.2007.01417.x. PMID 18028405 نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- Freeman JM, Vining EP, Pillas DJ, Pyzik PL, Casey JC, Kelly LM. The efficacy of the ketogenic diet—1998: a prospective evaluation of intervention in 150 children. Pediatrics. 1998 Dec;102(6):1358–63. doi:10.1542/peds.102.6.1358. PMID 9832569. https://web.archive.org/web/20040629224858/http://www.hopkinsmedicine.org/press/1998/DECEMBER/981207.HTM Lay summary]—JHMI Office of Communications and Public Affairs. Updated 7 December 1998. Cited 6 March 2008. نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- Hemingway C, Freeman JM, Pillas DJ, Pyzik PL. The ketogenic diet: a 3- to 6-year follow-up of 150 children enrolled prospectively. Pediatrics. 2001 Oct;108(4):898–905. doi:10.1542/peds.108.4.898.PMID 11581442
- Kossoff EH, Rho JM. Ketogenic diets: evidence for short- and long-term efficacy. Neurotherapeutics. 2009 Apr;6(2):406–14. doi:10.1016/j.nurt.2009.01.005 PMID 19332337. نسخة محفوظة 01 أبريل 2018 على موقع واي باك مشين.
- Henderson CB, Filloux FM, Alder SC, Lyon JL, Caplin DA. Efficacy of the ketogenic diet as a treatment option for epilepsy: meta-analysis. J Child Neurol. 2006 Mar;21(3):193–8. doi:10.2310/7010.2006.00044. PMID 16901419
- Liu H, Yang Y, Wang Y, Tang H, Zhang F, Zhang Y, Zhao Y. Ketogenic diet for treatment of intractable epilepsy in adults: A meta-analysis of observational studies. Epilepsia Open. 2018 Feb 19;3(1):9-17. doi:10.1002/epi4.12098. PMID 29588983. نسخة محفوظة 31 يناير 2020 على موقع واي باك مشين.
- Bergqvist AGC. Indications and Contraindications of the Ketogenic diet. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 53–61. .
- Epilepsies: diagnosis and management. National Institute for Health and Care Excellence (NICE). Published January 2012. Updated February 2016. Cited March 2018. . نسخة محفوظة 23 مارس 2018 على موقع واي باك مشين.
- Scottish Intercollegiate Guidelines Network. Guideline 81, Diagnosis and management of epilepsies in children and young people. A national clinical guideline (PDF). Edinburgh: Royal College of Physicians; 2005. . نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- Stainman RS, Turner Z, Rubenstein JE, Kossoff EH. Decreased relative efficacy of the ketogenic diet for children with surgically approachable epilepsy. Seizure. 2007 Oct;16(7):615–9. doi:10.1016/j.seizure.2007.04.010. PMID 17544706 نسخة محفوظة 2020-05-21 على موقع واي باك مشين.
- Kossoff EH, McGrogan JR, Freeman JM. Benefits of an all-liquid ketogenic diet. Epilepsia. 2004 Sep;45(9):1163. doi:10.1111/j.0013-9580.2004.18504.x. PMID 15329084.
- Kossoff EH, Freeman JM. The ketogenic diet—the physician's perspective. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 53–61. .
- Spendiff S. The diet that can treat epilepsy. Guardian. 2008 Aug 15;Sect. Health & wellbeing. نسخة محفوظة 01 أبريل 2018 على موقع واي باك مشين.
- Wang S, Fallah A. Optimal management of seizures associated with tuberous sclerosis complex: current and emerging options. Neuropsychiatr Dis Treat. 2014 Oct 23;10:2021-30. doi:10.2147/NDT.S51789. PMID 25364257 نسخة محفوظة 10 يناير 2020 على موقع واي باك مشين.
- Mastriani KS, Williams VC, Hulsey TC, Wheless JW, Maria BL. Evidence-based versus reported epilepsy management practices. J Child Neurol. 2008 Feb 15;23(5):507–14. doi:10.1177/0883073807309785. PMID 18281618
- Huffman J, Kossoff EH. State of the ketogenic diet(s) in epilepsy (PDF). Curr Neurol Neurosci Rep. 2006 Jul;6(4):332–40. doi:10.1007/s11910-006-0027-6. PMID 16822355 نسخة محفوظة 17 ديسمبر 2019 على موقع واي باك مشين.
- Zupec-Kania B, Werner RR, Zupanc ML. Clinical Use of the Ketogenic Diet—The Dietitian's Role. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 63–81. .
- Vogelstein F. Epilepsy's Big, Fat Miracle. New York Times. 2010 Nov 17. نسخة محفوظة 01 أبريل 2018 على موقع واي باك مشين.
- Kim DY, Rho JM. The ketogenic diet and epilepsy. Curr Opin Clin Nutr Metab Care. 2008 Mar;11(2):113–20. doi:10.1097/MCO.0b013e3282f44c06. PMID 18301085
- Martinez CC, Pyzik PL, Kossoff EH. Discontinuing the ketogenic diet in seizure-free children: recurrence and risk factors. Epilepsia. 2007 Jan;48(1):187–90. doi:10.1111/j.1528-1167.2006.00911.x. PMID 17241227 نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- Kossoff EH, McGrogan JR. Worldwide use of the ketogenic diet. Epilepsia. 2005 Feb;46(2):280–9. doi:10.1111/j.0013-9580.2005.42704.x. PMID 15679509.
- Kossoff EH, Dorward JL, Molinero MR, Holden KR. The modified Atkins diet: a potential treatment for developing countries. Epilepsia. 2008 Sep;49(9):1646–7. doi:10.1111/j.1528-1167.2008.01580_6.x PMID 18782218 نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- Kossoff EH. [webarchive|url=https://web.archive.org/web/20091228064054/http://www.epilepsy.com/epilepsy/keto_news_jul09 The Ketogenic Diet ... in a bottle?]. Keto News. Epilepsy.com. Updated July 2009. Cited 29 November 2009. نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- Zupec-Kania B. KetoCalculator: a web-based calculator for the ketogenic diet. Epilepsia. 2008 Nov;49 Suppl 8:14–6. doi:10.1111/j.1528-1167.2008.01824.x. PMID 19049577 نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- KetoVOLVE: 4:1 Ratio Powder. Solace Nutrition. Cited 17 June 2013. نسخة محفوظة 29 أبريل 2020 على موقع واي باك مشين.
- KetoCal Product Information. Nutricia North America. Updated 2009. Cited 16 January 2010. نسخة محفوظة 03 سبتمبر 2017 على موقع واي باك مشين.
- Barañano KW, Hartman AL. The ketogenic diet: uses in epilepsy and other neurologic illnesses. Curr Treat Options Neurol. 2008;10(6):410–9. doi:10.1007/s11940-008-0043-8. PMID 18990309 نسخة محفوظة 02 سبتمبر 2018 على موقع واي باك مشين.
- Allen BG, Bhatia SK, Anderson CM, et al. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism. Redox Biol. 2014 Aug 7;2C:963–70. doi:10.1016/j.redox.2014.08.002. PMID 25460731 نسخة محفوظة 12 مارس 2018 على موقع واي باك مشين.
- Weber DD, Aminazdeh-Gohari S, Kofler B. Ketogenic diet in cancer therapy. Aging (Albany NY). 2018 Feb 11;10(2):164-165. doi:10.18632/aging.101382. PMID 29443693. نسخة محفوظة 02 أبريل 2018 على موقع واي باك مشين.
- Kossoff EH, Dorward JL. The modified Atkins diet. Epilepsia. 2008 Nov;49 Suppl 8:37–41. doi:10.1111/j.1528-1167.2008.01831.x. PMID 19049584
- Pfeifer, Heidi H. Low glycemic index treatment. Epilepsy Foundation. 22 August 2013. Cited 31 March 2018. نسخة محفوظة 27 أبريل 2018 على موقع واي باك مشين.
- Wang D, Pascual JM, De Vivo D. Glucose Transporter Type 1 Deficiency Syndrome. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Stephens K, Amemiya A, editors. GeneReviews. Seattle (WA): University of Washington, Seattle; 1993-2018. 2002 Jul 30 [updated 2018 Mar 1]. PMID 20301603. نسخة محفوظة 18 يناير 2017 على موقع واي باك مشين.
- Muzykewicz DA, Lyczkowski DA, Memon N, Conant KD, Pfeifer HH, Thiele EA. Efficacy, safety, and tolerability of the low glycemic index treatment in pediatric epilepsy. Epilepsia. 2009 May;50(5):1118–26. doi:10.1111/j.1528-1167.2008.01959.x. PMID 19220406
- Hartman AL, Gasior M, Vining EP, Rogawski MA. The neuropharmacology of the ketogenic diet. Pediatr Neurol. 2007 May;36(5):281–292. doi:10.1016/j.pediatrneurol.2007.02.008. PMID 17509459 نسخة محفوظة 01 يونيو 2018 على موقع واي باك مشين.
- Kerndt PR, Naughton JL, Driscoll CE, Loxterkamp DA. Fasting: the history, pathophysiology and complications. West J Med. 1982 Nov;137(5):379–99. PMID 6758355 نسخة محفوظة 27 أكتوبر 2017 على موقع واي باك مشين.
- Porta N, Vallée L, Lecointe C, Bouchaert E, Staels B, Bordet R, Auvin S. Fenofibrate, a peroxisome proliferator-activated receptor-alpha agonist, exerts anticonvulsive properties. Epilepsia. 2009 Apr;50(4):943–8. doi:10.1111/j.1528-1167.2008.01901.x. PMID 19054409.
مزيد من القراءة
- Freeman JM, Kossoff EH, Freeman JB, Kelly MT. The Ketogenic Diet: A Treatment for Children and Others with Epilepsy. 4th ed. New York: Demos; 2007. (ردمك ).
روابط خارجية
- Matthew's Friends. A UK charity and information resource.
- نظام غذائي كيتوني على مشروع الدليل المفتوح
- The Charlie Foundation. A US charity and information resource, set up by جيم أبراهامز.
- epilepsy.com: Dietary Therapies & Ketogenic News. Information and regular research news updates.
- A Talk with John Freeman: Tending the Flame. An interview discussing the ketogenic diet that appeared in BrainWaves, Fall 2003, Volume 16, Number 2.
- Lurie Children's Hospital: How the Ketogenic Diet Works.