الحصاة الكلوية أو التحصي البولي (Urolithiasis)، هي كتلة من مواد صلبة تتجمع في مجرى البول.[2] تتشكل حصى الكلى عادة في الكلى، وتترك الجسم خلال تيار البول. قد تمر حصوة صغيرة، وتخرج من الجسم دون التسبب في أعراض.[2] ولكن إذا كان حجم الحصوة أكبر من 5 مللي متر (0.2 بوصة)، فيمكن أن تسبب انسداد الحالب، مما يؤدي إلى ألم شديد في أسفل الظهر أو البطن.[2][3] وقد تؤدي أيضًا إلى بول دموي أو قيء أو عسر التبول.[2] ويتكون لدى حوالي نصف المرضى حصوات مرة أخرى في غضون عشر سنوات.[4]
| مرض حصاة كلوية | |
|---|---|
حصاة كلوية بقطر قدره 8 ميليمتر أي ما يعادل 0.3 إنش
| |
| تسميات أخرى | urolithiasis, kidney stone, renal calculus, nephrolith, kidney stone disease,[1] |
| معلومات عامة | |
| الاختصاص | طب الجهاز البولي، طب الكلى |
| من أنواع | حصاة |
| التاريخ | |
| وصفها المصدر | قاموس الموسوعة الحديثة، وقاموس غرانات الموسوعي |
تتكون معظم الحصوات نتيجة مزيج من الوراثة والعوامل البيئية.[2] وتشمل عوامل الخطر ارتفاع مستويات الكالسيوم في البول، والسمنة، وبعض الأطعمة، وبعض الأدوية، ومكملات الكالسيوم، وفرط نشاط الغدة الدرقية، والنقرس، وعدم شرب السوائل الكافية.[2][4] وتتشكل الحصوات في الكلى عندما يزيد تركيز المعادن في البول. ويستند التشخيص عادة إلى الأعراض، وتحليل البول، والتصوير التشخيصي الطبي. وقد تكون اختبارات الدم مفيدة أيضًا. وعادة ما تصنف الحصوات حسب مكانها: تحصي الكلية (nephrolithiasis)، أو الحالب (ureterolithiasis)، أو المثانة (cystolithiasis)، أو باسم المادة المصنوعة منها (الكالسيوم، أو حمض اليوريك، أو السيستين).[2]
للوقاية في أولئك الذين لديهم حصوات، يجب شرب الكثير من السوائل بحيث يتم إنتاج أكثر من لترين من البول يوميًا. إذا لم يكن هذا فعالًا بما فيه الكفاية، يمكن أخذ ثيازيد المدر للبول، أو سيترات، أو ألوبورينول. ومن المستحسن تجنب المشروبات الغازية التي تحتوي على حمض الفوسفوريك (مثل الكولا).[5] لا حاجة للعلاج،[2] إذا كانت الحصوات لا تسبب أي أعراض. وإلا فإن السيطرة على الألم عادة ما تكون الخطوة الأولى في العلاج، وذلك باستخدام مضادات الالتهاب اللاستيرويدية أو الأفيونيات.[3][6] ويمكن مساعدة الحصوات الكبيرة على المرور باستخدام التامسولوسين،[7] أو قد تتطلب استخدام بعض الإجراءات، مثل تفتيت الحصوات بموجات صدمة من خارج الجسم، أو بمنظار الحالب، أو استئصال حصاة الكلية عن طريق الجلد.[2]
يصاب ما بين 1٪- 15٪ من الناس في جميع أنحاء العالم بحصى الكلى في مرحلة ما من حياتهم.[4] في عام 2015، حدثت 22.1 مليون حالة،[8] مما أدى إلى حوالي 16100 حالة وفاة.[9] وأصبحت أكثر شيوعًا في العالم الغربي منذ سبعينات القرن التاسع عشر.[4] وعمومًا، عدد الرجال الذين يكون لديهم حصوات كلى يكون أكبر من النساء.[2] وقد أصيب البشر بحصى الكلى عبر التاريخ، ويعود تاريخ بداية وصف العمليات الجراحية لإزالتها إلى عام 600 قبل الميلاد.[1]
العلامات والأعراض
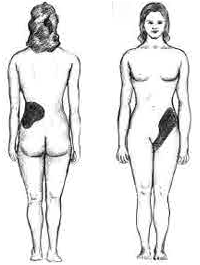
ومن أهم أعراض حصاة الكلية هو القولنج الكلوي.[10]، حيث أن السمة المميزة لحصوات الكلى التي تسد الحالب أو الحويضة الكلوية هو ألم شديد جدا متقطع يشع من الخاصرة إلى الأعضاء التناسلية أو إلى الجزء الداخلي من الفخذ.[11] وغالبًا ما يوصف هذا الألم، والمعروف باسم المغص الكلوي، بأنه واحد من أقوى أحاسيس الألم المعروفة.[12] وغالبًا ما يكون مصحوب بإلحاح بولي، وأرق، وبول دموي، وتعرق، وغثيان، وقيء. وعادة ما يأتي في شكل نوبات تستمر من 20 إلى 60 دقيقة، ناجمة عن تقلصات الحالب في محاولة منه لطرد الحصوة.[11] الاتصال الجنيني الأصل بين المسالك البولية، والجهاز التناسلي، والجهاز الهضمي هو أساس إشعاع الألم إلى الغدد التناسلية، وكذلك سبب أعراض الغثيان والقيء الشائعة مع حصوات الكلى.[13] ويمكن ملاحظة الآزوتيمية، وموه الكلية بعد عرقلة تدفق البول من خلال أحد أو كلا الحالبين.[14] أحيانًا يمكن الخلط بين الألم في الربع السفلي الأيسر من البطن والتهاب الرتوج؛ وذلك لأن القولون السيني يتداخل مع الحالب، لذا قد يكون من الصعب تحديد مكان الألم بسبب قرب هذين الهيكلين.
عوامل الخطر
يعتبر التجفاف الناتج من قلة تناول السوائل عامل رئيسي في تشكيل الحصوات.[11][15] كما أن السمنة عامل خطر رئيسي أيضًا.
وقد يؤدي تناول كميات كبيرة من البروتين الحيواني،[11] والصوديوم، والسكريات المكررة، والفركتوز، وشراب الذرة عالي الفركتوز،[16] والأكسالات،[17] وعصير الجريب فروت، وعصير التفاح إلى زيادة خطر تكون حصوات الكلى.[15]
يكن أن تنتج حصى الكلى من حالة مرضية كامنة في التمثيل الغذائي، مثل حماض الأنبوب الكلوي البعيد،[18] ومرض دنت،[19] وفرط جارات الدرقية،[20] وفرط أوكسالات البول الأولي،[21] والكلى الإسفنجية. حيث أن 3-20٪ من الناس الذين يشكلون حصى الكلى يكون لديهم نخاع كلى إسفنجي.[22][23]
وتكون حصى الكلى أكثر شيوعًا في الأشخاص الذين يعانون من مرض كرون.[24] ويرتبط مرض كرون بفرط أوكسالات البول، وسوء امتصاص المغنسيوم.[25]
قد يتم فحص شخص لمثل هذه الاضطرابات إذا كان لديه حصى كلى متكررة. ويتم ذلك عادة عن طريق جمع البول على مدار 24 ساعة، وتحليله لتحديد السمات التي تعزز تشكيل الحصوات.[14]
الكالسيوم
الكالسيوم هو أحد مكونات النوع الأكثر شيوعًا من حصى الكلى البشرية، وهي بلورات أكسالات الكالسيوم. وتشير بعض الدراسات إلى أن الأشخاص الذين يتناولون الكالسيوم أو فيتامين د كمكمل غذائي عرضة أكثر من غيرهم لتكوين حصى الكلى. وقد استخدمت هذه النتائج كأساس لتحديد الكمية اليومية الموصى بها من الكالسيوم للبالغين.[26]
في أوائل التسعينات، وجدت دراسة أجريت من أجل مبادرة صحة المرأة في الولايات المتحدة أن النساء بعد سن اليأس الذين يستهلكون 1000 مللي جم من الكالسيوم التكميلي، و400 وحدة دولية من فيتامين د يوميًا لمدة سبع سنوات كان لديهم خطر أعلى بنسبة 17٪ لتكوين حصى الكلى من النساء اللاتي تتناول الدواء الوهمي.[27] كما أظهرت دراسة صحة الممرضات أيضًا وجود علاقة بين تناول الكالسيوم التكميلي وتكوين حصوات الكلى.[17]
على عكس الكالسيوم التكميلي، لا يبدو أن تناول كميات كبيرة من الكالسيوم في الغذاء يسبب حصى الكلى، بل يمكن أن يحمي من تكوينها.[17][27] وربما يكون هذا مرتبطًا بدور الكالسيوم في الارتباط مع الأكسالات التي يتم تناولها، والموجودة في الجهاز الهضمي. مع انخفاض كمية الكالسيوم الذي يتم تناوله في الغذاء، تزداد كمية الأكسالات المتاحة للامتصاص في مجرى الدم. ثم تفرز هذه الأكسالات بكميات أكبر في البول عن طريق الكلى. وفي البول، تكون الأوكسالات محفز قوي جدًا لترسيب أكسالات الكالسيوم- حوالي 15 مرة أقوى من الكالسيوم. ووجدت دراسة أجريت في عام 2004 أن الوجبات الغذائية التي تحتوي على كمية منخفضة من الكالسيوم ترتبط بمخاطر عامة أعلى لتشكيل حصى الكلى.[28] وبالنسبة لكثير من الأفراد، فإن عوامل الخطر الأخرى لتكوّن حصى الكلى، مثل تناول كميات كبيرة من الأكسالات الغذائية، وانخفاض كمية السوائل، تلعب دورًا أكبر من تناول الكالسيوم.[29]
كهارل أخرى
الكالسيوم ليس الكهرل الوحيد الذي يؤثر على تشكيل حصى الكلى. على سبيل المثال، قد يؤدي زيادة تناول الطعام الذي يحتوي على كميات كبيرة من الصوديوم إلى خطر تشكيل الحصوات، مع زيادة إفراز الكالسيوم في البول.[17]
وقد يؤدي شرب مياه الصنبور المضاف إليها الفلورايد إلى زيادة خطر تكوّن حصاة الكلى بواسطة آلية مماثلة، على الرغم من أن هناك حاجة لمزيد من الدراسات الوبائية لتحديد ما إذا كان الفلورايد الموجود في مياه الشرب مرتبط بزيادة حالات حصى الكلى أم لا.[30] بينما يبدو أن زيادة تناول الغذاء المحتوي على بوتاسيوم يقلل من خطر تكوّن الحصوات؛ لأن البوتاسيوم يعزز إفراز البول من السترات المثبط لتكوين بلورات الكالسيوم.
كما أن حصى الكلى تكون أكثر عرضة للتطور والنمو، إذا تناول الشخص المغنسيوم الغذائي بكميات قليلة. حيث أن المغنيسيوم يمنع تكوّن الحصوات.[31]
البروتين الحيواني
وعادة ما تحتوي النظم الغذائية في الدول الغربية على نسبة كبيرة من البروتين الحيواني. ويخلق استهلاك البروتين الحيواني حمل حمضي يؤدي إلى زيادة إفراز الكالسيوم، وحمض اليوريك، والسيترات المختزل في البول. إفراز البول للأحماض الأمينية الكبريتية الزائدة (مثل: السيستين والميثيونين)، وحمض اليوريك، وغيرها من نتاج الأيض الحمضية من البروتين الحيواني يحمض البول، مما يعزز تشكيل حصى الكلى.[32] وعادة ما يكون إفراز السترات في البول منخفض في أولئك الذين يتناولون كميات كبيرة من البروتين الحيواني، في حين أن النباتيين يميلون إلى إفراز مستويات أعلى من السترات في البول.[17] حيث أن انخفاض السترات في البول يعزز تشكيل الحصوات.[32]
الفيتامينات
الأدلة التي تدل على ارتباط مكملات فيتامين ج مع زيادة معدل تكوّن حصى الكلى غير حاسمة.[33] قد يزيد المدخول الغذائي الزائد من فيتامين ج من خطر تكوّن حصوات أوكسالات الكالسيوم، ولكن هذا نادرًا ما يحدث في الواقع. كما أن الارتباط بين تناول فيتامين د، وحصى الكلى ضعيف أيضًا. وقد يزيد الإفراط في تناول مكملات فيتامين د من خطر تكوين الحصوات عن طريق زيادة امتصاص الأمعاء للكالسيوم. ولكن الجرعة التي تصحح نقص الفيتامين في الجسم لا تسبب ذلك.[17]
عوامل أخرى
لا توجد بيانات قاطعة تدل على علاقة السبب والنتيجة بين استهلاك المشروبات الكحولية وحصى الكلى. ومع ذلك، فقد افترض البعض أن بعض السلوكيات المرتبطة بالشرب المتكرر للكحوليات يمكن أن يؤدي إلى التجفاف، والذي يمكن بدوره أن يؤدي إلى تكوين حصى الكلى.[34]
توقعت الجمعية الأمريكية للمسالك البولية أن يؤدي الاحتباس الحراري إلى زيادة حالات حصى الكلى في الولايات المتحدة من خلال توسع "حزام حصى الكلى" في جنوب الولايات المتحدة.[35]
وقد أشارت دراسة ما أن الأشخاص الذين يعانون من اضطرابات التكاثر اللمفي، والتكاثر النقوي، وتم علاجهم بالعلاج الكيميائي يميلون إلى إظهار أعراض حصوات الكلى في 1.8٪ من الوقت.[36]
الفيسيولوجيا المرضية
نقص السيترات في البول
يمكن أن يسبب انخفاض إفراز السيترات البولية (< 320 ملغ / يوم) حصى الكلى في حوالي 2/3 الحالات. ويرتبط الدور الوقائي للسترات بعدة آليات؛ حيث تقلل السيترات من تشبع البول بأملاح الكالسيوم من خلال تشكيل مركبات قابلة للذوبان في الماء مع أيونات الكالسيوم، وعن طريق تثبيط نمو وتجمع البلورات. عادة ما يوصَف العلاج بسيترات البوتاسيوم، أو سيترات البوتاسيوم والمغنيسيوم، في الممارسة السريرية من أجل زيادة السيترات البولية، والحد من معدلات تكوين الحصوات.[37]
فرط تشبع البول
يصبح البول فائق التشبع عندما تكون كمية البول (المذيب) أكثر من المذاب مع تكوين واحد أو أكثر من البلورات، وتتكون نواة التبلور من خلال عملية التنوي.[22] وتكوّن النوى غير المتجانسة (حيث يوجد سطح صلب يمكن أن تنمو فيه البلورات) حصوات بسرعة أكبر من النوى المتجانسة (حيث تنمو البلورة في وَسَط سائل بدون وجود مثل ذلك السطح الصلب)، لأنها تتطلب طاقة أقل. وعن طريق التصاق الخلايا على سطح الحليمة الكلوية، تستطيع أنوية التبلور أن تنمو، وتتجمع في كتلة منتظمة. واعتمادًا على التركيب الكيميائي للبلورة، فإن عملية تشكيل الحصى قد تتقدم بسرعة أكبر عندما تكون درجة حموضة البول مرتفعة أو منخفضة بشكل غير عادي.[38]
يعتمد تشبع البول الفائق على الرقم الهيدروجيني للبول مع الوضع في الاعتبار مركبات البللورات. على سبيل المثال، عند الرقم الهيدروجيني 7.0، يكون ذوبان حمض اليوريك في البول هو 158 ملغ / 100 مل. وتقليل الرقم الهيدروجيني إلى 5.0 يقلل من ذوبان حمض اليوريك إلى أقل من 8 ملغ / 100 مل. يتطلب تكوين حصوات حمض اليوريك الجمع بين ارتفاع مستويات حمض اليوريك في البول، وانخفاض درجة حموضة البول. لا تتكون الحصوات إذا كان هناك فرط حمض اليوريك في البول وحده، إذا كانت درجة حموضة البول قلوية.[39] فوق تشبع البول هو ضروري، ولكن ليس كافيًا، كشرط لتكوين أي حصوات بولية.[22] فهو السبب الكامن وراء تكون حصوات حمض اليوريك والسيستين، ولكن الحصوات القائمة على الكالسيوم (وخاصة حصوات أكسالات الكالسيوم) قد يكون سببها أكثر تعقيدًا.[40]
مثبطات تكوين الحصوات
يحتوي البول العادي على عوامل مخلبية، مثل السيترات التي تمنع تنوي، ونمو، وتجمع البلورات التي تحتوي على الكالسيوم. وتشمل المثبطات الذاتية الأخرى كالغرانيولين (بروتين S-100 الرابط للكالسيوم )، وبروتين تام-هورسفال، وغليكوز أمينوغليكانز، ويوروبونتين (شكل من أشكال الأوستيوبونتين)، ونيفروكالسين (بروتين سكري حمضي)، وببتيد البروثرومبين F1، والبيكونين (بروتين غني بحمض اليورونيك). ولم يتم بعد توضيح الآليات الكيميائية الحيوية لعمل هذه المواد. ومع ذلك، عندما تقل هذه المواد عن نسبها الطبيعية، يمكن أن تتكون الحصوات من تجمع البلورات.[41]
يمنع تناول كمية غذائية كافية من المغنيسيوم والسيترات تشكيل أكسالات الكالسيوم، وحصى فوسفات الكالسيوم. بالإضافة إلى ذلك، يعمل المغنسيوم والسيترات بالتآزر لتثبيط تكوين حصى الكلى. وتعتمد فعالية المغنيسيوم في منع تكوين ونمو الحصوات على الجرعة.[17][31][42]
التشخيص
يتم تشخيص حصى الكلى على أساس المعلومات التي تم الحصول عليها من التاريخ المرضي، والفحص البدني، وتحليل البول، والفحوصات الإشعاعية.[43] وعادة ما يتم التشخيص السريري على أساس مكان وشدة الألم، الذي يكون عادة ألم مغصي. كما يكون هناك ألم في الظهر عندما تسد الحصوات الكلى.[44] وقد يكشف الفحص البدني عن حُمى، وألم في الزاوية الضلعية الفقرية على الجانب المصاب.[43]
التصوير التشخيصي
لا يتطلب الأشخاص الذين لديهم تاريخ من الحصوات، وسنهم أقل من 50 سنة، ويعانون من أعراض الحصوات دون أي علامات تأكيدية، التصوير بالحزمة الإسطوانية الحلزونية الطبقي المبرمج.[45]
وإلا فإن التصوير بالحزمة الإسطوانية الحلزونية الطبقي المبرمج بمقاطع 5 مليمتر (0.2 بوصة) هو الطريقة التشخيصية الأفضل في التقييم الشعاعي لتحصي الكلية المشتبه به.[3][13][43][46][47] يمكن الكشف عن جميع الحصوات بالأشعة المقطعية باستثناء نوع من الحصوات النادرة جدًا، التي تتكون من بعض بقايا الأدوية الموجودة في البول،[48] مثل إندينافير. الحصوات التي تحتوي على الكالسيوم تكون ظليلة للأشعة نسبيًا، ويمكن الكشف عنها في كثير من الأحيان عن طريق التصوير الشعاعي التقليدي للبطن، الذي يشمل الكلى، والحالب، والمثانة.[48] حوالي 60٪ من جميع الحصوات الكلوية تكون ذات كثافة إشعاعية عالية.[46][49] وبشكل عام، فإن حصوات فوسفات الكالسيوم لديها أكبر كثافة، تليها أكسالات الكالسيوم، وحصوات فوسفات الأمونيوم والمغنيسيوم. بينما حصوات السيستين هي فقط التي تكون ضعيفة الكثافة الإشعاعية، في حين أن حصوات حمض اليوريك عادة ما تكون شفافة تمامًا إشعاعياً.[50]
وفي حالة عدم توفر التصوير المقطعي المحوسب، يمكن إجراء فحص الحويضة الوريدية للمساعدة على تأكيد تشخيص التحصي البولي. وذلك عن طريق حقن مادة تباين في الوريد، ثم تصوير الكلى، والحالب، والمثانة. ويتم تحديد الحصوات الموجودة في الكلى، أو الحالب، أو المثانة بشكل أفضل من خلال استخدام عامل التباين. ويمكن أيضًا الكشف عن الحصوات عن طريق تصوير الحويضة من الوراء، حيث يتم حقن عامل تباين مماثل مباشرة في الفوهة البعيدة للحالب (حيث ينتهي الحالب عند دخوله المثانة).[46]
يمكن أن يكون التصوير بالموجات فوق الصوتية للكلى مفيداً في بعض الأحيان، لأنه يعطي تفاصيل عن وجود موه الكلية، مما يشير إلى أن الحصوة تمنع تدفق البول،[48] كما يمكن من خلاله رؤية الحصوات الخفيفة الكثافة الإشعاعية التي لا تظهر بالتصوير المقطعي. وتشمل المزايا الأخرى لتصوير الكلى بالموجات فوق الصوتية انخفاض تكلفته، وعدم تعرض المريض للإشعاع. كما أن التصوير بالموجات فوق الصوتية مفيد للكشف عن الحصوات في الحالات التي لا ينصح فيها بعمل الأشعة السينية أو الأشعة المقطعية، كما هو الحال في الأطفال أو النساء الحوامل.[51] على الرغم من هذه المزايا، لم يكن تصوير الموجات فوق الصوتية الكلوي في عام 2009 بديلًا عن الفحص المقطعي بالحزمة الأسطوانية الحلزونية في التقييم التشخيصي الأولي للتحصي البولي.[47] والسبب الرئيسي في ذلك هو أن الموجات فوق الصوتية تفشل في كثير من الأحيان في الكشف عن الحصوات الصغيرة (وخاصة حصى الحالب) مقارنة بالتصوير المقطعي، فضلا عن غيرها من الاضطرابات الخطيرة التي يمكن أن تسبب الأعراض.[11] وأكدت دراسة أجريت في 2014 أن الموجات فوق الصوتية كاختبار للتشخيص الأولي بدلًا من التصوير المقطعي تؤدي إلى تعرض أقل للإشعاع، مع عدم وجود أي مضاعفات خطيرة.[52]
الاختبارات المعملية
وتشمل التحقيقات المختبرية التي تجري عادة ما يلي:[43][47][48][53]
- الفحص المجهري للبول، والذي قد يُظهر خلايا دم حمراء، وبكتيريا، وكريات دم بيضاء، واسطوانات بولية، وبلورات.
- زراعة البول لتحديد أي كائنات حية مُعدية موجودة في الجهاز البولي، والحساسية لتحديد قابلية هذه الكائنات الحية لمضادات حيوية محددة.
- عد دموي شامل؛ للبحث عن العدلات (زيادة عدد الكرات البيض المتعادلة المحببة) التي تشير إلى العدوى البكتيرية.
- اختبارات وظائف الكلى؛ للبحث عن أي ارتفاع غير طبيعي لمستويات الكالسيوم في الدم (فرط كالسيوم الدم).
- جمع البول على مدار 24 ساعة؛ لقياس حجم مجموع البول اليومي، والمغنيسيوم، والصوديوم، وحمض اليوريك، والكالسيوم، والسيترات، والأكسالات، والفوسفات.
- جمع الحصوات عن طريق التبول خلال شبكة الحصى الموجودة في كوب جمع حصوات الكلى، أو مصفاة الشاي بسيطة هي طريقة مفيدة. حيث يساعد التحليل الكيميائي للحصوات التي تم جمعها في التعرف على تكوينها، والذي بدوره يمكن أن يساعد على تحديد طرق الوقاية والعلاج في المستقبل.
تركيب الحصوات
| أنواع حصوات الكلى | السكان | الظروف المحيطة | اللون | الحساسية | تفاصيل |
|---|---|---|---|---|---|
| أكسالات الكالسيوم | 80% | عندما يكون البول حامضي (انخفاض الرقم الهيدروجيني)[54] | أسود/ بني داكن | غير منفذ للأشعة (معتم) | يتم إنتاج بعض الأكسالات في البول من قِبل الجسم. ويلعب الكالسيوم والأكسالات الموجودة في الغذاء دورًا، ولكن ليست هي العامل الوحيدة التي تؤثر على تشكيل حصوات أكسالات الكالسيوم. وتوجد الأكسالات الغذائية في العديد من الخضروات، والفواكه، والمكسرات. وقد يلعب كالسيوم العظام أيضا دورًا في تشكيل حصاة الكلى. |
| فوسفات الكالسيوم | 5–10% | عندما يكون البول قلوياً (ارتفاع الرقم الهيدروجيني) | أبيض متسخ | معتم | تميل إلى النمو في البول القلوي خاصة مع وجود بكتريا بروتيوس. |
| حمض اليوريك | 5–10% | عندما يكون البول حمضياً باستمرار | أصفر/ بني محمر | شفاف للأشعة | الأغذية الغنية بالبروتينات الحيوانية والبيورينات: توجد المواد بشكل طبيعي في جميع المواد الغذائية، وخاصة في اللحوم العضوية، والأسماك، والمحار. |
| ستروفيت | 10–15% | عدوى في الكلى | أبيض متسخ | معتم | يعتمد منع تكوين حصوات ستروفيت على الوقاية من العدوى. ولا يُعتقد أن النظام الغذائي يؤثر على تشكيل حصوات ستروفيت. |
| سيستين | 1–2%[55] | اضطراب جيني نادر | زهري/ أصفر | معتم | يتسرب السيستين، هو حمض أميني (واحد من اللبنات الأساسية للبروتين)، من خلال الكلى إلى البول لتشكيل بلورات. |
| زانثين[56] | نادر جدًا | أحمر طوبي | شفاف للأشعة |
حصوات تحتوي على الكالسيوم
غالبًا يحتوي النوع الأكثر شيوعًا من حصى الكلى في جميع أنحاء العالم على الكالسيوم. على سبيل المثال، تمثل الحصوات المحتوية على الكالسيوم حوالي 80٪ من جميع الحالات في الولايات المتحدة؛ حيث تحتوي عادة على أكسالات الكالسيوم إما وحدها أو بالاشتراك مع فوسفات الكالسيوم في شكل أباتيت أو بروشيت.[22][41] وترتبط العوامل التي تعزز ترسب بلورات الأكسالات في البول، مثل فرط أكسالات البول الأولي، بتطور حصوات أكسالات الكالسيوم.[21] ويرتبط تكوّن حصوات فوسفات الكالسيوم مع بعض الظروف مثل فرط جارات الدرقية،[20] والحماض النبيبي الكلوي.[57]
تزداد الأوكسالات في البول في المرضى الذين يعانون من اضطرابات معينة في الجهاز الهضمي، مثل داء الأمعاء الالتهابي كمرض كرون، أو المرضى الذين خضعوا لاستئصال الأمعاء الدقيقة أو للإجراءات الالتفافية في الأمعاء الصغيرة. كما تزداد أوكسالات البول أيضًا في المرضى الذين يستهلكون كميات متزايدة من الأكسالات (الموجودة في الخضروات والمكسرات). فرط أوكسالات البول الابتدائي هو حالة نادرة مسؤول عنها جين وراثي جسدي متنحي، والتي عادة ما تظهر في مرحلة الطفولة.[58]
تظهر بلورات أكسالات الكالسيوم في البول مجهرياً على أنها "مغلفات". كما أنها قد تشكل "بلورات قضيب الكُرَتَين dumbbells".[58]
حصوات ستروفيت
تتكون حوالي 10-15٪ من الحصيات البولية من ستروفيت (فوسفات الأمونيوم والمغنيسيوم، NH4MgPO4. 6H2O).[59] وتتشكل حصوات الستروفيت (المعروفة أيضًا باسم "حصوات العدوى"، أو اليورياز، أو حصوات الفوسفات الثلاثي)، في معظم الأحيان في وجود عدوى بالبكتيريا القاسمة لليوريا. حيث تستقلب هذه الكائنات اليوريا إلى أمونيا، وثاني أكسيد الكربون باستخدام إنزيم اليورياز، مما يجعل البول قلوياً، ويوفر الظروف المناسبة لتشكيل حصوات الستروفيت. ومن أشهر الكائنات التي تسبب ذلك: بروتيوس ميرابيليس (Proteus mirabilis)، وبروتيوس فولغاريس (Proteus vulgaris)، ومورغانيلا مورغاني (Morganella morganii). بينما تشمل الكائنات الحية الأقل شيوعًا يوروبلازما يورياليتيكم (Ureaplasma urealyticum)، وبعض الأنواع من بروفيدنسيا (Providencia)، وكليبسيلا (Klebsiella)، وسيراتيا (Serratia)، والأمعائية (Enterobacter). وعادة ما يلاحظ هذه الحصوات في الناس الذين لديهم عوامل تؤهلهم لالتهابات المسالك البولية، كما في حالات إصابة الحبل الشوكي وغيرها من أشكال المثانة العصبية، وتحويل البول للقناة اللفائفية، والجزر المثاني الحالبي، والاعتلال البولي الانسدادي. كما توجد عادة في الأشخاص الذين يعانون من اضطرابات التمثيل الغذائي الكامنة، مثل فرط كالسيوم البول مجهول السبب، وفرط جارات الدرقية، والنقرس. يمكن أن تنمو حصوات العدوى بسرعة، وتشكل حصوات كبيرة على شكل قرن الوعل (حصوات مرجانية الشكل)، وتتطلب جراحة جائرة مثل تفتيت الحصوات عن طريق الجلد كعلاج نهائي.[59]
تأخذ بللورات حصوات الستروفيت شكل "غطاء التابوت" تحت المجهر.[58]
حصوات حمض اليوريك
تتكون حوالي 5-10٪ من جميع الحصوات من حمض اليوريك.[18] وغالبًا ما تتكون في الأشخاص الذين يعانون من بعض الشذوذات الأيضية، بما في ذلك السمنة.[17] كما أنها قد تتكون بالاشتراك مع الظروف التي تسبب فرط حمض اليوريك في البول مع أو بدون فرط حمض يوريك الدم. ويمكن أن تتكون أيضًا بالاشتراك مع اضطرابات أيض الأحماض والقواعد، حيث أن البول الحامضي بشكل مفرط (انخفاض درجة الحموضة) يؤدي إلى ترسب بلورات حمض اليوريك. يتم دعم تشخيص حصوات البول عن طريق وجود حصوات شفافة للأشعة مع وجود بول حامضي باستمرار، وبالتزامن مع العثور على بلورات حمض اليوريك في عينات البول الطازجة.[60]
وكما لوحظ أعلاه (في قسم حصوات أوكسالات الكالسيوم)، يميل الأشخاص الذين يعانون من داء الأمعاء الالتهابي (مثل: مرض كرون، والتهاب القولون التقرحي) إلى تكوين حصوات الأكسالات مع وجود فرط أوكسالات في البول. كما أن حصوات اليوريت شائعة بعد استئصال القولون بشكل خاص.
تظهر حصوات حمض اليوريك في شكل بلورات متعددة الأشكال، عادة على شكل ماس. كما أنها قد تبدو مثل المربعات أو الأعواد الاستقطابية.[58]
يمكن معالجة المرضى الذين يعانون من فرط حمض اليوريك في البول باستخدام الألوبيورينول، الذي سوف يقلل من تكوّن اليوريت. كما أن جعل البول قلوياً يساعد أيضًا في ذلك.
أنواع أخرى
الأشخاص الذين يعانون من بعض الأخطاء الأيضية الخلقية النادرة لديهم ميل لتراكم المواد التي تشكل بلورات في البول. على سبيل المثال، قد يكوّن أولئك الذين يعانون من بيلة سيستينية، والداء السيستيني، أو متلازمة فانكوني حصوات تتكون من السيستين. ويمكن علاج تكوين حصوات السيستين عن طريق قلونة البول، والحد من تناول البروتين الغذائي. وغالبًا يكوّن الأشخاص الذين يعانون من بيلة زانثينية حصوات تتكون من الزانثين. كما يكوّن الأشخاص الذين يعانون من نقص أدينين فسفوريبوسيل ترانزفيراس حصوات تتكون من 2,8-ثنائي هيدروكسي ادينين،[61] وتؤدي البيلة ألكابتونية إلى تكوّن حصوات حمض هوموجنتيسيك، وتُنتج بيلة الايمينوغليسين حصوات تتكون من الجلايسين، والبرولين، وهيدروكسي برولين.[62][63] كما لوحظ أن التحصي البولي يحدث مع تناول بعض الأدوية العلاجية، مع تكوّن بلورات الأدوية داخل الجهاز الكلوي كما يحدث مع الأشخاص التي تستخدم إندينافير،[64] والسولفاديازين،[65] وتريامتيرين.[66]
الموقع
يشير التحصي البولي إلى الحصوات التي تنشأ في أي مكان في الجهاز البولي، بما في ذلك الكلى، والمثانة.[13] بينما تشير تحصي الكلية إلى وجود مثل هذه الحصوات في الكلى. حصوات الكأس هي تجمعات الحصوات إما في الكأس الصغير أو الكبير، أو أجزاء الكلى التي تمرر البول إلى الحالب (أنبوب يربط الكلى بالمثانة البولية). وتسمى الحالة بتحصي الحالب عندما تتكون الحصوة في الحالب. ويمكن أن تتشكل الحصوة أو تمر إلى المثانة أيضًا فيما يسمى تحصي المثانة.[67]
الحجم
تمر الحصوات التي يقل قطرها عن 5 مم (0.2 بوصة) تلقائيا في 98٪ من الحالات، في حين أن تلك التي تتراوح قطرها من 5 إلى 10 مم (0.2 إلى 0.4 بوصة) تمر تلقائيًا في أقل من 53٪ من الحالات.[68]
أما الحصوات الكبيرة بما فيه الكفاية لملء كأس الكلى تسمى حصوة قرن الوعل، وتتكون من ستروفيت في الغالبية العظمى من الحالات، والتي تُشَكَل فقط في وجود البكتيريا المنتجة لليورياز. بينما تتكون الأشكال الأخرى التي يمكن أن تنمو لتصبح حصاة قرن الوعل من سيستين، وأحادي هيدرات أكسالات الكالسيوم، وحمض اليوريك.[69]
الوقاية
تعتمد الإجراءات الوقائية على نوع الحصوات. فمثلًا في أولئك الذين يعانون من حصوات الكالسيوم، شرب الكثير من السوائل، ومدرات البول الثيازيدية، والسيترات أمور فعالة، وألوبورينول في الأشخاص الذين لديهم مستويات عالية من حمض اليوريك في الدم أو البول.[70][71]
التدابير الغذائية
ينبغي أن يكون العلاج مصمم خصيصًا لنوع الحصوة المعنية. فالنظام الغذائي يمكن أن يكون له تأثير عميق على تطوير حصى الكلى. وتشمل الاستراتيجيات الوقائية مزيج من التعديلات الغذائية والأدوية بهدف الحد من حِمل إفراز المركبات القابلة لتكوين الحصوات من على الكلى.[28][72][73] وتتضمن التوصيات الغذائية الحالية للحد من تكوّن حصى الكلى ما يلي:[74]
- زيادة كمية السوائل الكلية لإنتاج أكثر من لترين بول في اليوم.
- زيادة كمية حامض الستريك؛ الليمون/ عصير الليمون هو أغنى مصدر طبيعي.[75]
- تناول الكالسيوم بكميات معتدلة
- تقليل تناول الصوديوم
- تجنب تناول جرعات كبيرة من فيتامين ج التكميلي
- تقليل تناول البروتين الحيواني بما لا يزيد عن وجبتين يوميًا (وقد وُجِدت علاقة بين استهلاك البروتين الحيواني وتكرار حصى الكلى في الرجال[76]).
- تقليل استهلاك المشروبات الغازية مثل الكولا،[70] التي تحتوي على حمض الفوسفوريك، إلى أقل من لتر واحد من المشروبات الغازية في الأسبوع.[77]
الحفاظ على البول المخفف عن طريق تناول الكثير من السوائل مفيد في جميع أشكال تحصي الكلية، لذا فإن زيادة حجم البول هو مبدأ رئيسي للوقاية من حصى الكلى. يجب أن يكون تناول السوائل كافيًا للحفاظ على كمية البول التي لا تقل عن 2 لتر في اليوم الواحد.[71] وقد ارتبط تناول السوائل بكميات كبيرة مع انخفاض خطر تكرار التحصي بنسبة 40%.[47] ومع ذلك فإن الأدلة على ذلك ليست كافية.[71]
يرتبط الكالسيوم مع الأكسالات الموجودة في الجهاز الهضمي، وبالتالي لا يتم امتصاصه في مجرى الدم، ويقلل الحد من امتصاص الأوكسالات من خطر تحصي الكلى في الأشخاص العرضة لذلك.[78] لذا، يوصي بعض أطباء الكلى والمسالك البولية بمضغ أقراص الكالسيوم خلال الوجبات التي تحتوي على أطعمة بها أكسالات.[79] كما يمكن تناول مكملات سيترات الكالسيوم مع الوجبات إذا كان لا يمكن زيادة الكالسيوم الغذائي بوسائل أخرى. مكمل الكالسيوم المفضل للأشخاص المعرضين لخطر تكوّن الحصوات هو سيترات الكالسيوم؛ لأنه يساعد على زيادة إفراز السيترات في البول.[73]
وبصرف النظر عن الترطيب الفموي القوي واستهلاك الكالسيوم الغذائي، تشمل استراتيجيات الوقاية الأخرى تجنب تناول جرعات كبيرة من فيتامين ج التكميلي، والحد من الأطعمة الغنية بالأكسالات، مثل الخضروات الورقية، وراوند الحدائق، ومنتجات فول الصويا، والشوكولاتة.[80] ومع ذلك، لم يتم إجراء أي تجربة عشوائية لاختبار فرضية أن الحد من الأكسالات يقلل من حدوث تكوّن الحصوات.[79] وتشير بعض الأدلة إلى أن تناول المغنيسيوم يقلل من خطر تحصي الكلية.[80]
قلونة البول
الدعامة الأساسية للتحكم الطبي في حصوات حمض اليوريك هي قلونة البول (زيادة الرقم الهيدروجيني). حصوات حمض اليوريك هي واحدة من الأنواع القليلة القابلة للعلاج بالحل عن طريق التحلل الكيميائي. وعادة ما يتم التحلل الكيميائي من خلال استخدام الأدوية عن طريق الفم، على الرغم من أنه في بعض الحالات، يمكن حقن مواد عن طريق الوريد، أو حتى تقطير بعض المواد مباشرة على الحصوة، وذلك باستخدام فغر الكلية من الأمام أو قسطرة الحالب من الوراء.[39] أسيتازولاميد (دياموكس) هو الدواء الذي يجعل البول قلوياً. ويمكن استخدام بعض المكملات الغذائية التي تنتج قلوية مماثلة للبول بالإضافة إلى أسيتازولاميد أو كبديل، مثل: بيكربونات الصوديوم، وسترات البوتاسيوم، وسيترات المغنيسيوم، وثنائي السترات (مزيج من أحادي هيدرات حامض الستريك وصوديوم سيترات ثنائي الهيدرات).[81] وبصرف النظر عن قلونة البول، هذه المكملات لها ميزة إضافية وهي زيادة مستوى السيترات البولية، مما يساعد على الحد من تجمع حصوات أكسالات الكالسيوم.[39]
توفر زيادة درجة حموضة البول إلى حوالي 6.5 الظروف المُثلى لإذابة حصوات حمض اليوريك. بينما يزيد ارتفاع درجة حموضة البول إلى قيمة أعلى من 7.0 من خطر تكوين حصوات فوسفات الكالسيوم. وقد يساعد اختبار البول بشكل دوري بورقة النيترازين على ضمان أن درجة حموضة البول لا تزال في هذا النطاق الأمثل. باستخدام هذا النهج، يُتَوَقع أن يكون معدل حل الحصوات حوالي 10 مم (0.4 بوصة) من نصف قطر الحصوة في الشهر.[39]
مدرات البول
واحدة من العلاجات الطبية المعترف بها للوقاية من الحصوات هي الثيازيد، ومدرات البول الشبيهه بالثيازيد، مثل كلورثاليدون أو إنداباميد. تمنع هذه الأدوية تكوين الحصوات التي تحتوي على الكالسيوم عن طريق الحد من إفراز الكالسيوم في البول.[11] الحد من الصوديوم هو أمر ضروري للتأثير السريري للثيازيدات، حيث تعمل زيادة الصوديوم على زيادة إفراز الكالسيوم. وتعمل الثيازيدات بشكل أفضل في حالات فرط كالسيوم البول الناتج من التسرب الكلوي، وهي الحالة التي ترتفع فيها مستويات الكالسيوم البولية نتيجة خلل أولي في الكلى. ويعتبر الثيازيد مفيد لعلاج فرط كالسيوم البول الممتص، وهي الحالة التي يزداد فيها الكالسيوم البولي نتيجة للامتصاص الزائد من الجهاز الهضمي.[41]
ألوبورينول
يعتبر ألوبورينول بالنسبة للأشخاص الذين يعانون من فرط حمض اليوريك في البول، وحصوات الكالسيوم واحد من العلاجات القليلة التي ثبت أنها تقلل من تكرار حصى الكلى، حيث يتداخل ألوبورينول مع إنتاج حمض اليوريك في الكبد. ويستخدم الدواء أيضًا في الأشخاص الذين يعانون من النقرس أو ارتفاع مستوى حمض يوريك في الدم.[82] ويتم تعديل الجرعة للحفاظ على خفض إفراز حمض اليوريك في البول. وغالبًا ما يكون الوصول إلى مستوى حمض اليوريك عند أو أقل من 6 ملغ / 100 مل في المصل هدفًا علاجيًا. فرط حمض يوريك الدم ليس ضرورياً لتكوين حصوات حمض اليوريك. فمن الممكن أن يرتفع مستوى حمض اليوريك في البول في وجود مستوى طبيعي من حمض اليوريك في المصل أو حتى مع وجود مستويات منخفضة. ويطالب بعض الممارسين إضافة ألوبورينول فقط في الأشخاص الذين لديهم فرط حمض اليورك في البول مع فرط حمض يوريك في الدم بصفة مستمرة، على الرغم من استخدام مواد تجعل البول قلوياً مثل بيكربونات الصوديوم أو سترات البوتاسيوم.[39]
العلاج
يؤثر حجم الحصاة على معدل مرور الحصوة التلقائي. على سبيل المثال، ما يصل إلى 98٪ من الحصوات الصغيرة (أقل من 5 مم (0.2 بوصة) في القطر) قد تمر تلقائيًا خلال التبول في غضون أربعة أسابيع من ظهور الأعراض،[3] ولكن بالنسبة للحصوات الكبيرة (5-10 مم (0.2 إلى 0.4 في) في القطر)، ينخفض معدل المرور التلقائي إلى أقل من 53٪.[68] كما أن موقع الحصوات الأولي يؤثر أيضًا على احتمال مروره التلقائي. وترتفع المعدلات من 48٪ للحصوات الموجودة في الجزء الداني من الحالب إلى 79٪ للحصوات التي تقع في تقاطع الحالب مع المثانة، بغض النظر عن حجم الحصاة.[68] وعلى افتراض عدم وجود عرقلة كبيرة في مسار البول أو عدوى مرتبطة بها في المسالك البولية، وكانت الأعراض خفيفة نسبيًا، يمكن استخدام مختلف التدابير غير الجراحية لتشجيع مرور الحصوة.[39] بينما تستخدم وسائل أكثر قوة مع أصحاب الحصوات المتكررة، بما في ذلك تناول السوائل المناسبة، واستخدام بعض الأدوية. وبالإضافة إلى ذلك، من الواضح أن هناك حاجة إلى المتابعة الدقيقة لتحقيق أقصى قدر من التدخل الإكلينيكي للأشخاص الذين يكوّنون حصوات متكررة.[83]
التحكم في الألم
يتطلب التحكم في الألم غالبًا حقن مضادات الالتهاب اللا ستيروئيدية أو المواد الأفيونية في الوريد.[11] وغالبًا ما تكون الأدوية التي يتم تناولها عن طريق الفم فعالة، وأقل ألماً.[51] بينما لم يظهر استخدام مضادات التقلصات أي فائدة.[6]
العلاج الطبي الطارد
وهو استخدام الأدوية لتسريع مرور الحصوات في الحالب تلقائياً.[84][85] وقد وُجِد أن العديد من المواد، مثل حاصرات ألفا الأدرينالية (مثل تامسولوسين)، ومحصرات قنوات الكالسيوم (مثل نيفيديبين) تكون فعالة.[84] ويبدو أن حاصرات ألفا تؤدي إلى معدلات أعلى وأسرع من إزالة الحصوات.[86] ومع ذلك، فإنها تبدو فعالة فقط مع الحصوات الأكثر من 4 ملم، ولكن أقل من 10 ملم في الحجم.[87] وقد يكون المزيج بين تامسولوسين والكورتيكوستيرويد أفضل من تامسولوسين وحده.[84] ويبدو أن هذه العلاجات مفيدة أيضا جنباً إلى جنب مع تفتيت الحصوات.[3]
تفتيت الحصى
تفتيت الحصاة بموجات صادمة من خارج الجسم هي تقنية غير تَوَغُلية لإزالة حصى الكلى. ويتم استخدامها غالبا عندما تكون الحصوة موجودة بالقرب من حويضة الكلية. حيث يتم استخدام آلة تفتيت الحصاة لإرسال نبضات عالية الكثافة ومركزة من الموجات فوق الصوتية، تعمل على تجزئة الحصى على مدى حوالي 30-60 دقيقة. بعد إدخاله في الولايات المتحدة في فبراير 1984، تم قبول تلك التقنية على نطاق واسع كبديل لعلاج حصى الكلى والحالب.[88] ويستخدم حاليًا في علاج الحصوات غير المعقدة، التي تقع في الكلى والجزء العلوي من الحالب، شريطة أن يكون حجم حصوة الكلى أقل من 20 مم، وتركيب الكلى المعنية طبيعي.[89][90] بينما في الحصوات التي يكون حجمها أكبر من 10 مم، قد لا يساعد تفتيت الحصوات بموجات صادمة من الخارج على تفتيت الحصوات في جلسة واحدة. بدلًا من ذلك، قد تكون هناك حاجة لاثنين أو ثلاثة. ويمكن علاج حوالي 80- 85٪ من الحصوات الكلوية البسيطة بشكل فعال باستخدام آلة تفتيت الحصوات.[3] وهناك عدد من العوامل التي يمكن أن تؤثر على فعاليتها، بما في ذلك التركيب الكيميائي للحصوة، والتشريح الكلوي الشاذ، وموقع الحصوات داخل الكلى، ووجود موه الكلية، ومؤشر كتلة الجسم، والمسافة بين الحصوة وسطح الجلد.[88] وتتضمن الآثار الجانبية الشائعة لتفتيت الحصوات باستخدام الموجات فوق الصوتية: الصدمة الحادة، مثل كدمات في موقع تطبيق الموجات الصادمة، والأضرار التي تلحق بالأوعية الدموية في الكلى.[91][92] في الواقع، فإن الغالبية العظمى من الناس الذين يعالجون بجرعة قياسية من موجات الصدمة باستخدام إعدادات العلاج المقبولة حاليًا من المرجح أن تواجه درجة ما من القصور الكلوي الحاد.[88] ويعتمد القصور الكلوي الحاد الناجم عن تفتيت الحصوات بالموجات الصادمة على الجرعة (يزيد مع العدد الإجمالي لموجات الصدمة التي تُعطى، ومع إعدادات الطاقة من آلة التفتيت)، ومن الممكن أن القصور شديد،[88] ويتضمن نزيف داخلي، وأورام دموية تحت المحفظة. في حالات نادرة، قد تتطلب مثل هذه الحالات نقل دم، وقد تؤدي إلى الفشل الكلوي الحاد. قد ترتبط معدلات الورم الدموي بنوع آلة التفتيت المستخدمة. وتم الإبلاغ عن معدلات حدوث ورم دموي بنسبة أقل من 1٪، وقد تصل إلى 13٪ لآلات تفتيت الحصى المختلفة.[92] وتُظهِر الدراسات الحديثة انخفاض إصابة الأنسجة الحاد عندما يتضمن بروتوكول العلاج وقفة قصيرة بعد بدء العلاج، مما يعمل على تحسين التفتيت الحصوي، وانخفاض الإصابة عند تطبيق تقنية تفتيت الحصوات باستخدام موجات الصدمة بمعدل بطيء.[88]
بالإضافة إلى الإمكانات المذكورة أعلاه للإصابة الكلوية الحادة، تشير الدراسات الحيوانية إلى أن هذه الإصابات الحادة قد تتطور لتشكيل ندبة، مما يؤدي إلى فقدان حجم الكلى الوظيفي.[91][92] وتشير الدراسات المستقبلية الأخيرة أيضًا إلى أن كبار السن معرضون لخطر متزايد لتطوير ارتفاع ضغط الدم تلي استخدام تلك التقنية. وبالإضافة إلى ذلك، وجدت دراسة استعادية نشرها باحثون من عيادة مايو في عام 2006 زيادة خطر الإصابة بمرض السكري، وارتفاع ضغط الدم في الأشخاص الذين خضعوا لتفتيت الحصوات باستخدام الموجات الصادمة، مقارنة بمجموعة من الأشخاص من نفس العمر، والجنس خضعوا للعلاج غير الجراحي. وتتوقف احتمالية تطور الصدمة الحادة إلى تأثيرات طويلة الأمد على عوامل متعددة تشمل جرعة موجة الصدمة (أي عدد موجات الصدمات التي تم توصيلها، ومعدل التوصيل، وإعدادات الطاقة، والخصائص الصوتية لآلة التفتيت، وعدد مرات تكرار العلاج)، فضلًا عن بعض عوامل الخطر الفسيولوجية المرضية الداخلية.[88]
ولمعالجة هذه المخاوف، أنشأت جمعية المسالك البولية الأمريكية فرقة عمل معنية بتفتيت الحصوات باستخدام الموجة الصادمة لتوفير رأي خبير بشأن السلامة ومعدل المخاطر والمنافع لاستخدامها. ونشرت فرقة العمل ورقة بيضاء توضح استنتاجاتها في عام 2009. وخلصوا إلى أن نسبة المخاطر والمنافع تظل مواتية لكثير من الناس.[88] وتشمل مزايا تقنية تفتيت الحصوات بالموجات الصادمة طبيعتها غير التعمقية، وحقيقة أنه من السهل من الناحية الفنية استخدامها لعلاج معظم الحصوات الموجودة في الجزء العلوي من المجرى البولي، وأنها يمكن تحملها، مع انخفاض معدلات الاعتلال بالنسبة للغالبية العظمى من الناس. ومع ذلك، فقد أوصوا ببطء معدل إطلاق موجة الصدمة من 120 نبضة في الدقيقة إلى 60 نبضة في الدقيقة الواحدة؛ للحد من خطر حدوث قصور كلوي، وزيادة درجة تجزئة الحصوات.[88]
الجراحة
تمر معظم الحصوات التي حجمها أقل من 5 مم بشكل تلقائي.[3][28] ومع ذلك، قد تكون هناك حاجة إلى جراحة سريعة في الأشخاص الذين لديهم كلية واحدة فقط عاملة، أو يوجد حصوات في كلا الكليتين، أو في حالة التهاب المسالك البولية؛ لأن في هذه الأحوال يُفترض أن تكون الكلية معدية، أو الألم غير محتمل.[93] ابتداء من منتصف الثمانينات، بدأت العلاجات الأقل إجارة مثل تفتيت الحصوة باستخدام موجات صادمة من خارج الجسم، وتنظير الحالب، واستخراج حصاة الكلية عن طريق الجلد تحل محل الجراحة المفتوحة كطرق مفضلة للعلاج الجراحي للتحصي البولي.[3] في الآونة الأخيرة، تم تعديل منظار الحالب المرن لتسهيل فغر الكلية من الوراء؛ لاستخراج حصاة الكلى عن طريق الجلد. ولا يزال هذا النهج قيد التجريب، وإن كانت النتائج الأولية مبشرة.[94] استخراج حصاة الكلى عن طريق الجلد هو العلاج المفضل للحصوات الكبيرة أو المعقدة (مثل الحصوات المرجانية) أو الحصوات التي لا يمكن استخراجها باستخدام إجراءات أقل إجارة.[3][43]
جراحة الحالب بالمنظار
وقد أصبح تنظير الحالب ذا شعبية متزايدة بعدما أصبح منظار الحالب ذو الألياف البصرية المرن، والصلب أصغر حجمًا. وتتضمن تقنية تنظير الحالب وضع دعامة (أنبوب صغير يمتد من المثانة حتى الحالب، وفي الكلى)؛ لتوفير الإغاثة الفورية للكلى المتضررة. يمكن أن يكون وضع الدعامة مفيدًا لإنقاذ الكلى المعرضة لخطر الفشل الكلوي الحاد نتيجة سبب بعد الكلى، مثل زيادة الضغط الهيدروستاتيكي، والتورم، والعدوى (التهاب الحويضة والكلية، وتقيح الكلية) بسبب عرقلة الحصوة لمجرى البول. وتتراوح الدعامات الحالبية في الطول من 24 إلى 30 سم (9.4 إلى 11.8 بوصة)، ومعظمها لها شكل يشار إليه عادة باسم "مزدوج J" أو "ضفيرة مزدوجة"، بسبب وجود حلقة في كلا الطرفين. وهي مصممة للسماح للبول بالتدفق قبل الجزء المسدود في الحالب. ويمكن الاحتفاظ بها في الحالب لعدة أيام إلى أسابيع حتى يتم علاج العدوى، وتفتيت الحصوة بواسطة الموجات الصادمة أو عن طريق طرق العلاج الأخرى. توسع الدعامات الحالبية، مما يسهل إدخال الآلات، كما توفر أيضًا معلمًا واضحًا للمساعدة في تصور الحالب وأي حصوات مرتبطة به في الفحص الشعاعي. وقد يسبب وجود دعامات الحالب في الداخل بعض الانزعاج، وعدم الراحة للمريض، وتواتر أو إلحاح البول، والعدوى، ويتم الشفاء من ذلك بشكل عام بعد إزالة الحصوات. يمكن إزالة معظم دعامات الحالب بمنظارالمثانة تحت التخدير الموضعي بعد حل التحصي البولي.[95]
وتشمل تقنيات تنظير الحالب الأساسية لاستخراج الحصوات (بدلًا من مجرد تجاوز العرقلة) تفتيت حصوات الحالب باستخدام الموجات فوق الصوتية. تفتيت الحصوات بالليزر هي تقنية أخرى، تتضمن استخدام ليزر الهولميوم: ييتريوم ألومنيوم غارنيت (Ho:YAG) لتفتيت الحصوات في المثانة، والحالب، والكلى.[96]
وبشكل عام، فإن تقنيات تنظير الحالب أكثر فعالية من استخدام موجات الصدمة لعلاج الحصوات الموجودة في جزء الحالب السفلي، مع معدلات نجاح 93-100٪ باستخدام تفتيت الحصوات بليزر (Ho:YAG).[68] على الرغم من أن التفتيت بالموجات الصادمة يُفضل تقليديًا من قبل العديد من الممارسين لعلاج الحصوات الموجودة في جزء الحالب العلوي، إلا أن التجارب الحديثة تشير إلى أن تقنيات تنظير الحالب تقدم مزايا متميزة في علاج الحصى في جزء الحالب العلوي، حيث أن معدل النجاح الكُلي أعلى، وهناك حاجة أقل إلى تكرار التدخلات الطبية، وزيارات ما بعد العملية الجراحية، كما أن تكاليف العلاج بتنظير الحالب أقل مقارنة بتفتيت الحصى باستخدام الموجات الصادمة من خارج الجسم. وتظهر هذه المزايا بشكل خاص مع الحصوات الأكبر من 10 ملم (0.4 بوصة) في القطر. ومع ذلك، لا يزال العديد من أطباء المسالك البولية يفضلون استخدام الموجات الصادمة من خارج الجسم كخط أول في علاج الحصوات التي يكون قطرها أقل من 10 ملم؛ لأن تنظير الجزء العلوي للحالب هو أكثر صعوبة بكثير من استخدام الموجات فوق الصوتية الصادمة، واستخدام تنظير الحالب للحصوات التي يكون قطرها أكبر من 10 ملم.[68] تنظير الحالب هو العلاج المفضل في الحوامل، والأشخاص الذين يعانون من السمنة المفرطة، وأولئك الذين يعانون من اضطرابات النزيف.[3]
وبائيات
| البلد | معدل الانتشار الأقدم (بالسنوات)[97] | معدل الانتشار الأحدث (بالسنوات)[97] |
|---|---|---|
| الولايات المتحدة | 2.6% (1964–1972) | 5.2% (1988–1994) |
| إيطاليا | 1.2% (1983) | 1.7% (1993–1994) |
| أسكتلندا | 3.8% (1977) | 3.5% (1987) |
| إسبانيا | 0.1% (1977) | 10.0% (1991) |
| تركيا | n/a | 14.8% (1989) |
| البلد | الحالات الجديدة لكل 100000 (في السنة)[97] | الاتجاه |
|---|---|---|
| الولايات المتحدة | 116 (2000) | يقل |
| ألمانيا | 720 (2000) | يزيد |
| اليابان | 114.3 (2005) | يزيد |
| إسبانيا | 270 (1984) | يقل |
| السويد | 200 (1969) | يزيد |
تصيب حصى الكلى جميع المجموعات الجغرافية، والثقافية، والعرقية. وتتراوح المخاطر بين 10 و 15٪ في الدول المتقدمة، ولكن يمكن أن تصل إلى 20- 25٪ في الشرق الأوسط. ويعتبر زيادة خطر التجفاف في المناخات الحارة، إلى جانب اتباع نظام غذائي أقل بنسبة 50٪ في الكالسيوم، و250٪ أعلى في الأكسالات مقارنة بالوجبات الغذائية الغربية، سبب ارتفاع المخاطر في الشرق الأوسط.[98] في الشرق الأوسط، حصوات حمض اليوريك هي أكثر شيوعا من الحصى التي تحتوي على الكالسيوم.[22] ويقدر عدد الوفيات الناجمة عن حصى الكلى بـ 19,000 حالة وفاة سنويا في الفترة ما بين 1990 و2010.[99]
في أمريكا الشمالية وأوروبا، العدد السنوي للحالات الجديدة من حصى الكلى هو ما يقرب من 0.5٪. وقد ازدادت معدلات إصابة السكان في الولايات المتحدة بتحصي البول من 3.2٪ إلى 5.2٪ من منتصف السبعينات إلى منتصف التسعينات.[18] وحوالي 9٪ من سكان الولايات المتحدة لديهم حصوات في الكلى.[2]
وبلغت التكلفة الإجمالية لعلاج التحصي البولي 30 مليار دولار أمريكي في عام 2003.[48] وحوالي 65-80٪ من الذين يعانون من حصى الكلى هم من الرجال. بينما تكون معظم الحصوات في النساء بسبب عيوب التمثيل الغذائي (مثل بيلة سستينية) أو العدوى.[59][100] ومن الشائع أن يكون عمر الرجال عند النوبة الأولى بين 30- 40 سنة، أما بالنسبة للنساء، تظهر الأعراض لأول مرة في سن متأخر عن الرجال.[59] ويُظهر سن البداية في النساء توزيع ثنائي، تصل ذروته إلى 35- 55 عاما.[48] وتقدر معدلات التكرار بنسبة 50٪ على مدى 10 سنوات، و75٪ على مدى 20 عاما،[18] وقد يعاني بعض الناس من 10 نوبات أو أكثر على مدى العمر.[59]
وخَلُصَ استعراض أُجري في عام 2010 إلى أن معدلات المرض تتزايد.[97]
التاريخ
تم تسجيل وجود حصى الكلى لأول مرة منذ آلاف السنين، وتفتيت الحصاة لاستخراجها هي واحدة من أقدم العمليات الجراحية المعروفة.[101] في عام 1901، تم العثور على حصوة اُكتُشِفَت في حوض مومياء مصرية قديمة ترجع إلى عام 4800 قبل الميلاد. كما ذكرت النصوص الطبية من بلاد ما بين النهرين القديمة، والهند، والصين، وبلاد فارس، واليونان، وروما مرض حصاة الكلى. ويشير جزء من قَسَم أبقراط إلى أنه كان هناك جراحين ممارسين في اليونان القديمة لإزالة الحصوات. وقد كان يحتوي كتاب الطب الروماني لآولوس كورنيليوس سلزوس على وصف لاستخراج الحصاة،[102] وكان هذا العمل بمثابة الأساس لهذا الإجراء حتى القرن الثامن عشر.[103]
ومن بين الأشخاص المشهورين الذين أصيبوا بحصوات كلوية نابليون الأول، وأبيقور، ونابليون الثالث، وبطرس الأكبر، ولويس الرابع عشر، وجورج الرابع، وأوليفر كرومويل، وليندون جونسون، وبنيامين فرانكلين، وميشيل دي مونتين، وفرانسيس بيكون، وإسحاق نيوتن، وصموئيل بيبس، وويليام هارفي، وهيرمان بورهافا، وأنطونيو سكاربا.[104]
بدأت تقنيات جديدة لاستخراج الحصاة في الظهور ابتداء من عام 1520، ولكن ظلت العملية محفوفة بالمخاطر. بعد أن قام هنري جاكوب بيجيلو بتعميم تقنية تفتيت الحصوات في عام 1878،[105] انخفض معدل الوفيات من حوالي 24٪ إلى 2.4٪. ومع ذلك، واصلت تقنيات العلاج الأخرى في إنتاج مستوى عال من الوفيات، وخاصة بين أطباء المسالك البولية عديمي الخبرة.[103][104] في عام 1980، قدم دورنيه ميدتيش تقنية تفتيت الحصوات باستخدام موجة الصدمة لكسر الحصوة عن طريق النبضات الصوتية، وأصبحت هذه التقنية منذ ذلك الحين ضمن حيز الاستخدام على نطاق واسع.[88]
أصل الكلمة
الحصوة الكلوية هي من (باللاتينية: rēnēs) بمعنى "الكلى"، وpebble تعنى "حصاة". ويسمى تكوين الحصوات في الكلى بـ (/nephrolithiasis) (/ ɛnɛfroɪèlɪəaᵻsᵻs)، حيث nephro تعني كلية، وlith تعني حصوة، وiasis تعني اضطراب
اتجاهات البحث
قد يتم منع تبلور أكسالات الكالسيوم عن طريق استخدام بعض المواد في البول تؤخر تشكيل، ونمو، وتجميع، والتصاق البلورات بالخلايا الكلوية. من خلال تنقية البول باستخدام ترسيب الأملاح، وبأر متساوي التكهرب، واستبعاد الحجم بالكروماتوجرافيا، وجد بعض الباحثين أن كالغرانولين، وهو بروتين يتكون في الكلى، هو مثبط قوي لتشكيل بلورات أكسالات الكالسيوم داخل الجسم. وبالنظر إلى قدرته العالية في تثبيط نمو، وتجميع بلورات أكسالات الكالسيوم، قد يكون كالغرانولين عاملا جوهريا هاما في الوقاية من تحصي الكلية.[106]
الأطفال
على الرغم من أن حصى الكلى لا تحدث في كثير من الأحيان في الأطفال، إلا أن نسبة حدوثها في تزايد.[107] حيث توجد الحصوات في الكلى في ثلثي الحالات المبلغ عنها، وفي الحالب في الحالات المتبقية. ويتعرض الأطفال الأكبر سنًا لخطر أكبر بصرف النظر عن الجنس.[108]
كما هو الحال مع البالغين، تتكون الحصوات في معظم الأطفال من أكسالات الكالسيوم، بينما حصوات الستروفيت، وفوسفات الكالسيوم تكون أقل شيوعًا. وترتبط حصوات أوكسالات الكالسيوم في الأطفال بوجود بكميات عالية من الكالسيوم، والأكسالات، والمغنيسيوم في البول الحمضي.[109]
حيوانات أخرى
مشكلات التحصي البولي أكثر شيوعًا في الذكور من الإناث بين المُجْتَرّات، حيث أن الثنية السينية للمجاري البولية في ذكر المجترة هي أكثر عرضة لعرقلة مرور البول. كما أن صغار الذكور عرضة بشكل أكبر للحصوات؛ بسبب صغر قطر الإحليل.[110]
كما يؤدي انخفاض نسبة الكالسيوم إلى الفوسفور إلى تكوين حصوات الفوسفات، مثل الستروفيت.[110] ويمكن الحد من الإصابة بين الحِملان عن طريق الحفاظ على المدخول الغذائي للكالسيوم إلى الفوسفور بنسبة 2: 1.[110][111]
ويميل الرقم الهيدروجيني القلوي إلى تكوين حصوات الكربونات، والفوسفات. وبالنسبة للمجترات الأليفة، يتم تعديل التوازن بين الكاتيون والأنيون في الغذاء أحيانًا لضمان أن يكون البول حامضي قليلًا، للوقاية من تكوين الحصوات.[110]
يمكن العثور على تعميمات مختلفة فيما يتعلق بآثار الرقم الهيدروجيني على تشكيل حصوات السيليكات في البول.[110][112] وفي هذا الصدد، يمكن ملاحظة أنه في بعض الظروف، ترافق كربونات الكالسيوم السيليكا في حصوات السليكات البولية.[113]
وقد تساعد الأعلاف التي تكون على شكل كرات على تشكيل حصوات الفوسفات، بسبب زيادة إفراز البول للفوسفور. ويرجع ذلك إلى انخفاض إنتاج اللعاب. وبسبب وجود الفوسفات المنقسم باللعاب بكمية أقل في الدم، يميل إلى أن يُفرز في البول.[114] (معظم فوسفات اللعاب يفرز البراز[115]).
يمكن أن تحدث حصوات الأوكسالات في الحيوانات المجترة، على الرغم من أن مثل هذه المشاكل من أكل الأكسالات قد تكون غير شائعة نسبيًا. وتم الإبلاغ عن تحص بولي في المجترات مرتبط بأكل الأكسالات.[116] ومع ذلك، لم يتم العثور على أي تلف أنبوبي كلوي أو ترسب مرئي لبلورات أكسالات الكالسيوم في الكلى في رضيع الأغنام الذي يتغذى على طعام يحتوي على أوكسالات قابلة للذوبان بنسبة 6.5% من المادة الجافة الغذائية لمدة 100 يوم.[117]
ويمكن أن تؤدي الظروف التي تحد من تناول المياه إلى تكوين حصوات.[118]
ويمكن استخدام تدخلات جراحية مختلفة، مثل بتر نتوء الإحليل عند قاعدته بالقرب من حشفة القضيب في الحيوانات المجترة الذكور، أو فغر الإحليل، أو أنبوب المثانة؛ للتخفيف من انسداد تحصي البول.[118]
مقالات ذات صلة
المصادر
- Schulsinger, David A. (2014). Kidney Stone Disease: Say NO to Stones! (باللغة الإنجليزية). Springer. صفحة 27. . مؤرشف من الأصل في 28 فبراير 2020.
- "Kidney Stones in Adults". February 2013. مؤرشف من الأصل في 4 أكتوبر 201622 مايو 2015.
- Miller, NL; Lingeman, JE (2007). "Management of kidney stones" ( كتاب إلكتروني PDF ). المجلة الطبية البريطانية. 334 (7591): 468–72. doi:10.1136/bmj.39113.480185.80. PMC . PMID 17332586. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 27 ديسمبر 2010.
- Morgan, MS; Pearle, MS (14 March 2016). "Medical management of renal stones". BMJ (Clinical research ed.). 352: i52. PMID 26977089.
- Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). "Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians". Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- Afshar, K; Jafari, S; Marks, AJ; Eftekhari, A; MacNeily, AE (29 June 2015). "Nonsteroidal anti-inflammatory drugs (NSAIDs) and non-opioids for acute renal colic". The Cochrane database of systematic reviews. 6: CD006027. doi:10.1002/14651858.CD006027.pub2. PMID 26120804.
- Wang, RC; Smith-Bindman, R; Whitaker, E; Neilson, J; Allen, IE; Stoller, ML; Fahimi, J (7 September 2016). "Effect of Tamsulosin on Stone Passage for Ureteral Stones: A Systematic Review and Meta-analysis". Annals of Emergency Medicine. doi:10.1016/j.annemergmed.2016.06.044. PMID 27616037.
- GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet (London, England). 388 (10053): 1545–1602. PMID 27733282.
- GBD 2015 Mortality and Causes of Death, Collaborators. (8 October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet (London, England). 388 (10053): 1459–1544. PMID 27733281.
- كتاب قسم المسالك البولية كلية الطب بجامعة الإسكندرية
- Preminger, GM (2007). "Chapter 148: Stones in the Urinary Tract". In Cutler, RE (المحرر). دليل ميرك للتشخيص والعلاج (الطبعة 3rd). Whitehouse Station, New Jersey: ميرك آند كو.
- Nephrolithiasis~Overview في موقع إي ميديسين § Background.
- Pearle, MS; Calhoun, EA; Curhan, GC (2007). "Ch. 8: Urolithiasis". In Litwin, MS; Saigal, CS (المحررون). Urologic Diseases in America (NIH Publication No. 07–5512) ( كتاب إلكتروني PDF ). Bethesda, Maryland: National Institute of Diabetes and Digestive and Kidney Diseases, معاهد الصحة الوطنية الأمريكية, خدمة الصحة العامة بالولايات المتحدة, وزارة الصحة والخدمات البشرية الأمريكية. صفحات 283–319. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 10 يونيو 2013.
- Cavendish, M (2008). "Kidney disorders". Diseases and Disorders. 2 (الطبعة 1st). Tarrytown, New York: Marshall Cavendish Corporation. صفحات 490–3. . مؤرشف من الأصل في 28 فبراير 2020.
- Curhan, GC; Willett, WC; Rimm, EB; Spiegelman, D; et al. (Feb 1996). "Prospective study of beverage use and the risk of kidney stones". المجلة الأمريكية لعلم الأوبئة. 143 (3): 240–7. doi:10.1093/oxfordjournals.aje.a008734. PMID 8561157.
- Knight, J; Assimos, DG; Easter, L; Holmes, RP (2010). "Metabolism of fructose to oxalate and glycolate". Hormone and Metabolic Research. 42 (12): 868–73. doi:10.1055/s-0030-1265145. PMC . PMID 20842614.
- Johri, N; Cooper, B; Robertson, W; Choong, S; et al. (2010). "An update and practical guide to renal stone management". Nephron Clinical Practice. 116 (3): c159–71. doi:10.1159/000317196. PMID 20606476. مؤرشف من الأصل في 22 نوفمبر 2011.
- Moe, OW (2006). "Kidney stones: Pathophysiology and medical management" ( كتاب إلكتروني PDF ). ذا لانسيت. 367 (9507): 333–44. doi:10.1016/S0140-6736(06)68071-9. PMID 16443041. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 14 فبراير 2019.
- Thakker, RV (2000). "Pathogenesis of Dent's disease and related syndromes of X-linked nephrolithiasis" ( كتاب إلكتروني PDF ). Kidney International. 57 (3): 787–93. doi:10.1046/j.1523-1755.2000.00916.x. PMID 10720930. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 5 نوفمبر 2012.
- National Endocrine and Metabolic Diseases Information Service (2006). "Hyperparathyroidism (NIH Publication No. 6–3425)". Information about Endocrine and Metabolic Diseases: A-Z list of Topics and Titles. Bethesda, Maryland: National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, Public Health Service, US Department of Health and Human Services. مؤرشف من الأصل في 24 مايو 201127 يوليو 2011.
- Hoppe, B; Langman, CB (2003). "A United States survey on diagnosis, treatment, and outcome of primary hyperoxaluria". Pediatric Nephrology. 18 (10): 986–91. doi:10.1007/s00467-003-1234-x. PMID 12920626.
- Reilly, RF, Jr, Ch. 13: "Nephrolithiasis" In Reilly Jr & Perazella 2005، صفحات 192–207.
- National Kidney and Urologic Diseases Information Clearinghouse (2008). "Medullary Sponge Kidney (NIH Publication No. 08–6235)". Kidney & Urologic Diseases: A-Z list of Topics and Titles. Bethesda, Maryland: National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, Public Health Service, US Department of Health and Human Services. مؤرشف من الأصل في 16 فبراير 201527 يوليو 2011.
- National Digestive Diseases Information Clearinghouse (2006). "Crohn's Disease (NIH Publication No. 06–3410)". Digestive Diseases: A-Z List of Topics and Titles. Bethesda, Maryland: National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, United States Public Health Service, United States Department of Health and Human Services. مؤرشف من الأصل في 6 نوفمبر 201427 يوليو 2011.
- Farmer, RG; Hossein Mir-Madjlessi, S; Kiser, WS (1974). "Urinary excretion of oxalate, calcium, magnesium, and uric acid in inflammatory bowel disease: Relationship to urolithiasis". Cleveland Clinic Quarterly. 41 (3): 109–17. doi:10.3949/ccjm.41.3.109. PMID 4416806. مؤرشف من الأصل في 20 مارس 2020.
- Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, Summary, pp. 1-14 in Committee to Review Dietary Reference Intakes for Vitamin D and Calcium (2011)
- "Tolerable upper intake levels: Calcium and vitamin D". In Committee to Review Dietary Reference Intakes for Vitamin D and Calcium 2011، صفحات 403–56.
- Parmar, MS (2004). "Kidney stones". المجلة الطبية البريطانية. 328 (7453): 1420–4. doi:10.1136/bmj.328.7453.1420. PMC . PMID 15191979.
- Liebman, M; Al-Wahsh, IA (2011). "Probiotics and Other Key Determinants of Dietary Oxalate Absorption" ( كتاب إلكتروني PDF ). Advances in Nutrition. 2 (May): 254–60. doi:10.3945/an.111.000414. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 25 أكتوبر 201727 يوليو 2011.
- Committee on Fluoride in Drinking Water of the National Academy of Sciences (2006). "Chapter 9: Effects on the Renal System". Fluoride in Drinking Water: A Scientific Review of EPA's Standards. Washington, DC: The National Academies Press. صفحات 236–48. . مؤرشف من الأصل في 9 سبتمبر 2015.
- Riley, JM; Kim, H; Averch, TD; Kim, HJ (Oct 2013). "Effect of magnesium on calcium and oxalate ion binding". J Endourol. 27 (12): 1487–92. doi:10.1089/end.2013.0173. PMID 24127630.
- Negri, AL; Spivacow, FR; Del Valle, EE (2013). "[Diet in the treatment of renal lithiasis. Pathophysiological basis]". Medicina (B Aires). 73 (3): 267–71. PMID 23732207.
- Goodwin, JS; Mangum, MR (1998). "Battling quackery: Attitudes about micronutrient supplements in American academic medicine". Archives of Internal Medicine. 158 (20): 2187–91. doi:10.1001/archinte.158.20.2187. PMID 9818798.
- Rodman, JS; Seidman, C (1996). "Ch. 8: Dietary Troublemakers". In Rodman, JS; Seidman, C; Jones, R (المحررون). No More Kidney Stones (الطبعة 1st). New York: John Wiley & Sons, Inc. صفحات 46–57. . مؤرشف من الأصل في 10 يناير 2020.
- Brawer, MK; Makarov, DV; Partin, AW; Roehrborn, CG; et al. (2008). "Best of the 2008 AUA Annual Meeting: Highlights from the 2008 Annual Meeting of the American Urological Association, May 17–22, 2008, Orlando, FL". Reviews in Urology. 10 (2): 136–56. PMC . PMID 18660856.
- Mirheydar, Hossein S.; Banapour, Pooya; Massoudi, Rustin; Palazzi, Kerrin L.; Jabaji, Ramzi; Reid, Erin G.; Millard, Frederick E.; Kane, Christopher J.; Sur, Roger L. (Dec 2014). "What is the Incidence of Kidney Stones after Chemotherapy in Patients with Lymphoproliferative or Myeloproliferative Disorders?". Int Braz J Urol. 40 (6): 772–80. doi:10.1590/S1677-5538.IBJU.2014.06.08. PMID 25615245.
- Caudarella, R; Vescini, F (September 2009). "Urinary citrate and renal stone disease: the preventive role of alkali citrate treatment". Archivio Italiano di Urologia, Andrologia. 81 (3): 182–7. PMID 19911682.
- Perazella, MA, Ch. 14: "Urinalysis" In Reilly Jr & Perazella 2005، صفحات 209–26.
- Knudsen, BE; Beiko, DT; Denstedt, JD, Ch. 16: "Uric Acid Urolithiasis" In Stoller & Meng 2007، صفحات 299–308.
- Nephrolithiasis~Overview في موقع إي ميديسين § Pathophysiology.
- Coe, FL; Evan, A; Worcester, E (2005). "Kidney stone disease". The Journal of Clinical Investigation. 115 (10): 2598–608. doi:10.1172/JCI26662. PMC . PMID 16200192.
- del Valle, EE; Spivacow, FR; Negri, AL (2013). "[Citrate and renal stones]". Medicina (B Aires). 73 (4): 363–8. PMID 23924538.
- Anoia, EJ; Paik, ML; Resnick, MI (2009). "Ch. 7: Anatrophic Nephrolithomy". In Graham, SD; Keane, TE (المحررون). Glenn's Urologic Surgery (الطبعة 7th). Philadelphia: Lippincott Williams & Wilkins. صفحات 45–50. . مؤرشف من الأصل في 28 فبراير 2020.
- Weaver, SH; Jenkins, P (2002). "Ch. 14: Renal and Urological Care". Illustrated Manual of Nursing Practice (الطبعة 3rd). Lippincott Williams & Wilkins. . مؤرشف من في 10 يناير 2020.
- American College of Emergency Physicians (October 27, 2014). "Ten Things Physicians and Patients Should Question". http://www.choosingwisely.org/. مؤرشف من الأصل في 14 أبريل 201514 يناير 2015.
- Smith, RC; Varanelli, M (2000). "Diagnosis and management of acute ureterolithiasis: CT is truth". American Journal of Roentgenology. 175 (1): 3–6. doi:10.2214/ajr.175.1.1750003. PMID 10882237.
- Fang, LST (2009). "Chapter 135: Approach to the Paient with Nephrolithiasis". In Goroll, AH; Mulley, AG (المحررون). Primary care medicine: office evaluation and management of the adult patient (الطبعة 6th). Philadelphia: Lippincott Williams & Wilkins. صفحات 962–7. . مؤرشف من الأصل في 28 فبراير 2020.
- Pietrow, PK; Karellas, ME (2006). "Medical management of common urinary calculi" ( كتاب إلكتروني PDF ). American Family Physician. 74 (1): 86–94. PMID 16848382. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 4 مارس 2016.
- Bushinsky, D; Coe, FL; Moe, OW (2007). "Ch. 37: Nephrolithiasis". In Brenner, BM (المحرر). Brenner and Rector's The Kidney. 1 (الطبعة 8th). Philadelphia: WB Saunders. صفحات 1299–349. . مؤرشف من الأصل في 20 ديسمبر 2014.
- Smith, RC; Levine, JA; Rosenfeld, AT (1999). "Helical CT of urinary tract stones. Epidemiology, origin, pathophysiology, diagnosis, and management". Radiologic Clinics of North America. 37 (5): 911–52, v. doi:10.1016/S0033-8389(05)70138-X. PMID 10494278.
- Cormier, CM; Canzoneri, BJ; Lewis, DF; Briery, C; et al. (2006). "Urolithiasis in pregnancy: Current diagnosis, treatment, and pregnancy complications" ( كتاب إلكتروني PDF ). Obstetrical and Gynecological Survey. 61 (11): 733–41. doi:10.1097/01.ogx.0000243773.05916.7a. PMID 17044950. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 14 أبريل 2016.
- Smith-Bindman, R; Aubin, C; Bailitz, J; Bengiamin, RN; et al. (18 September 2014). "Ultrasonography versus computed tomography for suspected nephrolithiasis". نيو إنغلاند جورنال أوف ميديسين. 371 (12): 1100–1110. doi:10.1056/NEJMoa1404446. PMID 25229916.
- National Kidney and Urologic Diseases Information Clearinghouse (2007). "Kidney Stones in Adults (NIH Publication No. 08–2495)". Kidney & Urologic Diseases: A-Z list of Topics and Titles. Bethesda, Maryland: National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, Public Health Service, US Department of Health and Human Services. مؤرشف من الأصل في 15 أبريل 201527 يوليو 2011.
- contributors, ed. Kenneth L. Becker... With 330 (2001). Principles and practice of endocrinology and metabolism (الطبعة 3). Philadelphia, Pa. [u.a.]: Lippincott, Williams & Wilkins. صفحة 684. . مؤرشف من الأصل في 28 فبراير 2020.
- "Cystine stones". آب تو ديت. مؤرشف من الأصل في 26 ديسمبر 201720 فبراير 2014.
- Bailey & Love's/25th/1296
- National Endocrine and Metabolic Diseases Information Service (2008). "Renal Tubular Acidosis (NIH Publication No. 09–4696)". Kidney & Urologic Diseases: A-Z list of Topics and Titles. Bethesda, Maryland: National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, Public Health Service, US Department of Health and Human Services. مؤرشف من الأصل في 14 فبراير 201527 يوليو 2011.
- De Mais, Daniel (2009). ASCP Quick Compendium of Clinical Pathology (الطبعة 2nd). Chicago: ASCP Press.
- Weiss, M; Liapis, H; Tomaszewski, JE; Arend, LJ (2007). "Chapter 22: Pyelonephritis and Other Infections, Reflux Nephropathy, Hydronephrosis, and Nephrolithiasis". In Jennette, JC; Olson, JL; Schwartz, MM; Silva, FG (المحررون). Heptinstall's Pathology of the Kidney. 2 (الطبعة 6th). Philadelphia: Lippincott Williams & Wilkins. صفحات 991–1082. . مؤرشف من الأصل في 28 فبراير 2020.
- Halabe, A; Sperling, O (1994). "Uric acid nephrolithiasis". Mineral and Electrolyte Metabolism. 20 (6): 424–31. ISSN 0378-0392. PMID 7783706.
- Kamatani, N (1996). "Adenine phosphoribosyltransferase (APRT) deficiency". Nippon Rinsho. Japanese Journal of Clinical Medicine (باللغة اليابانية). 54 (12): 3321–7. ISSN 0047-1852. PMID 8976113.
- Rosenberg, LE; Durant, JL; Elsas, LJ (1968). "Familial iminoglycinuria. An inborn error of renal tubular transport". نيو إنغلاند جورنال أوف ميديسين. 278 (26): 1407–13. doi:10.1056/NEJM196806272782601. PMID 5652624.
- Coşkun, T; Ozalp, I; Tokatli, A (1993). "Iminoglycinuria: A benign type of inherited aminoaciduria". The Turkish Journal of Pediatrics. 35 (2): 121–5. PMID 7504361.
- Merck Sharp; Dohme Corporation (2010). "Patient Information about Crixivan for HIV (Human Immunodeficiency Virus) Infection" ( كتاب إلكتروني PDF ). Crixivan® (indinavir sulfate) Capsules. Whitehouse Station, New Jersey: Merck Sharp & Dohme Corporation. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 5 فبراير 201727 يوليو 2011.
- Schlossberg, D; Samuel, R (2011). "Sulfadiazine". Antibiotic Manual: A Guide to Commonly Used Antimicrobials (الطبعة 1st). Shelton, Connecticut: People's Medical Publishing House. صفحات 411–12. . مؤرشف من الأصل في 18 نوفمبر 2016.
- Carr, MC; Prien, EL, Jr; Babayan, RK (1990). "Triamterene nephrolithiasis: Renewed attention is warranted". The Journal of Urology. 144 (6): 1339–40. PMID 2231920.
- McNutt, WF (1893). "Chapter VII: Vesical Calculi (Cysto-lithiasis)". Diseases of the Kidneys and Bladder: A Text-book for Students of Medicine. IV: Diseases of the Bladder. Philadelphia: J.B. Lippincott Company. صفحات 185–6. مؤرشف من الأصل في 28 فبراير 2020.
- Gettman, MT; Segura, JW (2005). "Management of ureteric stones: Issues and controversies". British Journal of Urology International. 95 (Supplement 2): 85–93. doi:10.1111/j.1464-410X.2005.05206.x. PMID 15720341.
- Segura, Joseph W. (1997). "STAGHORN CALCULI". Urologic Clinics of North America. 24 (1): 71–80. doi:10.1016/S0094-0143(05)70355-4. ISSN 0094-0143.
- Fink, HA; Wilt, TJ; Eidman, KE; Garimella, PS; et al. (2 April 2013). "Medical management to prevent recurrent nephrolithiasis in adults: A systematic review for an American College of Physicians clinical guideline". Annals of Internal Medicine. 158 (7): 535–43. doi:10.7326/0003-4819-158-7-201304020-00005. PMID 23546565.
- Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; Denberg, TD; Clinical Guidelines Committee of the American College of, Physicians (4 November 2014). "Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: a clinical practice guideline from the American College of Physicians". Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/m13-2908. PMID 25364887.
- Goldfarb, DS; Coe, FL (1999). "Prevention of recurrent nephrolithiasis". American Family Physician. 60 (8): 2269–76. PMID 10593318. مؤرشف من الأصل في 6 يونيو 2011.
- Finkielstein, VA; Goldfarb, DS (2006). "Strategies for preventing calcium oxalate stones". Canadian Medical Association Journal. 174 (10): 1407–9. doi:10.1503/cmaj.051517. PMC . PMID 16682705. مؤرشف من الأصل في 15 أكتوبر 2008.
- Paterson, R; Fernandez, A; Razvi, H; Sutton, R (2010). "Evaluation and medical management of the kidney stone patient". Canadian Urological Association Journal. 4 (6): 375–9. doi:10.5489/cuaj.10166. PMC . PMID 21191493.
- Penniston, Kristina, PhD, RD. Citric Acid and Kidney Stones. UW Hospital Metabolic Stone Clinic. Retrieved: 8 March 2015. نسخة محفوظة 19 مايو 2017 على موقع واي باك مشين.
- Taylor, EN; Curhan, GC (September 2006). "Diet and fluid prescription in stone disease". Kidney International. 70 (5): 835–9. doi:10.1038/sj.ki.5001656. PMID 16837923.
- "What are kidney stones?". kidney.org. مؤرشف من الأصل في 25 أكتوبر 201519 أغسطس 2013.
- Heaney, RP (2006). "Nutrition and Chronic Disease" ( كتاب إلكتروني PDF ). Mayo Clinic Proceedings. 81 (3): 297–9. doi:10.4065/81.3.297. PMID 16529131. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 9 أبريل 202027 يوليو 2011.
- Tiselius, HG (2003). "Epidemiology and medical management of stone disease". British Journal of Urology International. 91 (8): 758–67. doi:10.1046/j.1464-410X.2003.04208.x. PMID 12709088.
- Taylor, EN; Stampfer, MJ; Curhan, GC (2004). "Dietary factors and the risk of incident kidney stones in men: New insights after 14 years of follow-up" ( كتاب إلكتروني PDF ). Journal of the American Society of Nephrology. 15 (12): 3225–32. doi:10.1097/01.ASN.0000146012.44570.20. PMID 15579526. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 21 سبتمبر 2017.
- Cicerello, E; Merlo, F; Maccatrozzo, L (Sep 2010). "Urinary alkalization for the treatment of uric acid nephrolithiasis". Archivio Italiano di Urologia, Andrologia. 82 (3): 145–8. PMID 21121431.
- Cameron, JS; Simmonds, HA (1987). "Use and abuse of allopurinol". المجلة الطبية البريطانية. 294 (6586): 1504–5. doi:10.1136/bmj.294.6586.1504. PMC . PMID 3607420.
- Macaluso, JN (1999). "Management of stone disease—bearing the burden". The Journal of Urology. 156 (5): 1579–80. doi:10.1016/S0022-5347(01)65452-1. PMID 8863542.
- Seitz, C; Liatsikos, E; Porpiglia, F; Tiselius, HG; et al. (September 2009). "Medical therapy to facilitate the passage of stones: What is the evidence?". European Urology. 56 (3): 455–71. doi:10.1016/j.eururo.2009.06.012. PMID 19560860.
- Campschroer, T; Zhu, Y; Duijvesz, D; Grobbee, DE; et al. (2 April 2014). "Alpha-blockers as medical expulsive therapy for ureteral stones". مؤسسة كوكرين. 4 (4): CD008509. doi:10.1002/14651858.CD008509.pub2. PMID 24691989.
- Campschroer, T; Zhu, Y; Duijvesz, D; Grobbee, DE; Lock, MT (2 April 2014). "Alpha-blockers as medical expulsive therapy for ureteral stones". The Cochrane database of systematic reviews. 4 (4): CD008509. doi:10.1002/14651858.CD008509.pub2. PMID 24691989.
- Wang, Ralph C.; Smith-Bindman, Rebecca; Whitaker, Evans; Neilson, Jersey; Allen, Isabel Elaine; Stoller, Marshall L.; Fahimi, Jahan (September 2016). "Effect of Tamsulosin on Stone Passage for Ureteral Stones: A Systematic Review and Meta-analysis". Annals of Emergency Medicine. doi:10.1016/j.annemergmed.2016.06.044. PMID 27616037.
- Shock Wave Lithotripsy Task Force (2009). "Current Perspective on Adverse Effects in Shock Wave Lithotripsy" ( كتاب إلكتروني PDF ). Clinical Guidelines. Linthicum, Maryland: American Urological Association. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 18 يوليو 201313 أكتوبر 2015.
- Lingeman, JE; Matlaga, BR; Evan, AP (Campbell-Walsh Urology). "Surgical Management of Urinary Lithiasis". In Wein, AJ; Kavoussi, LR; Novick, AC; Partin, AW; Peters, CA (المحررون). Philadelphia: W. B. Saunders. صفحات 1431–1507.
- Preminger, GM; Tiselius, HG; Assimos, DG; Alken, P; et al. (2007). "2007 Guideline for the management of ureteral calculi". The Journal of Urology. 178 (6): 2418–34. doi:10.1016/j.juro.2007.09.107. PMID 17993340.
- Evan, AP; McAteer, JA (1996). "Ch. 28: Q-effects of Shock Wave Lithotripsy". In Coe, FL; Favus, MJ; Pak, CYC; Parks, JH; Preminger, GM (المحررون). Kidney Stones: Medical and Surgical Management. Philadelphia: Lippincott-Raven. صفحات 549–60.
- Evan, AP; Willis, LR (2007). "Ch. 41: Extracorporeal Shock Wave Lithotripsy: Complications". In Smith, AD; Badlani, GH; Bagley, DH; Clayman, RV; Docimo, SG (المحررون). Smith's Textbook on Endourology. Hamilton, Ontario, Canada: B C Decker, Inc. صفحات 353–65.
- Young, JG; Keeley, FX, Ch. 38: "Indications for Surgical Removal, Including Asymptomatic Stones" In Rao, Preminger & Kavanagh 2011، صفحات 441–54.
- Wynberg, JB; Borin, JF; Vicena, JZ; Hannosh, V; Salmon, SA (Oct 2012). "Flexible ureteroscopy-directed retrograde nephrostomy for percutaneous nephrolithotomy: description of a technique". J Endourol. 26 (10): 1268–74. doi:10.1089/end.2012.0160. PMID 22563900.
- Lam, JS; Gupta, M, Ch. 25: "Ureteral Stents" In Stoller & Meng 2007، صفحات 465–83.
- Marks, AJ; Qiu, J; Milner, TE; Chan, KF; et al., Ch. 26: "Laser Lithotripsy Physics" In Rao, Preminger & Kavanagh 2011، صفحات 301–10.
- Romano, Victoriano; Akpinar, Haluk; Assimos, Dean G (2010). "Kidney Stones: A Global Picture of Prevalence, Incidence, and Associated Risk Factors". Rev. Urol. 12 (2010 Spring–Summer): 2–3. PMC . PMID 20811557.
- Lieske, JC; Segura, JW (2004). "Ch. 7: Evaluation and Medical Management of Kidney Stones". In Potts, JM (المحرر). Essential Urology: A Guide to Clinical Practice (الطبعة 1st). Totowa, New Jersey: Humana Press. صفحات 117–52. .
- Lozano, R; Naghavi, Mohsen; Foreman, Kyle; Lim, Stephen; et al. (December 15, 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- Windus, editor, David (2008). The Washington manual nephrology subspecialty consult (الطبعة 2nd). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins Health. صفحة 235. . مؤرشف من الأصل في 28 فبراير 2020.
- Eknoyan, G (2004). "History of urolithiasis". Clinical Reviews in Bone and Mineral Metabolism. 2 (3): 177–85. doi:10.1385/BMM:2:3:177. ISSN 1534-8644.
- Aulus Cornelius Celsus (1831). "Book VII, Chapter XXVI: Of the operation necessary in a suppression of urine, and lithotomy". In Collier, GF (المحرر). A translation of the eight books of Aul. Corn. Celsus on medicine (الطبعة 2nd). London: Simpkin and Marshall. صفحات 306–14. مؤرشف من الأصل في 28 فبراير 2020.
- Shah, J; Whitfield, HN (2002). "Urolithiasis through the ages". British Journal of Urology International. 89 (8): 801–10. doi:10.1046/j.1464-410X.2002.02769.x. PMID 11972501.
- Ellis, H (1969). A History of Bladder Stone. Oxford, England: Blackwell Scientific Publications. .
- Bigelow, HJ (1878). Litholapaxy or rapid lithotrity with evacuation. Boston: A. Williams and Company. صفحة 29. مؤرشف من الأصل في 28 فبراير 2020.
- Coe, FL; Evan, A; Worcester, E (2008). "Chapter 114: Kidney stone disease". In Marks, AR; Neill, US (المحررون). Science in medicine: the JCI textbook of molecular medicine. Part II: Kidney and urinary tract (الطبعة 1st). Sudbury, Massachusetts: Jones and Bartlett Publishers. صفحات 898–908. . مؤرشف من الأصل في 18 نوفمبر 2016.
- Dwyer, Moira E.; Krambeck, Amy E.; Bergstralh, Eric J.; Milliner, Dawn S.; Lieske, John C.; Rule, Andrew D. (July 2012). "Temporal Trends in Incidence of Kidney Stones Among Children: A 25-Year Population Based Study". Pediatric Urology. 188 (1): 247–252. doi:10.1016/j.juro.2012.03.021. PMID 22595060.
- "Diet and Definition of Kidney Stones, Renal Calculi". مؤرشف من الأصل في 17 نوفمبر 200711 أكتوبر 2013.
- Kirejczyk, JK.; Porowski, T.; Filonowicz, R.; Kazberuk, A.; Stefanowicz, M.; Wasilewska, A.; Debek, W. (Aug 2013). "An association between kidney stone composition and urinary metabolic disturbances in children". J Pediatr Urol. 10 (1): 130–5. doi:10.1016/j.jpurol.2013.07.010. PMID 23953243.
- Pugh, D. G. 2002. Sheep and goat medicine. Saunders, Philadelphia. 468 pp.
- Bushman, D. H.; Emerick, R. J.; Embry, L. B. (1965). "Urolithiasis: relationships involving dietary calcium, phosphorus and magnesium". J. Nutr. 87: 499–504.
- Stewart, S. R.; Emerick, R. J.; Pritchard, R. H. (1991). "Effects of dietary ammonium chloride and variations in calcium to phosphorus ratio on silica urolithiasis in sheep". J. Anim. Sci. 69: 2225–2229. doi:10.2527/1991.6952225x.
- Forman, S. A.; Whiting, F.; Connell, R. (1959). "Silica urolithiasis in beef cattle. 3. Chemical and physical composition of the uroliths". Can. J. Compar. Med. 23 (4): 157–162.
- Scott, D.; Buchan, W. (1988). "The effects of feeding pelleted diets made from either coarsely or finely ground hay on phosphorus balance and on the partition of phosphorus excretion between urine and faeces in the sheep". Q. J. Exp. Physiol. 73: 315–322. doi:10.1113/expphysiol.1988.sp003148.
- Bravo, D.; Sauvant, D.; Bogaert, C.; Meschy, F. (2003). "III. Quantitative aspects of phosphorus excretion in ruminants". Reprod. Nutr. Dev. 43: 285–300. doi:10.1051/rnd:2003021.
- Waltner-Toews, D. and D. H. Meadows. 1980. Case report: Urolithiasis in a herd of beef cattle associated with oxalate ingestion. Can. Vet. J. 21: 61-62
- James, L. F.; Butcher, J. E. (1972). "Halogeton poisoning of sheep: effect of high level oxalate intake. J. Anim". Sci. 35: 1233–1238. doi:10.2527/jas1972.3561233x.
- Kahn, C. M. (ed.) 2005. Merck veterinary manual. 9th Ed. Merck & Co., Inc., Whitehouse Station.
ملاحظات
- Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, Institute of Medicine of the National Academies (2011). Ross, AC; Taylor, CL; Yaktine, AL; Del, HB (المحررون). Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: The National Academies Press. . مؤرشف من الأصل في 09 سبتمبر 2014.
- Rao, PN; Preminger, GM; Kavanagh, JP, المحررون (2011). Urinary Tract Stone Disease (الطبعة 1st). London: Springer-Verlag. doi:10.1007/978-1-84800-362-0_26. . مؤرشف من الأصل في 28 فبراير 2020.
- Reilly Jr., RF; Perazella, MA, المحررون (2005). Nephrology in 30 Days (الطبعة 1st). New York: The McGraw-Hill Companies, Inc. . مؤرشف من الأصل في 28 فبراير 2020.
- Stoller, ML; Meng, MV, المحررون (2007). Urinary stone disease: the practical guide to medical and surgical management (الطبعة 1st). Totowa, New Jersey: Humana Press. . مؤرشف من الأصل في 09 أبريل 2020.