Concombre de mer, Holothuroidea

| Règne | Animalia |
|---|---|
| Sous-règne | Bilateria |
| Infra-règne | Deuterostomia |
| Embranchement | Echinodermata |
| Sous-embr. | Echinozoa |
Ordres de rang inférieur
- Apodida Brandt, 1835
- Dendrochirotida Grube, 1840
- Elasipodida Théel, 1882
- Holothuriida Miller, Kerr, Paulay, Reich, Wilson, Carvajal & Rouse, 2017
- Molpadida Haeckel, 1896
- Persiculida Miller, Kerr, Paulay, Reich, Wilson, Carvajal & Rouse, 2017
- Synallactida Miller, Kerr, Paulay, Reich, Wilson, Carvajal & Rouse, 2017

Les Holothuries (Holothuroidea) sont une classe d'animaux marins de l'embranchement des échinodermes au corps mou et oblong et possédant un cercle de tentacules autour de la bouche. Elles sont aussi appelées concombres de mer ou bêches de mer et possèdent une grande diversité de sobriquets sur les différentes côtes, "vier marin" dans la région marseillaise.
Ces animaux, majoritairement benthiques, vivent, selon les espèces, de la surface aux abysses. Les holothuries mesurent généralement de 10 à 30 cm de long ; mais certaines espèces comme le cordon mauresque peuvent dépasser 3 m. Leurs plus proches parents sont les oursins en dépit du peu de ressemblance visible. Ce sont des animaux inoffensifs, mais parfois toxiques.
Anatomie
Les concombres de mer, comme leur nom l'indique, ont pour la plupart un corps mou et cylindrique, plus ou moins allongé, arrondi aux extrémités, et généralement sans appendices solides. Leur forme va de presque globulaire pour les « pommes de mer » (genre Pseudocolochirus) à serpentiforme pour le groupe des Apodida (« holothuries-serpents »). Les holothuries mesurent généralement de 10 à 30 cm de long avec des extrêmes de quelques millimètres pour Rhabdomolgus ruber et jusqu'à plus de 3 m pour Synapta maculata[1]. La plupart possèdent 5 rangées de petits pieds à ventouse appelés « podia », mais les Apodida en sont dépourvus et se déplacent en rampant. Leur épiderme peut être d'aspect lisse ou pourvu d'excroissances charnues (comme Thelenota ananas). Les podia de la face dorsale n'ont généralement pas de rôle locomoteur, et sont transformés en papilles[2]. À l'une des extrémités s'ouvre la bouche (en position plus ou moins ventrale), entourée d'une couronne de tentacules qui peuvent être très complexes chez certaines espèces (ce sont en fait des podia modifiés) ; à l'autre bout l'anus est postéro-dorsal[3].
Les holothuries ressemblent peu aux autres échinodermes, du fait de leur corps ramassé en tube, sans squelette apparent ni appendices durs. De plus, la symétrie pentaradiaire propre aux échinodermes, quoique conservée structurellement, est ici doublée par une symétrie bilatérale qui les fait ressembler à des chordés[4]. Cependant, la symétrie centrale est encore visible chez certaines espèces à travers les 5 méridiens (ou « radius ») qui parcourent le corps de l'animal de la bouche à l'anus (comme chez les oursins), d'où sortent les cinq rangées de pieds ambulacraires (appelés « podia »)[4]. Il n'y a donc pas de face « orale » ou « aborale » comme chez les étoiles de mer et les autres échinodermes, mais l'animal repose sur un de ses côtés (ce qui est unique chez les échinodermes contemporains), et cette face ventrale est appelée trivium (car elle comporte 3 rangées de podia), alors que la face dorsale est nommée bivium (avec 2 rangées de podia ou de papilles)[2].
 Une Actinopyga echinites : on voit la couronne de tentacules buccaux et les podia.
Une Actinopyga echinites : on voit la couronne de tentacules buccaux et les podia. Détail de la bouche d’une holothurie, avec ses tentacules.
Détail de la bouche d’une holothurie, avec ses tentacules. Holothurie ensablée (Holothuria poli), une des espèces les plus communes de Méditerranée.
Holothurie ensablée (Holothuria poli), une des espèces les plus communes de Méditerranée.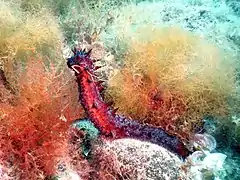 Holothuria tubulosa, autre espèce commune en Europe.
Holothuria tubulosa, autre espèce commune en Europe. Synaptula lamperti sur un récif de coraux et d'éponges en Indonésie.
Synaptula lamperti sur un récif de coraux et d'éponges en Indonésie. Holothurie nageuse du genre Enypniastes.
Holothurie nageuse du genre Enypniastes. Cucumaria miniata, espèce filtreuse.
Cucumaria miniata, espèce filtreuse. Pseudocolochirus axiologus (« pomme de mer »).
Pseudocolochirus axiologus (« pomme de mer »). Holothuria leucospilota.
Holothuria leucospilota. Isostichopus badionotus.
Isostichopus badionotus. Thelenota rubralineata.
Thelenota rubralineata. Holothuria fuscopunctata.
Holothuria fuscopunctata.
Physiologie
Squelette

Les holothuries n'ont pas de squelette développé, contrairement aux autres échinodermes, à l'exception d'une couronne calcaire péripharyngienne[5], qui sert de support aux tentacules buccaux ainsi qu'à cinq bandes musculaires longitudinales qui parcourent tout l'animal (doublés par des muscles rétracteurs chez les Dendrochirotida)[2].
Le tégument contient un squelette relictuel constitué de minuscules spicules de calcite de formes très variées (ancres, tables, roues...) parfois appelées « ossicules », qui constituent souvent un critère d'identification et de classification des espèces. Généralement, elles sont de formes tridimensionnelles près de la surface de l'épiderme (notamment en « tables »), et bidimensionnelles plus en profondeur (boutons, bâtons)[6]. Elles mesurent généralement quelques dizaines de micromètres, mais peuvent atteindre le millimètre chez certaines Apodida[3].
Quelques espèces comme Psolus chitonoides (en) et Psolus diomedeae ont cependant développé un squelette externe composé de plaques dures, les faisant ressembler à certains groupes d'échinodermes fossiles ou à d'autres animaux cuirassés contemporains tels les chitons[7], voire à des oursins quand ces plaques développent des piquants (comme chez Ypsilothuria bitentaculata)[8].
Système nerveux
Le système nerveux est constitué comme chez tous les échinodermes d'un anneau nerveux péri-stomacal, rond ou pentagonal, duquel partent cinq nerfs radiaux qui innervent tout le corps et notamment les aires ambulacraires.
Les sens des holothuries sont relativement rudimentaires : elles sont principalement sensibles au toucher, aux variations lumineuses et à certains composés chimiques présents dans l'eau. Des taches présentes à la base des tentacules chez certaines espèces sont interprétées comme des organes visuels, d'une acuité probablement limitée[9].
Système digestif
La bouche, dépourvue de dents, est suivie d'un pharynx et d'un œsophage ; l'intestin qui suit est très long pour optimiser la digestion d'une alimentation peu énergétique ; la digestion peut durer jusqu'à 36 heures chez certaines espèces[2]. Le gros intestin se termine par une poche cloacale, où peuvent vivre certains symbiotes.
Certaines familles d'holothuries sont pourvues de dents anales, cependant celles-ci ont un rôle essentiellement défensif et n'interviennent pas dans la digestion[2]. Les holothuries respirant par le cloaque, sont contraintes de garder celui-ci béant l'essentiel du temps, laissant donc la porte ouverte à toutes sortes de parasites et de profiteurs : les dents anales, présentes notamment chez le genre Actinopyga, permettent donc de limiter ce genre d'intrusion.
Système circulatoire
Comme tous les échinodermes, les holothuries sont pourvues d'un système aquifère ou ambulacraire à symétrie pentaradiale, avec une madréporite réduite et interne, reliée aux podia et à des vésicules de Poli. La respiration peut être assurée par la peau (chez les Apodida et Elasipodida[10]) ou par un appareil respiratoire interne appelé « arbre respiratoire » qui débouche sur le cloaque et se remplit ou se vide d'eau par contractions de l'organe[2]. Comme tous les échinodermes, les holothuries n'ont pas à proprement parler de « sang », mais leurs fluides internes sont équipés de cellules (coelomocytes) similaires à nos cellules sanguines : hémocytes (ou « caroténocytes », car riches en caroténoïdes), phagocytes, sphérulocytes.
Organes reproducteurs
Le système reproducteur est composé d'une gonade (mâle ou femelle) et d'un gonoducte débouchant sur le gonopore externe, situé à proximité de la bouche. La gonade se compose d'un grand nombre de tubes gonadiques ramifiés dont la partie distale flotte librement dans le cœlome. Elle est soutenue du côté proximal par un mésentère relié à la partie antérieure du tube digestif : Les cellules reproductrices sont situées dans ces tubes gonadiques et seront relarguées à maturation[2].
Écologie et comportement
.jpg.webp)

.png.webp)
Locomotion
Presque toutes les holothuries sont dites « benthiques » : cela signifie qu'elles vivent posées sur (ou parfois dans) le fond marin[11]. Certaines sont sédentaires, vivant fixées sur ou dans le substrat, où elles se nourrissent généralement en filtrant l'eau à l'aide de leurs tentacules buccaux : c'est le cas de nombreuses espèces de l'ordre des Dendrochirotida (cependant la plupart demeurent capables de se déloger en cas de menace ou d'arrachage). Cependant, la plupart des espèces de concombres de mer sont capables de se déplacer : celles-là sont dites « vagiles », et rampent lentement sur le fond, d'une manière qui peut parfois rappeler les chenilles, à une vitesse comprise entre 5 et 50 cm/h[3] (57 cm/h chez l'holothurie géante Thelenota anax[12]). Malgré cette lenteur habituelle, certaines espèces sont capables de fuir assez rapidement une menace par de puissantes convulsions et torsions.
La grande majorité des espèces (à part celles de l'ordre des Apodida et quelques espèces très dérivées[13]) se déplacent et se maintiennent grâce à de minuscules tubes souples munis de pseudo-ventouses (en fait des plates-formes adhésives[14]) qui tapissent leur face ventrale, et que l'on appelle « pieds ambulacraires » ou « podia »[15]. Les podia sont capables d'un pouvoir d'adhérence élevé qui leur permet souvent de se maintenir à la verticale ou même à l'envers dans des courants importants, et empêchent certains prédateurs de les déloger. Les espèces de l'ordre des Apodida, dépourvues de podia comme leur nom l'indique, se déplacent en rampant lentement, et ne fréquentent que les fonds calmes ou les milieux à forte rugosité. Certaines holothuries abyssales (famille des Elpidiidae) ont des podia très modifiés, moins nombreux et plus charnus et rappelant plus des « pattes », par leur forme et leur usage.
Plusieurs espèces d'holothuries (environ 25, réparties dans la plupart des groupes, mais surtout les Elasipodida) sont capables de nager un court instant, pour échapper à un danger ou se déplacer plus rapidement. Cette capacité se fait par ondulation du corps et éventuellement à l'aide d'appendices palmés (comme chez les Psychropotes). Certaines espèces de grande profondeur peuvent même adopter un mode de vie « benthopélagique », ce qui signifie qu'elles passent une partie de leur temps en suspension dans l'eau, mais regagnent le sol de temps à autre ; c'est notamment le cas des espèces du genre Enypniastes. La seule espèce complètement pélagique[16] connue est Pelagothuria natatrix, qui ressemble sous beaucoup d'aspects à une méduse[11]. Il semble que d'autres espèces benthiques (comme Holothuria scabra (en) et Cucumaria frondosa (en)) soient capables de modifier leur densité (« active buoyancy adjustment ») pour se mettre à flotter quelque temps, afin d'échapper facilement à des conditions d'eau devenues dangereuses[17].
Le déplacement lent et timide des holothuries les lie profondément à leur habitat, vu qu'elles peuvent difficilement en changer : en conséquence, certaines études suggèrent qu'elles pourraient constituer des bioindicateurs du milieu plus fins que les poissons, qui sont plus mobiles[18].

Cycle de vie et reproduction

Les sexes sont toujours séparés chez les holothuries, qui peuvent donc être mâles ou femelles[3] (seules quelques espèces sont hermaphrodites, mais jamais capables d'autofécondation[3]). Il n'y a cependant pas de dimorphisme sexuel, et seul l'examen microscopique des gonades permet de déterminer le sexe d'un individu[19]. Les gonades forment de petites touffes de cæca situées dans la partie antérieure de l'animal (une chez les Holothuriidae, deux chez les Stichopodidae[3]), et reliées à un conoducte qui débouche au-dessus de la bouche[3].
Les holothuries sont toutes ovipares ; la fécondation est sexuée et externe, et son développement est indirect (présence d'un stade larvaire)[3]. Les gamètes sont relarguées dans l'eau où a lieu la fécondation ; lors de l'éjection des gamètes, la plupart des holothuries adoptent généralement une position érigée caractéristique, parfois juchées au sommet d'un promontoire[19]. Une fois l'ovule fécondé, après plusieurs divisions cellulaires apparaissent les stades larvaires, qui font encore partie du plancton et permettent ainsi une bonne dispersion des individus. La première forme larvaire est appelée auricularia[19] (appelée ainsi car ses segments ciliés évoqueraient une oreille[3]) et précède parfois un second stade appelé doliolaria, qui est la larve compétente qui subit la métamorphose ; elle précède le stade juvénile, dont la morphologie est généralement similaire à l'adulte, excepté la taille et la maturité sexuelle. Cependant, chez de nombreuses familles la larve se développe directement en doliolaria, sans passer par le stade auricularia (stade toutefois présent chez la plupart des familles communes, notamment les Holothuriidae, les Stichopodidae et les Synaptidae). Certaines holothuries des eaux glaciaires ou des abysses possèdent certaines spécificités dans le développement ou le mode de reproduction : par exemple, l'espèce Paroriza pallens, qui vit dans les abysses du golfe du Mexique, se regroupe par couples lors de la reproduction pour optimiser les chances de fertilisation[19].
 Larve auricularia dessinée par Ernst Haeckel.
Larve auricularia dessinée par Ernst Haeckel. Pearsonothuria graeffei juvénile, mimétique des nudibranches toxiques de la famille des Phyllidiidae.
Pearsonothuria graeffei juvénile, mimétique des nudibranches toxiques de la famille des Phyllidiidae.
De nombreuses espèces d'holothuries (comme Holothuria atra ou Stichopus chloronotus) sont également capables d'une reproduction asexuée par scission[3] : un rétrécissement apparaît progressivement chez l'animal, qui à force de s'amenuiser finit par le couper en deux parties (égales chez H. atra, inégales chez S. chloronotus). La plaie se referme en deux jours seulement. Chaque partie régénère ensuite un individu complet en deux à 6 mois, et vit généralement caché le temps de la régénération (l'individu est de toute façon provisoirement incapable de se nourrir)[3]. On observe à la Réunion que la reproduction sexuée a plutôt lieu pendant la saison chaude (où l'eau est plus riche en plancton pour nourrir les larves), et la reproduction asexuée pendant la saison froide[3].
La détermination de l'âge des holothuries est complexe, car il semble que la croissance se stabilise rapidement à la maturité au profit d'un investissement dans la reproduction : leur espérance de vie reste donc mal connue. Cependant, une étude publiée en 2019 montre que les spicules dermiques possèdent des stries de croissance (à la manière des arbres), qui permettent de compter les années à la manière de ce qui se pratique en dendrochronologie. Avec cette méthode, l'espèce filtreuse d'eau froide Psolus fabricii a pu être estimée vivant plusieurs décennies : il est probable que, comme pour beaucoup d'autres animaux, les espèces d'eaux froides et profondes aient un cycle de vie plus lent et vivent plus longtemps que les espèces littorales d'eaux chaudes[20].
Moyens de défense

- Toxines
Les holothuries ont la particularité de dégager en permanence des toxines appelées saponines (aglycone triterpénoïde). Ces toxines sont cytotoxiques et hémolytiques, donc dangereuses pour la plupart des poissons, ce qui fait que les holothuries adultes ont généralement peu de prédateurs[21]. Suivant l'espèce et la condition des individus, ces toxines sont présentes en plus ou moins grande quantité et plus ou moins efficaces.
- Durcissement
Le corps des holothuries est structuré par des fibres de collagène. Cependant, celui-ci est très particulier en tant qu'il est capable de changer de structure en un instant (appelé « MCT », pour mutable collagenous tissue[22]), permettant la rétractation et le durcissement du corps de l'animal, qui chez certaines espèces peut devenir presque dur comme de la pierre (d'où le nom vernaculaire de certaines d'entre elles comme l'« holothurie caillou », Actinopyga lecanora[23]).
- Les tubes de Cuvier
Lorsqu'elles sont inquiétées, certaines holothuries appartenant toutes à la famille des Holothuriidae peuvent émettre de longs filaments collants appelés tubes de Cuvier[24] : expulsés par l'orifice cloacal, le réseau de filaments quiescents s'allonge de 20 à 30 fois[2] et devient collant[24], immobilisant l'ennemi : poisson, crabe, gastéropode ou étoile de mer[2]. Les Polynésiens se servent de ces filaments, en les enroulant sur leurs pieds, pour marcher sur les récifs de coraux[25]. Après expulsion, l'holothurie met de deux à cinq semaines pour régénérer ses tubes[26].
- L'éviscération
Mécanisme de défense qui consiste à éjecter une grande partie des organes internes : on parle d'« éviscération ». L'holothurie continue ensuite ses mouvements respiratoires, drainant l'eau de mer directement dans la cavité générale du corps, et vit quelques semaines au ralenti jusqu'à ce que de nouveaux organes soient régénérés (ce qui peut prendre entre 7 et 145 jours suivant les espèces et les conditions)[27]. Ce phénomène rappelant l'autotomie, n'est observé que chez deux ordres : les Dendrochirotida (qui s'éviscèrent par la partie antérieure) et les Holothuriida (qui s'éviscèrent par la partie postérieure ou cloacale)[27]. L'éviscération semble également parfois avoir lieu en dehors d'une agression, peut-être dans un but purgatif[27].
- La fuite
La plupart des grosses holothuries de l'ordre des Holothuriida et des Synallactida sont capables, en cas de menace, de s'enfuir grâce à des mouvements de contorsion brusques et plus ou moins organisés. Ces convulsions peuvent impressionner un prédateur, lui faire lâcher prise ou permettre de semer un prédateur benthique plus lent (étoile de mer, mollusque entre autres) mais aussi dénoncer sa présence à un plus gros prédateur[21]. Quelques espèces sont capables de nager plus ou moins longtemps : ce mode de fuite est notamment répandu chez de nombreuses espèces abyssales de l'ordre des Elasipodida[11].
- Bioluminescence
Certaines holothuries abyssales (comme Pannychia moseleyi) sont capables d'émettre de la lumière par bioluminescence quand elles se sentent menacées, dénonçant ainsi l'importun aux prédateurs de niveau supérieur[28].
Écologie

Habitat
Les holothuries vivent de la zone littorale jusqu'aux plus grandes profondeurs des océans, elles sont enfouies dans le sable vaseux, rampent sur le fond parmi les algues, ou sont logées dans les anfractuosités des rochers[2].
Les holothuries sont le groupe de détritivores le plus important des faunes récifales et abyssales[2]. Elles peuvent former des populations très denses, particulièrement dans les profondeurs : dans une fosse océanique très profonde, elles constituent la moitié des formes vivantes à 4 000 mètres et 90 % à 8 000 mètres. Les holothuries sont les échinodermes les mieux adaptés aux profondeurs extrêmes, et sont encore très diversifiées au-delà de 5 000 m de fond : plusieurs espèces de la famille des Elpidiidae (« cochons de mer ») se retrouvent à plus de 9 500 m, et le record semble détenu par des espèces du genre Myriotrochus (notamment Myriotrochus bruuni, famille des Myriotrochidae), identifiées jusqu'à 10 687 mètres de profondeur[29].
Certaines espèces vivent en symbiose avec d'autres êtres : par exemple celles du genre Synaptula vivent presque exclusivement sur des éponges[13].
Alimentation

.jpg.webp)
Les holothuries connaissent trois sources de nourriture :
- Plancton (Suspensivorie)
- Détritus (Détritivorie)
- Matériel organique des sédiments de fond (dépositivorie).
La forme des tentacules est généralement adaptée au régime et au calibre des particules à ingérer : les espèces suspensivores ont ainsi le plus souvent de grands tentacules arborescents, destinés à maximiser la surface de filtrage, alors que les espèces se nourrissant dans des substrats grossiers auront plus souvent besoin de tentacules digités pour trier le matériel nutritif ; les espèces détritivores de substrats fins auront quant à elle souvent des tentacules plus courts, souvent peltés[2]. Un seul spécimen peut avaler plus de 45 kg de sédiments par an, et leurs excellentes capacités digestives leur permettent de rejeter un sédiment fin, pur et homogène. Ainsi, les concombres de mer jouent un rôle capital dans les processus biologiques des fonds marins (bioturbation, épuration, homogénéisation du sédiment...). L'espèce Holothuria scabra, qui vit dans les herbiers de l'Indo-Pacifique, semble jouer un rôle fondamental dans ces écosystèmes, ce qui rend sa surexploitation d'autant plus préoccupante[30]. Certaines espèces nécessitent des eaux très pures - comme Thelenota ananas - alors que d'autres préfèrent les eaux turbides - comme Bohadschia vitiensis. Plusieurs espèces tolèrent même des seuils de pollution importants. Les espèces pourvues de puissants podia sont plus souvent adaptées à des courants importants, alors que d'autres comme Synapta maculata nécessitent des eaux calmes. Certaines espèces comme Actinopyga echinites tolèrent même de passer plusieurs heures à l'air libre, pendant les marées basses[2].
 Bouche d'une holothurie serpent aux tentacules digités et pinnés, adaptés au triage du sédiment.
Bouche d'une holothurie serpent aux tentacules digités et pinnés, adaptés au triage du sédiment. Bouche d'une Pearsonothuria graeffei aux tentacules peltés, adaptés au ramassage du sédiment.
Bouche d'une Pearsonothuria graeffei aux tentacules peltés, adaptés au ramassage du sédiment. Bouche d'une Cucumaria miniata, pourvue de bras tentaculaires arborescents en fractales, destinés au filtrage de l'eau.
Bouche d'une Cucumaria miniata, pourvue de bras tentaculaires arborescents en fractales, destinés au filtrage de l'eau. Réjections d'holothuries sédimentivores. Ce sable filtré et recyclé permettra d'enrichir et d'homogénéiser le sédiment.
Réjections d'holothuries sédimentivores. Ce sable filtré et recyclé permettra d'enrichir et d'homogénéiser le sédiment.
Il a été montré en 2013 que certaines holothuries comme Apostichopus californicus peuvent également se nourrir par leur anus, en même temps qu'elles respirent : ce stratagème leur permettrait de complémenter leur régime détritivore par un régime suspensivore[31].
Symbioses et commensalismes
_on_Bohadschia_argus_(Sea_cucumber).jpg.webp)
De très nombreux petits animaux ainsi que certains parasites, peuvent vivre en symbiose ou en commensalisme avec les holothuries. Certaines crevettes nettoyeuses (groupe des Pontoniinae), notamment plusieurs espèces du genre Periclimenes (genre spécialisé dans les échinodermes) dont Periclimenes imperator vivent sur le tégument des holothuries[32].
Le commensalisme est fréquent dans la cavité cœlomique des grosses holothuries tropicales[3]. On y trouve notamment plusieurs espèces de crabes et de crevettes nettoyeuses pouvant entrer et sortir librement de l'anus[32], comme le crabe Lissocarcinus orbicularis qui peut même vivre dans la bouche de certaines espèces tropicales[33]. Certains petits poissons de la famille des Carapidae séjournent et circulent librement dans l'anus - et parfois une partie du tube digestif - des grosses holothuries[34], où ils trouvent un abri mais aussi une aire de reproduction pour certaines espèces, qui peuvent y habiter en couple. Certains de ces Carapidae sont cependant des parasites délétères, comme les Encheliophis sp., qui se nourrissent des organes internes des holothuries[34]. Certaines espèces d'holothuries peuvent réguler leurs hôtes internes grâce à des dents anales[34]. D'autres endocommensaux comme les bivalves du genre Entovalva vivent dans l'œsophage des holothuries[35]. Sans que la nature de l'association soit encore complètement élucidée, il existe sur le tégument d'holothuries des observations de plusieurs espèces vers polychètes (notamment des Polynoidae)[36].
Plusieurs parasites vivent accrochés sur le tégument des holothuries, comme des gastéropodes ectoparasites de la famille des Eulimidae[37] (par exemple Melanella sp. ou Stilapex sp.[36]), qui vivent accrochés sur le tégument qu'ils percent au moyen d'une trompe, un peu à la manière des tiques[3].
 Carapus acus, un poisson-perle qui vit dans la cavité cloacale des holothuries.
Carapus acus, un poisson-perle qui vit dans la cavité cloacale des holothuries..jpg.webp) Le petit crabe Lissocarcinus orbicularis peut vivre à la surface des holothuries, mais aussi à l'intérieur de leur bouche ou (comme ici) de leur cloaque.
Le petit crabe Lissocarcinus orbicularis peut vivre à la surface des holothuries, mais aussi à l'intérieur de leur bouche ou (comme ici) de leur cloaque. La crevette Periclimenes imperator, commensal fréquent de nombreux échinodermes.
La crevette Periclimenes imperator, commensal fréquent de nombreux échinodermes. Des gastéropodes parasites de la famille des Eulimidae sur le trivium d'une H. verrucosa juvénile.
Des gastéropodes parasites de la famille des Eulimidae sur le trivium d'une H. verrucosa juvénile. Deux polychètes polynoïdes sur une Thelenota anax.
Deux polychètes polynoïdes sur une Thelenota anax.
Prédateurs


Les holothuries sont dédaignées par la plupart des prédateurs marins en raison des toxines qu'elles contiennent (notamment l'holothurine) et de leurs moyens de défense parfois spectaculaires[21]. Cependant, elles demeurent la proie de certains prédateurs très spécialisés qui ne craignent pas leurs toxines, comme le gros mollusque Tonna perdix[38], qui les paralyse à l'aide d'un puissant venin avant de les avaler entièrement[39], en étirant sa bouche dans des proportions parfois spectaculaires[40].
D'autres prédateurs plus généralistes et opportunistes peuvent aussi parfois s'en prendre aux holothuries les moins bien défendues faute de mieux, comme certains poissons (balistes, poissons-globes...), étoiles de mer et crustacés (crabes, langoustes, bernard-l'ermite...)[21]. Le crabe nageur tropical Thalamita crenata est particulièrement connu pour faire des ravages sur les jeunes spécimens dans les élevages d'Holothuria scabra dans l'Indo-Pacifique[41]. Il existe aussi des observations de prédation par des tortues marines (Caretta caretta)[42].

Cependant, le principal prédateur actuel des holothuries reste l'Homme : de nombreuses espèces sont intensément pêchées et braconnées pour alimenter le marché asiatique, et plusieurs ont connu un effondrement spectaculaire de leur population[43], avec parfois des conséquences néfastes sur les écosystèmes[30].
Systématique

Histoire scientifique

La plus ancienne mention connue du terme grec ὁλοθούριον / holotoúrion (gén.ὁλοθούριου / holotoúriou)[44],[45] se trouve chez le poète Épicharme vers -450[46]. Platon, Aristote et Théophraste ont tous les trois utilisé le nom générique de πλεύμον θαλάσσιος / pleúmon thalássios pour désigner un zoophyte marin mou et flasque - ce que l'on a traduit par « poumon marin » ; le terme pourrait désigner les holothuries, mais peut-être aussi les ascidies ou encore des méduses[47].
L'un des plus anciens textes scientifiques concernant les holothuries remonte à Aristote, dans ses Parties des animaux[48] (vers -343) : il y nomme un animal « holothurie » sans le décrire, mais en le classant parmi les animaux dépourvus de sens (avec les éponges et « poumons de mer », correspondant apparemment aux tuniciers) ; ce nom sera conservé et utilisé par la suite pour nommer les concombres de mer, sans preuve qu'il s'agit bien de l'animal dont parlait le Philosophe[46]. La première utilisation de ce terme pour nommer indubitablement un concombre de mer se trouve dans les Libri de Piscibus Marinis de Guillaume Rondelet, publié en 1554 (toutefois il décrit deux espèces, dont la seconde est une ascidie, et il en sépare injustement le « vit de mer »[49])[46]. En Orient, les traités de médecine ou de zoologie évoquent les holothuries dès le VIIIe siècle, notamment le Kojiki en Chine (712), puis le Wamyō ruijushō au Japon (934), ouvrant la voie à une longue tradition d'excellente représentation de ces animaux dans les traités chinois et japonais[46].
Les scientifiques occidentaux recommencent à s'intéresser aux échinodermes à partir de la Renaissance, et Pierre Belon en 1553 est le premier à proposer de les rapprocher des étoiles de mer et oursins[50]. Les véritables progrès arrivent avec le siècle des Lumières : en 1751 un article « Holothurie » est rédigé dans l'Encyclopédie, sur la base des commentaires d'Aristote et Rondelet, mais leur position taxinomique (et même leur description) est encore peu claire :
« HOLOTHURIE, s.f. holothurium, (Hist. nat. Zool.) animal de mer. M. Linnæus le met au rang des zoophytes, qui sont nuds & qui ont des membres. Rondelet fait mention de deux espèces d’holothuries dont il donne les figures. La première espèce a une écorce dure, elle est oblongue ; l’une des extrémités est mousse & terminée par une écorce percée de plusieurs trous. La seconde espèce a le corps parsemé d’aiguillons ; il est terminé à l’un des bouts par une sorte de tête ronde percée d’un trou rond & ridé qui s’ouvre & se ferme, & qui est la bouche de l’animal ; l’autre bout du corps est menu & allongé en forme de queue. Il y a de chaque côté un prolongement qui est une jambe, ou plûtôt une nageoire, car l’animal s’en sert pour se mouvoir. L’un des prolongemens est plus étroit que l’autre, découpé tout-autour, & terminé en pointe[51]. »
En 1758 les holothuries figurent dans le Systema Naturae de Carl von Linné, mais ce terme n'y désigne toujours pas des échinodermes[6], mais regroupe des animaux assez hétéroclites, comme la physalie[52], et ce n'est qu'en 1767 que Linné corrige son entrée Holothuria[6]. C'est Nathanael Gottfried Leske qui crée l'embranchement des échinodermes en 1778 (systématisé par Jean-Guillaume Bruguière en 1791[6]) et incorpore définitivement ce clade aux classifications scientifiques. C'est Henri-Marie Ducrotay de Blainville qui se fait le descripteur scientifique du sous-embranchement des holothuroidea en 1834, en y désignant spécifiquement les concombres de mer (encore tous regroupés dans un genre unique). Au cours du XIXe siècle, de nombreuses espèces sont découvertes, et rapidement divisées en ordres et familles, notamment par Grube, Théel et Haeckel.
Au cours du XXe siècle, la pêche commerciale de plus en plus intensive menée pour satisfaire la clientèle asiatique mène à l'effondrement rapide de nombreux stocks[53] ; cette situation commença à inquiéter le secteur et les gouvernements à partir des années 1970, qui commencèrent à demander des études scientifiques sur l'état des populations, ce qui contribua à redynamiser la recherche sur ces animaux. En 1990 est créé le SPC Beche-de-mer Information Bulletin, premier périodique scientifique exclusivement dédié aux holothuries[54]. Les holothuries sont aujourd'hui étudiées par de nombreux spécialistes de pays variés, comme Chantal Conand, Gustav Paulay, Sven Uthicke, Nyawira Muthiga, Maria Byrne, Steven Purcell, François Michonneau ou Yves Samyn[43].
Classification
Les holothuries n'ayant pas de squelette comme les autres échinodermes, leur classification est particulièrement complexe et leur étude demande l'examen de spécimens bien conservés. La classification morphologique se fonde tout d'abord sur la présence ou la forme de certaines parties molles (podia, poumons, tentacules...) pour déterminer les grands ordres, et secondairement sur les quelques parties dures (quand elles existent) comme la couronne péripharyngienne et l'examen microscopique des ossicules pour déterminer le genre et l'espèce. Les méthodes génétiques contemporaines ont aussi grandement aidé à faire progresser la classification de ces animaux[2],[55]. Il fallut attendre 2017 pour qu'une étude génétique de grande ampleur réorganise la classification des holothuries sur des critères phylogénétiques, validant certains groupes morphologiques traditionnels et en rejetant d'autres[10]. Ainsi, les critères définitoires des grands ordres sont la présence de podia (absents chez les Apodida, groupe le plus dérivé) et d'arbres respiratoires (absent chez les Apodida et Elasipodida).
On compte actuellement environ 1 250 espèces d'holothuries[56]. Celles-ci sont généralement divisées en cinq à sept ordres :

_01.jpg.webp)
|
Selon World Register of Marine Species (26 novembre 2017)[56] :
|
Selon ITIS (2 décembre 2013)[58] :
|
 Les Apodida comme cette Euapta godeffroyi ont un corps serpentiforme, dépourvu de podia, et des tentacules pinnés.
Les Apodida comme cette Euapta godeffroyi ont un corps serpentiforme, dépourvu de podia, et des tentacules pinnés. Les Dendrochirotida comme cette Cercodemas anceps ont un corps ramassé et des tentacules arborescents.
Les Dendrochirotida comme cette Cercodemas anceps ont un corps ramassé et des tentacules arborescents. Les Elasipodida comme ce Scotoplanes globosa ont un corps translucide et des appendices de marche ou de natation. Ils sont abyssaux.
Les Elasipodida comme ce Scotoplanes globosa ont un corps translucide et des appendices de marche ou de natation. Ils sont abyssaux.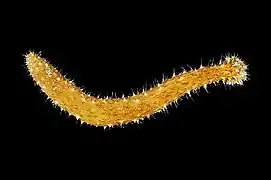 Les Holothuriida comme cette Holothuria olivacea ont un corps boudiné et des tentacules peltés.
Les Holothuriida comme cette Holothuria olivacea ont un corps boudiné et des tentacules peltés. Les Molpadida comme ce Paracaudina chilensis vivent enfouis dans le sable, ont des tentacules courts et sont munis d'un appendice caudal.
Les Molpadida comme ce Paracaudina chilensis vivent enfouis dans le sable, ont des tentacules courts et sont munis d'un appendice caudal. Les Persiculida comme cette Hansenothuria benti sont abyssaux, dépourvus de spicules dermiques et pourvus d'un sillon anal.
Les Persiculida comme cette Hansenothuria benti sont abyssaux, dépourvus de spicules dermiques et pourvus d'un sillon anal. Les Synallactida comme ce Stichopus chloronotus sont encore mal définis morphologiquement.
Les Synallactida comme ce Stichopus chloronotus sont encore mal définis morphologiquement.
Origines et registre fossile

.jpg.webp)
Les holothuries étant des animaux au corps mou et très peu minéralisé (contrairement à la plupart des autres échinodermes), leur corps est généralement intégralement consommé par les bactéries et nécrophages à leur mort, ne permettant pas un processus de fossilisation dans la plupart des cas[59]. Le seul élément parfois préservé est la couronne calcaire péripharyngienne, ainsi que des spicules[5]. Ainsi, leur histoire évolutive est encore en grande partie obscure, et passe par quelques spécimens à la conservation exceptionnelle et surtout par des fossiles d'ossicules ou d'anneau calcaire, qui ne donnent cependant que peu d'informations sur l'allure générale de l'animal[59].
Les plus anciennes traces assignables à des holothuries dateraient de l'Ordovicien[59] (-485-443 millions d'années), mais sont encore sujets à caution, comme l'espèce contestée Oesolcucumaria eostre[60]. Parmi les plus anciens fossiles complets, on trouve le genre Palaeocucumaria (groupe des Arthrochirotida), qui a la spécificité de présenter un exosquelette constitué de plaques calcaires à l'excellent potentiel de fossilisation[61]. Le registre fossile commence à être mieux documenté à partir du Dévonien, avec le plus vieux fossile de corps entier d'holothurie[62] et une quarantaine d'espèces identifiées (essentiellement sur la base de couronnes et de spicules, qui renseignent peu sur l'allure générale de l'animal), puis 65 au Carbonifère. Le pic de diversité observée est atteint entre le Trias (252 espèces) et le Jurassique (264), avant que la diversité apparente du registre ne diminue jusqu'à nos jours[59], ce qui pourrait être en partie lié à la diminution des groupes cuirassés, au meilleur potentiel de fossilisation[62].
Le groupe le plus ancien serait donc celui des Arthrochirotida, apparu à l'Ordovicien médian (il y a environ 471 millions d'années) et disparu au Dévonien inférieur (environ 397 millions d'années) ; proche des Apodida, ce groupe s'en serait séparé dès l'Ordovicien inférieur, mais on ne connaît pas de fossiles crédibles d'Apodida avant le Silurien (environ 430 millions d'années). Les Elasipodida se seraient séparés du reste des holothuries à l'Ordovicien médian (460 Ma), mais n'apparaissent dans le registre fossile qu'au Dévonien médian (397 Ma)[61].
Le groupe actuel le plus proche semble être les oursins, classés avec les holothuries (et quelques autres groupes éteints) au sein du sous-embranchement Echinozoa, et dont ils auraient divergé dès l'Ordovicien inférieur, voire avant[59]. Leur ancêtre commun serait un groupe frère des Ophiocystoidea[62], voire carrément les ophiocystoïdes eux-mêmes, après avoir perdu au cours de l'évolution la minéralisation de leur test[63].
Les holothuries et l'Homme
Nom
Le terme scientifique « holothurie » est emprunté au grec ὁλοθούριον / holotoúrion (gén.ὁλοθούριου / holotoúriou), via Aristote[46], latinisé en holothuria ; le sens en est encore assez obscur (d'autant qu'Aristote ne désignait sans doute pas les concombres de mer par ce terme), mais pourrait signifier « entièrement nu ».
Les holothuries portent également de nombreux noms populaires, souvent liés à des objets de même forme (concombres, saucisses), des animaux d'apparence proche (limace, chenille) ou surtout des sobriquets scabreux (à base de pénis ou d'étron). Elles sont ainsi appelées en France concombres de mer ou bêches de mer (voire biche de mer par déformation en Nouvelle-Calédonie), mais également vié marin sur la côte marseillaise (du provençal viech marin, sexe marin), pich du ou pich marv en Bretagne (littéralement « phallus noir » ou « phallus mort »), ou cazzu marinu en Corse (même sens qu'en provençal). Son ancien nom en portugais, « bicho-do-mar » (à présent « pepino-do-mar », traduction littérale de l'anglais « sea cucumber »), « bête de la mer », serait à l'origine du nom de la langue parlée au Vanuatu : le bichelamar. En Japonais, elles sont appelées namako, « limace de mer », mais cette expression désigne en français plutôt des mollusques marins (Opisthobranches)[64].
Relations à l'homme

Les holothuries sont des animaux extrêmement lents, et parfaitement inoffensifs même si certaines possèdent des mécanismes de défense susceptibles de provoquer des nuisances (ossicules collantes, tubes de Cuvier...). Les toxines qu'elles contiennent interdisent généralement de les manger crues ou non préparées. Leur forme étonnante leur vaut souvent le dégoût des baigneurs, qui les utilisent parfois aussi pour jouer (notamment en les pressant pour voir sortir un jet d'eau depuis le cloaque, ce qui blesse l'animal).
Si les holothuries demeurent des animaux relativement mal connus et souvent méprisés des baigneurs européens[65], de nombreuses espèces tropicales sont toutefois considérées comme particulièrement esthétiques, et ces animaux jouissent d'une image bien plus positive dans certaines régions du monde, notamment au Japon où, en plus d'être des mets de choix, elles font l'objet d'un intérêt populaire certain, jusque dans la poésie traditionnelle[64].
Certains des comportements des holothuries (durcissement, expulsion des tubes de Cuvier, éviscération) ont valu d'après l'écrivain aventurier Henry de Monfreid aux holothuries de Mer Rouge le nom vernaculaire et imagé de Zob el Bahar (le pénis de la mer) et ont initié une pêche destinée à la préparation (réputée aphrodisiaque) de l'holothurie séchée, à destination du marché chinois, et entrant entre autres dans la composition du potage aux nids d'hirondelles[66].
Dans les arts
Les holothuries, animaux parfois vus comme mystérieux, ont une place de choix dans le roman de Jules Verne Vingt mille lieues sous les mers (1870), où elles reviennent plusieurs fois à la table du capitaine Nemo : « Goûtez à tous ces mets. Voici une conserve d’holoturies qu’un Malais déclarerait sans rivale au monde. [...] Je fis honneur au repas. Il se composait de divers poissons et de tranches d’holoturies, excellents zoophytes, relevés d’algues très apéritives »[67].
Le romancier italien Emilio Salgari consacre son roman I Pescatori di Trepang[68] (1896) à un groupe de pêcheurs d'holothuries (ici appelées trepang) confronté à des aborigènes en Papouasie-Nouvelle-Guinée.
Au Japon, les holothuries sont des animaux relativement répandus dans l'art poétique du Haiku, et ont même fait l'objet d'un recueil dédié[64]. On trouve également une holothurie dans le bestiaire de la franchise de jeux vidéo Pokémon : Concombaffe (Pyukumuku en anglais), qui se bat grâce à ses tubes de Cuvier[69].
Gastronomie



La pêche commerciale des holothuries semble s'être développée il y a environ mille ans en Chine, et l'engouement suscité provoqua rapidement un effondrement des stocks locaux menant à l'élaboration d'un marché d'importation international[43]. Diverses espèces d'holothuries, connues sous le nom de trepang en malais, vidées, bouillies, séchées et fumées sont consommées en Chine et à Singapour et y sont très appréciées[2]. On en consomme également au Japon sous le nom de namako. De l'Océan Indien au Pacifique en passant par l'Indonésie (Makassar), les concombres de mer sont récoltés pour prélever leurs téguments, sur un mode principalement artisanal mais localement relativement intensif. Sur place, on les mange bouillis, séchés, marinés, en potage ou encore frits : la technique du séchage est la plus appropriée à l'exportation vers l'Asie du Sud-Est, qui demeure la principale raison de cette pêche dans les pays insulaires. Quelques espèces peuvent être consommées crues (Apostichopus japonicus, Cucumaria frondosa, Parastichopus californicus)[43].
Les holothuries sont aujourd'hui pêchées pour être mangées dans plus de soixante-dix pays, et consommées principalement en Indonésie, en Chine (et plus globalement en Asie du Sud-Est) et à Madagascar, ainsi que dans certains pays insulaires de l'Indo-Pacifique[43]. Selon un rapport de la FAO, on estime qu'à la fin des années 1970 la consommation mondiale était de 25 000 tonnes[2].
L'essor économique de l'Asie du Sud-Est depuis les années 1980, couplé aux faibles revenus de nombreux pays coralliens où vivent les holothuries comestibles, font peser de lourdes menaces sur ces espèces autrefois communes, dont certaines voient leurs stocks s'effondrer d'une manière inquiétante[70]. Un réseau international de braconnage féroce s'est également mis en place, visant notamment les zones protégées désertes ou de pays en voie de développement, et est actif jusqu'en Afrique de l'Ouest[71].
Les populations d'holothuries ont ainsi diminué de 98 % aux Galapagos entre 1993 et 2004, et de 94 % en Égypte entre 1998 et 2001, puis encore de 45 % entre 2002 et 2007 malgré l'interdiction de leur récolte[72]. La situation est proche dans la plupart des pays de l'Indo-Pacifique tropical[43].
La consommation des holothuries fut historiquement importante en Nouvelle-Calédonie (où on les appelle « bèches de mer »), mais a très fortement diminué depuis la seconde guerre mondiale. La préparation était complexe : les animaux étaient bouillis une première fois dans de l'eau de mer, puis une seconde fois dans de l'eau douce avant d'être éviscérés. Le produit était ensuite fumé au bois de mangrove puis séché au soleil[2].
En France, la principale holothurie consommée traditionnellement est l'« Espardenya » (Parastichopus regalis), notamment dans le sud-ouest ; c'est un mets qui peut agrémenter la paella en cuisine catalane, mais son commerce demeure très marginal et essentiellement lié à des prises accessoires de la pêche au chalut.
D'après une synthèse commandée par la FAO en 2012[43], 58 espèces sont significativement exploitées pour la consommation humaine. Presque toutes appartiennent aux ordres des Holothuriida et des Synallactida (sauf 3 espèces de l'ordre des Dendrochirotida, toutes de la famille des Cucumariidae), dont la plupart à la famille des Holothuriidae, et secondairement des Stichopodidae[43]. La très large majorité sont des espèces tropicales[43].
Parmi les espèces comestibles, on peut citer (par ordre décroissant de valeur marchande) Holothuria nobilis, Thelenota ananas, Actinopyga echinites, Actinopyga palauensis, ou encore Holothuria scabra. Les espèces Holothuria lessoni, Holothuria fuscogilva et Holothuria whitmaei ont également connu une forte flambée des prix en 2014[73]. En dépit de son nom, l'« holothurie comestible » Holothuria edulis n'est que peu consommée en Asie[2].
D'un point de vue nutritionnel, les téguments d'holothuries sont riches en protéines (45 % du poids sec)[2] et en minéraux, et contiennent peu de graisses et de sucres.
Utilisations pharmaceutique et cosmétique
La consommation pharmaceutique d'holothurie est attestée depuis l'ère Ming (XIVe siècle) : la ressemblance des holothuries avec un pénis humain (renforcée par leur capacité à se durcir, se tenir droit lors de la reproduction et le mode de défense de certaines consistant à éjecter des filaments blancs) a fait croire aux Chinois analogistes de l'époque qu'ils pourraient avoir des vertus sur la virilité[74].
Certaines compagnies pharmaceutiques produisent des produits dérivés à partir du « trépang ». Ces produits se présentent sous la forme d'huiles, de crèmes et cosmétiques, mais aussi parfois de spécimens séchés. Certains d'entre eux sont destinés à être ingérés. Certains soigneurs attribuent aux extraits de concombre de mer des propriétés aphrodisiaques ou antiseptiques jamais démontrées scientifiquement. De prétendues propriétés anticancéreuses ont été mises à l'étude, et sérieusement mises en doute.
 Holothuries séchées et conservées en bocal, utilisées à des fins médicinales par la médecine chinoise.
Holothuries séchées et conservées en bocal, utilisées à des fins médicinales par la médecine chinoise.
 A Hong Kong.
A Hong Kong.
Statut de protection
Plusieurs espèces d'holothuries voient leur effectif tomber de manière préoccupante depuis quelques décennies, principalement en raison de la surpêche, mais aussi de la dégradation de leur environnement. La fonction écologique capitale de ces animaux rend leur raréfaction d'autant plus préoccupante pour les écologues. En conséquence, les concombres de mer font l'objet d'un suivi de la part de la FAO, de la CITES et de l'IUCN. 16 espèces figurent ainsi sur la Liste rouge de l'UICN depuis 2013, dont 9 classées comme « vulnérables » et 7 « en danger ou à forte probabilité d'extinction » (Apostichopus japonicus, Holothuria lessoni, Holothuria nobilis, Holothuria scabra, Holothuria whitmaei, Isostichopus fuscus et Thelenota ananas)[75].
Galerie

 Pseudocolochirus violaceus. Les espèces de plusieurs genres de cette famille, rondes, colorées et sédentaires, sont couramment appelées pomme de mer.
Pseudocolochirus violaceus. Les espèces de plusieurs genres de cette famille, rondes, colorées et sédentaires, sont couramment appelées pomme de mer. Concombre de mer ensablé (Holothuria poli), espèce méditerranéenne vivant à proximité des plages.
Concombre de mer ensablé (Holothuria poli), espèce méditerranéenne vivant à proximité des plages..jpg.webp) Apostichopus californicus, une holothurie californienne, rejetée sur la côte avec des restes de kelp et d'algues vertes.
Apostichopus californicus, une holothurie californienne, rejetée sur la côte avec des restes de kelp et d'algues vertes. Isostichopus fuscus, holothurie des Îles Galápagos, cachée dans l'anfractuosité d'un fond rocheux.
Isostichopus fuscus, holothurie des Îles Galápagos, cachée dans l'anfractuosité d'un fond rocheux. Une Holothuria leucospilota (noire, ordre Holothuriida) et une Synapta maculata (brune, ordre Apodida) à La Réunion.
Une Holothuria leucospilota (noire, ordre Holothuriida) et une Synapta maculata (brune, ordre Apodida) à La Réunion. Une holothurie nageuse de la famille des Pelagothuriidae (genre Enypniastes).
Une holothurie nageuse de la famille des Pelagothuriidae (genre Enypniastes). Une holothurie nageuse de la famille des Psychropotidae (genre Psychropotes).
Une holothurie nageuse de la famille des Psychropotidae (genre Psychropotes). Holothurie léopard (Bohadschia argus).
Holothurie léopard (Bohadschia argus). Isostichopus badionotus.
Isostichopus badionotus. Cucumaria miniata.
Cucumaria miniata. Pearsonothuria graeffei.
Pearsonothuria graeffei._on_Plakortis_sp._(Chicken_liver_sponge).jpg.webp) Synaptula lamperti.
Synaptula lamperti. Colochirus robustus.
Colochirus robustus. Chiridota discolor.
Chiridota discolor. Holothuria pervicax.
Holothuria pervicax. Stichopus chloronotus.
Stichopus chloronotus. Thelenota rubralineata.
Thelenota rubralineata.
Voir aussi
Références taxinomiques
- (en) Référence World Register of Marine Species : Holothuroidea (de Blainville, 1834) (+ liste ordres + liste familles)
- (en) Référence Paleobiology Database : Holothuroidea de Blainville 1834
- (fr+en) Référence ITIS : Holothuroidea de Blainville, 1834
- (en) Référence Tree of Life Web Project : Holothuroidea
- (en) Référence Animal Diversity Web : Holothuroidea
- (en) Référence Catalogue of Life : Holothuroidea (consulté le )
- (en) Référence NCBI : Holothuroidea (taxons inclus)
Bibliographie
- (en) Annie Mercier, Jean-Francois Hamel, Andrew Suhrbier et Christopher Pearce, The World of Sea Cucumbers : Challenges, Advances, and Innovations, Academic Press, , 854 p. (ISBN 978-0-323-95377-1, lire en ligne).
- (en) Maria Byrne et Timothy O'Hara, Australian echinoderms : Biology, Ecology and Evolution, CSIRO Publishing, (ISBN 978-1-4863-0763-0, lire en ligne).
- Chantal Conand, Sonia Ribes-Beaudemoulin, Florence Trentin, Thierry Mulochau et Émilie Boissin, Oursins, étoiles de mer & autres échinodermes : Biodiversité de La Réunion, La Réunion, Les éditions du Cyclone, , 168 p. (ISBN 979-10-94397-04-6).
- (en) Steven W. Purcell, Alessandro Lovatelli, Mercedes González-Wangüemert, Francisco A. Solís-Marín, Yves Samyn et Chantal Conand, Commercially important sea cucumbers of the world, Rome, FAO Species Catalogue for Fishery Purposes No. 6, , 256 p. (ISBN 978-92-5-137793-2, DOI 10.4060/cc5230en).
- Alain Guille, Pierre Laboute et Jean-Louis Menou, Guide des étoiles de mer, oursins et autres échinodermes du lagon de Nouvelle-Calédonie, ORSTOM, , 244 p. (lire en ligne)
- René Koehler, Faune de France : 1 : Échinodermes, Paris, Librairie de la Faculté des Sciences, (lire en ligne).
- (en) A.M. Clark et F.W.E. Rowe, Monograph of Shallow-water Indo-West Pacific Echinoderms, Londres, Trustees of the British Museum (Natural History), , 238 p. (lire en ligne).
Références
- ↑ Philippe Bourjon, « Synapta maculata », sur Sous Les Mers (consulté le ).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Alain Guille, Pierre Laboute et Jean-Louis Menou, Guide des étoiles de mer, oursins et autres échinodermes du lagon de Nouvelle-Calédonie, ORSTOM, , 244 p. (lire en ligne).
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Chantal Conand, Sonia Ribes-Beaudemoulin, Florence Trentin, Thierry Mulochau et Émilie Boissin, Oursins, étoiles de mer & autres échinodermes : Biodiversité de La Réunion, La Réunion, Les éditions du Cyclone, , 168 p. (ISBN 979-10-94397-04-6).
- 1 2 (en) Christopher Mah, « Why five ? Mysteries in Symmetry! », sur Echinoblog, .
- 1 2 (en) Jackie Sones, « Cool as a... », sur bodegahead.blogspot.fr, .
- 1 2 3 4 (en) Francis W.E. Rowe, A review of the family Holothuriidae (Holothuroidea : Aspidochirotida), vol. 18, Bulletin of the British Museum (Natural History), , 54 p. (www.vliz.be/imisdocs/publications/276172.pdf), chap. 4.
- ↑ (en) Kelly Williams, « Psolus chitonoides », sur inverts.wallawalla.edu, .
- ↑ « Parallelisms in the Evolution of Sea Cucumbers (Echinodermata: Holothuroidea). », Paleontological Journal, vol. 50, no 14, , p. 1610-1625 (lire en ligne).
- ↑ Cherbonnier G., « Echinodermes : holothurides », dans Faune de Madagascar, Paris, ORSTOM, , 297 p.
- 1 2 (en) Allison K. Miller, Alexander M. Kerr, Gustav Paulay, Mike Reich, Nerida G. Wilson, Jose I. Carvajal et Greg W. Rouse, « Molecular Phylogeny of Extant Holothuroidea (Echinodermata) », Molecular Phylogenetics and Evolution, vol. 111, (DOI 10.1016/j.ympev.2017.02.014, lire en ligne).
- 1 2 3 (en) Christopher Mah, « Deep-Sea Swimming Sea Cucumbers and the "most bizarre holothurian species in existence" ! », sur Echinoblog, .
- ↑ (en) Hammond, A.R., Meyers, L. & Purcell, S.W., « Not so sluggish: movement and sediment turnover of the world’s heaviest holothuroid, Thelenota anax », sur Marine Biology, .
- 1 2 (en) Christopher Mah, « Synaptid Sea Cucumbers! Big, Long & Wormy or small and live in bunches on sponges! », sur Echinoblog, .
- ↑ (en) Christopher Mah, « Echinoderm Tube Feet Don't Suck! They Stick! », sur Echinoblog, .
- ↑ Christopher Taylor, « Echinodermata »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur Palaeos (consulté le ).
- ↑ Ce qui signifie qu'elle vit en permanence en pleine eau, ne s'approchant jamais du fond.
- ↑ (en) Jean‐François Hamel, Jiamin Sun, Bruno L. Gianasi, Emaline M. Montgomery, Ellen L. Kenchington, Benoit Burel, Sherrylynn Rowe, Paul D. Winger, Annie Mercier, « Active buoyancy adjustment increases dispersal potential in benthic marine animals », Journal of Animal Ecology, (DOI 10.1111/1365-2656.12, lire en ligne).
- ↑ (en) Frédéric Ducarme, « Field observations of sea cucumbers in Ari Atoll, and comparison with two nearby atolls in Maldives », SPC Bêche-de-mer Information Bulletin, vol. 36, (lire en ligne).
- 1 2 3 4 (en) Christopher Mah, « Its Sea Cucumber Spawning Time », sur Echinoblog, .
- ↑ (en) Jiamin Sun, Jean-François Hamel, Bruno L. Gianasi et Annie Mercier, « Age determination in echinoderms: first evidence of annual growth rings in holothuroids », Proc. R. Soc. B, vol. 286, no 20190858, (DOI 10.1098/rspb.2019.0858).
- 1 2 3 4 (en) Patrice Francour, « Predation on Holothurians: A Literature Review », Invertebrate Biology, vol. 116, no 1, , p. 52-60 (DOI 10.2307/3226924, lire en ligne).
- ↑ (en) « Scientists discover mechanisms of shape-shifting sea cucumbers »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur phys.org, .
- ↑ « holothurie caillou », sur DORIS.
- 1 2 (en) Patrick Flamang, Jérôme Ribesse et Michel Jangoux, « Biomechanics of Adhesion in Sea Cucumber Cuvierian Tubules (Echinodermata, Holothuroidea) », Interg. Compl. Biol., vol. 42, , p. 1107-1115.
- ↑ Série-documentaire Steffens entdeckt, épisode Palau - Korallenparadies der Südsee (réalisation Dirk Steffens et Ninette Kraunus, 2009.
- ↑ (en) Christopher Mah, « Sea Cucumber Defense Pt.2 : Evisceration of Cuvierian Tubules », sur Echinoblog, .
- 1 2 3 (en) Christopher Mah, « Sea Cucumber Evisceration : Defense, Regeneration, Why ? », sur Echinoblog, .
- ↑ (en) Amy Maxmen, « The hidden lives of deep-sea creatures caught on camera », sur Nature.com, .
- ↑ (en) Christopher Mah, « What are the Deepest known echinoderms ? », sur Echinoblog, .
- 1 2 (en) Christopher Mah, « The Ecology of Holothuria scabra : The CUKE-SEA GRASS Connection », sur Echinoblog, .
- ↑ (en) Christopher Mah, « The Anus as a Second Mouth : A Sea Cucumber that feeds via its butt », sur Echinoblog, .
- 1 2 (en) Christopher Mah, « Crabs & Shrimps that Live in Sea Cucumber Anuses », sur Echinoblog, .
- ↑ Paula Ayotte (2005), The relationship between holothurians and the portunid crab Lissocarcinus orbicularis, University of Hawaii at Hilo.
- 1 2 3 (en) Christopher Mah, « When Fish Live in your Cloaca & How Anal Teeth are Important : The Pearlfish-Sea Cucumber Relationship », sur Echinoblog, .
- ↑ (en) Christopher Mah, « Sea cucumbers got fish that live in their anus and CLAMS that live in their throat! (but not at the same time) », sur Echinoblog, .
- 1 2 (en) Christopher Mah, « Worms & Snails that Live On/In Sea Cucumbers! », sur Echinoblog, .
- ↑ (en) Christopher Mah, « P is for Parasitic Snail ! Enter: The Eulimidae », sur Echinoblog, .
- ↑ (en) Philippe Bourjon et Sébastien Vasquez, « Predation by the gastropod Tonna perdix (Gastropoda: Tonnoidea) on the holothurian Actinopyga echinites (Echinodermata: Holothuroidea) on a reef of Réunion », SPC Bêche-de-mer Information Bulletin, vol. 36, (lire en ligne).
- ↑ François Cornu, « Tonne perdrix », sur SousLesMers.
- ↑ Voir par exemple cette photographie spectaculaire, qui montre combien la bouche de ce mollusque peut s'étendre.
- ↑ Eeckhaut I., Février J., Todinanahary G., Delroisse J., « Impact of Thalamita crenata (Decapoda; Portunidae) predation on Holothuria scabra juvenile survival in sea farming pens », SPC Bêche-de-mer Information Bulletin, no 40, (lire en ligne).
- ↑ Rogers A., Caal W., Hamel J.-F. Mercier A., « Loggerhead sea turtle Caretta caretta found preying on a sea cucumber on a reef in Belize », SPC Bêche-de-mer Information Bulletin, no 40, (lire en ligne).
- 1 2 3 4 5 6 7 8 9 (en) Steven W. Purcell, Yves Samyn et Chantal Conand, Commercially important sea cucumbers of the world, Rome, FAO Species Catalogue for Fishery Purposes No. 6, , 233 p. (ISBN 978-92-5-106719-2).
- ↑ Anatole Bailly ; 2020 : Hugo Chávez, Gérard Gréco, André Charbonnet, Mark De Wilde, Bernard Maréchal & contributeurs, « Le Bailly »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), (consulté le ).
- ↑ Maria Pantelia, « The Online Liddell-Scott-Jones Greek-English Lexicon », (consulté le ).
- 1 2 3 4 5 (en) Alexander M. Kerr, « A Philology of Òλοθóυριου : From Ancient Times to Linnaeus, including Middle and Far Eastern Sources », University of Guam Marine Laboratory Technical Report, no 151, (lire en ligne).
- ↑ Platon, Philèbe (21b) ; Aristote, Histoire des animaux (Livre V, 15) ; Théophraste, Des Signes du temps (Frag. 40).
- ↑ Aristote, Parties des Animaux, vol. IV, (lire en ligne).
- ↑ Guillaume Rondelet, De piscibus marinis, libri XVIII, in quibus veræ piscium effigies expressæ sunt, Lyon, apud Matthiam Bonhomme, 1554.
- ↑ (en) A.V. Smirnov, « System of the Class Holothuroidea », Paleontological Journal, vol. 46, no 8, (DOI 10.1134/s0031030112080126, lire en ligne).
- ↑ L’Encyclopédie, 1re édition, 1751 (Tome 8, p. 247). lire en ligne.
- ↑ Gustav Paulay, Holothuria sur World Register of Marine Species.
- ↑ Hampus Eriksson, Purcell, S., Conand, C., Muthiga, N., & Lovatelli, A. (2013), Report on the FAO Workshop on Sea Cucumber Fisheries: An Ecosystem Approach to Management in the Indian Ocean (SCEAM Indian Ocean), Mazizini, Zanzibar, the United Republic of Tanzania, 12–16 November 2012. FAO Fisheries and Aquaculture Report, 1038, 92.
- ↑ (en) Alexander Ziegler, Michel Jangoux, Georgy Mirantsev et Andreas Kroh, « Historical aspects of meetings, publication series, and digital resources dedicated to echinoderms », Zoosystematics and Evolution, vol. 90, no 1, , p. 45-56 (DOI 10.3897/zse.90.7201, lire en ligne).
- ↑ (en) S.W. Kim, A.M. Kerr et G. Paulay, « Colour, confusion, and crossing: resolution of species problems in Bohadschia (Echinodermata: Holothuroidea) », Zoological Journal of the Linnean Society, vol. 168, no 1, , p. 81–97 (DOI 10.1111/zoj.12026, lire en ligne).
- 1 2 World Register of Marine Species, consulté le 26 novembre 2017
- ↑ (en) Maria Byrne et Timothy O'Hara, Australian echinoderms : Biology, Ecology and Evolution, CSIRO Publishing, (ISBN 978-1-4863-0763-0, lire en ligne).
- ↑ Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 2 décembre 2013
- 1 2 3 4 5 (en) M. Reich, « How many species of fossil holothurians are there? », Echinoderms in a Changing World, (ISBN 978-1-138-00010-0).
- ↑ (en) Andrew B. Smith, Mike Reich et Samuel Zamora, « Comment on supposed holothurian body fossils from the middle Ordovician of Wales (Botting and Muir, Palaeontologia Electronica: 15.1.9A) », Palaeontologia Electronica, vol. 16, no 1, (lire en ligne).
- 1 2 (en) Mike Reich, « The early evolution and diversification of holothurians (Echinozoa) », Echinoderms: Durham – Harris et al. (eds), (ISBN 978-0-415-40819-6, lire en ligne).
- 1 2 3 (en) Alexander M. Kerr, « Holothuroidea », sur Tree Of Life, .
- ↑ (en) Imran A. Rahman, Jeffrey R. Thompson, Derek E. G. Briggs, David J. Siveter, Derek J. Siveter & Mark D. Sutton, « A new ophiocistioid with soft-tissue preservation from the Silurian Herefordshire Lagerstätte, and the evolution of the holothurian body plan », Proceedings of the Royal Society B, vol. 286, no 1900, (DOI 10.1098/rspb.2018.2792, lire en ligne).
- 1 2 3 (en) Robin D. Gill, Rise, Ye Sea Slugs!, Paraverse Press, 2003.
- ↑ Frédéric Ducarme, « Pourquoi étudier les invertébrés ? Quelques arguments d’Aristote », sur No Bones, Smithsonian Institute, .
- ↑ Henry de Monfreid, Aventures en mer Rouge, Paris, Graset et Fasquelle, , 444 p. (ISBN 978-2-246-41029-4, lire en ligne).
- ↑ Jules Verne, Vingt mille lieues sous les mers, Paris, Pierre-Jules Hetzel, coll. « Voyages extraordinaires », .
- ↑ « I pescatori di trepang », sur it.wikisource.org, (consulté le ).
- ↑ « Concombaffe », sur Pokepedia.
- ↑ (en) Steven W. Purcell, Beth A. Polidoro, Jean-François Hamel, Ruth U. Gamboa et Annie Mercier, « The cost of being valuable: predictors of extinction risk in marine invertebrates exploited as luxury seafood », Proceedings of the Royal Society B, vol. 281, .
- ↑ (en) Tommy Trenchard, « China's hunger for sea cucumbers reaches islands of Sierra Leone », Reuters, (lire en ligne).
- ↑ WWF, Rapport Planète vivante, Londres, Société zoologique de Londres, .
- ↑ (en) Steven W. Purcell, « Value, Market Preferences and Trade of Beche-De-Mer from Pacific Island Sea Cucumbers », PLOS One, vol. 9, no 4, , p. 8 (DOI [https://dx.doi.org/10.1371/journal.%0Apone.0095075 10.1371/journal. pone.0095075]).
- ↑ (en) Kimon de Greef, « Sea cucumbers are being eaten to death », sur 2018, novembre.
- ↑ (en) Chantal Conand, Beth Polidoro, Annie Mercier, Ruth Gamboa, Jean-François Hamel et Steve Purcell, « The IUCN Red List assessment of aspidochirotid sea cucumbers and its implications », Bêche-de-mer Information Bulletin, vol. 34, , p. 3-7 (lire en ligne).
Liens externes
- « Bêche-de-mer Information Bulletin », sur Secretariat of the Pacific Community, éditée par Chantal Conand & Igor Eeckhaut, revue scientifique spécialisée sur les holothuries.
- « Holothurides (concombres de mer) »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur DORIS, encyclopédie marine en ligne de la FFESSM.
- François Cornu, « Holothuries », sur Sous Les Mers.
- (en) « Sea cucumbers: the new resource for a hungry fishery », sur CumFish.
- Le concombre de mer démasqué : Reportage sur la pêche et la préparation des concombres de mer aux Philippines.
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- (en) Animal Diversity Web
- (en) Australian Faunal Directory
- (sv) Dyntaxa
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (nl) Nederlands Soortenregister
- (en + en) New Zealand Organisms Register
- (en) Plazi
- (en) Système d'information taxonomique intégré
- (en) World Register of Marine Species
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
Articles connexes
- Echinodermata (classification phylogénétique)
- Échinoderme
- Echinozoa
- Echinodermes de Méditerranée




