

Selon Hensen (1887), le plancton (du grec ancien πλανκτός / planktós, « errant, instable ») est un groupe polyphylétique d'organismes généralement unicellulaires vivant dans les eaux douces, saumâtres et salées, le plus souvent en suspension et apparemment passivement : gamètes, larves, animaux inaptes à lutter contre le courant (petits crustacés planctoniques, siphonophores et méduses), végétaux et algues microscopiques. Les organismes planctoniques sont donc définis à partir de leur niche écologique et non selon des critères phylogénétiques ou taxonomiques.
Le plancton est à la base de nombreux réseaux trophiques. Il constitue la principale nourriture des baleines à fanons et des coquillages filtreurs (dont moules, coques, huîtres, etc.), qu'il peut parfois intoxiquer par diverses toxines.
Bien que le phytoplancton représente moins de 1 % de la biomasse photosynthétique, il contribue pour environ 45 % de la production primaire sur la planète Terre, fixant la moitié du CO2 atmosphérique, et ayant fixé un tiers du carbone anthropique rejeté dans l'atmosphère dans le dernier siècle[1], mais il semble en diminution régulière depuis la fin du XXe siècle.
Les mouvements natatoires et déplacements verticaux de vastes populations de zooplancton[2] (migrations cycliquement liés à la lumière et aux saisons) contribuent au mélange des couches d'eau[3]. C'est un aspect de la bioturbation qui a été sous-estimé[4],[5]. L'observation du mélange d'eau par un banc de petites crevettes permet de visualiser les turbulences qu'elles induisent ; en présence de crevettes ces couches se mélangent environ 1 000 fois plus vite. De tels phénomènes existent également en eau douce (avec le mouvement des populations de daphnies par exemple).
La migration quotidienne du krill peut atteindre un kilomètre[6]. Sa capacité à mélanger la colonne d'eau et à transporter verticalement des calories, microbes, sels, nutriments et oxygène[7] et CO2 pourrait donc dépasser celle du vent, ce qui invite à mieux prendre en compte ce processus dans les modèles de circulation océanique. Ce type de phénomène a peut-être contribué à l'évolution du vivant[8] ; selon John Dabiri, « Il est maintenant clair que l'écologie animale doit être prise en compte dans les modèles de fonctionnement des océans modernes »[9].
Définitions scientifiques contemporaines
La définition de Hensen est perçue comme incomplète car elle n'inclut pas certains êtres. Des scientifiques ont proposé différents termes pour désigner une certaine partie des organismes vivant en milieu aquatique :
- le necton, capable de se déplacer activement horizontalement et/ou verticalement éventuellement contre le courant : poissons, cétacés, etc.
L'ensemble constitué du plancton et du necton constitue le pélagos.
Le caractère passif du déplacement est réputé être le seul critère valable pour caractériser l'appartenance au plancton, mais de nombreuses espèces planctoniques sont capables de se déplacer (flagelles, modifications de la densité des cellules, etc.) ; - le tripton, appelé pseudoplancton par Davis (1955)[10], qui rassemble les éléments supposés morts (nécromasse) ou d'origine minérale ou organique (excreta, particules issues du plancton mort, etc.) ;
- Le seston, qui regroupe l'ensemble des particules, de toute nature, mortes ou vives, organiques ou inorganiques en suspension dans l'eau (seston = tripton + plancton). Le seston est notamment formé des excreta du plancton et des autres organismes, dont leurs excréments.
Types de plancton

.jpg.webp)


- Le plancton végétal, ou phytoplancton (du grec φυτόν / phutón, « plante »), est le point de départ de toute l'activité biologique de la mer, à la base de toutes les chaînes alimentaires aquatiques. Il réalise la photosynthèse. Il utilise l'énergie solaire comme source d'énergie et le carbone inorganique (CO2, CO) comme source de carbone. Hormis pour le nanoplancton et le picoplancton, il est essentiellement présent dans les couches superficielles de la mer (de 0 à 15 mètres de profondeur). Il détermine sa position, en surface ou entre deux eaux, en fonction de la quantité de lumière qu'il peut capter, indispensable à sa photosynthèse. Il est constitué d'algues microscopiques, formées d'une seule cellule ou de cellules réunies en chaînes, se multipliant par division cellulaire grâce à la lumière, au CO2 et aux sels nutritifs. Elles produisent de grandes quantités d'oxygène nécessaire à la vie dans l'eau, mais aussi, par les échanges gazeux, participent à l'oxygénation de la planète. Pour se multiplier, le phytoplancton a besoin non seulement de soleil et de gaz carbonique, mais aussi d'éléments minéraux et d'oligoéléments variés et complexes, en particulier le phosphore et l'azote. Ces éléments proviennent de la décomposition, par des bactéries, des déchets organiques[11]. Au sein du phytoplancton, les groupes les plus nombreux et les plus représentés en termes d'espèces sont les diatomées, les dinoflagellés[12] et les cyanobactéries.
- Le plancton animal, ou zooplancton (du grec ζῷον / zõon, « animal »), est catégorisé en deux groupes selon leurs tailles et leurs rôles fonctionnels[13] : le protozooplancton (constitué de protozoaires, HNF[14] et ciliés) et le métazooplancton (constitué de métazoaires tels que les Cnidaires, Cnétaires, Crustacés, mollusques, tuniciers, vers) ; on peut aussi les diviser en deux catégories: l'holoplancton (en) constitué des organismes passant toute leur vie en tant que plancton, et le méroplancton, constitué des organismes ne passant qu'une partie de leur vie (la vie larvaire) en tant que plancton.
D'après le cycle biologique des organismes, l'holoplancton (ou plancton permanent) se reproduit par accouplement et se multiplie. Le méroplancton ou (plancton temporaire) concerne de très nombreuses espèces marines telles que les homards, les crevettes les huîtres, les moules qui, à un moment donné de leur existence, passent par des stades larvaires très complexes. Les crustacés copépodes composent plus de 80 % du zooplancton. Il remonte la nuit vers la surface pour se nourrir de phytoplancton et redescend pendant la journée vers les eaux plus profondes. Il échappe ainsi aux prédateurs et économise de l’énergie car la température est moins élevée. Ce mouvement du zooplancton, qui contribue au brassage des eaux et des couches de températures variées ou diversement oxygénées est appelé migration verticale ou nycthémérale — un nycthémère, du grec νύξ, νυκτός / nýx, nyktós, « nuit », et ἡμέρα / hêméra, « jour », désigne une durée de 24 heures. Certains prédateurs du plancton suivent ces mouvements. Sur certains littoraux, et berges urbanisées, il est possible que certaines espèces de zooplancton puissent être affectées par la pollution lumineuse. Les migrations verticales sont biquotidiennes, mais parfois aussi plus ou moins saisonnières selon les régions du monde[15], jouant un rôle important dans le mélange des eaux océaniques et des eaux douces arrivant en mer[16],[17]. - le bactérioplancton est constitué de bactéries qui ont au moins une phase de vie libre en pleine eau. Notons que certains membres du bactérioplancton sont des cyanobactéries photosynthétiques. Ainsi, les cyanobactéries sont à la fois membres du bactérioplancton (ce sont des bactéries avec phase de vie libre en pleine eau) et membres du phytoplancton (leur métabolisme peut-être photosynthétique).
- Le nanoplancton (20-2 µm) et le picoplancton (2-0,2 µm), et femtoplancton, ou le virioplancton (virus marins essentiellement) découverts plus récemment, constituent une part encore mal connue de la biodiversité marine. Ces catégories de taille incluent de nombreuses espèces qui semblent pouvoir vivre à grande profondeur où l'intensité lumineuse est extrêmement faible. Certaines de ces espèces semblent avoir des rythmes de reproduction très lents ainsi qu'une durée de vie exceptionnellement longue (caractéristique qu'on retrouve aussi chez des organismes plus complexes des grandes profondeurs, dont certains poissons des grands fonds).
Le plancton désignant l'ensemble d'organismes différents, il est incorrect de dire « un plancton » : on devrait préciser de quel organisme (taxon) on parle.
Les tailles du plancton
L'effort collectif de standardisation des méthodes de récolte, qui regroupe des planctologistes qualifiés sur le plan international, a permis d'établir une nomenclature qui définit les catégories en fonction de la taille, liée au type de filtre utilisé pour le recueillir[18] :
- mégaplancton : 20-200 cm (ex : grosses méduses, colonies de salpes, superorganismes tels que les siphonophores dont une espèce du genre Apolemia atteindrait près de 120 m de longueur totale, ce qui en ferait l'organisme vivant le plus long au monde[19]) ;
- macroplancton : 2-20 cm ;
- mésoplancton : 0,2 mm-2 cm (visible à l'œil nu) ;
- microplancton : 20-200 μm (filtre en toile) ;
- nanoplancton : 2-20 μm (filtre à café) ;
- picoplancton : 0,2-2 μm (bactéries et eucaryotes) ;
- femtoplancton : < 0,2 μm (essentiellement des virus).
Le nanoplancton et les planctons de tailles inférieures ont seulement été découverts dans les années 1980. L’un des plus gros organismes planctoniques est la méduse Chrysaora, qui mesure 1 m de diamètre et 6 m de long. Le plancton de grande taille ne renferme que des espèces animales (zooplancton), alors que les espèces végétales (phytoplancton) dominent les plus petites classes de taille[20].
Adaptations du plancton à la vie pélagique
Malgré la très grande diversité du plancton, certains caractères généraux donnent une physionomie particulière aux organismes planctoniques qui est liée à leur mode de vie en pleine eau. En effet, ce mode de vie requiert des adaptations qui permettent aux organismes 1) d'éviter d'être vus par les prédateurs puisqu'ils sont incapables de se déplacer volontairement sur de grandes distances : ils constituent des proies faciles et 2) de se maintenir dans la colonne d'eau et éviter de couler[21].
- Coloration : Les organismes planctoniques sont en général peu pigmentés et tendent même à la transparence. Chez les organismes pigmentés, la pigmentation se limite à des organes précis et de petite taille (ex: les plastes ou les organes de la vision).
- Flottabilité : Les organismes planctoniques doivent se maintenir entre deux eaux, et éviter de couler de la façon aussi économique en énergie que possible. Ils ont pour cela développé plusieurs stratégies qui leur permettent soit de réduire leur poids, soit d'augmenter leur surface de flottaison.
- Ils sont riches en eau, avec un corps qui peut être constitué de substances gélatineuses. Certains individus appartenant au mégaplancton peuvent avoir une teneur en eau supérieure à 95 %. À titre de comparaison, le corps humain en contient 56 %.
- Ils possèdent très peu de formations squelettiques, et les organismes qui en possèdent ont un squelette moins lourd et résistant que les organismes benthiques (qui vivent sur ou à proximité du fond. Voir benthos). Les diatomées ont par exemple des frustules plus minces, et la chitine, qui est la matière qui constitue la carapace des crustacés, est plus fine et contient moins de calcaire.
- Certains organismes possèdent des vacuoles ou des flotteurs remplis de lipides ou de gaz avec une densité plus faible que l’eau.
- D’autres ont même modifié la composition ionique de leurs cellules : les ions légers tels que le chlore (Cl) ou le potassium (K) remplacent les sulfates (SO4) et le magnésium (Mg) de poids moléculaire plus important.
- Ils possèdent des organes qui augmentent leur surface. Par exemple, certaines diatomées possèdent des filaments. D'autres organismes se regroupent en colonies (ex : les salpes qui constituent des chaînes pouvant atteindre plus de 10 m de long).
Ces adaptations n’étant parfois pas suffisantes pour éviter de couler, certains organismes les ont complétées par une activité motrice réduite par le biais de cils, flagelles ou de contractions du corps.
Productivité
La productivité primaire, réalisée par le phytoplancton (algues planctoniques), dépend de la disponibilité en nutriments (azote, phosphore et selon les espèces de phytoplancton silicium), de la température et de la lumière dans l'eau. La productivité secondaire est liée à la biomasse du zooplancton (plancton animal) et à son efficacité de croissance.
La productivité, liée à la biomasse, est plus élevée dans l’eau froide, généralement plus dense et riche en nutriments. Elle est aussi souvent plus forte en milieu côtier soumis aux enrichissement en nutriments des fleuves.
Malgré une augmentation de productivité dans le nord, autour des pôles, et malgré quelques blooms spectaculaires locaux, l’activité planctonique semble en diminution à échelle planétaire de 1999 à 2006.
Le plancton est à la base de nombreux réseaux trophiques.
Plancton et réseau trophique
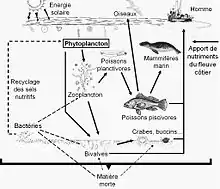
Le plancton est le premier maillon du réseau trophique marin. Le phytoplancton est consommé par le zooplancton et par une multitude d’organismes marins. Ils seront la proie de petits prédateurs eux-mêmes chassés par de grands prédateurs. Certains gros animaux comme la baleine et le requin pèlerin se nourrissent directement de zooplancton. Dans les eaux douces et plus encore dans les eaux saumâtres, le phytoplancton est une des bases principales des chaînes alimentaires.
Dans les eaux particulièrement turbides, chargées de particules sableuses ou de vases en suspension, des types particuliers de plancton apparaissent, qui colonisent les particules en suspension, permettant une biomasse élevée malgré le fait que la turbidité ne permette pas la pénétration du soleil. Ces eaux sont généralement soumises à une agitation et ou à des courants importants qui les oxygènent.

Un cas particulier est celui du bouchon vaseux des estuaires, qui se meut au rythme des marées et des afflux d'eaux douces. Il sert de nurserie ou de protection et de zone de nourrissage aux alevins de certaines espèces. Il peut aussi concentrer certaines pollutions. La « pluie » ou « neige » que constituent les cadavres ou excréments de zooplanctons qui descendent passivement vers les fonds marins a une grande importance pour l'alimentation des espèces de grands fonds et pour les cycles biogéochimiques.
Certaines espèces planctoniques peuvent produire des toxines puissantes (dont botuliques), lesquelles peuvent être concentrées dans la chaîne alimentaire par les coquillages, organismes filtreurs ou certains poissons. Ces mêmes organismes peuvent aussi et en sus concentrer des toxiques modifiés et/ou bioaccumulés par le plancton tel le mercure méthyle, dont la quantité tend à augmenter régulièrement chez les poissons prédateurs et cétacés, de manière très préoccupante pour la santé des consommateurs humains et des écosystèmes marins.
Dans certaines conditions (apports élevés de nutriments, généralement des matières organiques, nitrates ou phosphates), un « excès » de plancton conduit à une situation d'eutrophisation, voire de dystrophisation, c'est-à-dire de mort ponctuelle ou durable de la plupart des organismes aquatiques. L'ONU a identifié une centaine de zones mortes (Dead zone) dont en mer Baltique. Dans ces zones, l'eutrophisation peut être combinée à d'autres types de pollution ou de perturbation.
Plancton et climat
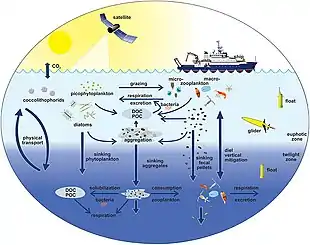
Le plancton interagit avec le climat local et global dont en intervenant dans le cycle du carbone via la photosynthèse, mais aussi en émettant après sa mort des molécules soufrées qui contribuent à la nucléation de la vapeur d'eau en gouttes de pluie, c'est-à-dire à la formation des nuages et des précipitations et en déplaçant ce carbone dans la colonne d'eau[22]. Le Sulfure de diméthyle est le plus abondant des composés biologiques soufré émis dans l'atmosphère et il l'est essentiellement à partir des océans. Il est dégradé dans l'atmosphère marine ; principalement en dioxyde de soufre, diméthylsulfoxyde (DMSO), acide sulfonique et acide sulfurique qui forme des aérosols dont les molécules se comportent comme des noyaux de condensation de nuages. Le plancton a ainsi une influence sur la formation des nuages, et secondairement sur les apports terrigènes à la mer par le ruissellement (voir article sur le diméthylsulfure).
La biomasse planctonique par litre d'eau est en moyenne bien plus importante dans les eaux froides, même sous la calotte glaciaire, que dans les eaux chaudes tropicales, si elles sont éloignées de sources d'oligoéléments tels que les apports volcaniques des atolls coralliens.
Les phénomènes de remontée d'eau des profondeurs (« upwellings ») et d'endo-upwellings sont à l'origine de la répartition des masses de planctons qui conditionnent les espèces des réseaux trophiques supérieurs. Les modifications climatiques, en affectant les courants marins et la température de l'eau (et donc sa teneur passive en oxygène) pourraient modifier la répartition et la nature des masses de plancton et donc des ressources halieutiques. Des modifications importantes sont observées depuis près d'un siècle, mais la part des impacts de la surpêche et des pollutions (nitrates, phosphates, pesticides, métaux lourds, turbidité, pollution thermique..) dans ces phénomènes est encore difficile à déterminer.
Dans l'océan mondial le plancton subit aussi très fortement les modifications anthropiques du climat[23], et il le subit de plus en plus[24],[25]. La répartition des espèces et leur phénologie ainsi que la composition et les fonctionnalités écologiques[26] des communautés planctoniques ont déjà fortement changé[27],[28],[23]. Une étude récente[29] a montré que le plancton n'est partout plus le même qu'à l'ère préindustrielle, et que les assemblages d'espèces de l'Anthropocène ont presque toujours divergé de leurs homologues préindustriels proportionnellement à l'ampleur des changements de température de l'eau (corrélation nette dans 85% des cas étudiés grâce aux archives sédimentaires de foraminifères marins[30] (micropaléontologie océanique[31]).
Plancton et oxygène
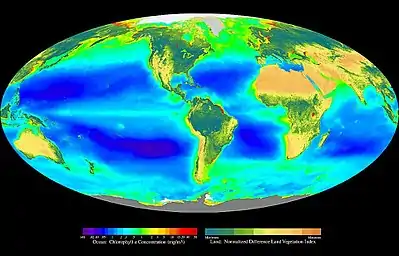

Selon les données « couleur de l'océan » recueillies par le capteur SeaWiFS et l'indice de végétation terrestre par différence normalisée obtenu par la détection des teneurs en chlorophylle par réflectance via des satellites, la production primaire brute dans l'océan mondial (autrement dit la quantité de carbone fixée par les organismes marins photosynthétiques, et la production d'oxygène) est sensiblement égale à celle sur les terres émergées, bien que la biomasse primaire océanique soit environ 500 fois moins importante que la biomasse terrestre, ce qui traduit la très grande efficacité du phytoplancton océanique (avec notamment les diatomées qui représentent 40 % de la production primaire des écosystèmes marins)[32]. Les forêts concentrent 50 % de la photosynthèse terrestre (34 % pour les forêts tropicales et 16 % pour la forêt amazonienne)[33], ce qui conduit les médias à utiliser abusivement la métaphore anthropocentrique de « poumon de la Terre » ou de « poumon vert ». Cependant, leur production primaire nette (bilan photosynthèse-respiration) est nulle du point de vue de l'oxygène alors que le phytoplancton océanique, qui ne constitue que de 1 à 2 % de la biomasse végétale mondiale, produit, via la photosynthèse, de 60 à 80 % de l'oxygène atmosphérique[34],[35], ce qui vaut aux océans d'être qualifiés à raison de « poumon bleu »[36],[37]
Grâce à la photosynthèse effectuée par le phytoplancton, l'océan stocke le CO2 dissous dans la couche superficielle et rejette l'oxygène dans l'air. Environ un tiers du CO2 de l'air est absorbé par les mers et les océans grâce au phytoplancton[38] soit autant que par tous les végétaux terrestres et les plantes aquatiques (le dernier tiers étant celui qui serait responsable de l’augmentation des gaz à effet de serre dans l'atmosphère)[39].
Plus de 150 scientifiques, originaires de 26 pays, ont lancé un appel international pour stopper l'acidification des océans, due à l'absorption en grande quantité de CO2, car elle menace les écosystèmes marins, notamment par la dissolution de nombreux organismes planctoniques à squelettes de calcaire[40]).
Plancton et nécromasse

Le plancton est à l'origine d'une biomasse considérable, mais aussi d'une nécromasse qui constitue une part importante de certains sédiments (la craie est la nécromasse fossile de plancton marin). La sédimentation de la nécromasse planctonique est un des puits de carbone planétaire, mais aussi une des voies qui a permis la détoxication des océans primitifs trop riches en certains sels, de calcium notamment, pour permettre une vie complexe sur les modèles que nous connaissons.
Histoire du plancton
Les microfossiles permettent d'étudier comment le plancton a évolué au sein de la biodiversité marine. Ils confirment l'importance des liens entre climat et plancton, et ont montré que lors des grandes extinctions massives, le plancton aussi a été fortement affecté. En particulier, une étude récente qui a comparé le contenu en microfossiles de nanoplancton de 823 carottes de sédiments marins provenant de 17 forages océaniques faits dans les hémisphères nord et sud. On a constaté qu'à la « limite Crétacé-Tertiaire » (dernière grande crise d'extinctions), ce sont 93 % des espèces de nanoplancton possédant un test calcaire qui ont subitement disparu, avec une extinction plus rapide et plus massive dans l’hémisphère nord. Ceci est un indice de plus en faveur de l'hypothèse d'une cause qui serait la chute d'un gros astéroïde au Yucatán, d'autant que les dates sont corrélées avec une extinction massive d'espèces végétales terrestres en Amérique du Nord. À la suite de cet évènement catastrophique, la diversité du nanoplancton est restée dans l’hémisphère nord beaucoup plus faible durant environ 40 000 ans et il lui a fallu près de 270 000 ans pour retrouver son niveau initial. Sa diversité est encore aujourd'hui plus importante dans l'hémisphère sud. Lors de cette extinction, le nanoplancton photosynthétique a aussi été fortement touché, ce qui laisse supposer que l'impact et les incendies ont libéré une grande quantité de métaux toxiques dans l'air et l'océan, qui aurait touché l'hémisphère nord, plus que la moitié sud de la planète. Le cuivre est toxique pour le plancton à très faible dose (quelques parties par milliard), mais du nickel, du cadmium et fer ont sans doute aussi été libérés en grande quantité, ainsi peut-être que du chrome, de l'aluminium et surtout du mercure et du plomb dont les effets toxiques, presque universels sont bien connus[41].
Menaces sur le plancton

Le taux de phytoplancton présent en surface dans les mers est suivi à grande échelle, par satellite depuis 1979. Il montre des fluctuations cycliques, à échelle décennale, a priori liée au forçage radiatif. Les observations sont encore trop courtes pour prédire des tendances à long terme[1], mais la modélisation et l'étude des paléoclimats aident déjà à mieux comprendre les liens entre plancton et climat.
En 2006, Michael Behrenfeld (Université d'État de l'Oregon) montre dans la revue Nature () comment l’imagerie satellitale permet d'évaluer la quantité de chlorophylle dans l'eau, et que 60 % environ des mers de 1998 à 1999 ont eu un niveau d'activité planctonique très bas, en raison du phénomène El Niño, avant de récupérer avec La Niña puis de chuter régulièrement : de 1999 à 2005 (durant 6 ans). De blooms planctoniques de grande envergure sont parfois observés (en mer Baltique par exemple) mais l'activité planctonique semble régulièrement diminuer :
- l’océan perd – en moyenne, et chaque année - une capacité d’absorption de 190 millions de tonnes (Mt) de carbone par rapport à l'année précédente. Si cette tendance devait être confirmée dans les années à venir, le réchauffement climatique pourrait être accéléré. Ce sont en effet environ 695 Mt de CO2, soit plus que le total des émissions annuelles de la France, qui n’ont pas - en 6 ans - été absorbées dans les zones tropicales et équatoriales, à la suite du recul de l’activité planctonique.
Scott Doney[42], également dans la revue Nature, précise que, dans le même temps, la productivité a augmenté aux hautes latitudes en raison du réchauffement des eaux de surface, mais sans pouvoir compenser le déficit de la zone tropicale, le gain de productivité étant limité et concernant un volume d’eau très inférieur.
L’acidification des océans affecte aussi le plancton. De même que la surexploitation dont les impacts sont mal compris, et probablement le blanchiment ou de la mort des coraux, ainsi que l’eutrophisation et la turbidité anormales des estuaires et de vastes zones marines.
Les biocides (pesticides et antifooling notamment) sont d'autres sources de mortalité ou sélection du plancton ; même à faible dose ces molécules apportées par les eaux de ruissellement (voire par la pluie parfois) sont retrouvées dans les estuaires puis en mer, avec des effets de perturbations métaboliques, engendrant quelques phénomènes de résistance et la régression de planctons plus vulnérables, au détriment des équilibres naturels, et en altérant les écosystèmes[43].
Le réchauffement est une des menaces possibles, la plus souvent citée, avant l'acidification ou la pollution. Il agit de plusieurs manières :
- la « stratification » des eaux qu’il engendre, implique une moindre remontée de sels nutritifs pour le plancton.
- La partie mobile du plancton contribuant elle-même indirectement à la formation des nuages, et au mélange des couches thermiques et de densité différente[5],[4], ce cycle pourrait s’auto-entretenir, d’autant que les poissons, qui contribuent aussi au mélange des couches de surface sont également de moins en moins nombreux, alors que les zones marines mortes sont en augmentation.
En Mer du Nord, depuis 1961, la part du plancton d’eau chaude ne cesse de croître par rapport à celle du plancton d’eau froide. De plus, l'acidification a un impact sur les enveloppes calcaires du plancton, comme celles de certains protistes, de mollusques et de crustacés.
Des régressions importantes de phytoplancton semblent être déjà survenues, notamment il y a environ 55 millions d'années, à une période justement caractérisée par une augmentation des taux de gaz à effet de serre (de cause inconnue). Le plancton marin pourrait à nouveau être mis à mal, avant 2050 (voire avant 2030 dans l'océan Austral).
Méthodes d’étude du plancton

Le plancton est traditionnellement prélevé à partir de filets appelés filets à plancton. Ces filets sont constitués d’un grand cercle métallique sur lequel est attachée une toile de nylon ou de soie de forme conique qui se termine par un récipient appelé collecteur. Il existe plusieurs modèles de toiles avec différentes tailles de mailles. La taille des mailles est sélectionnée en fonction de la taille des organismes que l’on souhaite récolter : elle est toujours inférieure à la taille des organismes visés. Le filet est descendu dans l’eau à l’aide d’un câble. La longueur de câble déployée permet de savoir à quelle profondeur maximale le filet est envoyé. Lorsque le filet est tiré par le câble, l’eau passe à travers les mailles du filet qui laissent échapper l’eau et tous les organismes qui ont une taille plus petite que les mailles du filet tandis que les plus gros s’accumulent dans le collecteur. L’entrée des filets est généralement munie d’une petite hélice appelée volucompteur qui permet de déterminer la quantité d’eau qui pénètre dans le filet. Une fois le filet remonté, le collecteur est démonté et son contenu est récupéré dans un récipient afin d’être étudié.

Les études quantitatives précises utilisent des bouteilles de prélèvement. Le filet à plancton peut être utilisé de plusieurs façons. Si le bateau est à l’arrêt, le filet peut être remonté verticalement. La collecte donnera alors des informations sur la répartition verticale des espèces dans la colonne d'eau. Si le bateau est en mouvement, la collecte se fera horizontalement à une profondeur donnée et donnera des informations sur la répartition des espèces à cette profondeur. Dans ce cas, un filet muni d’un système de fermeture sera utilisé pour ne pas polluer la récolte au moment de la remontée du filet. Ces méthodes de collecte du plancton permettent de filtrer de grandes quantités d’eau ce qui permet d’effectuer des études dans différents types d’eaux y compris dans des zones pauvres en plancton. Elles sont cependant peu précises pour l’étude quantitative du plancton. En effet, même en utilisant un volucompteur, il reste difficile d’estimer précisément la quantité d’eau filtrée par le filet et comme le filet est traîné grâce à des câbles, il n’est pas facile d’effectuer des prélèvements à une profondeur exacte et constante. Cette méthode de collecte est donc généralement utilisée pour l’étude qualitative des espèces c’est-à-dire pour obtenir des informations sur la présence ou l’absence de telle ou telle espèce.
Il existe plusieurs modèles de bouteilles. Les plus courantes sont les bouteilles Niskin. Ces bouteilles permettent de prélever un volume d’eau connu à une profondeur précise. La bouteille est un cylindre en plastique muni à chaque extrémité de deux clapets qui servent de bouchons. La bouteille est attachée sur un câble et les clapets sont maintenus ouverts soit par un système de ressort ou par une corde élastique en fonction des modèles. Elle est descendue dans l’eau avec les deux clapets ouverts. La longueur du câble déployée permet d’estimer la profondeur atteinte par la bouteille. Arrivée à la profondeur que l’on souhaite échantillonner, la bouteille est refermée à l’aide d’un petit poids appelé messager que l’on fait glisser le long du câble et qui va libérer les deux clapets de la bouteille. L’eau et le plancton qu’elle contient sont ainsi emprisonnés dans la bouteille étanche qui peut être remontée à la surface pour être vidée. Les bouteilles les plus récentes utilisent des électrovalves qui peuvent être actionnées à une profondeur prédéfinie grâce à un détecteur de pression ou à l’aide d’un signal électrique envoyé par l’utilisateur depuis la surface. La bouteille peut être utilisée seule ou couplée à d’autres bouteilles pour échantillonner simultanément à plusieurs profondeurs. Des supports métalliques appelés rosettes permettent de fixer ensemble jusqu’à 36 bouteilles de prélèvement et de déclencher la fermeture de chaque bouteille à différentes profondeurs. Il est ainsi possible d’échantillonner les différentes couches de la colonne d'eau et d’obtenir une répartition précise du plancton sur la verticale.
Le plancton et l'art
Les formes parfois très géométriques et volontiers complexes de nombreux types d'organismes planctoniques ont fasciné les scientifiques à leur découverte, entre le XVIIIe et le XIXe siècle. Leur beauté et leur diversité furent popularisées auprès du grand public en 1904 par le best-seller du biologiste et dessinateur naturaliste Ernst Haeckel, intitulé « Formes artistiques de la nature » (Kunstformen der Natur). Cet ouvrage eut un impact extrêmement important sur le courant de l'Art nouveau du début du XXe siècle, et notamment sur des artistes comme Constant Roux ou encore René Binet, auteur de la porte monumentale de l'exposition universelle de Paris en 1900[44].

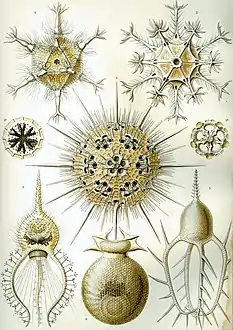 Planche des « Phaeodaria » (ibid)
Planche des « Phaeodaria » (ibid)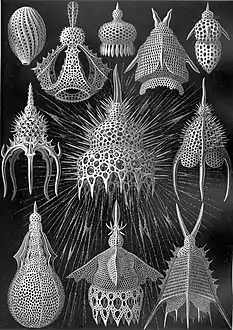 Planche des « Cyrtoidea »
Planche des « Cyrtoidea »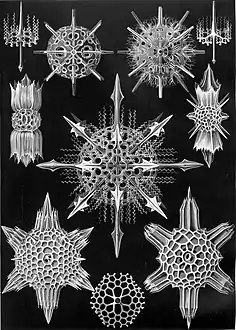 Planche des « Acanthophracta »
Planche des « Acanthophracta » Planche des « Phaeodaria »
Planche des « Phaeodaria »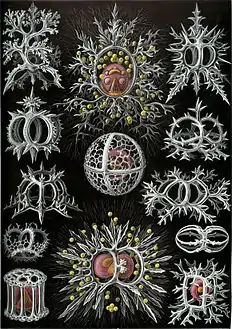 Planche des « Stephoidea »
Planche des « Stephoidea »
 Planche des « Spumellaria »
Planche des « Spumellaria » La porte monumentale de l'Exposition universelle de Paris (1900) conçue par René Binet et ouvertement inspirée des dessins d'Haeckel.
La porte monumentale de l'Exposition universelle de Paris (1900) conçue par René Binet et ouvertement inspirée des dessins d'Haeckel.
Notes et références
- 1 2 Daniel G. Boyce, Marlon R. Lewis et Boris Worm, « Global phytoplankton decline over the past century », Nature, vol. 466, , p. 591-596 (lire en ligne)
- ↑ Koch D.L & Subramanian G. (2011) Collective hydrodynamics of swimming microorganisms: living fluids. Annu. Rev. Fluid Mech. 43, 637–659
- ↑ Dewar, W. K. et al. (2006) Does the marine biosphere mix the ocean? J. Mar. Res. 64, 541–561.
- 1 2 études conduite par Katija et Dabiri au California Institute of Technology de Pasadena, relatée par la revue Nature (Brève NatureNews publiée on Line 2009/07/29, Nature doi:10.1038/news.2009.745) et Article Nature ; William K. Dewar ; Oceanography : A fishy mix ; Nature 460, 581-582 (2009/07/30) ; doi:10.1038/460581a ; online 2009/07/29 (payant)
- 1 2 Bibliographie
- ↑ Hamner W.M, Hamner P.P, Strand S.W & Gilmer R.W (1983) Behavior of antarctic krill, Euphausia superba: chemoreception, feeding, schooling, and molting. Science 220, 433–435
- ↑ Bianchi D, Galbraith E.D, Carozza D.A, Mislan K.A.S & Stock C.A (2013) Intensification of open-ocean oxygen depletion by vertically migrating animals. Nat. Geosci. 6, 545–548.
- ↑ Isabel A. Houghton, Jeffrey R. Koseff, Stephen G. Monismith & John O. Dabiri (2018) Vertically migrating swimmers generate aggregation-scale eddies in a stratified column ; Nature (2018) doi:10.1038/s41586-018-0044-z ; mis en ligne le 18 avril 2018 (résumé)
- ↑ Tiny shrimp may be mixing ocean water as much as the wind and waves, par Elizabeth Pennisi, le 18 avril 2018 (avec vidéo)
- ↑ Davis C.C (1955) The marine and fresh-water plankton, Michigan State Univ. Press, 562 p.
- ↑ Maëlle Thomas-Bourgneuf et Pierre Mollo, L'Enjeu plancton : L’écologie de l’invisible, Paris, éditions Charles Léopold Mayer, , 272 p. (ISBN 978-2-84377-147-7, lire en ligne), p. 21-23
- ↑ Océan et Mers (vie marine) vie pélagique|auteur= Lucien Laubier|année= 2008 |éditeur= Encyclopaedia Universalis|consulté le= 07 mai 2011
- ↑ (en) Sieburth, J. M., Smetacek, V. and Lenz, J. (1978) Pelagic ecosystem structure: heterotrophic compartments of plankton and their relationship to plankton size fractions. Limnol. Oceanogr., 23, 1256–1263.
- ↑ Acronyme anglophone de "heterotrophic nanoflagellates", nanoflagellés hétérotrophes.
- ↑ Sato, M., Dower, J. F., Kunze, E. & Dewey, R. (2013) Second-order seasonal variability in diel vertical migration timing of euphausiids in a coastal inlet. Mar. Ecol. Prog. Ser. 480, 39–56
- ↑ Huntley, M. E. & Zhou, M. (2004) Influence of animals on turbulence in the sea. Mar. Ecol. Prog. Ser. 273, 65–79
- ↑ Visser A.W (2007) Biomixing of the oceans ? Science 316, 838–839 .
- ↑ Paul Bougis, Écologie du plancton marin. Le phytoplancton, Masson, , p. 2.
- ↑ Brice Louvet, « VIDÉO : la plus grande colonie de siphonophores jamais observée », sur sciencepost.fr, .
- ↑ Lucien Laubier, « Océan et Mers (vie marine) : Vie pélagique », dans Encyclopaedia Universalis, ([http://www.universalis-edu.com/encyclopedie/ocean-et-mers-vie-marine-vie-pelagique/#2/).
- ↑ (en) Gunter Dietrich, General oceanography, Wiley, 626 p.
- ↑ Zhang X & Dam H.G (1997) Downward export of carbon by diel migrant mesozooplankton in the central equatorial Pacific. Deep Sea Res. Part II Top. Stud. Oceanogr. 44, 2191–2202
- 1 2 Hoegh-Guldberg O & Bruno J.F (2010) The impact of climate change on the world’s marine ecosystems. Science, 328(5985), 1523-1528
- ↑ IPCC. Climate Change (2013) : The Physical Science Basis (eds Stocker, T. F. et al.) (Cambridge Univ. Press, 2013).
- ↑ Abram N;J & al. (2016) Early onset of industrial-era warming across the oceans and continents. Nature 536, 411–418.
- ↑ Waters C.N & al. (2016) The Anthropocene is functionally and stratigraphically distinct from the Holocene. Science 351, aad2622
- ↑ Poloczanska, E. S. et al. Global imprint of climate change on marine life. Nat. Clim. Change 3, 919–925 (2013).
- ↑ Beaugrand, G., McQuatters-Gollop, A., Edwards, M. & Goberville, E. Long-term responses of North Atlantic calcifying plankton to climate change. Nat. Clim. Change 3, 263–267 (2013).
- ↑ Lukas Jonkers, Helmut Hillebrand & Michal Kucera (2019) Global change drives modern plankton communities away from the pre-industrial state| Nature | 22 mai 2019
- ↑ Siccha M & Kucera M (2017) ForCenS, a curated database of planktonic foraminifera census counts in marine surface sediment samples. Sci. Data 4, 170109
- ↑ Bé A.W.H & Tolderlund D.S in The Micropaleontology of Oceans (eds Funnell, B. M. & Riedel, W. R.) Ch. 6, 105–149 (Cambridge Univ. Press, 1971)
- ↑ (en) C. B. Field, M. J. Behrenfeld, J. T. Randerson et P. Falkowski, « Primary production of the biosphere: integrating terrestrial and oceanic components », Science, vol. 281, no 5374, , p. 237-240.
- ↑ (en) Christian Beer et al., « Terrestrial Gross Carbon Dioxide Uptake: Global Distribution and Covariation with Climate », Science, vol. 329, no 5993, , p. 834-838 (DOI 10.1126/science.1184984)
- ↑ (en) Chip Fletcher, Climate Change, John Wiley & Sons, , p. 95
- ↑ (en) P.G. Falkowski, « The role of phytoplankton photosynthesis in global biogeochemical cycles », Photosynth Research, vol. 39, no 5993, , p. 3 (DOI 10.1007/BF00014586)
- ↑ Eric Karsenti et Dino Di Meo, Tara océans, Actes Sud, , p. 87.
- ↑ « Éclosarium. À la découverte du phytoplancton », sur letelegramme.fr, .
- ↑ Commission océanographique intergouvernementale (COI) de l'Unesco.
- ↑ Michael Behrenfeld, Université de l'Oregon, in le journal Nature du 7 décembre 2006
- ↑ Le CO2 se combine à une molécule d'eau (H2O) pour donner un ion positif H+ et un hydrogénocarbonate (HCO3) qui finit lui-même par se décomposer en carbonate (CO3) et en autre H+. Résultat, la concentration de la mer en ion hydrogène (H+) augmente et elle devient plus corrosive, ce qui limite voir anéantit la synthèse de carbonate de calcium, principale brique de la formation du squelette externe de nombreux organismes planctoniques.
- ↑ Des traces de la météorite tueuse de dinosaures dans le nanoplancton Synthèse proposée par legeologue.com, consultée 2010/11/02.
- ↑ Woods Hole Oceanographic Institution
- ↑ Collectif ; coordonné par Geneviève Arzul & Françoise Quiniou (2014) ; Plancton marin et pesticides : quels liens ? Ed Quae, ISN:9782759220359, paru le 01/02/2014 ; 144pp (présentation)
- ↑ Jean-Michel Othoniel, « L'Art nouveau ou l'esthétique des courbes », France Culture.com Les jeudis de l'expo par Elizabeth Couturier (consulté le )
Voir aussi
Articles connexes
- Pleiston
- Necton
- Acidification des océans
- Zone morte
- Bactérioplancton
- Serge Frontier
Liens externes
- Les chroniques du plancton : Série de courts films documentaires (20 épisodes) et site éducatif sur le plancton.
- Note sur la terminologie des planctons (Gérard BALVAY, INRA, 1994, revu 2006)
- Plankton*Net : Images des espèces planctoniques.
- Plankton Planet : Consortium international d'acteurs de la recherche sur la biodiversité et l'évolution du microbiome océanique.
- Plancton du monde : Site créé par Océanopolis pour tout savoir sur le plancton à travers des images et vidéos.
- TARA OCEANS une expédition scientifique de 2 ans et demi. De nombreuses vidéos racontant la vie du plancton et le travail des scientifiques peuvent être consultées.
- Le plancton : Histoire naturelle d'une vie à la dérive Conférence. Jean-Philippe Labat. 2019.
Bibliographie
- Pierre Mollo, Anne Noury, Le Manuel du plancton, Ed. Charles Léopold Mayer, 2013. Disponible en libre téléchargement : http://www.eclm.fr/ouvrage-360.html
- Pierre Mollo, Maëlle Thomas-Bourgneuf, L'enjeu plancton, l'écologie de l'invisible, Ed. Charles Léopold Mayer, 2009. Disponible en libre téléchargement: http://www.eclm.fr/ouvrage-338.html
- (en) Haury, L. R., J. A. McGowan, and P. H. Wiebe. 1978, Patterns and processes in the time-space scales of plankton distribution. Pattern in plankton communities (eds J. H. Steele), Plenum Press, New York, p. 227-327