سرطان الموثة أو سرطان البروستاتا هو شكل من أشكال السرطان الذي يتطور في البروستاتة، وهي غدة في الجهاز التناسلي الذكري. معظم سرطانات البروستاتة غالبا ماتكون بطيئة النمو[2]، غير إن هناك بعض الحالات التي تتميز بكونها أكثر شراسة وخطورة.[3] يمكن للخلايا السرطانية التي تنتشر من البروستاتة إلى أجزاء أخرى من الجسم، خصوصا العظام والعقد الليمفاوية. يمكن أن يسبب سرطان البروستاتة الألم، صعوبة في التبول,، مشاكل أثناء الاتصال الجنسي أو ضعف الانتصاب. يمكن للأعراض الأخرى أن تتطور خلال المراحل المتقدمة للمرض.
| سرطان البروستات | |
|---|---|
موقع البروستات
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| الموقع التشريحي | بروستاتا[1] |
| الإدارة | |
| أدوية | |
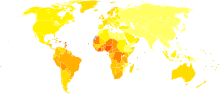
تختلف نسبة اكتشاف المرض حول العالم، حيث أنها اقل في جنوب وشرق آسيا عنها في أوروبا وأمريكا تحديدًا[4]. يعتبر سرطان البروستاتة أكثر شيوعا لدى الرجال الذين تجاوزوا سن الخمسين[5]. عالميا، يعتبر سرطان البروستاتة سادس نوع من أنواع السرطانات المسببة للوفاة[6] (الثاني في الولايات المتحدة الأمريكية)[5]. سرطان البروستاتة أكثر شيوعا في البلدان المتقدمة بينما تتزايد نسبته في البلدان النامية[6]. العديد من المصابين بسرطان البروستاتة لا تظهر لديهم الأعراض أو لا يحصلون على علاج معين وقد يتوفون لأسباب غير متعلقة بالمرض في نهاية الأمر. العوامل المؤثرة على تطور المرض تشمل العوامل الوراثية والطبيعة الغذائية وغيرها.
يمكن اكتشاف سرطان البروستاتة بالتعرف على الأعراض المصاحبة، الفحص الإكلينكي ( السريري ) , اختبار نسبة المستضد الخاص "الانتيجين" في الدم specific antigen-prostate (PSA) أو عن طريق الخزعة (أخذ عينة من النسيج). اختبار المستضد الخاص بالبروستاتة يساعد على فرص اكتشاف السرطان ولكنه لا يقلل من نسبة الوفاة[7]. أوصت هيئة الخدمات الوقائية الأمريكية United States Preventive Services Task Force عام 2012 ضد استخدام اختبار المستضد الخاص "الانتيجين" PSA test وذلك بسبب مخاوف في الإفراط في التشخيص والعلاج مع كون معظم حالات سرطان البروستاتة بدون أعراض[8]. معتبرة أن الفائدة المتوقعة من ذلك الاختبار لا تفوق المخاطر المحتملة[8].
الاستراتيجيات المتبعة للسيطرة على المرض ينبغي أن توجه تبعا لحدة المرض. الأورام المنخفضة الخطورة يمكن أن تخضع للمتابعة الدورية والمستمرة من قبل الطبيب. العلاج يتضمن : الجراحة والعلاج الإشعاعي وفي الحالات الأكثر تقدما يمكن استخدام طرق مثل العلاج بالتبريد أو التجميد cryosurgery، العلاج الهرموني والعلاج الكيميائي (في بعض الحالات يعطى المريض العلاج الهرموني مصاحبا للعلاج الإشعاعي). بعض الدراسات تقترح أن ممارسة العادة السرية تقلل من خطر الإصابة بسرطان البروستاتة[9][10][11]
من العوامل المهمة المحددة لنتيجة العلاج عمر المريض وحالته الصحية العامة، مدى الانتشار السرطاني، شكل الأنسجة المصابة تحت المجهر ومدى الاستجابة للعلاج الأولي. اتخاذ القرار المناسب سواء المباشرة في علاج سرطان البروستاتة (المحصور في الغدة فقط ) من عدمه هو نوع من المقايضة يجريها المريض بين الفوائد المتوقعة والأضرار المحتملة، من ناحية نجاة المريض ونوعية الحياة التي سوف يحياها.
الأعراض
عادةً لا يسبب سرطان البروستات أي أعراض في مراحله الأولى. وفي بعض الأحيان تشبه أعراض سرطان البروستات أعراض الأمراض الحميدة كضخامة البروستات الحميدة. هذه الأعراض تشمل كثرة التبول، كثرة التبول أثناء الليل، وصعوبة في بداية التبول وصعوبه في الحفاظ على تدفق مستمر من البول، بول دموي (دم في البول) أو تبول مؤلم.
تقريباً حوالي ثلث المرضى الذين شُخصوا بسرطان البروستاتة لديهم على الأقل واحد أو أكثر من هذه الأعراض، بينما الباقون ليس لديهم أي أعراض.[12]
ويرتبط سرطان البروستاتة عادةً باختلال في وظيفه التبول، وذلك لأن غدة البروستاتة تحيط بقناة مجرى البول من جميع الجهات. وبالتالي أي تغييرات في الغدة تؤثر بشكل مباشر على وظيفة التبول .
ولأن "الوعاء الناقل " يفرز السائل المنوي في قناة مجرى البول في البروستاتة ولأن إفرازات غدة البروستاتة نفسها تشكل نسبه من محتوى السائل المنوي، قد يسبب سرطان البروستاتة أيضاً بمشاكل في الوظيفة الجنسية والأداء الجنسي مثل صعوبة الانتصاب أو آلام عند القذف.[12]
يمكن لسرطان البروستاتة في مراحله المتقدمة أن ينتشر إلى أجزاء أخرى من الجسم، مما يسبب أعراض إضافية . وأكثر الأعراض شيوعا هي آلام العظام، وغالباً في الفقرات (عظام العمود الفقري) ، الحوض، أو الأضلاع . ومن الممكن أن ينتشر أيضاً في العظام الأخرى مثل عظم الفخذ "عادة الجزء القريب من العظام". كما يمكن لسرطان البروستاتة المنتشر في العمود الفقري أن يسبب ضغطاً في الحبل الشوكي أيضا، مما يؤدي إلى أعراض كضعف بالساق وسلس البول أوالبراز.[13]
الأسباب
حتى هذه اللحظة أسباب سرطان البروستاتة لا تزال غير واضحه ولا يوجد تفسير كامل لها.[14] عوامل الخطر الأساسية هي السمنة والعمر والتاريخ العائلي، سرطان البروستاتة غير شائع في الرجال الذين تقل أعمارهم عن 45 عاما، ولكنه يصبح أكثر شيوعا مع التقدم في السن . متوسط أعمار المصابين بسرطان البروستاتة عند التشخيص هو 70 سنة.[15]
ومع ذلك، كثير من الرجال لا يعرفون أن لديهم سرطان البروستاتة، فقد وجدت الدراسات التي أقيمت على عينه مأخوذه من جثث رجال من مختلف الجنسيات "الصينية والألمانية، جامايكا، السويدية، والأوغندية" الذين ماتو بأسباب أخرى لا علاقة لها بسرطان البروستاتة، أن نسبة 30% من الرجال في الخمسينات ونسبة 80% من الرجال في السبعينات كان لديهم سرطان البروستاتة دون علمهم..[16]
يتضاعف خطر الإصابة بسرطان البروستاتة عند الرجال الذين لديهم أفراد الأسرة من الدرجة الأولى مصابين بهذا السرطان مقارنة بالرجال الذين ليس لديهم أقرباء مصابين بسرطان البروستاتة في الأسرة.[17]
و هذا الخطر يبدو أكبر عند الرجال الذي لديهم أشقاء مصابين مقارنة بالرجال الذين لديهم آباء مصابين بهذا السرطان . في الولايات المتحدة في عام 2005، كان هناك ما يقدر ب 230,000 حالة جديدة من سرطان البروستاتة و 30,000 حالة وفاة بسبب سرطان البروستاتة.[18] الرجال المصابين بارتفاع ضغط الدم هم أكثر عرضة لسرطان البروستاتة.[19] وهناك ارتفاع صغير في نسبه خطورة الإصابة بسرطان البروستاتة ترتبط بعدم ممارسة الرياضة.[20] الدراسات التي أجريت خلال عام 2010 وجدت أن المنشأ الأكثر شيوعا لسرطان البروستاتة هو الخلايا القاعدية.[21]
الجينات
كما أشارت المنظمات فقد تساهم الخلفية الوراثية في خطر الإصابة بسرطان البروستات لارتباطه بالعرق والعائلة وجينات خاصة منوعة . ويحتمل إصابة الرجل الذي له قريب مصاب من الدرجة الأولى (أب أو أخ) بسرطان البروستات بمرتين، ويرتفع خطر إصابة أولئك الذين لديهم أقارب مصابين بالدرجة الأولى (2) إلى خمسة أضعاف مقارنة مع الرجال الذين لايوجد لديهم إصابات في تاريخهم العائلي.[22]
ويؤثر سرطان البروستات في الولايات المتحدة على الرجال أصحاب البشرة السوداء أكثر من تأثيرة على أصحاب البشرة البيضاء أو اللون الحنطي.[23][24]
في المقابل، تعتبر نسبة معدل الإصابة والوفيات للرجال البيض الثلث بالنسبة لأصحاب البشرة الحنطية، وأشارت الدراسات التي جرت على التوأم في إسكندنافيا ( Scandinavia) أن معدل خطر الإصابة الوراثي يمثل 40%.[25]
لايوجد جين محدد يسبب الإصابة بسرطان البروستات : قد تسببه جينات كثيرة، ويكون التغيير في BRCA1 و BRCA2 له تأثير كبير للإصابة بسرطان المبيض والثدي لدى النساء والبروستاتة عند الرجال.[26]
هناك جينات أخرى لها علاقة مثل سرطان البروستات الجيني ومُستقبِل منشط الذكورة ومُستقبِل الفيتامين د[23] ويساعد انقسام خلية TMPRSS2 وخصوصاً TMPRSS2-ERG أو TMPRSS2-ETV1\4 على نمو خلايا سرطانية.[27]
يعود فقدان الجينات الكابتة للسرطان في وقت مبكر من تسرطن البروستات إلى الصبغيات 8P,10Q,13Q,16Q . حيث تكون نسبة تحول P53 في سرطان البروستات الأولي منخفضة وترى كثيراً في الأماكن النقيلية . بالتالي تكون تحولات P53 متأخرة في مرض سرطان البروستات . ويعتقد أن جينات أخرى تلعب دور في كبت جينات سرطان البروستات مثل جينات PTEN و KALI . وتصل نسبة الرجال الذين أصيبوا بسرطان البروستاتة وفقدوا جين واحد من جينات PTEN في وقت التشخيص إلى 70%.[28] وتم كذلك ملاحظة فقدان التكرار النسبي لجين E-cadherin و CD44 .
التغذية
هناك بعض العوامل الغذائية التي قد رُبطت بسرطان البروستات في حين أن الأدلة مازالت غيرمؤكدة لذلك [29]. لكن بعض الأدلة أثبتت، بأن هناك أنواع من الأغذية من الفواكه والخضراوات، تلعب دوراً ضئيلاً حيث تعتبر من العوامل المسببة لسرطان البروستات[30]. أيضا وحسب بعض الدراسات الإنسانية، أن أنواع اللحوم الحمراء والمصنعة قد تؤثر قليلاً على البروستات[31]. كما أن بعض الدراسات أثبتت، بأن استهلاك كمية كبيرة من اللحوم له ارتباط بارتفاع خطر الإصابة بسرطان البروستات[32]. و أن النقص في فيتامين د، يزيد من خطر الإصابة به أيضا[33]. بالإضافة إلى تناول بعض من الفيتامينات المتنوعة أكثر من سبع مرات في الأسبوع، قد يزيد من خطر الإصابة بالمرض[34][35]. ولقد أظهرت دراسة في عام 2009، أن تناول المكملات الغذائية: مثل حمض الفوليك يزيد من خطرالإصابة بالمرض[36].
التعرض للعلاجات
يوجد هناك بعض الروابط بين سرطان البروستات وتعاطي أنواع من العلاجات، والخضوع للعمليات الطبية، وبعض من الحالات الطبية[37]. وأن استخدام بعض العقاقير المخفضة للكوليسترول المعروفة باسم استاتين، قد تساعد في تقليل خطر الإصابة بالمرض[38].
و أن بعض الإصابات أو التهابات البروستات قد تساهم في زيادة فرص الإصابة بالمرض، بينما اثبتت دراسات أخرى أن بعض الإصابات قد تحد منه وذلك عبر تحفيز جريان الدم في المنطقة. وبالتحديد، الإصابة بالأمراض التي تنتقل عن طريق الاتصال الجنسي مثل: الكلاميديا والسيلان، والزهري، التي تزيد من خطر الإصابة[39]. أخيرًا السمنة[40] وارتفاع مستويات التيستوستيرون[41] في الدم قد يزيد من خطر الإصابة أيضا. كما أن هناك علاقة بين استئصال الاسهر وسرطان البروستات، ولكن هناك حاجة لمزيد من البحوث لتحديد ما إذا كانت هذه العلاقة سببية[42]. مثل البحوث التي نُشرت في مايو عام 2007 وجدتْ أن المحاربين الأمريكين القدامى الذين تعرضوا لمادة أورانج، قد زادت نسبة الخطورة في إصابتهم بالمرض مرة أخرى بعد العملية الجراحية بما يعادل 48 %[43].
العدوى الفيروسية
في عام 2006، ربط بعض الباحثين "فيروس إكس إم آر في" - والذي لم يكن معروفاً حتى ذلك الوقت - بأورام البروستات.[44] وكانت التقارير اللاحقة بشأن الفيروس متناقضة. فقد وجدت مجموعةٌ أخرى من الباحثين الأمريكان هذا الفيروس في أورام البروستات،[45][46] بينما أكد علماء ألمان أنهم لم يجدوه في عينات من الأورام نفسها [47]. وفي دراسةٍ أخرى في وقت لاحق (شارك فيها عدد من باحثي دراسة عام 2006)، توصل الباحثون إلى إن الاكتشاف المعلن في عام 2006 ربَّما كان نتيجة وجود تلوث في الأورام لا بسببها هي نفسها، ومن ثم فإن الفيروس لا علاقة له بالمرض.[48][49]
العوامل الجنسية
أظهرت العديد من الدراسات، أن تعدد الشركاء الجنسيين أو البدء في العلاقة الجنسية مبكراً تزيد من الإصابة بسرطان البروستاتة.[50][51][52] حيث تظهر الدراسات وجود أمراضٍ منتقلة جنسياً مسببة لسرطان البروستاتة في بعض الحالات، وفي أبحاثٍ كثيرةٍ لم يتم تحديد رابط واضح بين الأمراض الجنسية وظهورها قبل أم بعد تشخيص سرطان البروستات،[53][54] وأظهرت دراسات عن الأمراض المنتقلة جنسياً وذلك قبل عقد من تشخيص سرطان البروستات وجود رابطٍ بين أنواع عديدة من هذه الأمراض،(HPV-16, HPV-18 and HSV-2).[55][56][57]). ويمكن تفسير مثل هذا الأمر بوجود مرض منتقل جنسياً غير معروفٍ بعد، وبأن أعراض سرطان البروستات لا تبدأ بالظهور إلا بعد الإصابة بهذا المرض بوقتٍ طويل.[51][53][54]
الميكانيكية (الآلية) المرضية
البروستات هي جزء من أجزاء الجهاز التناسلي الذكري، والتي تساعد في تكوين وتخزين السائل المنوي عند الذكر البالغ. تكون البروستات بطول 3 سم تقريباً وتزن مايقارب 20 غراماً.[58] تقع البروستات في منطقة الحوض تحت المثانة وأمام القناة الشرجية. تحيط القناة بجزءٍ من الإحليل، وهو الأنبوب الذي ينقل البول من المثانة أثناء عملية التبول، ويحمل السائل المنوي أثناء عميلة القذف،[59] وبسبب موقعها هذا فإن أمراض البروستات تؤثر على عملية التبول والقذف وفي حالاتٍ نادرةٍ على عملية التغوط. تحتوي البروستات على العديد من الغدد الصغيرة والتي تساهم في تكوين 20% من السائل الموجود في السائل المنوي الذكري.[60] في سرطان البروستات، تتحول خلايا البروستات الغددية إلى خلايا سرطانية. تحتاج الغدد البروستاتية للهرمونات الذكرية المعروفة بالأندروجينات للعمل بشكل صحيح، والأندروجينات تتكون من التستوستيرون (Testosterone) الذي يُصنَع في الخصيتين، والديهايدروابندروستيرون (dehydroepiandrosteron) الذي يُصنَع من الغدد الكظرية، والديهايدروتيستوستيرون (dihydrotestosterone) والذي يتحول من التستوستيرون (Testosterone) في البروستات نفسها. وأما الأندروجينات فهي مسؤلة عن الصفات الجنسية الثانوية، كظهور شعر الوجه وزيادة الكتلة العضلية للجسم.
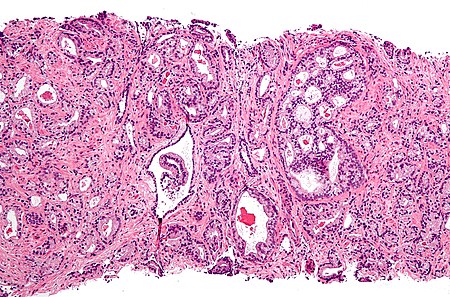
يُصنَّف سرطان البروستات بين السرطانات الغددية (adenocarcinoma)، والتي تحدث نتيجة تحول خلايا الغدد الطبيعية المفرزة للسائل المنويّ إلى خلايا سرطانية. المنطقة التي تحتوي الغدد الإفرازية في البروستات - والتي تتحول إلى خلايا سرطانية - تقع في المنطقة الطرفية (الخارجية) من البروستات. في البداية تكون الكتل السرطانية محدودة ومعزولة عن الغدد البروستاتية، وهذه الحالة تُسمَّى السرطان المغلف (carcinoma in situ) أو الأورام البروستاتية داخل الطهارة (prostatic intraepithelial neoplasia). ومع ذلك لا يوجد دليلٌ يُثبِت أن هذه الأورام البروستاتية "داخل الطهارة" هي خلايا سرطانية، إلا إنها مرتبطة بشكل وثيقٍ بالسرطان. مع مرور الوقت تبدأ هذه الخلايا السرطانية بالتكاثر والانتشار للأنسجة البروستاتية المحيطة بها، وفي نهاية المطاف سينمو هذا الورم بشكل كافٍ لاختراق الأعضاء المحيطة به، كالحويصلات المنوية أو القناة الشرجية. أو أن تكون هذه الخلايا السرطانية ذات قدرةٍ على الانتقال عبر الأوعية الدموية أو الجهاز اللمفاوي. يعتبر سرطان البروستات من السرطانات الخبيثة، لأن خلاياه تستطيع زراعة نفسها في الأجزاء الأخرى من الجسم. وهذا ما يُسمَّى بالانتشار، وسرطان البروستات ينتشر بشكلٍ أكبر في العظام والغدد اللمفاوية، ومن الممكن أن ينتشر إلى القناة الشرجية والمثانة والجزء السفلي من الحالب. ويعتقد أن طريقة انتشاره في العظم تعتمد على الأوردة كالشبكة الوريدية للبروستات، والتي تَصبُّ في الأوردة الفقرية.[61]
البروستات هو عضو يقوم بتجميع الزنك وإنتاج السترات. البروتين "ZIP1" هو المسؤول عن نقل الزنك إلى داخل خلايا البروستات، ومن أهم أدوار الزنك في الخلية هو تغيير عملية الأيض في الخلايا لإنتاج السترات، الذي يعتبر من المكوّنات الأساسية للسائل المنوي. إن عملية تخزين الزنك وتغيير مستوى الأيض وإنتاج السترات عملية مستهلكة للطاقة، فخلايا البروستات تستهلك كميَّاتٍ كبيرةً من الطاقة (ATP) حتى تقوم بتلك المهام. تكون الخلايا السرطانية في البروستات عادة خالية من الزنك، ممَّا يًمَكِّنها من توفير الطاقة، حيث أنها لا تقوم بإنتاج السترات وبذلك تستفيد من الطاقة المتوفرة في النموّ والانتشار. يعتقد أن سبب انعدام الزنك في الخلايا المسرطنة في البروستات هو توقف عمل المورث المسؤول عن إنتاج البروتين الناقل "ZIP1"، لذلك فإن البروتين "ZIP1" يعتبر منتجاً جينياً مانعاً للأورام، وهو ناتج عن المورث "SLC39A1". سبب حدوث الخلل اللاجيني الذي يجعل خلايا البروستات تتوقف عن إنتاج البروتين الناقل "ZIP1" غير معروف. جُرِّبت طرق عدّة لنقل الزنك إلى داخل الخلايا المسرطنة في الحيوانات للتخلص منها، فعند إدخال الزنك يقوم بوقف عمل المسار الكيميائي للبروتين "NF-κB"، وبالتالي يمنع انقسام وتزايد الخلايا المصابة، ويُحَفِّز موتها. إلا إنَّ تناول كميَّاتٍ من الزنك عن طريق الفم غير مفيد لعلاج مثل هذه الحالات، وذلك لعدم وجود البروتين الناقل "ZIP1".[62] يمنع عامل النسخ الجيني "RUNX2" حدوث الموت الطبيعي للخلايا السرطانية، ممَّا يُحفّز تكاثرها وانتشار سرطان البروستات.[63] ويعمل مؤشر التتالي "PI3k/Akt" مع موشر التتالي لعامل النمو "beta/SMAD" حتى يضمن حماية الخلايا السرطانية من الموت الطبيعي.[64]
يُعتَقد أن المورث "XIAP" والذي يمنع موت الخلايا طبيعياً، يدعم بقاء وتزايد الخلايا السرطانية في البروستات، وهو هدف للباحثين في هذا المجال/ حيث إنَّ معرفة كيفية تعطيل عمل هذا المورث ستعيد عملية الموت الطبيعي للخلايا إلى العمل، وبالتالي ستُوقف تزايد الخلايا السرطانية.[65] يقوم المورث "MIC-1" بتحفيز مسار عمل البروتين "FAK" ممَّا يؤدي إلى نموّ وتكاثر الخلايا السرطانية في البروستات.[66]
تساعد مستقبلات الأندروجين خلايا سرطان البروستات على البقاء على قيد الحياة، وهو محطّ اهتمام كثيرٍ من الباحثين في مجال دراسة وعلاج السرطان. حتى الآن، لم ينجح كبح عمل هذه المستقبلات إلا في الأبحاث التي أجريت على الفئران.[67]
يُحفّز العامل المضاد الخاص بالبروستات "PSMA" نموّ وتطور سرطان البروستات، حيث إنه يرفع مستويات الفوليت الذي تتعذى عليه الخلايا السرطانية. ويرفع هذا العامل المضاد مستوى الفوليت عن طريق الحليل المائي للقلوتاميتيد فولايت.[68]
التشخيص
إن موقف الجمعية الأمريكية للسرطان فيما يتعلق بالكشف المبكّر هو: «لم يُثبِت البحث حتى الآن أن الفوائد المحتملة المرجوة من الفحص، تفوق الأضرار التي يسببها الفحص والعلاج. إن الجمعية تؤمن بأن الرجال يجب ألا يخضعوا للفحص بدون أن يعلموا عمَّا نعرفه وعمَّا لا نعرفه من المخاطر والفوائد المحتملة للفحص والعلاج، تحدث إلى طبيبك حول سلبيات وإيجابيات الفحص، بدءاً من سن الـ50 (أو 45 في حال كنت أمريكياً من أصل أفريقي، أو لديك أخ أو أب أصيب بالحالة قبل سن الـ65)، لتستطيع اتخاذ القرار عما إذا كان الفحص هو الخيار المناسب لك.[69]»
إن الفحص الوحيد الذي يؤكد بشكل كامل التشخيص بالإصابة بسرطان البروستات، هو أخذ الخزعة (biopsy), و هو إجراء يتم فيه إزالة قطع صغيرة من البروستات للفحص المجهري. و على أية حال، من الممكن إجراء فحوصات أقل عدوانية قبل إجراء الخزعة.
ووفقاً للبروفيسور هاردي باندا، رئيس مشروع البروستات وأستاذ علم المسالك البولية في كلية الدراسات العليا الطبية بجامعة سري، أن فحصاً أقلَّ عدوانية يبحث في وجود البروتين إنجرايلد-2 أو "Engrailed-2" (EN2) في عينة البول، من شأنه أن يكون أكثر موثوقيَّة ودقَّة من الفحوصات التي تُجرَى حالياً.
«أظهرنا في هذه الدراسة، أن الفحص الجديد كان أفضل بمرتين في اكتشاف سرطان البروستات من الفحص القياسي بي إس إيه (Standard PSA). حيث إنه ندر وجود بروتين الإن2 (EN2) في عيّنات بول الرجال غير المصابين بالسرطان، لذلك إذا وجد البروتين إن2، نستطيع أن نكون متأكدين من أن الرجل مصاب بسرطان البروستات، وفي ذات اولقت فإن هذا البروتين لم يكتشف عند الرجال الذين يعانون من خللٍ في البروستات – غير السرطان - مثل الالتهاب أو الأورام الحميدة. كثيراً ما تسبّب هذه الحالات ارتفاعاً في نتيجة فحص البي إس إيه، مما يسبب توتراً للمريض، وفي بعض الأحيان يتسبب بإجراء المزيد من الفحوصات غير الضرورية مثل خزعات البروستات.[70]»
هناك أيضاً عدة فحوصات أخرى يمكن أن تستخدم لجمع معلومات أكثر حول البروستات والمسالك البولية. فهناك مثلاً الفحص الاصبعي للمستقيم (DRE)، الذي قد يسمح للطبيب باكتشاف أي شذوذٍ يطرأ على البروستات. وأيضاً فحص تنظير المثانة، الذي يعرض للطبيب المسالك البولية من داخل المثانة، وذلك باستخدام أنبوب رفيع مرن موصل بكاميرا يتم إدخاله إلى الإحليل. أما التصوير بالموجات الصوتية عبر المستقيم فيستخدم لتكوين صورةٍ للبروستات باستخدام الموجبات الصوتية الصادرة من مسبار يدخل في المستقيم.
تصوير البروستات
الموجات فوق الصوتية والرنين المغناطيسي هما وسيلتا التصوير المستخدمتان للكشف عن سرطان البروستات. يستخدم أطباء المستقيم والمسالك البولية الموجات فوق الصوتية للحصول على خزعة، ولكن مجال الرؤية فيها يكون أحياناً ناقص الصدى. كما أن الموجات فوق الصوتية لديها رؤية نسيجية ضعيفة، لذلك لا تستخدم سريرياً في الغالب. في المقابل، يتميَّز تصوير البروستات بالرنين المغناطيسي بالنسيج الرقيق العلوي. التصوير بالرنين المغناطيسي هو نوع من أنواع التصوير، يعتمد على المجالات المغناطيسية لتحديد وتمييز مكان سرطان البروستات، وتوجد منه أربعة أنواع هي: "تصوير T2 الموزون"، "وتصوير T2 الموزون"، و"التصوير الانتشاري الموزون"، و"تصوير الرنين المغناطيسي الطيفي"، و"تصوير التباين الديناميكي المعزز".[71] ويستخدم الأخصائيون أشعة الرنين المغناطيسي للتعرف على سرطان البروستات. وفي الغالب تستخدم وحدها لتحديد المنطقة الأفضل لأخذ الخزعة منها، وقد تستخدم - بالإضافة إليها - الموجات فوق الصوتية. وفي دراسة أجريت على عدد من الرجال المرشحين وجد الباحثون أن الرنين المغناطيسي اكتشف 33% من السرطانات، مقارنة بـ7% اكتشفت عن طريق الأشعة فوق الصوتية.[72] كما أنه يساعد في التخطيط الجراحي الذي يجرى للمرضى قبل عملية استئصال البروستات، إذ يمكنه تحسين تحديد طريقة إجراء الجراحة، فإمَّا يقوم الجراح باستئصال الحزم الوعائية العصبية، أو يُقرّر علاج حصر البول ومن ثم إعادة تقييم صعوبة الجراحة.[73] تعتقد بعض جماعات التوعية بسرطان البروستات أنه ينبغي استخدام الرنين المغناطيسي للكشف عن السرطان، كما هو الحال في الماموغرام ودوره في كشف سرطان الثدي. وتقوم الدراسات السريرية التي يجريها معهد الصحة الوطنية الأمريكية حالياً بدراسة تكاليف استخدام الرنين المغناطيسي في مثل هذه التطبيقات.[74]
الخزعة
- مقالة مفصلة: خزعة البروستات
إذا اشتُبِه بوجود سرطان البروستات عند أحد المرضى، يتم أخذ خزعة على وجه السرعة. حيث يقوم أخصائي المسالك البولية أو أخصائي الأشعة بأخذ عينة من أنسجة البروستات عن طريق المستقيم، فيتم إدخال المنظار وتستعمل إبرة مجوفة لإزالة ما يقدر بثلاثة إلى ستة إنشات من كل جانبٍ في البروستات في أقل من ثانية، وعادة يتم القيام بها كإجراء روتيني في العيادات الخارجية، إذ لا يتطلب هذا دخولاً أو تنويماً في المستشفى. وقد أوردت التقارير أنَّ ما نسبته خمسة وخمسون في المئة من الرجال يشعرون بعدم الراحة أثناء إجرائها.[75]
مقياس (نقاط) جليسون
- مقالة مفصلة: مقياس جليسون
يتم فحص عيّنات الأنسجة المأخوذة عن طريقة الخزعة بالمجهر للبحث عن الخلايا السرطانية وتقييم خواصّها المجهرية، التي يطلق عليها مقياس (نقاط) جليسون. مولد المضاد الغشائي للبروستات (PSA) هو عبارة عن إنزيم يُسمَّى الكاربوكسي بيبتيداز (Carboxypeptidase) مسؤول عن تنشيط إنزيم فوليت هيدرولاز ((Folate hydrolase). ويتمثل هذا البروتين في الأنسجة السرطانية في البروستات، وبالتالي يرتفع معدل نقاط جليسون.[36]
علامات الأورام
يتم صبغ عيّنات الأنسجة للكشف عن وجود مولّد المضاد الغشائي للبروستات (PSA) وعلامات الأورام الأخرى، من أجل تحديد منشأ الخلايا الخبيثة المنتشرة.[76]
يعتبر سرطان الخلايا الصغيرة أحد أنواع سرطان البروستات النادرة، ويشكل نسبة 1% من معدل الإصابات بالسرطان،[77] ولا يمكن اكتشافه بفحص مولد المضاد الغشائي للبروستات (PSA) المستعمل عادةً.[77][78] اعتباراً من عام 2009 بدأ الباحثون في البحث عن أفضل طريقة للكشف عن هذا النوع من سرطان البروستات، نظراً إلى قلَّة المعلومات عنه وعن مدى خطورته الشديدة وانتشاره السريع إلى كافَّة أجزاء الجسم.[78] من الطرق الممكنة للكشف عنه طريقة الفصل الكروماتوغرافي بمطياف الكتلة، أو فصل البروتينات عن طريق أجهزة الكشف عن الأجسام المضادة أو الأجسام المناعية. يعتمد هذا الاختبار على قياس كميَّة إحدى علامات الأورام المسماة "مثبط البروتين سي" (Protein C inhibitor) مع استخدام نقاط جليسون. لا تكمن ميزة هذا الاختبار في سرعته فقط، ولكن بحساسيّته وقدرته للكشف عن مرضى المنطقة الرمادية من التشخيص الذين يخلو مصلهم من مولدات المضاد الغشائية الخاصة بسرطان البروستات، ونسبتهم تعادل 10-20% من إجماليّ مرضى هذا السرطان.[79]
يرتبط وجود الأونكوبروتين (Oncoprotein) لخلايا بي الليمفاوية 2 (B-cell lymphoma2) مع تطور الأندروجين المستقلّ لسرطان البروستات، وذلك بسبب سرعة تمثيل الأندروجينات المستقلة للأورام في المراحل المتقدمة من المرض. عادة ما ينتج عن إزالة الأندروجين من خطوط خلايا سرطان البروستات في فئران التجارب المخصية تمثيل خلايا بي الليمفاوية 2، ويشير هذا إلى وجود علاقةٍ بينها وبين تطور سرطان البروستات.[80] وقد يكون اختبار وجود بروتين "Ki-67" بالطرق المناعية النسيجية الكيميائية (Immunohistochemistry) مؤشراً هامَّاً في التأكد من نتائج إصابة المريض بسرطان البروستات.[81]
الإي آر كي 5 (ERK5) هو عبارة عن بروتين آخر يمكن استخدامه كعلامةٍ من علامات الورم، حيث يوجد بمعدَّلاتٍ عاليةٍ في حالة سرطان البروستات، بما في ذلك السرطان الشرس الذي ينتشر في بقية أجزاء الجسم. كما يتواجد أيضاً في الحالات التي يتراجع فيها السرطان نتيجة العلاج عن طريق الهرمونات. وقد وجد الباحثون أن نقص معدل الإي آر كي5 في الخلايا السرطانية يُقلّل من قدرتها على الانتشار.[82]
التصنيف
- مقالة مفصلة: تصنيف سرطان البروستاتة
يعتبر تقييم سرطان البروستات أو تحديد مرحلته أو مدى انتشاره، جزءاً مهماً من تقييم السرطان، ومعرفة المرحلة يساعد على تحديد التشخيص ويُفِيد أثناء اختيار العلاجات المناسبة.
النظام الأكثر شيوعاً لعملية التصنيف هو نظام المراحل الأربعة تي إن إم، المختصر من الحروف الإنجليزية الأولى لكلمة ورم وعقد ونقائل، ويعتمد هذا النظام على قياس حجم الورم، وإحصاء عدد الغدد اللمفاوية المعنية، ووجود النقائل الاخرى.[83] الميزة الأهم التي يوفّرها نظام التصنيف هي ما إذا كان السرطان مقتصراً على البروستات أم لا. ففي نظام التي إن إم ذو الأربع مراحل، يظهر أن سرطانات تي 1 وتي 2 للسرطان توجد في البروستات فقط، بينما سرطانات تي 3 وتي 4 تنتشر في أماكن أخرى من الجسم.
وهناك عدة اختبارات يمكن استخدامها للكشف عن انتشار السرطان في الجسم، وتوصي المنظمات المهنية التخصصية الطبية بعدم استخدام المسح المقطعي البوزيتروني (PET SCAN) أو المسح المقطعي المحوسب (CT SCAN) أو مسح العظام أثناء تصنيف الطبيب لمرحلة مبكّرة من سرطان البروستات يحتمل وجود ورم خبيث فيها.[84][85] سوف تكون هذه الاختبارات مناسبةً في بعض الحالات، مثل التي يُقيّم فيها المسح المقطعي المحوسب انتشار السرطان في الحوض، أو يحدد فيها مسح العظم انتشاره إلى العظام، أو فحص الرنين المغناطيسي عن طريق المستقيم وتقييمه للكبسولة البروستاتية والحويصلات المنوية. فمسح العظم يجب أن يكشف عن ظهور خلايا عظمية نتيجةً لازدياد كثافة العظام في مناطق تواجد النقائل العظمية، وهذا على عكس العديد من السرطانات الأخرى ذات النقائل.
بعد إجراء خزعة البروستات، يفحص اختصاصي علم الأمراض العينات المأخوذة تحت المجهر، فإذا ما لوحظ وجود ورم سرطاني يُقرّر المختص درجة الورم. وهذه الدرجة تُبيّن مدى اختلاف أنسجة الورم عن أنسجة البروستات الطبيعية، وتضع تصوُّراً لسرعة نموّه. ويستخدم نظام جليسون لتقييم درجات أورام البروستات على مقياسٍ من 2 إلى 10، حيث الدرجة 10 في هذا النظام تشير إلى الحالة الأكثر اختلالاً. ثم يُعيّن اختصاصي علم الأمراض رقما من 1 إلى 5 للنمط الأكثر شيوعاً الذي لوحظ تحت المجهر، ويكرر ذلك على النمط الثاني الأكثر شيوعاً. ومجموع هذين الرَّقمين هو درجة غليسون. وهنالك طريقة أخرى تستخدم في بعض الأحيان تسمى نظام إيتمور-جيويت (Whitmore-Jewett stage).
الوقاية
هناك علاقة معتبرة بين أسلوب الحياة (شاملاً النظام الغذائي) والوقاية من السرطان.[86] في ضوء النظرة إلى الدهون المشبعة، من المحتمل أنَّ لها علاقة بزيادة مخاطر الإصابة.[86][87] فيما أن الأحماض الدهنية وأوميغا 3 ليست لها أي مخاطر أو تأثير على السرطان.[86][88] ربَّما يخفض تناول الأسماك من معدل الموت بسبب سرطان البروستات، إلا إنَّ تأثيره على الإصابة بالسرطان من الأساس غير واضح.[89] وتدعم بعض الأدلة أن الوجبات النباتية الخالية من اللحوم تُخفّض من معدل الإصابة بسرطان البروستات.[90]
النظام الغذائي
من المستحسن أن يحافظ الناس على نظام غذائي يحد من استهلاك الأطعمة والمشروبات السكرية الكثيفة، واللحوم الحمراء والمصنعة، والكحول، بينما يزيد من تناول الطعام النباتي. تؤيّد بعض الأدلة اتّباع نظام غذائي نباتي أو حمية نباتية. وقد تساهم الدهون المتحولة في زيادة خطر الإصابة بالسرطان، ولكن الأدلة ما زالت محدودة.
قد يقلل القذف على نحو أكثر تواتراً أيضاً من خطر إصابة الرجل بسرطان البروستات. أظهرت إحدى الدراسات أن الرجل الذي يقذف بين 3-5 مرات في الأسبوع في سن 15-19 سنة، سيقلّ معدل إصابته بسرطان البروستات عندما يصبح في سن متقدم، وذلك على الرغم من أن بعض الدراسات الأخرى أظهرت - على العكس - عدم وجود فائدة أو أثرٍ للقذف على الإصابة بالمرض.[91][92] وتظلُّ الأدلة على هذه الظاهرة ضعيفة.[93] المعلومات التي تربط التغذية بسرطان البروستاتا ضعيفة.[86][94] في ضوء هذا يرتبط معدل الإصابة بسرطان البروستاتا باتباع النظام الغذائي الغربي.[86][95] وهناك أدلة قليلة تدعم وجود ارتباط بين الدهون المشبعة والغير مشبعة وكذلك تناول الكربوهيدرات وخطر الإصابة بسرطان البروستاتا.[86][96] الأدلة بشأن دور أحماض أوميغا 3 الدهنية في الوقاية من سرطان البروستاتا لا تشير إلى أنها تقلل من خطر الإصابة به، إلا أن هناك حاجة لبحوث إضافية.[86][97] ويبدو أن مكملات الفيتامينات ليس لها تأثير على السرطان، ولكن بعضها قد يسبب زيادة خطر الإصابة به،[98] وتناول كميات كبيرة من الكالسيوم يرتبط بسرطان البروستاتا المتقدم.[99] ربما يخفض تناول الأسماك من معدل الوفيات الناتجة عن سرطان البروستاتا ولكن لا يظهر له أي تأثير على إمكانية الإصابة بالسرطان.[100] وبعض الأدلة تدعم وجود معدلات منخفضة من سرطان البروستاتا مع اتباع النظام الغذائي النباتي.(91) هناك بعض الأدلة الأولية للأطعمة التي تحتوي على الليكوبين والسيلينيوم.[101] النظام الغذائي الغني بالخضروات، والصويا، والفول والبقوليات الأخرى يرتبط مع خطر أقل للإصابة بسرطان البروستاتا خاصة السرطانات المتقدمة.[92] الرجال الذين يمارسون الرياضة بانتظام قد يقل لديهم خطر الإصابة بشكل طفيف.خاصة التمارين الحركية النشيطة ، تقلل خطر السرطانات المتقدمة خصوصا.
الأدوية
بالنسبة للأشخاص الذين يجرون دورياً فحص "5-alpha-reductase inhibitor" بكلا نوعيه، فإنَّ خطر الإصابة بسرطان البروستات يون أقلّ, لكن على أية حال، لا توجد بعد معلومات كافية للحكم بما إذا كان لهذا أثر على خطر الموت لدى مرضى السرطان.[102]
هناك علاجان يقومان بمنع تحول هرمون التوستيرون إلى ديهادروتوستيرون وهما الفيناستيرايدو (finasteride) والدوتاستيرايد (dutasteride)، وقد أظهرت هذه الأدوية بعض النتائج الواعدة. لا يزال استخدام هذه العلاجات في الوقاية من سرطان البروستات قيد البحث، وهي لا تستخدم بكثرة بعد لهذا الغرض. أظهرت دراسة في عام 2008 أن استخدام الفيناستيرايد قلَّل من احتمال الإصابة بسرطان البروستات بنسبة 30%، بدون أي خطر من الإصابة بسرطان البروستات من الدرجة العالية. في الدراسة الأساسية، اتَّضح أن حجم البروستات المصغر الناتج عن عقار الفيناستيرايد معناه أن هناك إمكانية أكبر لأن يتمكن الأطباء من تحديد مكان التجمع السرطاني وإيجاد الخلايا التي تبدو عنيفة. من الممكن أيضاً لتناول مثبطات الاختزال 5 -ألفا (5-alpha-reductase inhibitors-ARIs) أن يقلل من نسب الإصابة بسرطان البروستات من حوالي 5-9% إلى حوالي 4-6% خلال 7 سنوات من العلاج.
الفحوصات
فحوصات سرطان البروستات هي عبارةٌ عن محاولاتٍ لإيجاد سرطانات غير متصورة أو متوقعة، وقد تؤدي إلى فحوصات أخرى مترتبة عليها مثل الخزعة، حيث تؤخذ عينة من الخلايا لتحليلها ودراستها. تتضمَّن الوسائل المتاحة الفحص الشرجي الرقمي (DRE) بالإضافة إلى فحص الدم الجيني الخاص بالبروستات (PSA). لا زالت هذه الفحوصات مثيرة للجدل، وقد تؤدي عند البعض إلى أعراض مؤلمة وخطرةٍ في بعض الأحيان.[103] الفحوصات الروتينية التي تستعمل أيّ من هاتين الطريقتين ليست مؤيدة بأي أدلة علمية، حيث أنه لا يوجد تأثير إيجابي لها لخفض معدل الوفيات جرَّاء الإصابة بالمرض.[7]
لا تنصح القوات الأمريكية الخاصة للخدمات الوقائية (USPSTF) بفحص البي إس إيه لتشخيص سرطان البروستات للرجال الأصحَّاء، بغضّ النظر عن العمر،[104] وقد استنتجت أن المنافع المرجوَّة من الفحوصات لا تفوق المخاطر المحتملة: «لم يثبت أن الفحوصات الجينية الخاصة بسرطان البروستات أدت لتقليل نسبة الوفيات من المرض، كما أن لهذه الفحوصات آثاراً جانبية مؤذية مرتبطة بالعلاج قد تكون غير ضرورية».[8][105] وقد أيَّد مراكز مكافحة الأمراض واتقائها هذه النتائج.[106] اقترحت الجمعية الأمريكية لعلم الأورام السريري (ASCO) عدم الحثّ على إجراء الفحوصات لمن يُتوقَّع أن يعيشوا عشر سنواتٍ أو أقل، في حين إذا كان من المتوقع أن يعيش الشخص لمدَّةٍ أطول فيجب أن يتم اتخاذ القرار عن طريق مناقشة الشخص المعنيّ بطرح الميزات والمساوئ للفحص والعلاج.[107] وعموما، وبالاعتماد على الأبحاث السابقة تم استنتاج أنه: " غير مؤكد ما إذا كانت المنافع المرجوة من فحص الأنتيجين الخاص بالبروستاتا للكشف عن سرطان البروستاتا تستحق الأضرار الناتجة أو المترتبة على هذا الفحص والتي يترتب عليها علاجات غير ضرورية.[108] ودعت الجمعية الأمريكية للمسالك البولية إلى الموازنة بين منافع منع الوفاة من سرطان البروستاتا في رجل من كل 1000 رجل يخضع للفحص في فترة زمنية تتجاوز عشر سنوات وبين الأضرار المترتبة على الفحص والعلاج. وأوصت هذه الجمعية أيضا باتخاذ قرار الفحص للأشخاص الذين في العمر من 55 إلى 69 سنة مع مشاركة هؤلاء الأشخاص في اتخاذ هذا القرار. وفي حال تم إجراء هذه الفحوصات يجب ألا تجرى أكثر من مرة كل سنتين.[109]
علاج سرطان البروستات
أول قرار يتخذ لعلاج سرطان البروستاتا هو تحديد إذا ما يحتاج المريض إلى علاج أصلاً. حيث أن سرطان البروستاتا - خاصة النوع الشائع منه - من الأشكال منخفضة الدرجة ويشخص به المرضى كبار السن ويتطور غالبا ببطء ولا يتطلب علاجا [110]، ويموت الشخص من أسباب أخرى. وقد يكون العلاج غير مناسب أو غير ممكن إذا كان لدى المريض مشاكل صحية خطيرة تمنع العلاج أو لا يتوقع أن يعيش مدة كافية لظهور الأعراض. في هؤلاء الأشخاص يقوم الأطباء بما يسمى المراقبة التوقعية أو الفاعلة [110]، حيث يتم متابعة المريض بشكل دوري، والتدخل فقط عندما يبرز أدلة تدل على تطور المرض.
ويعتمد تحديد الخيار الأفضل بين العلاج أم المراقبة الفاعلة على مرحلة المرض ومقياس جليسون و مستوى المستضد البروستاتي النوعي PSA. كما يعتبر السن والصحة العامة وتصوّر المريض للعلاج المحتمل وآثاره الجانبية من العوامل المهمة أيضاً في قرار العلاج. ولأن كل العلاجات لها آثار جانبية كبيرة مثل عدم القدرة على الانتصاب و سلس البول؛ خاصةً سلس الإجهاد، تركز المشاورات بشأن العلاج على تحقيق التوازن بين أهداف العلاج ومخاطر تغيير نمط الحياة.
ويستطيع المريض أيضا تعبئة استبيان الثمانية عشر بندا الموضوع حديثا لمعرفة ما إذا كان لديه معرفة جيدة وفهمه خيارات العلاج قبل اختيار أحدها. و لكن معظم المرضى المشخصين حديثا الذين اختاروا فعلا أحد الخيارات العلاجية لم يتمكنوا من الإجابة بشكل صحيح على أكثر من نصف الأسئلة.[111]
الغالبية العظمى من الحالات لازالت تشخص للرجال الأكبر من 65 عام، وتقريباً 25% من الحالات هي للرجال الأكبر من 75 عام. توجيهات الشبكة الوطنية العامة لسرطان البروستات في الولايات المتحدة أوصت باستخدام متوسط العمر المتوقع أكبر من وأقل من 10 سنوات للمساعدة في اتخاذ قرارات المعالجة؛ عملياً فإن العديد من المرضى الأكبر سناً لم تعرض لهم خيارات علاج شفائية مثل الاستئصال الجذري لغدة البروستاتا (RP) أو المعالجية بالإشعاع ويتم التعامل بدلاً من ذلك بالعلاج الهروموني أو الانتظار اليقظ (المراقبة الفاعلة). كما أن متوسط العمر المتوقع يزيد بسبب التطورات في معالجة القلب الأوعية الدموية والمعالجة الرئوية وأمراض أخرى مزمنة. وعلى الأرجح أن أكثر المرضى من كبار السن سوف يعيشون حياة طويلة كافية ليتحملوا الآثار من مرضهم بسرطان البروستات؛ بسبب ذلك يوجد حالياً الكثير من الاهتمام بوسائل علاج انتشار سرطان البروستات مثل الجراحة أو بالإشعاع لكبار السن الذي لديهم مرض متمركز. عندما يكون السرطان مقتصر على غدة البروستات (غير منتشر لأجزاء أخرى من الجسم) فإنه من غير المعروف ما إذا كان استئصال البروستاتا أفضل أو أسوأ من الانتظار اليقظ.[112]
المراقبة الفاعلة
العديد من الرجال والذين تم تشخيصهم باحتمالية قليلة لاصابتهم بسرطان البروستات يجب مراقبتهم بشكل فاعل. وهذا المصطلح معناه الملاحظة الدقيقة للورم مع مرور الوقت، بنية المعالجة في حال ظهور أي ورم سرطاني. المراقبة الفاعلة تعني مراقبة الورم لأي علامة لنموه أو ظهور الأعراض. قد تحتوي عملية الترصد على تسلسل فحوصات المستضد البروستاتي النوعي PSA، أو فحص بدني للبروستاتا، أو فحص النسيج الجسدي بشكل دوري عند الطبيب [113]. الهدف من الترصد النشط هو تجنب العلاج الزائد، وأحياناً تجنب للأعراض الجانبية المزمنة والجدية لعلاج ورم لا يشكل خطورة على المريض في حالات أن الورم بطيء النمو، أو محدود النمو ذاتياً. هذا النهج لا يستخدم للسرطانات العدوانية، وقد يسبب خوف وقلق للمرضى اللذين يعتقدون أن كل السرطانات قاتلة، أو أن ورمهم بهدد حياتهم. بالنسبة لـ 50% إلى 75% المصابين بسرطان البروستاتا، لا يشكل السرطان أي أذى للرجل، المراقبة الفاعلة أو الترصد النشط قد يكون أجدى الخيارات [114].
بسبب فحص المستضد البروستاتي النوعي (PSA)، حوالي 90% من المرضى يتم تشخيص حالاتهم باكراً، حيث يتمركز السرطان في غدة البروستاتا ولا ينتشر، ويتم استئصال البروستات بواسطة عملية جراحية أو بالمعالجة بالإشعاع، وتؤول معظم الحالات إلى النجاح والشفاء. لذلك، حوالي 94% من المرضى الأمريكيين يرغبون بالمعالجة، ومع ذلك 50-70% من هؤلاء المرضى لم ولن يؤثر السرطان على حياتهم حتى لو ظلوا بدون معالجة؛ وبموافقتهم على العلاجهم يجازفون بحياتهم الجنسية ووظائفهم البولية والعوارض الجانبية الأخرى للعلاج . فعلى سبيل المثال ، ثلثي المرضى المعالجين لا يستطيعون الحصول على انتصاب كاف للعضو الذكري خلال العملية الجنسية؛ والثلث الآخر أغلبهم لديهم مشاكل في التسرب البولي.
العلاج
يوجد الكثير من الخيارات العلاجية الجراحية وغير الجراحية لسرطان البروستات، ولكن قد يكون العلاج صعباً، ويتطلب استخدام أكثر من طريقة سوياً. علاج سرطان البروستاتا يقتضي الجراحة (عملية استئصال البروستات)، والعلاج الإشعاعي الموضعي (prostate brachytherapy)، والعلاج الإشعاعي الخارجي المتذبذب، وموجات الصوتية عالية الكثافة (HIFU)، والعلاج الكيميائي، و مخدرات العلاج الكيميائي الفمي (Temozolomide/TMZ)، والتجميد، والعلاج الهرموني، أو تجميع بعض العلاجات [115].
العلاجات المتاحة للمرضى الذين لايزال السرطان ضمن البروستات " غير منتشر" بشكل عام هي هي الانتظار مع المراقبة الحذرة / المراقبة النشطة، العلاج الإشعاعي بالإشعاع الخارجي، العلاج الإشعاعي الموضعي، التجميد، HIFU، والجراحة. وغالبا ما يتم التحفظ على العلاج الهرموني والعلاج الكيميائي للمرضى الذين انتشر السرطان فيهم لخارج البروستات. ومع ذلك، هناك استثناءات: يمكن استخدام العلاج الإشعاعي لبعض الأورام المتقدمة، كما يمكن أن يستخدم العلاج الهرموني لبعض الأورام في مرحلة مبكرة.[116] ويمكن أيضا العلاج بالتبريد (عملية تجميد الورم)، ويمكن أن يقدم للمريض العلاج الهرموني، والعلاج الكيميائي إذا فشل العلاج المبدئي وكان السرطان في تقدم. تم اكتشاف لقاح يدعى "sipuleucel-T"، وجد أنه يحقق فائدة [117].
حينما يجرى العلاج الإشعاعي أولا ويفشل؛ فإن عملية استئصال البروستات تعتبر عملية صعبة فنيا وربما تكون غير ممكنة. ومن الناحية الأخرى، فإن القيام بالعلاج الإشعاعي بعد عملية استئصال فاشلة يحتمل مضاعفات عديدة. [118]
العلاج الغير جراحي
يتضمن العلاج الغير جراحي العلاج الإشعاعي الموضعي (prostate brachytherapy)، والعلاج الإشعاعي الخارجي المتذبذب، والموجات الصوتية عالية الكثافة (HIFU)، والعلاج الكيميائي، والعلاج الكيميائي الفمي (Temozolomide/TMZ)، والتجميد، والعلاج الهرموني، وقد يحتوي أكثر من واحد من هؤلاء. معظم أنواع السرطان المعتمدة على العلاج بالهرمونات تسترجع نشاطها خلال فترة 1-3 سنوات على الرغم من الاستمرار في عملية العلاج. يطلق على هذا النوع مسمى السرطان المقاوم للإخصاء (CRPC) وذلك لعدم استجابته للعلاج الإخصائي (الحد من انتاج هرمون الأندروجين، التستسترون، DHT وذلك عن طريق الطرق الكيميائية أو الجراحية) فهذا النوع من السرطان مازال يظهر نوع من الاعتماد على الهرمونات لتنشيط مستقبلات الأندروجين. ومع ذلك، هنالك اليوم العديد من العقارات المتوفرة لعلاج هذا النوع من السرطان والتي تساعد على اطالة مدة البقاء.
تم استخدام عقار الدوسيتاكسل (docetaxel) كعلاج كيميائي لسرطان البروستات المقاوم للإخصاء والذي يساعد على البقاء بمتوسط 2-3 أشهر [119][120] وقد كان أول عقار ينال ترخيص منظمة الغذاء والدواء الأمريكية في عام 2004 والذي ثبت إطالته لمدة البقاء على قيد الحياة. وفي عام 2010 وافقت منظمة الغذاء والدواء الأمريكية أيضا على خط ثاني للعلاج الكيميائي يسمى كابازيتاكسل وبغض النظر عن استخدام عقار الكيتوكونازول (ketoconazole) عن طريق الفم لعلاج أمراض الفطريات فهو يستخدم أحيانا كوسيلة للتلاعب بالهرمونات ذات الأثر العلاجي لسرطان البروستات المقاوم للإخصاء ولكن يظل له بعض الآثار الجانبية ولذلك يفضل أن يستخدم عقار أبيراتيرون (abiraterone) كبديل له نظرا لتميزه بنفس خاصية العمل مع آثار جانبية أقل سمية. وبإستخدام مزيج من كل من بيفاسيزوماب (bevacizumab) والمعروف تجاريا باسم أفاستين (Avastin) مع دوسيتاكسل (docetaxel) و ثاليدومايد (thalidomide) و بريدنيزون(prednisone) يبدو أنه فعال في علاج سرطان البروستات المقاوم للإخصاء [121] وكذلك العلاج بـ سيبيلوكال تي sipuleucel-T ويطيل معدل البقاء على قيد الحياة بمتوسط 4-1 أشهر.[122] الخط الثاني في العلاج الهرموني (abiraterone) (Zytiga) أكمل مرحلته التجريبية الثالثة المرضى الذين لديهم سرطان بروستات مقاوم للخصي وفشلوا في العلاج الكيميائي في عام 2010. وكانت النتائج إيجابية مع ارتفاع معدل النجاة بالإجمال بنسبة 4.6 أشهر مقارنة مع الدواء الوهمي. في 28 أبريل 2011، صدقت منظمة الغذاء والدواء الأمريكية على استخدام (acetate abiraterone) مع تركيبة مع بريدنيزون لعلاج المرضى الذين يعانون من المرحلة المتأخرة (المنتشر) ولديهم سرطان البروستاتا المقاوم للخصي واللذين تلقوا علاج (docetaxel) "علاج الكيميائي" من قبل. (Enzalutamide) هو علاج آخر من الخط الثاني في العلاجات الهرمونية صدق عليه في أغسطس 2012 من قبل إدارة الأغذية والعقاقير في الولايات المتحدة. أظهرت نتائج المرحلة التجريبه الثالثة له في المرضى الذين يعانون من سرطان البروستات المقاوم للخصي بعدما فشل العلاج الكيميائي معهم أثبتت النتائج نسبه بقاء على قيد الحياة لأكثر من 5 أشهر مقارنه بالعلاج الوهمي. وحاليا كل من (abiraterone) و(enzalutamide) يجري اختبارها في التجارب السريرية مع المرضى ذوي سرطان بروستات مقاوم للخصي الذين لم يتلقوا العلاج الكيميائي سابقا.[123][124]
الآن لوحظ أن مجموعة فرعية فقط من المرضى استجابو لأدوية تمنع الاشارات الخليويه الاندروجينيه وخلايا معينة ذات خصائص تشبه الخلايا الجذعية لم تتأثر [125][126]. لذلك الرغبة في تحسين نتائج المرضى الذين يعانون من سرطان البروستات المقاوم للخصي أدت إلى المطالبة بجرعات إضافية أو زيادة الدمج بين العلاجات التي تعطي نتائج مضاعفه في النتيجة كدمج أدوية منع الإشارات الخليوية الاندروجينية. ولكن حتى هذه العلاجات المركبة أو المدمجة لا تؤثر على الخلايا-مثل-الجذعية ،لأنه لا تظهر إشارات خليوية اندروجينية .
من الوسائل الممكن جدا أن تحرز المزيد من التقدم في العلاج بشكل مثالي أن يتم دمج عوامل مانعة للإشارات الخليوية الاندروجينية مع خلايا شبه جذعية موجهه للتمايز العلاجي . [127]
العلاج الجراحي
- إستئصال البروستات الجذري يعتبر الركن الأساس في العلاج الجراحي لسرطان البروستات، حيث يزيل الجراح البروستات، الحويصلات المنوية، والغدد اللمفاوية المحيطة. يمكن القيم بهذه العملية عبر جراحة التنظير أو من خلال الجراحة التقليدية (عبر شق في أسفل البطن). الجراحة بمساعدة الروبوت أصبحت مؤخراً إحدى الطرق الأكثر إستخداماً في بعض البلدان أيضاً [128]. في إحدى الدراسات التي أقيمت على رجال يعانون من سرطان البروستات الغير منتشر، وجد الأطباء أن مدة البقاء في المستشفى والحاجة إلى نقل الدم كانت أقل في هؤلاء الذين خضعوا للجراحة التنظيرية أو بالروبوت مقابل هؤلاء الذين خضعوا للجراحة التقليدية [129]. بالرغم من هذا، ما زال من غير المعروف أي من هذه الطرق هي الأفضل في زيادة العمر وتقليل احتمال عودة المرض [129].
- إستئصال البروستات عبر الإحليل هي العملية الجراحية الأساسية لمعالجة التضخم الحميد للبروستات [128]. في سرطان البروستات، يمكن الاستعانة بهذه العملية الجراحية لعلاج العوارض كانسداد مجرى البول (الإحليل) الذي قد يسبب حصر البول. لا تقوم هذه الجراحة بعلاج السرطان بنفسه، انما الانسداد فقط. تتم العملية عبر إدخال منظار المثانة عبر القضيب وقص البروستات لفتح مجرى البول.
مضاعفات العلاج
المضاعفات الأساسية لعلاج سرطان البروستات الجراحي أو الشعاعي هما ضعف الإنتصاب (عنانة)، والسلس البولي، خاصةً الإجهادي. أغلب الرجال يتحسنون خلال فترة 6 إلى 12 شهر، لذلك قد يؤجل الأطباء علاج هذه المشاكل إلى ما بعد السنة [130].
- السلس البولي يحصل عادةً بعد جراحة البروستات أو العلاج بالأشعة لعدة أسباب، كالتلف الذي يصيب العضلة المصرة للإحليل التي تغلق المثانة أو الأعصاب أو الأنسجة المحيطة [131]. العلاج الأولي يتضمن تمرين المثانة، تغييرات حياتية، تمارين كيجل، واستخدم الفوط الصحية. أما العلاج الجراحي فيتضمن استخدام المعلاق الإحليلي أو المصرة البولية الصناعية، وهو جهاز ميكانيكي يقوم بمحاكاة وظيفة العضلة المصرة للإحليل، حيث يتم تفعيل هذه العاصرة يدويا من قبل المريض عبر الضغط على زر يتم زراعته في الصفن. تعتبر هذه المصرة الاصطناعية العلاج الأفضل للسلس البولي المتوسط والحاد في الرجال الذين خضعوا لجراحة البروستات [132].
- ضعف الانتصاب أو العنانة قد يحصل بدرجات مختلفة في أغلب الرجال الذين يخضعون لجراحة البروستات أو العلاج الشعاعي للبروستات. بالرغم من ذلك، يتحسن الانتصاب خلال سنة في أغلب الرجال، إلا في حال حصول ضرر دائم في أعصاب الحوض. تتضمن العلاجات الدوائية مثبطات ال PDE-5 مثل الفياجرا أو السياليس، أو الأدوية التي تحقن مباشرةً في القضيب (البروستاجلاندين E1، أو الأدوية التي تعمل على الأوعية الدموية). العلاجات الإخرى تتضمن دعّامات القضيب (بدلة قضيبية) التي تزرع جراحياً، أو الأجهزة الفراغية. [133]
نظام التصنيف
سرطان البروستاتا في كثير من أنواعه لا يعدّ قاتلا بحد ذاته، وغالبا ما يموت العديد من المصابين به نتيجة أسباب أخرى وليس نتيجة المرض ذاته. قرارات العلاج والوقت المحدد تحدد بناء على تقدير مخاطر الورم بعد العلاج ومدى قابليته للانتشار وتسببه بالوفاة.
تساعد عدة عوامل في توقع نتائج المرض مثل مراحل المرض وتكراره بعد الجراحة أو العلاج الإشعاعي. وبالإضافة لذلك، فإن الرتب ومستوى المولد المضاد الخاص (PSA)، وبإضافة عدد أو نسب ايجابية من العينات، والعمر وبعض المعلومات الأخرى، كلها تساعد في سرعة تقدير نتائج المرض.
-تصنيف اميكو (D'Amico) يقسم على أساس انخفاض ، توسط ، أو ارتفاع المخاطر، معتمد على المرحلة، الرتبة ومستوى (PSA). يستخدم هذا التصنيف بتوسع في العمل السريري وإعدادات البحوث. الجانب السلبي الرئيسي في نظام المستوى الثالث 3-level) system) أنه لايأخذ في الحسبان القياسات المتعددة السلبية مثل :ارتفاع مستوى الغيلسون ومستوى (PSA) (e.g., high Gleason score and high PSA) في المرضى المقسمين.
-جداول بارتين Partin tables : تنبأ بالنتائج المرضية (الهوامش، تمدد المرض خارج البروستات والتأثير على الحويصلات المنوية) يعتمد على نفس المتغيرات الثلاثة وجداول البحث.
-مخططات قطان Kattan nomogramS :تنبأ بتكرار المرض بعد إجراء الجراحة و/أو العلاج الإشعاعي، يعتمد على البيانات المتاحة سواء أثناء التشخيص أو بعد العلاج. هذه المخططات قادرة على الحساب باستخدام اوراق الرسوم البيانية المتاحة أو مواقع الانترنت أو أجهزة الكمبيوتر المحمولة.
-نتيجة جامعتي كالفورنيا وسان فرانسيسكو لتقدير مخاطر سرطان البروستات (CAPRA): تقدّر كلا الحالة المرضية والتكرار بعد الجراحة، وتوفر مقارنة دقيقة قبل إجراء الجراحة كما هو موجود في مخططات قطان. تستطيع الحساب بدون استخدام الحاسبة أو جداول الورق. يتم تعيين النقطة اعتمادا على PSA ، الرتبة، المرحلة ، العمر ونسبة العينات الإيجابية; مجموع نقاط من 0-10 مع كل نقطتين تمثل مضاعفة خطر تكرار المرض.
نقاط كابرا CAPRA score: المشتقة من قاعدة البيانات المجتمعية من قاعدة بيانات CaPSURE، وقد تم التحقق منها على مستوى 10.000 مريض مستأصل للبروستات، تتضمن مرضى من CaPSURE;[134]
تسجيل البحث تم من إدارة المحاربين القدامى والعديد من المراكز الطبية العسكرية [135]; النشطة ولفيف متعدد من المؤسسات في ألمانيا [136]; ومجموعة من المستأصلين للبروستات في جامعة جون هوكنز.[137]
في الآونة الأخيرة قدرت العديد من الوفيات وانتشار المرض بعد استئصال البروستات والعلاج الإشعاعي ، الانتظار اليقظ والعلاج المعتمد على الحرمان من الاندروجين.[138]
اعتباراً من عام 2011 أعتبر سرطان البروستاتا ثاني أكثر أنواع السرطان شيوعاً ، وشخص بأنه السبب السادس للوفاة بالسرطان عند الذكور في جميع أنحاء العالم.[139] معدلات انتشار سرطان البروستاتا تختلف على نطاق واسع في جميع أنحاء العالم فهو أقل شيوعاً في جنوب وشرق آسيا، وأكثر شيوعاً في أوروبا والولايات المتحدة.[4] وفقا لإحصائيات جمعية السرطان الأمريكية، سرطان البروستاتا يكون أقل شيوعاً بين الرجال الآسيويين، ويكون أكثر شيوعاً بين الرجال السود، بينما بين الرجال البيض يكون في [140][141] وكان متوسط معدل الإصابة السنوية بسرطان البروستاتا بين عامين 1988و 1992بين الرجال الصينين الذين يعيشون في الولايات المتحدة أعلى 15 مره من نظرائهم الذين يعيشون في شانغهاي وتيانجين.[140][141][142] ومع ذلك قد تتأثر هذه المعدلات المرتفعة من خلال زيادة معدلات الكشف.[143] وتشير إلى إن معدلات سرطان البروستاتا قد تكون قيد المبلغ عنها، وبعد حدوث BPH اصبحت المعدلات في الصين واليابان تشبه المعدلات في الدول الغربية [144][145] سرطان البروستاتا لدى الرجال تطور بأكثر من خمسين بالمئة. وفي عام 2008 في الولايات المتحدة كان هناك 186000 حالة مصابة بالسرطان ووفاة 28600 شخص بسبب هذا المرض.[146] وهو السبب الرئيسي الثاني لوفيات السرطان في الرجال بعد سرطان الرئة، حيث يتم تشخيص حوالي 35000 حالة كل عام 10000 منها تموت بسببه، وقد تسببت عدة عوامل منها علم الوراثة والنظام الغذائي في تطور سرطان البروستاتا، وسرطان البروستاتا يمكن منعه بطريقة ابتدائية باستخدام (فينا ستريد ) حيث يقلل من حدوثه بنسبة 30٪ ، وكان هناك أيضاً جدل حول هذا حيث أنه يزيد من خطر الإصابة بالسرطان ، إلا أن الأبحاث الأخيرة أظهرت عكس ذلك.[147][148] أكثر من 80 ٪ من الرجال المصابين بهذا النوع من السرطان كانوا في سن الثمانين.[149] ومع ذلك في معظم الحالات يكون بطئ النمو، وتشخيص سرطان البروستاتا ( over diagnosis) والعلاج في مثل هؤلاء الرجال يعرضهم لمجموعه من الآثار الضارة، مع عدم وجود إمكانية لتمديد حياتهم.[150]
وعلى الرغم من الوصف الأول للبروستاتا الذي كان بواسطة ( Venetian anatomist Niccolò ) في عام 1536 ، ويتضح أيضاً من تشريح ( Flemish anatomist Andreas ) في عام 1538، سرطان البروستاتا لم يعرف هويته حتى عام 1538 ، [151] واعتبر سرطان البروستاتا مرض نادر، وعلى الأرجح كان ذلك بسبب قصر حياة المصابين به ولأن أساليب الكشف عنه كانت قليلة جداً في القرن التاسع عشر، كانت العلاجات الأولى لسرطان البروستاتا عملية جراحية لتخفيف انسداد المسالك البولية.[152] وكانت أول إزالة للغدة بالكامل بواسطة (radical perinealprostatectomy) في عام 1904 من قبل ( H Hugh Young ) في مستشفى (Johns Hopkins Hospital) .[153] كان أول استئصال جراحي للخصيتين ( استئصال الخصية ) لعلاج سرطان البروستاتا في عام 1890s، ولكن مع نجاح محدود. استبدال استئصال البروستاتا عبر الإحليل من (TURP) واستئصال البروستاتا كان لتخفيف أعراض الانسداد في منتصف القرن العشرين لأنه يمكن الحفاظ على وظيفة انتصاب القضيب بشكل أفضل. وقد كان استئصال البروستاتا الجذري خلف العانة عام 1983 بواسطة ( Patrick Walsh) . ،[154] واستخدموا في هذا شبكات اتصال لاستئصال البروستاتا والغدد اللمفاوية مع الحفاظ على وظيفة القضيب.
في عام 1941 ( Charles B. Huggins ) نشر دراسات عن هرمون الاستروجين التي استخدمها لمعارضة إنتاج هرمون تستوستيرون لدى الرجال المصابين بسرطان البروستاتا النقيلي. فاز هذا الاكتشاف بجائزة نوبل عام 1966 في الفسيولوجيا أو الطب.[155] وتم تحديد دور هرمون موجه للغدد التناسلية لإفراز (GnRH ) في الإنجاب عن طريق اندريه. شالي وروجر جيومان ( Schally and Roger Guillemi) اللذين فازا عام 1977 بجائزة نوبل في الفسيولوجيا أو الطب. وقد وضعت في وقت لاحق مستقبلات (GnRH) مثل يوبروليد وجوسيريلين (leuprolide and goserelin) وتستخدم لعلاج سرطان البروستاتا.[156][157] كان أول من طور العلاج الإشعاعي لسرطان البروستاتا في أوائل القرن العشرين وتألف في البداية من زرع الراديوم داخل البروستاتا، وأصبح العلاج بالإشعاع الخارجي أكثر شعبية وأقوى ( الأشعة السينية ) أصبحت متاحة في منتصف القرن العشرين. وكان أول وصف للعلاج الإشعاعي الموضعي مع البذور المزروعة لسرطان البروستاتا في عام 1983.[158] كان أول درس للعلاج الكيميائي النظامي لسرطان البروستاتا في عام 1970. وسرعان ما انضم الأولي لنظام ( cyclophosphamide and 5-fluorouracil) على عدة نظم متعددة باستخدام مجموعة أخرى من أدوية العلاج الكيميائي النظامية.[159]
خلية من خلايا المنشأ
نشرت مجلة science سلسلة من الدراسات شملت فيروسات يعرف بأنها مسببة لتحولات سرطانية في خلايا البروستاتا، حيث حُولت AKT و ERG و AR إلى عينات معزولة من الخلايا اللمعية والقاعدية، وزرعت الانسجة المعالجة في الفئران، وبعد 16 اسبوعا، لم تخضع أيا من العينات اللمعية على تحولات خبيثة، في حين تحولت العينات القاعدية إلى أنابيب تشبه البروستاتا، والتي تطورت بعد ذلك إلى خلايا خبيثة وشكلت أوراما سرطانية، والتي ظهرت مطابقة للعينات البشرية تحت التكبير، وهذا يقودنا إلى نهاية مفادها أن خلايا البروستاتا القاعدية قد تكون موقع المنشأ لسرطان البروستاتا.[21]
يصادف المصابين بسرطان البروستاتا بشكل عام فروقات مهمة في التعريف، والتمويل، والتغطية الإعلامية، انتشار البحث، ولذلك يحصلون على معاملة أدنى ونتائج أقل جودة، مقارنة بسرطانات أخرى تعادلها [160] "ذا غارديان" أن نشرت 2001 بان 3000 ممرضة في بريطانيا تخصصت في مجال سرطان الثدي مقابل شخص واحد في سرطان البروستاتا، كما كشفت أن وقت الانتظار بين الإحالة والتشخيص بالنسبة لسرطان الثدي إسبوعين فقط، في حين يصل إلى ثلاثة أشهر بالنسبة لسرطان البروستاتا .[161]
وفي تقرير أصدرته الولايات المتحدة متمثلة في الإتلاف الوطني لسرطان البروستاتا تقريرا ذكر أن كل عقار في السوق لعلاج سرطان البروستاتا يقابله سبعة عقارات لعلاج سرطان الثدي، كما أشارت "ذا تايمز" إلى
وجود تحيز ضد الذكور في تمويل السرطان، مع تناقض إلى أربعة تناقضات في المملكة المتحدة من قبل جمعيات السرطان الخيرية أيضا ك "كانسر ريسيرش يو كي" وحكال [160][162]
وبنفس المعدل تحدث عدد من النشطاء كالمؤلف وارن فارل عن انفاق غير متساو ليكون مثالا واضحا عن تفضيل الحكومة غير العادل لصحة الإناث على صحة الذكور.[163]
وتمتد التفرقة لتشمل مناطق أخرى كالكشف، مع فشل الحكومة في تمويل أو التكلف بفحص سرطان البروستاتا لفحص سرطان البروستاتا في حين هناك دعم كامل لبرامج سرطان الثدي. ففي عام 2007 مثلا وجد تقرير أن ولاية فقط لسرطان 28ولاية أمريكية غطت التأمين للفحص الروتيني لسرطان الثدي، في مقابل 49البروستاتا.[160][164]
كما أن سرطان البروستاتا حصل على تغطية إعلامية أقل بكثير مقارنة بالسرطانات الأخرى تساويها في الانتشار، وقد أظهرت دراسة للإتلاف البروستاتا أن مقابل 2,6 قصة لسرطان الثدي هناك قصة واحدة فقط لسرطان البروستاتا.[160]
تحدث التوعية بسرطان البروستاتا في شهر سبتمبر في عدد من الدول، ويستخدم شريط ذا لون أزرق فاتح لتعزيز القضية.[165][166]
بحث
العلاج
حصل دواء Enzalutamide على موافقة هيئة الغذاء والدواء الأمريكية لعلاج سرطان البروستاتا المقاوم للإخصاء [167] في عام 2012 كما يستخدم دواء Alpharadin لعلاج مرضى سرطان البروستاتا المقاوم للإخصاء الذين انتشر لديهم السرطان للعظام.[83][168] وأظهرت التحاليل تحسن في مدة البقاء على قيد الحياة وفي نوعية الحياة، وأوقفت الدراسات لاحقا لاسباب أخلاقية؛ حيث أعطي المرضى الوهميين نفس العلاج. يستخدم Alpharadinعنصر الراديوم الذي يستهدف العظم ويقتل الخلايا السرطانية بواسطة إشعاع ألفا.[169] وقد وافقت عليه هيئة إدارة الغذاء والدواء الأمريكية في شهر مايو 2013 ولكنه ما زال تحت الرقابة.[170] بينما لم توافق عليه بعد الوكالة الأوروبية للأدوية. انزيم أركيدونات 5-أكسيجيناز شحمية له دور كبير في بقاء الخلايا السرطانية على قيد الحياة.[171][172][173] الأدوية والعقاقير التي تستهدف هذا الإنزيم قد يكون لها تأثير فعال في الحد من نمو الورم وانتشاره وكذلك تحفيز عملية الموت المبرمج للخلية في الخلايا السرطانية.[171][172][173] وعلى وجه الخصوص، فإن مثبطات هذا الإنزيم تحفز الموت المبرمج السريع للخلايا السرطانية.[171][172][173]
نماذج سرطان البروستاتا
قام العلماء بزرع الخلايا السرطانية وتنمية عدد من منها لمعرفة آلية تطور سرطان البروستاتا. و خلايا سرطان البروستاتا LNCAP، PC3 ،DU-145 هي المستخدمة عادة لدارستها. خلايا LNCAP تؤخذ من القعد اليمفاوية التي انتشر إليها السرطان بينما PC3 و DU-145 تؤخذ من سرطان البروستاتا المنتشر لكل من العظم والدماغ على الترتيب. لها السرطان، أما خلايا LNCAP و تحوي التعبير الجيني لمستقبلات الأندروجين (AR) (هرمون تنشيط الذكورة )، بينما خلايا PC3 و DU145 لديها تعبير جيني قليل أو معدوم لهذه المستقبلات(AR) و لكنها عوامل نسخ وهي من عائلة المستقبلات الستيرويدية النووية. وتطور سرطان البروستاتا يعتمد على إشارات الأندروجين المنتقلة بواسطة مستقبلات الأندروجين لذلك فإن مستقبلات الأندروجين مهمة في تطور سرطان البروستاتا. تكاثر خلايا LNCAP لا يتأثر بالاندروجين بينما تطور خلايا DU-145 وPC3 ونموها يعتمد على الاندروجين. زيادة التعبير الجيني لمستقبلات الاندروجين يلاحظ غالبا لدى مرضى سرطان البروستاتا المتقدم.[174][175] بعض خلايا LNCAP الغير معتمدة على الأندروجين تطورت من خلايا تعتمد على الأندروجين بعد إزالة الأندروجين لدراسة تطور سرطان البروستاتا. وهذه الخلايا الغير معتمدة على الأندروجين يزيد فيها مستقبلات الأندروجين والأنتيجين الخاص بالبروستاتا بعد العلاج بالأندروجين. الأندروجين يثبط نمو وتكاثر خلايا سرطان البروستاتا الغير معتمدة على الأندروجين.[176][177][178]
التشخيص
في الوقت الحالي تجري العديد من الأبحاث والتحقيقات غير السريرية التي تتضمن طرق غير مؤذية للكشف عن سرطان ليصيب خلايا الورم السرطاني بجيناته غير المؤذية البروستاتا. يعدل العلماء نوع من الفيروسات Adenovirusis وهذه الطريقة أثبتت فعاليتها في التشخيص المبكرعن طريق نقل انواع محددة من الجينات مثل (luciferase)، ومع ذلك حتى الآن هذه البحوث تم اختبارها على الحيوانات وعينات خلايا LNCAP.[179]
EN2
وجود هذا الجين في البول يرتبط باحتمالية كبيرة للإصابة بسرطان البروستاتا.[180]
PCA3
طريقة أخرى للكشف المبكر عن سرطان البروستاتا من خلال الاختبار الجزيئي الذي يكشف وجود (PCA3 mRNA) في الخلايا الموجودة في السائل المأخوذ من البروستاتا والذي يدمج مع كمية قليلة من البول في وعاء يحوي العينة. PCA3 mRNA تتواجد طبيعيا بكميات كبيرة في غدة البروستاتا وتزداد بشكل كبير في خلايا سرطان البروستاتا. نتيجة الاختبار تسجل كنسبة PCA3 mRNA إلى نسبة mRNA PSA. وبالرغم من أنه لا يحل محل اختبار مستوىPSA في الدم إلا انه يساعد على معرفة ما إذا كان من المتوقع حدوث سرطان البروستاتا. وكلما زادت نسبة في العينة زادت احتمالية الإصابة بالسرطان.[181]
أنتيجين سرطان البروستاتا المبكرAPCA-2
هناك اختبار جديد لمستوى هذا الأنتيجين في الدم، يمكن أن يدل الرجال ما إذا كانوا مصابين بسرطان البروستاتا ومدى تقدم المرض لديهم.[182] التهاب الوريد الخثاري يصاحبه زيادة خطر الإصابة بسرطان البروستاتا وقد يكون طريقة جيدة ليتذكر الأطباء أن يفحصوا مرضى التهاب الوريد الخثاري للكشف عن سرطان البروستاتا، لأن هذين المرضين مرتبطان ببعضهما.[183]
البروستاسومز
البروستاسومز هي عضيات محاطة بغشاء من (PSA)و(Prostasomes ) الخلايا الطلائية في غدة البروستاتا تفرز البروستاتا وتكون خارج الخلايا، وإحدى وظائفها الفسيولوجية توفير حماية للحيوانات المنوية من مهاجمة الجهاز المناعي.[184]
مقالات ذات صلة
معرض صور
المراجع
- معرف أنطولوجية المرض: http://www.disease-ontology.org/?id=DOID:10283 — تاريخ الاطلاع: 15 مايو 2019 — الاصدار 2019-05-13
- Sam Lister (February 11, 2009). "Urine test could speed treatment of prostate cancer". London: الصنداي تايمز. مؤرشف من الأصل في 29 يونيو 201109 أغسطس 2010.
- "ACS :: What Is Prostate Cancer?" American Cancer Society :: Information and Resources for Cancer: Breast, Colon, Prostate, Lung and Other Forms. Web. 15 June 2010. "?". مؤرشف من الأصل في 26 مارس 201609 أغسطس 2010.
- "IARC Worldwide Cancer Incidence Statistics—Prostate". JNCI Cancer Spectrum. مطبعة جامعة أكسفورد. December 19, 2001. مؤرشف من الأصل في February 5, 2006. Retrieved on 5 April 2007 through the أرشيف الإنترنت
- Siegel R, (2011). "Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths". CA Cancer J Clin. 61: 212–36. doi:10.3322/caac.20121. PMID 21685461.
- Baade, PD (2009 Feb). "International epidemiology of prostate cancer: geographical distribution and secular trends". Molecular nutrition & food research. 53 (2): 171–84. PMID 19101947.
- Djulbegovic M, Beyth RJ, Neuberger MM, Stoffs TL, Vieweg J, Djulbegovic B, Dahm P (2010). "Screening for prostate cancer: systematic review and meta-analysis of randomised controlled trials". BMJ. 341: c4543. doi:10.1136/bmj.c4543. PMC . PMID 20843937.
- "Talking With Your Patients About Screening for Prostate Cancer" ( كتاب إلكتروني PDF ). مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 11 أكتوبر 201402 يوليو 2012.
- Ejaculation Frequency and Subsequent Risk of Prostate Cancer, Michael F. Leitzmann, MD; Elizabeth A. Platz, ScD; Meir J. Stampfer, MD; Walter C. Willett, MD; Edward Giovannucci, MD, Journal of the American Medical Association. 2004;291(13):1578-1586. doi:10.1001/jama.291.13.1578.
- Giles, G.G., Severi, G., English, D.R., McCredie, M.R.E., Borland, R., Boyle, P. and Hopper, J.L. (2003), Sexual factors and prostate cancer. BJU International, 92: 211–216. doi: 10.1046/j.1464-410X.2003.04319.x
- Dimitropoulou, P., Lophatananon, A., Easton, D., Pocock, R., Dearnaley, D. P., Guy, M., Edwards, S., O’Brien, L., Hall, A., Wilkinson, R., The UK Genetic Prostate Cancer Study Collaborators, British Association of Urological Surgeons Section of Oncology, Eeles, R. and Muir, K. R. (2009), Sexual activity and prostate cancer risk in men diagnosed at a younger age. BJU International, 103: 178–185. doi: 10.1111/j.1464-410X.2008.08030.x
- Miller DC, Hafez KS, Stewart A, Montie JE, Wei JT (2003). "Prostate carcinoma presentation, diagnosis, and staging: an update form the National Cancer Data Base". Cancer. 98 (6): 1169–78. doi:10.1002/cncr.11635. PMID 12973840. مؤرشف من الأصل في 12 سبتمبر 2017.
- van der Cruijsen-Koeter IW, Vis AN, Roobol MJ, Wildhagen MF, de Koning HJ, van der Kwast TH, Schroder FH (2005). "Comparison of screen detected and clinically diagnosed prostate cancer in the European randomized study of screening for prostate cancer, section rotterdam". Urol. 174 (1): 121–5. doi:10.1097/01.ju.0000162061.40533.0f. PMID 15947595.
- Hsing AW, Chokkalingam AP (2006). "Prostate cancer epidemiology". Frontiers in Bioscience. 11: 1388–413. doi:10.2741/1891. PMID 16368524.
- Hankey BF, Feuer EJ, Clegg LX, Hayes RB, Legler JM, Prorok PC, Ries LA, Merrill RM, Kaplan RS (1999). "Cancer surveillance series: interpreting trends in prostate cancer—part I: Evidence of the effects of screening in recent prostate cancer incidence, mortality, and survival rates". J Natl Cancer Inst. 91 (12): 1017–24. doi:10.1093/jnci/91.12.1017. PMID 10379964.
- Breslow N, Chan CW, Dhom G, Drury RA, Franks LM, Gellei B, Lee YS, Lundberg S, Sparke B, Sternby NH, Tulinius H. (1977). "Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France". Int J Cancer. 20 (5): 680–8. doi:10.1002/ijc.2910200506. PMID 924691.
- Zeegers MP (2003). "Empiric risk of prostate carcinoma for relatives of patients with prostate carcinoma: a meta-analysis". Cancer. 97 (8): 1894–903. doi:10.1002/cncr.11262. PMID 12673715.
- Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ (2005). "Cancer statistics, 2005". CA Cancer J Clin. 55 (1): 10–30. doi:10.3322/canjclin.55.1.10. PMID 15661684.
- Martin RM, Vatten L, Gunnell D, Romundstad P (2010). "Blood pressure and risk of prostate cancer: cohort Norway (CONOR)". Cancer Causes Control. 21 (3): 463–72. doi:10.1007/s10552-009-9477-x. PMID 19949849.
- Friedenreich CM, Neilson, HK, Lynch, BM (2010). "State of the epidemiological evidence on physical activity and cancer prevention". European journal of cancer (Oxford, England : 1990). 46 (14): 2593–604. doi:10.1016/j.ejca.2010.07.028. PMID 20843488.
- Goldstein AS, Huang J, Guo C, Garraway IP, Witte ON (2010). "Identification of a cell of origin for human prostate cancer". Science. 329 (5991): 568–71. doi:10.1126/science.1189992. PMC . PMID 20671189.
- Steinberg GD, Carter BS, Beaty TH, Childs B, Walsh PC (1990). "Family history and the risk of prostate cancer". Prostate. 17 (4): 337–47. doi:10.1002/pros.2990170409. PMID 2251225.
- Gallagher RP, Fleshner N (1998). "Prostate cancer: 3. Individual risk factors" ( كتاب إلكتروني PDF ). CMAJ. 159 (7): 807–13. PMC . PMID 9805030. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 29 ديسمبر 2009.
- Hoffman RM, Gilliland FD, Eley JW, Harlan LC, Stephenson RA, Stanford JL, Albertson PC, Hamilton AS, Hunt WC, Potosky AL (2001). "Racial and ethnic differences in advanced-stage prostate cancer: the Prostate Cancer Outcomes Study". J. Natl. Cancer Inst. 93 (5): 388–95. doi:10.1093/jnci/93.5.388. PMID 11238701.
- Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (2000). "Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland". N. Engl. J. Med. 343 (2): 78–85. doi:10.1056/NEJM200007133430201. PMID 10891514.
- Struewing JP, Hartge P, Wacholder S, Baker SM, Berlin M, McAdams M, Timmerman MM, Brody LC, Tucker MA (1997). "The risk of cancer associated with specific mutations of BRCA1 and BRCA2 among Ashkenazi Jews". N. Engl. J. Med. 336 (20): 1401–8. doi:10.1056/NEJM199705153362001. PMID 9145676.
- Beuzeboc P, Soulié M, Richaud P, Salomon L, Staerman F, Peyromaure M, Mongiat-Artus P, Cornud F, Paparel P, Davin JL, Molinié V (2009). "[Fusion genes and prostate cancer. From discovery to prognosis and therapeutic perspectives]". Prog. Urol. (باللغة الفرنسية). 19 (11): 819–24. doi:10.1016/j.purol.2009.06.002. PMID 19945666.
- "Scientists Discover Anti-Cancer Mechanism that Arrests Early Prostate Cancer". August 4, 2005. مؤرشف من الأصل في 19 مايو 2008.
- Venkateswaran V, Klotz, LH (2010). "Diet and prostate cancer: mechanisms of action and implications for chemoprevention". Nature reviews. Urology. 7 (8): 442–53. doi:10.1038/nrurol.2010.102. PMID 20647991.
- Key TJ (2011). "Fruit and vegetables and cancer risk". British journal of cancer. 104 (1): 6–11. doi:10.1038/sj.bjc.6606032. PMC . PMID 21119663.
For other common cancers, including colorectal, breast and prostate cancer, epidemiological studies suggest little or no association between total fruit and vegetable consumption and risk.
- Alexander DD, Mink, PJ, Cushing, CA, Sceurman, B (2010). "A review and meta-analysis of prospective studies of red and processed meat intake and prostate cancer". Nutrition journal. 9. doi:10.1186/1475-2891-9-50. PMC . PMID 21044319.
- "Chemicals in Meat Cooked at High Temperatures and Cancer Risk". National Cancer Institute. مؤرشف من الأصل في 12 فبراير 2015.
- Wigle DT, Turner MC, Gomes J, Parent ME (2008). "Role of hormonal and other factors in human prostate cancer". Journal of Toxicology and Environmental Health. Part B, Critical Reviews. 11 (3–4): 242–59. doi:10.1080/10937400701873548. PMID 18368555.
- "Multivitamin prostate warning". Health. BBC NEWS. 16 May 2007. مؤرشف من الأصل في 02 مارس 2012.
- Lawson KA, Wright ME, Subar A, Mouw T, Hollenbeck A, Schatzkin A, Leitzmann MF (2007). "Multivitamin use and risk of prostate cancer in the National Institutes of Health-AARP Diet and Health Study". J. Natl. Cancer Inst. 99 (10): 754–64. doi:10.1093/jnci/djk177. PMID 17505071.
- Figueiredo JC, Grau MV, Haile RW, Sandler RS, Summers RW, Bresalier RS, Burke CA, McKeown-Eyssen GE, Baron JA (2009). "Folic Acid and Risk of Prostate Cancer: Results From a Randomized Clinical Trial". J. Natl. Cancer Inst. 101 (6): 432–5. doi:10.1093/jnci/djp019. PMC . PMID 19276452.
- Jacobs EJ, Rodriguez C, Mondul AM, Connell CJ, Henley SJ, Calle EE, Thun MJ (2005). "A large cohort study of aspirin and other nonsteroidal anti-inflammatory drugs and prostate cancer incidence". J. Natl. Cancer Inst. 97 (13): 975–80. doi:10.1093/jnci/dji173. PMID 15998950.
- Shannon J, Tewoderos S, Garzotto M, Beer TM, Derenick R, Palma A, Farris PE (2005). "Statins and prostate cancer risk: a case-control study". Am. J. Epidemiol. 162 (4): 318–25. doi:10.1093/aje/kwi203. PMID 16014776.
- Dennis LK, Lynch CF, Torner JC (2002). "Epidemiologic association between prostatitis and prostate cancer". Urology. 60 (1): 78–83. doi:10.1016/S0090-4295(02)01637-0. PMID 12100928.
- Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ (2003). "Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults". N. Engl. J. Med. 348 (17): 1625–38. doi:10.1056/NEJMoa021423. PMID 12711737.
- Gann PH, Hennekens CH, Ma J, Longcope C, Stampfer MJ (1996). "Prospective study of sex hormone levels and risk of prostate cancer". J. Natl. Cancer Inst. 88 (16): 1118–26. doi:10.1093/jnci/88.16.1118. PMID 8757191.
- "?". مؤرشف من الأصل في 19 مايو 201909 أغسطس 2010.
- "Veterans exposed to Agent Orange have higher rates of prostate cancer recurrence". Medical College of Georgia News. May 20, 2007. مؤرشف من الأصل في 16 أغسطس 2011.
- Urisman A, Molinaro RJ, Fischer N, Plummer SJ, Casey G, Klein EA, Malathi K, Magi-Galluzzi C, Tubbs RR, Ganem D, Silverman RH, DeRisi JL (2006). "Identification of a Novel Gammaretrovirus in Prostate Tumors of Patients Homozygous for R462Q RNASEL Variant". PLoS Pathog. 2 (3): e25. doi:10.1371/journal.ppat.0020025. PMC . PMID 16609730.
- Schlaberg R, Choe DJ, Brown KR, Thaker HM, Singh IR (2009). "XMRV is present in malignant prostatic epithelium and is associated with prostate cancer, especially high-grade tumors". Proc. Natl. Acad. Sci. U.S.A. 106 (38): 16351–6. doi:10.1073/pnas.0906922106. PMC . PMID 19805305.
- Hohn O, Krause H, Barbarotto P, Niederstadt L, Beimforde N, Denner J, Miller K, Kurth R, Bannert N (2009). "Lack of evidence for xenotropic murine leukemia virus-related virus (XMRV) in German prostate cancer patients". Retrovirology. 6. doi:10.1186/1742-4690-6-92. PMC . PMID 19835577.
- Lee, D.; Das Gupta, J.; Gaughan, C.; Steffen, I.; Tang, N.; Luk, K. C.; Qiu, X.; Urisman, A.; Fischer, N.; Molinaro, R.; Broz, M.; Schochetman, G.; Klein, E. A.; Ganem, D.; Derisi, J. L.; Simmons, G.; Hackett Jr, J.; Silverman, R. H.; Chiu, C. Y. (2012). Tachedjian, Gilda (المحرر). "In-Depth Investigation of Archival and Prospectively Collected Samples Reveals No Evidence for XMRV Infection in Prostate Cancer". PLoS ONE. 7 (9): e44954. doi:10.1371/journal.pone.0044954. PMC . PMID 23028701.
- Alberts, B (2011 Dec 23). "Retraction". Science (New York, N.Y.). 334 (6063): 1636. PMID 22194552.
- "Retraction. Identification of a novel gammaretrovirus in prostate tumors of patients homozygous for R462Q RNASEL variant". PMID 23028303.
- Dennis, LK (2002 Jan). "Meta-analysis of measures of sexual activity and prostate cancer". Epidemiology (Cambridge, Mass.). 13 (1): 72–9. PMID 11805589.
- Rosenblatt, KA (2001 Jun 15). "Sexual factors and the risk of prostate cancer". American journal of epidemiology. 153 (12): 1152–8. PMID 11415949.
- Sarma, AV (2006 Sep). "Sexual behavior, sexually transmitted diseases and prostatitis: the risk of prostate cancer in black men". The Journal of urology. 176 (3): 1108–13. PMID 16890703.
- Strickler, HD (2001). "Sexual behavior and evidence for an infectious cause of prostate cancer". Epidemiologic reviews. 23 (1): 144–51. PMID 11588840.
- Sutcliffe, S (2008 May). "Inflammation and prostate cancer: a focus on infections". Current urology reports. 9 (3): 243–9. PMID 18765120.
- Dillner, J (1998 Feb 9). "Sero-epidemiological association between human-papillomavirus infection and risk of prostate cancer". International journal of cancer. Journal international du cancer. 75 (4): 564–7. PMID 9466657.
- Hisada, M (2000 Jan 19). "Human papillomavirus antibody and risk of prostate cancer". JAMA : the journal of the American Medical Association. 283 (3): 340–1. PMID 10647795.
- Dennis, LK (2009 Oct). "Sexually transmitted infections and prostate cancer among men in the U.S. military". Cancer epidemiology, biomarkers & prevention : a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology. 18 (10): 2665–71. PMID 19755645.
- Aumüller, G. (1979). Prostate Gland and Seminal Vesicles. Berlin-Heidelberg: Springer-Verlag.
- Moore, K. (1999). Clinically Oriented Anatomy. Baltimore, Maryland: Lippincott Williams & Wilkins. .
- Steive, H. (1930). "Männliche Genitalorgane". Handbuch der mikroskopischen Anatomie des Menschen. Vol. VII Part 2. Berlin: Springer. صفحات 1–399.
- "Male Genitals - Prostate Neoplasms". Pathology study images. University of Virginia School of Medicine. مؤرشف من الأصل في 28 أبريل 201128 أبريل 2011.
There are many connections between the prostatic venous plexus and the vertebral veins. The veins forming the prostatic plexus do not contain valves and it is thought that straining to urinate causes prostatic venous blood to flow in a reverse direction and enter the vertebral veins carrying malignant cells to the vertebral column.
- Journal-molecular cancer, review, 2006 5:17, doi:10.1186/1476-4598-5-17
- Leav I, Plescia J, Goel HL, Li J, Jiang Z, Cohen RJ, Languino LR, Altieri DC (2010). "Cytoprotective Mitochondrial Chaperone TRAP-1 As a Novel Molecular Target in Localized and Metastatic Prostate Cancer". Am. J. Pathol. 176 (1): 393–401. doi:10.2353/ajpath.2010.090521. PMC . PMID 19948822.
- Zha J, Huang YF (2009). "[TGF-beta/Smad in prostate cancer: an update]". Zhonghua Nan Ke Xue (باللغة الصينية). 15 (9): 840–3. PMID 19947572.
- Watanabe SI, Miyata Y, Kanda S, Iwata T, Hayashi T, Kanetake H, Sakai H (2009). "Expression of X-linked inhibitor of apoptosis protein in human prostate cancer specimens with and without neo-adjuvant hormonal therapy". J Cancer Res Clin Oncol. 136 (5): 787–93. doi:10.1007/s00432-009-0718-x. PMID 19946707.
- Senapati S, Rachagani S, Chaudhary K, Johansson SL, Singh RK, Batra SK (2010). "Overexpression of macrophage inhibitory cytokine-1 induces metastasis of human prostate cancer cells through the FAK–RhoA signaling pathway". Oncogene. 29 (9): 1293–302. doi:10.1038/onc.2009.420. PMC . PMID 19946339.
- Narizhneva NV, Tararova ND, Ryabokon P, Shyshynova I, Prokvolit A, Komarov PG, Purmal AA, Gudkov AV, Gurova KV (2009). "Small molecule screening reveals a transcription-independent pro-survival function of androgen receptor in castration-resistant prostate cancer". Cell Cycle. 8 (24): 4155–67. doi:10.4161/cc.8.24.10316. PMC . PMID 19946220.
- Yao V, Berkman CE, Choi JK, O'Keefe DS, Bacich DJ (2010). "Expression of prostate-specific membrane antigen (PSMA), increases cell folate uptake and proliferation and suggests a novel role for PSMA in the uptake of the non-polyglutamated folate, folic acid". Prostate. 70 (3): 305–16. doi:10.1002/pros.21065. PMID 19830782.
- http://www.cancer.org/Healthy/FindCancerEarly/CancerScreeningGuidelines/american-cancer-society-guidelines-for-the-early-detection-of-cancer American Cancer Society American Cancer Society Guidelines for the early detection of cancer Cited: September 2011
- http://caerleonpharmacy.cambrianalliance.co.uk/index.php?option=com_news&view=news&layout=archive&id=543 New prostate cancer twice as effective as a PSA test could be available by next year. Wednesday, 02 March 2011
- Bonekamp D, Jacobs MA, El-Khouli R, Stoianovici D, Macura KJ (2011). "Advancements in MR Imaging of the Prostate: From Diagnosis to Interventions". Radiographics. 31 (3 Suppl): 677–703. doi:10.1148/rg.313105139. PMC . PMID 21571651.
- Natarajan S, Marks LS, Margolis DJ, Huang J, Macairan ML, Lieu P, Fenster A (2011). "Clinical application of a 3D ultrasound-guided prostate biopsy system". Urol Oncol. 29 (3 Suppl): 334–42. doi:10.1016/j.urolonc.2011.02.014. PMID 21555104.
- Tan N, Margolis DJ, McClure TD, Thomas A, Finley DS, Reiter RE, Huang J, Raman SS (2011). "Radical prostatectomy: value of prostate MRI in surgical planning". Abdominal Imaging. doi:10.1007/s00261-011-9805-y. PMID 21993567.
- Search of: prostate mri - List Results - ClinicalTrials.gov - تصفح: نسخة محفوظة 08 مارس 2016 على موقع واي باك مشين.
- Essink-Bot ML, de Koning HJ, Nijs HG, Kirkels WJ, van der Maas PJ, Schröder FH (1998). "Short-term effects of population-based screening for prostate cancer on health-related quality of life". J. Natl. Cancer Inst. 90 (12): 925–31. doi:10.1093/jnci/90.12.925. PMID 9637143.
- Chuang AY, DeMarzo AM, Veltri RW, Sharma RB, Bieberich CJ, Epstein JI (2007). "Immunohistochemical differentiation of high-grade prostate carcinoma from urothelial carcinoma". Am. J. Surg. Pathol. 31 (8): 1246–55. doi:10.1097/PAS.0b013e31802f5d33. PMID 17667550.
- Nutting C, Horwich A, Fisher C, Parsons C, Dearnaley DP (1997). "Small-cell carcinoma of the prostate". Journal of the Royal Society of Medicine. 90 (6): 340–1. PMC . PMID 9227387.
- Wei ZF, Xu H, Wang H, Wei W, Cheng W, Zhou WQ, Ge JP, Zhang ZY, Gao JP, Yin HL (2009). "[Clinicopathological characterization of prostatic small cell carcinoma: a case report and review of the literature]". Zhonghua Nan Ke Xue (باللغة الصينية). 15 (9): 829–32. PMID 19947569.
- "Biomarker for Prostate Cancer" ( كتاب إلكتروني PDF ). Freepatentsonline.com. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 30 يونيو 201729 أغسطس 2011.
- Catz SD, Johnson JL (2003). "BCL-2 in prostate cancer: a minireview". Apoptosis. 8 (1): 29–37. doi:10.1023/A:1021692801278. PMID 12510149.
- Srikumar Chakravarthi, David Low Wee Yang, Thanikachalam P, Nagaraja HS, Nadeem Irfan Bukhari (2009). "Assessment of proliferative index and its association with Ki-67 antigen molecule expression in nodular hyperplasia of prostate". Indian Journal of Science & Technology. 2 (8): 1–4.
- British Journal of Cancer - 15 Feb 2011
- BMJ Group (8 December 2009). "Prostate cancer: How far has your cancer spread? The TNM system". London: الجارديان دوت كوم. مؤرشف من الأصل في 04 أبريل 200909 أغسطس 2010.
- American Society of Clinical Oncology, "Five Things Physicians and Patients Should Question" ( كتاب إلكتروني PDF ), Choosing Wisely: an initiative of the ABIM Foundation, American Society of Clinical Oncology, مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 8 أغسطس 2012,14 أغسطس 2012
-
- PMID 22088337 (ببمد 22088337)
Citation will be completed automatically in a few minutes.
- National Comprehensive Cancer Network - Prostate (2012 [last update]). "NCCN Clinical Practice Guidelines in Oncology". nccn.org. مؤرشف من الأصل في 8 أكتوبر 201715 نوفمبر 2012.
- PMID 17509297 (ببمد 17509297)
Citation will be completed automatically in a few minutes.
- PMID 22088337 (ببمد 22088337)
- Masko, EM (2012 Nov 15). "The Relationship Between Nutrition and Prostate Cancer: Is More Always Better?". European urology. PMID 23219353.
- Thompson AK, Shaw, DI, Minihane, AM, Williams, CM (2008). "Trans-fatty acids and cancer: the evidence reviewed". Nutrition research reviews. 21 (2): 174–88. doi:10.1017/S0954422408110964. PMID 19087370.
- Heinze, VM (2012 Feb). "Dietary conjugated linoleic acid and long-chain n-3 fatty acids in mammary and prostate cancer protection: a review". International journal of food sciences and nutrition. 63 (1): 66–78. PMID 21762028.
- Szymanski KM, Wheeler, DC, Mucci, LA (2010). "Fish consumption and prostate cancer risk: a review and meta-analysis". The American journal of clinical nutrition. 92 (5): 1223–33. doi:10.3945/ajcn.2010.29530. PMID 20844069.
- American Dietetic Association and Dieticians of Canada (2003). "Position of the American Dietetic Association and Dietitians of Canada: Vegetarian diets". Journal of the American Dietetic Association. 103 (6): 748–65. doi:10.1053/jada.2003.50142. PMID 12778049.
- Scardino, Peter (2005). Comprehensive textbook of genitourinary oncology (الطبعة 3rd ed.). Philadelphia: Lippincott Williams & Wilkins. صفحة 16. . مؤرشف من الأصل في 13 ديسمبر 2014.
- "American Cancer Society Guidelines on Nutrition and Physical Activity for Cancer Prevention" ( كتاب إلكتروني PDF ). Last Revised: 1/11/2012. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 27 ديسمبر 2016.
- Male Reproductive Cancers. Springer New York. 2010. صفحة 27. . مؤرشف من الأصل في 13 ديسمبر 2014.
- Masko EM, Allott EH, Freedland SJ (Nov 15, 2012). "The Relationship Between Nutrition and Prostate Cancer: Is More Always Better?". European Urology. 63 (5): 810–20. doi:10.1016/j.eururo.2012.11.012. PMC . PMID 23219353.
- Thompson AK, Shaw DI, Minihane AM, Williams CM (Dec 2008). "Trans-fatty acids and cancer: the evidence reviewed". Nutrition research reviews. 21 (2): 174–88. doi:10.1017/S0954422408110964. PMID 19087370.
- Heinze VM, Actis AB (February 2012). "Dietary conjugated linoleic acid and long-chain n-3 fatty acids in mammary and prostate cancer protection: a review". International journal of food sciences and nutrition. 63 (1): 66–78. doi:10.3109/09637486.2011.598849. PMID 21762028.
- Stratton J, Godwin M (2011). "The effect of supplemental vitamins and minerals on the development of prostate cancer: A systematic review and meta-analysis". Family practice. 28 (3): 243–52. doi:10.1093/fampra/cmq115. PMID 21273283.
- Datta M, Schwartz GG (2012). "Calcium and vitamin D supplementation during androgen deprivation therapy for prostate cancer: a critical review". The oncologist. 17 (9): 1171–9. doi:10.1634/theoncologist.2012-0051. PMC . PMID 22836449.
- Szymanski KM, Wheeler DC, Mucci LA (Nov 2010). "Fish consumption and prostate cancer risk: a review and meta-analysis". The American journal of clinical nutrition. 92 (5): 1223–33. doi:10.3945/ajcn.2010.29530. PMID 20844069.
- American Dietetic Association and Dieticians of Canada (June 2003). "Position of the American Dietetic Association and Dietitians of Canada: Vegetarian diets". Journal of the American Dietetic Association. 103 (6): 748–65. doi:10.1053/jada.2003.50142. PMID 12778049.
- Research, World Cancer Research Fund ; American Institute for Cancer (2007). Food, nutrition, physical activity, and the prevention of cancer a global perspective ( كتاب إلكتروني PDF ). Washington, D.C.: American Institute for Cancer Research. صفحة 76. . مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 8 ديسمبر 2013.
- Wilt TJ, MacDonald R, Hagerty K, Schellhammer P, Kramer BS (2008). "Five-alpha-reductase Inhibitors for prostate cancer prevention". Cochrane Database Syst Rev (2): CD007091. doi:10.1002/14651858.CD007091. PMID 18425978.
- Marcione, Marilyn (12 October 2011). "Prostate testing's dark side: Men who were harmed". أسوشيتد برس. مؤرشف من الأصل في 30 يونيو 201713 أكتوبر 2011.
- Moyer VA, on behalf of the U.S. Preventive Services Task, Force (2012). "Screening for Prostate Cancer: U.S. Preventive Services Task Force Recommendation Statement". Annals of internal medicine. doi:10.1059/0003-4819-157-2-201207170-00459. PMID 22615453.
- Chou R, Croswell JM, Dana T, Bougatsos C, Blazina I, Fu R, Gleitsmann K, Koenig HC, Lam C, Maltz A, Rugge JB, Lin K (2011). "Screening for prostate cancer: a review of the evidence for the U.S. Preventive Services Task Force". Ann. Intern. Med. 155 (11): 762–71. doi:10.1059/0003-4819-155-11-201112060-00375. PMID 21984740. مؤرشف من الأصل في 18 أغسطس 2014.
- Prostate Cancer Screening CDC, updated April 6, 2010 نسخة محفوظة 16 ديسمبر 2017 على موقع واي باك مشين.
- Basch, E (2012 Jul 16). "Screening for Prostate Cancer With Prostate-Specific Antigen Testing: American Society of Clinical Oncology Provisional Clinical Opinion" ( كتاب إلكتروني PDF ). Journal of clinical oncology : official journal of the American Society of Clinical Oncology. PMID 22802323. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 9 مارس 2013.
- Basch E, Oliver TK, Vickers A, Thompson I, Kantoff P, Parnes H, Loblaw DA, Roth B, Williams J, Nam RK (Jul 16, 2012). "Screening for Prostate Cancer With Prostate-Specific Antigen Testing: American Society of Clinical Oncology Provisional Clinical Opinion" ( كتاب إلكتروني PDF ). Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 30 (24): 3020–5. doi:10.1200/JCO.2012.43.3441. PMC . PMID 22802323. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 9 مارس 2013.
- "EARLY DETECTION OF PROSTATE CANCER: AUA GUIDELINE". American Urological Association. 2013. مؤرشف من الأصل في 6 فبراير 201710 مايو 2013.
- Filson CP, Marks LS, Litwin MS (8 May 2015). "Expectant management for men with early stage prostate cancer". Ca: A Cancer Journal for Clinicians. 65 (4): 265–82. doi:10.3322/caac.21278. PMID 25958817.
- Mohan R, Schellhammer PF (2011). "Treatment options for localized prostate cancer". Am Fam Physician. 84 (4): 413–20. PMID 21842788.
- Hegarty J, Beirne PV, Walsh E, Comber H, Fitzgerald T, Wallace Kazer M (November 2010). Hegarty J (المحرر). "Radical prostatectomy versus watchful waiting for prostate cancer" ( كتاب إلكتروني PDF ). The Cochrane Database of Systematic Reviews (11): CD006590. doi:10.1002/14651858.CD006590.pub2. PMID 21069689. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 22 ديسمبر 2019.
- "Active Surveillance for the Management of Localized Prostate Cancer". Cancer Care Ontario. مؤرشف من الأصل في 10 أبريل 2020.
- "Active Surveillance May Be Preferred Option in Some Men with Prostate Cancer". Cancer.gov. 2011-04-19. مؤرشف من الأصل في 03 مايو 201129 أغسطس 2011.
- Sartor O, de Bono JS (February 2018). "Metastatic Prostate Cancer". The New England Journal of Medicine. 378 (7): 645–657. doi:10.1056/NEJMra1701695. PMID 29412780.
- Dhondt B, De Bleser E, Claeys T, Buelens S, Lumen N, Vandesompele J, et al. (December 2018). "Discovery and validation of a serum microRNA signature to characterize oligo- and polymetastatic prostate cancer: not ready for prime time". World Journal of Urology. 37 (12): 2557–2564. doi:10.1007/s00345-018-2609-8. PMID 30578441.
- Hammerstrom AE, Cauley DH, Atkinson BJ, Sharma P (August 2011). "Cancer immunotherapy: sipuleucel-T and beyond". Pharmacotherapy. 31 (8): 813–28. doi:10.1592/phco.31.8.813. PMC . PMID 21923608.
- Mouraviev V, Evans B, Polascik TJ (2006). "Salvage prostate cryoablation after primary interstitial brachytherapy failure: a feasible approach". Prostate Cancer and Prostatic Diseases. 9 (1): 99–101. doi:10.1038/sj.pcan.4500853. PMID 16314889.
- Clarke NW (c. 2005). "Docetaxel for the Treatment of Hormone Refractory Prostate Cancer" ( كتاب إلكتروني PDF ). مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 12 يوليو 2012.
- "Prostate cancer (hormone-refractory) - docetaxel". National Institute for Health and Clinical Excellence. 2010-12-10. مؤرشف من الأصل في 02 فبراير 201204 يوليو 2011.
- "Avastin, Thalomid, Taxotere, and Prednisone Effective for Men with Hormone Refractory Prostate Cancer". March 2010. مؤرشف من الأصل في 15 يونيو 201010 مايو 2010.
- Kantoff PW, Higano CS, Shore ND, Berger ER, Small EJ, Penson DF, et al. (July 2010). "Sipuleucel-T immunotherapy for castration-resistant prostate cancer". The New England Journal of Medicine. 363 (5): 411–22. doi:10.1056/NEJMoa1001294. PMID 20818862. مؤرشف من الأصل في 10 أبريل 2020.
- "FDA approves new treatment for a type of late stage prostate cancer" (Press release). Food and Drug Administration. 2012-08-31. مؤرشف من الأصل في 02 أكتوبر 2013.
- Anna Azvolinsky (September 4, 2012). "FDA Approves Enzalutamide (Xtandi) for Late-Stage Prostate Cancer". CancerNetwork. مؤرشف من الأصل في 13 سبتمبر 2012.
- Qin J, Liu X, Laffin B, Chen X, Choy G, Jeter CR, et al. (May 2012). "The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration". Cell Stem Cell. 10 (5): 556–69. doi:10.1016/j.stem.2012.03.009. PMC . PMID 22560078. مؤرشف من الأصل في 10 أبريل 2020.
- Maitland NJ, Collins AT (June 2008). "Prostate cancer stem cells: a new target for therapy". Journal of Clinical Oncology. 26 (17): 2862–70. doi:10.1200/JCO.2007.15.1472. PMID 18539965.
- Rane JK, Pellacani D, Maitland NJ (October 2012). "Advanced prostate cancer--a case for adjuvant differentiation therapy". Nature Reviews. Urology. 9 (10): 595–602. doi:10.1038/nrurol.2012.157. PMID 22890299.
- "Surgery for Prostate Cancer". www.cancer.org (باللغة الإنجليزية). مؤرشف من الأصل في 10 أبريل 202030 مارس 2020.
- Ilic D, Evans SM, Allan CA, Jung JH, Murphy D, Frydenberg M (September 2017). "Laparoscopic and robotic-assisted versus open radical prostatectomy for the treatment of localised prostate cancer". The Cochrane Database of Systematic Reviews. 9: CD009625. doi:10.1002/14651858.cd009625.pub2. PMC . PMID 28895658.
- "Continence management following prostate surgery". Continence Foundation of Australia. مؤرشف من الأصل في 10 أبريل 2020.
- Singla, Nirmish; Singla, Ajay K. (March 2014). "Post-prostatectomy incontinence: Etiology, evaluation, and management". Turkish journal of urology. 40 (1): 1–8. doi:10.5152/tud.2014.222014. ISSN 2149-3235. PMC . PMID 26328137. مؤرشف من الأصل في 10 أبريل 2020.
- "EAU Guidelines on Urinary Incontinence in Adults" ( كتاب إلكتروني PDF ). European Association of Urology. 2018. مؤرشف من الأصل ( كتاب إلكتروني PDF ) في 24 فبراير 2020.
- "Erectile Dysfunction After Prostate Cancer". www.hopkinsmedicine.org (باللغة الإنجليزية). مؤرشف من الأصل في 10 أبريل 202001 أبريل 2020.
- Cooperberg MR (2005). "The UCSF Cancer of the Prostate Risk Assessment (CAPRA) Score: a straightforward and reliable preoperative predictor of disease recurrence after radical prostatectomy". J. Urol. 173 (6): 1938–42. doi:10.1097/01.ju.0000158155.33890.e7. PMC . PMID 15879786.
- Cooperberg MR, Freedland SJ, Pasta DJ, Elkin EP, Presti JC Jr, Amling CL, Terris MK, Aronson WJ, Kane CJ, Carroll PR (2006). "Multiinstitutional validation of the UCSF cancer of the prostate risk assessment for prediction of recurrence after radical prostatectomy". Cancer. 107 (10): 2384–91. doi:10.1002/cncr.22262. PMID 17039503.
- May M, Knoll N, Siegsmund M, Fahlenkamp D, Vogler H, Hoschke B, Gralla O (2007). "Validity of the CAPRA score to predict biochemical recurrence-free survival after radical prostatectomy. Results from a european multicenter survey of 1,296 patients". J. Urol. 178 (5): 1957–62, discussion 1962. doi:10.1016/j.juro.2007.07.043. PMID 17868719.
- Zhao KH, Hernandez DJ, Han M, Humphreys EB, Mangold LA, Partin AW (2008). "External validation of University of California, San Francisco, Cancer of the Prostate Risk Assessment score". Urology. 72 (2): 396–400. doi:10.1016/j.urology.2007.11.165. PMID 18372031.
- Cooperberg MR, Broering JM, Carroll PR (2009). "Risk Assessment for Prostate Cancer Metastasis and Mortality at the Time of Diagnosis". J. Natl. Cancer Inst. 101 (12): 878–87. doi:10.1093/jnci/djp122. PMC . PMID 19509351.
- Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D (2011). "Global cancer statistics". CA: A cancer journal for clinicians. 61 (2): 69–90. doi:10.3322/caac.20107. PMID 21296855.
- Overview: Prostate Cancer—What Causes Prostate Cancer? American Cancer Society (2 May 2006). Retrieved on 5 April 2007 نسخة محفوظة 14 يناير 2010 على موقع واي باك مشين.
- Prostate Cancer FAQs. State University of New York School of Medicine Department of Urology (31 August 2006). Retrieved on 5 April 2007 نسخة محفوظة 30 مارس 2014 على موقع واي باك مشين.
- Lee MM, Gomez SL, Chang JS, Wey M, Wang RT, Hsing AW (2003). "Soy and isoflavone consumption in relation to prostate cancer risk in China". Cancer Epidemiol Biomarkers Prev. 12 (7): 665–8. PMID 12869409.
- Potosky AL, Miller BA, Albertsen PC, Kramer BS (1995). "The role of increasing detection in the rising incidence of prostate cancer". JAMA. 273 (7): 548–52. doi:10.1001/jama.273.7.548. PMID 7530782.
- Hanno P.M., Malcowicz S. B., Wein A. J., "Clinical Manual of Urology" McGraw Hill 2001
- Homma Y, Kawabe K, Tsukamoto T, Yamanaka H, Okada K, Okajima E, Yoshida O, Kumazawa J, Gu FL, Lee C, Hsu TC, dela Cruz RC, Tantiwang A, Lim PH, Sheikh MA, Bapat SD, Marshall VR, Tajima K, Aso Y (1997). "Epidemiologic survey of lower urinary tract symptoms in Asia and Australia using the international prostate symptom score". International Journal of Urology. 4 (1): 40–46. doi:10.1111/j.1442-2042.1997.tb00138.x. PMID 9179665.
- Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ (2008). "Cancer Statistics, 2008". CA Cancer J Clin. 58 (2): 71–96. doi:10.3322/CA.2007.0010. PMID 18287387.
- Redman MW, Tangen CM, Goodman PJ, Lucia MS, Coltman CA, Thompson IM (2008). "Finasteride Does Not Increase the Risk of High-grade Prostate Cancer: A Bias-adjusted Modeling Approach". Cancer Prev Res (Phila Pa). 1 (3): 174–81. doi:10.1158/1940-6207.CAPR-08-0092. PMC . PMID 19138953.
- Gine Kolata (June 15, 2008). "New Take on a Prostate Drug, and a New Debate". NY Times. مؤرشف من الأصل في 31 مارس 201815 يونيو 2008.
- Bostwick, David G.; Eble, John N. (2007). Urological Surgical Pathology. St. Louis: Mosby. p. 468. .
- Woloshin, Steve; Schwartz, Lisa A. (2011). Overdiagnosed: Making People Sick in the Pursuit of Health. USA: Beacon Press. صفحات 45–60. .
- Adams J (1853). "The case of scirrhous of the prostate gland with corresponding affliction of the lymphatic glands in the lumbar region and in the pelvis". Lancet. 1.
- Lytton B (2001). "Prostate cancer: a brief history and the discovery of hormonal ablation treatment". The Journal of Urology. 165 (6 Pt 1): 1859–62. doi:10.1016/S0022-5347(05)66228-3. PMID 11371867.
- Young HH (1905). "Four cases of radical prostatectomy". Johns Hopkins Bull. 16.
- Walsh PC, Lepor H, Eggleston JC (1983). "Radical prostatectomy with preservation of sexual function: anatomical and pathological considerations". The Prostate. 4 (5): 473–85. doi:10.1002/pros.2990040506. PMID 6889192.
- Huggins CB, Hodges CV (1941). "Studies on prostate cancer: 1. The effects of castration, of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate". Cancer Res. 1.
- Schally AV, Kastin AJ, Arimura A (1971). "Hypothalamic follicle-stimulating hormone (FSH) and luteinizing hormone (LH)-regulating hormone: structure, physiology, and clinical studies". Fertility and Sterility. 22 (11): 703–21. PMID 4941683.
- Tolis G, Ackman D, Stellos A, Mehta A, Labrie F, Fazekas AT, Comaru-Schally AM, Schally AV (1982). "Tumor growth inhibition in patients with prostatic carcinoma treated with luteinizing hormone-releasing hormone agonists". Proc. Natl. Acad. Sci. U.S.A. 79 (5): 1658–62. doi:10.1073/pnas.79.5.1658. PMC . PMID 6461861.
- Denmeade SR, Isaacs JT (2002). "A history of prostate cancer treatment". Nature Reviews. Cancer. 2 (5): 389–96. doi:10.1038/nrc801. PMID 12044015.
- Scott WW, Johnson DE, Schmidt JE, Gibbons RP, Prout GR, Joiner JR, Saroff J, Murphy GP (1975). "Chemotherapy of advanced prostatic carcinoma with cyclophosphamide or 5-fluorouracil: results of first national randomized study". The Journal of Urology. 114 (6): 909–11. PMID 1104900.
- Arnst, Catherine (2007-06-13). "A Gender Gap in Cancer". Businessweek.com. مؤرشف من الأصل في 29 مايو 201229 أغسطس 2011.
- Browne, Anthony (2001-10-07). "Cancer bias puts breasts first". The Guardian. London. مؤرشف من الأصل في 30 يونيو 2013.
- Men lose out in battle for cancer cash - Times Onlineنسخة محفوظة 24 مايو 2011 على موقع واي باك مشين.
- Does feminism discriminate against ... - Google Books. Books.google.co.uk. 2008-07-24. . مؤرشف من الأصل في 08 مارس 202029 أغسطس 2011.
- [1]نسخة محفوظة 24 مايو 2011 على موقع واي باك مشين.
- "Breast cancer receives much more research funding, publicity than prostate cancer despite similar number of victims". The Daily Caller. 2010-10-05. مؤرشف من الأصل في 28 أبريل 201929 أغسطس 2011.
- "Prostate cancer in shadow of female counterpart - Health - Cancer - msnbc.com". MSNBC. 2005-03-28. مؤرشف من الأصل في 24 نوفمبر 201229 أغسطس 2011.
- http://www.clinicaltrials.gov/ct2/results?intr=%22MDV3100%22 ClinicalTrials.gov listing of MDV3100 articles
- Anna Azvolinsky (September 4, 2012). "FDA Approves Enzalutamide (Xtandi) for Late-Stage Prostate Cancer". CancerNetwork. مؤرشف من الأصل في 13 سبتمبر 2012.
- "Positive Outcome of Interim Analysis of pivotal Alpharadin study: Primary endpoint met in Phase III ALSYMPCA study". Press Release. Algeta.com. 2011-06-06. مؤرشف من الأصل في 25 أبريل 201204 يوليو 2011.
- FDA approves new drug for advanced prostate cancer - تصفح: نسخة محفوظة 18 يناير 2017 على موقع واي باك مشين.
- Ghosh J, Myers CE (October 1998). "Inhibition of arachidonate 5-lipoxygenase triggers massive apoptosis in human prostate cancer cells". Proc. Natl. Acad. Sci. U.S.A. 95 (22): 13182–13187. doi:10.1073/pnas.95.22.13182. PMC . PMID 9789062.
Inhibition of 5-lipoxygenase by MK886 completely blocks 5-HETE production and induces massive apoptosis in both hormone-responsive (LNCaP) and -nonresponsive (PC3) human prostate cancer cells. This cell death is very rapid
- Greene ER, Huang S, Serhan CN, Panigrahy D (November 2011). "Regulation of inflammation in cancer by eicosanoids". Prostaglandins Other Lipid Mediat. 96 (1–4): 27–36. doi:10.1016/j.prostaglandins.2011.08.004. PMC . PMID 21864702.
The 5-lipoxygenase (5-LOX) pathway is implicated in the development and progression of human cancers. 5-LOX, whose crystal structure was recently identified (118), is a key enzyme in metabolizing arachidonic acid to leukotrienes. 5-LOX can be induced by pro-inflammatory stimuli and is expressed in epithelial cancers including lung, prostate, breast, and colon (113). Hence, 5-LOX inhibitors have been targeted for their chemopreventive effects. Inhibition of 5-LOX activity is shown to block prostate cancer cell proliferation as well as carcinogen-induced lung tumorigenesis (119, 120). ... Both 5-HETE and 12-HETE are also products of lipoxygenase and are involved in tumor progression (12). Exogenous 5-HETE can stimulate the proliferation of prostate cancer cells and act as a survival factor (137, 138). These results require relatively high concentrations (at a concentration of 10 μM). Blocking the formation of 5-HETE, by inhibiting 5-lipoxygenase, results in massive apoptosis of human prostate cancer cells (139).
- Bishayee K, Khuda-Bukhsh AR (September 2013). "5-lipoxygenase antagonist therapy: a new approach towards targeted cancer chemotherapy". Acta Biochim. Biophys. Sin. (Shanghai). 45 (9): 709–719. doi:10.1093/abbs/gmt064. PMID 23752617.
Recent studies demonstrated the involvement of growth factors, such as epidermal growth factor (EGF) and neurotensin in the 5-LOX-mediated tumor progression in prostate cancer [22,23]. Recent studies with 5-LOX siRNA [10] and specific blocker of 5-LOX [24] revealed the relation of this gene with the tumor cell proliferation. ... Meclofenamate sodium (MS) is known for its anti-inflammatory activity, and apart from this, Boctor et al. [37] reported that it caused reduction in the formation of 5-HETE in human leucocytes when used. MS can thus be considered a dual inhibitor of 5-LOX and COX pathways of arachidonic acid cascade. Further investigation with this substance revealed that it could interfere with the LT receptors in the lung carcinoma [38]. In a recent study, a group of scientists have shown the effect of MS on prostate cancer cells both in vitro and in vivo [39], and their result suggests a profound reduction in the tumor growth and cancer metastasis. ... While the commonly used inhibitors produced strong cytotoxicity, notably, zileuton, the only commercialized 5-LOX inhibitor, failed to induce an anti-proliferative or cytotoxic response in all other types of tumor cells where 5-LOX was in inactive state (e.g. HeLa cells); however, where 5-LOX was in active state, zileuton could effectively inhibit progression, as in case of prostate cancer.
- Linja MJ, Savinainen KJ, Saramäki OR, Tammela TL, Vessella RL, Visakorpi T (May 2001). "Amplification and overexpression of androgen receptor gene in hormone-refractory prostate cancer". Cancer Research. 61 (9): 3550–5. PMID 11325816. مؤرشف من الأصل في 08 مارس 2020.
- Ford OH, Gregory CW, Kim D, Smitherman AB, Mohler JL (November 2003). "Androgen receptor gene amplification and protein expression in recurrent prostate cancer". The Journal of Urology. 170 (5): 1817–21. doi:10.1097/01.ju.0000091873.09677.f4. PMID 14532783.
- Kokontis J, Takakura K, Hay N, Liao S (March 1994). "Increased androgen receptor activity and altered c-myc expression in prostate cancer cells after long-term androgen deprivation". Cancer Research. 54 (6): 1566–73. PMID 7511045. مؤرشف من الأصل في 08 مارس 2020.
- Umekita Y, Hiipakka RA, Kokontis JM, Liao S (October 1996). "Human prostate tumor growth in athymic mice: inhibition by androgens and stimulation by finasteride". Proc. Natl. Acad. Sci. U.S.A. 93 (21): 11802–7. doi:10.1073/pnas.93.21.11802. PMC . PMID 8876218.
- Kokontis JM, Hsu S, Chuu CP, Dang M, Fukuchi J, Hiipakka RA, Liao S (December 2005). "Role of androgen receptor in the progression of human prostate tumor cells to androgen independence and insensitivity". The Prostate. 65 (4): 287–98. doi:10.1002/pros.20285. PMID 16015608.
- Iyer M, Salazar FB, Lewis X, Zhang L, Wu L, Carey M, Gambhir SS (February 2005). "Non-invasive imaging of a transgenic mouse model using a prostate-specific two-step transcriptional amplification strategy". Transgenic Res. 14 (1): 47–55. doi:10.1007/s11248-004-2836-1. PMID 15865048.
- Morgan R, Boxall A, Bhatt A, Bailey M, Hindley R, Langley S, Whitaker HC, Neal DE, Ismail M, Whitaker H, Annels N, Michael A, Pandha H (March 2011). "Engrailed-2 (EN2): a tumor specific urinary biomarker for the early diagnosis of prostate cancer". Clin. Cancer Res. 17 (5): 1090–8. doi:10.1158/1078-0432.CCR-10-2410. PMID 21364037. ضع ملخصا – BBC News.
- Bourdoumis A, Papatsoris AG, Chrisofos M, Efstathiou E, Skolarikos A, Deliveliotis C (2010). "The novel prostate cancer antigen 3 (PCA3) biomarker". Int Braz J Urol. 36 (6): 665–8, discussion 669. doi:10.1590/S1677-55382010000600003. PMID 21176272.
- Hansel DE, DeMarzo AM, Platz EA, Jadallah S, Hicks J, Epstein JI, Partin AW, Netto GJ (May 2007). "Early prostate cancer antigen expression in predicting presence of prostate cancer in men with histologically negative biopsies". J. Urol. 177 (5): 1736–40. doi:10.1016/j.juro.2007.01.013. PMID 17437801. ضع ملخصا – Newsweek.
- van Weert HC, Pingen F (2009). "Recurrent thromboflebitis as a warning sign for cancer: a case report". Cases J. 2: 153. doi:10.1186/1757-1626-2-153. PMC . PMID 19946524.
- Nilsson BO, Carlsson L, Larsson A, Ronquist G (2001). "Autoantibodies to prostasomes as new markers for prostate cancer". Ups. J. Med. Sci. 106 (1): 43–9. doi:10.3109/2000-1967-171. PMID 11817562.