L'immunothérapie consiste à administrer des substances stimulant les défenses immunitaires du malade pour lutter contre des pathologies installées, le plus souvent des cancers, voire contre des maladies dégénératives. Ceci inclut les thérapies utilisant des protéines (anticorps) produites par les cellules du système immunitaire, en particulier les immunoglobulines, sans que l'objectif de cette thérapie ne soit nécessairement la stimulation de l'immunité. On distingue l'immunothérapie locale (rare) et l'immunothérapie générale (beaucoup plus fréquente).
Des ancêtres de l'immunothérapie contemporaine sont la « thérapie sérique » et l'immunothérapie allergénique mise au point par Leonard Noon et John Freeman en 1911. Les essais modernes d'immunothérapie remontent aux années 1970, basés sur des anticorps polyclonaux. Depuis, d'autres molécules sont arrivées sur le devant de la scène, telles les immunoglobulines monoclonales, et de façon moindre les interférons, les interleukines et les inhibiteurs de point de contrôle.
Histoire médicale
Des ancêtres de l'immunothérapie contemporaine sont la thérapie sérique et l'immunothérapie allergénique mise au point par Leonard Noon et John Freeman en 1911.
Avant la découverte des antibiotiques, l'administration passive d'anticorps s'est montrée pertinente pour traiter de nombreuses maladies infectieuses, bien avant les anticorps monoclonaux et l'utilisation récente des « biomédicaments ». Les thérapies sériques étaient déjà basées sur le transfert artificiel d'une immunité humorale d'un organisme à un autre (éventuellement d'une espèce animale à l'homme) ; on parle aussi de transfert artificiel d'immunité passive ou de TIP artificiel (TIP signifiant ici « transfert d'immunité passive »). Parfois très efficace, il a néanmoins posé de graves problèmes (dits « maladie sérique ») mais reste encore utilisé de nos jours pour quelques cas où les alternatives n'existent pas.
Puis, à partir des années 1940, la généralisation des antibiotiques et d'autres chimiothérapies antimicrobiennes a abouti à la suppression de la plupart des types de thérapies passives par anticorps (elles étaient plus dangereuse en termes d'effets secondaires difficiles à prévoir)[1].
Dans les années 1990, la chimiothérapie antimicrobienne a perdu beaucoup de son efficacité en raison du développement de l'antibiorésistance et de maladies nosocomiales d'une part, et de la forte augmentation du nombre de patients immunodéprimés d'autre part (du fait de maladies telles que le VIH/SIDA, du nombre croissant de greffés et éventuellement de facteurs environnementaux tels que la pollution ou l'alimentation qui pourraient affecter les forces immunitaires). Au début du XXe siècle, le nombre de maladies émergentes ou ré-émergentes a augmenté.
Une alternative aux antibiotiques a été de développer des anticorps monoclonaux et de générer des thérapies à base d'anticorps humains[1] puis de développer des dizaines de biomédicaments (souvent des anticorps produits par les moyens du génie génétique, via un animal, une plante, un champignon ou une bactérie transgénique biotechnologiquement modifiés afin de produire des protéines complexes et de grande taille que l'industrie chimique ou pharmaceutique classique serait incapable de produire par chimie de synthèse).
Au XXIe siècle, alors que l'antibiorésistance continue à se développer et que le risque pandémique augmente, les anticorps et les thérapies sériques ont à nouveau suscité un certain intérêt. Théoriquement, à chaque microbe pathogène correspond un anticorps qui freinera ou bloquera l'infection au profit de l'hôte. Le génie génétique permet aujourd'hui de reproduire avec plus ou moins de fidélité ces anticorps. Comparées à la chimiothérapie standard, les thérapies à base d'anticorps ont des avantages et des inconvénients importants[1].
En 2020 l'usage à grande échelle de l'immunothérapie aux États-Unis est envisagée dans le cadre de la pandémie de maladie à coronavirus de 2019-2020. Des essais cliniques ont été lancés en France, aux États-Unis et en Asie[2],[3].
Objectifs thérapeutiques
Les thérapies sériques puis plus généralement l'immunothérapie peuvent :
- avoir un objectif général (il est alors atteint via le transfert d'anticorps produits dans le sang d'un organisme sain) ;
- cibler une maladie spécifique (dans ce cas, les anticorps sont transférés, avec le sang ou le sérum, d'un organisme ayant été infecté par le virus ou la bactérie que l'on souhaite combattre et déjà en voie de guérison) ;
- cibler une intoxication (le sérum provient alors d'un animal qui a résisté à la toxine en question, toxine botulique par exemple).
À noter que l'immunoscintigraphie (en) est une application diagnostique reposant aussi sur l'utilisation d'anticorps comme sonde spécifique mais marqués par fluorescence ou radioactivité faible et visualisés in vivo par imagerie. En immunothérapie, on utilise des anticorps modifiés pour être, seulement mais de façon plus critique, « humanisés » afin d'éviter les réactions de défense immunitaire parce que les quantités employées sont justement plus fortes.
Contre les tumeurs et le cancer
Après des décennies de déceptions dans le traitement du cancer, l'immunothérapie a atteint une maturité ayant permis un changement de paradigme dans le traitement de nombreux types de tumeurs et de cancers. Avec une compréhension accrue du système immunitaire, la guérison est devenue une possibilité réelle pour de nombreux patients[4].
Techniques
L'immunothérapie désigne une gamme de traitements destinés à stimuler l'immunité chez un patient. Ces traitements comprennent des vaccins, des inhibiteurs du contrôle immunitaire, des lymphocytes T avec des récepteurs de l'antigène chimérique (CAR), des immunothérapies à base de virus oncolytique[4].
Vaccination contre le cancer
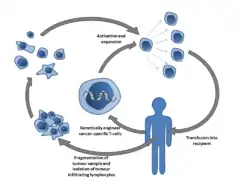
Transfert adoptif de cellules
Immunothérapie locale
Utilisée dans le cas du cancer de la vessie pour limiter les récidives à la suite de l'ablation chirurgicale du cancer. Le principe consiste à stimuler l'immunité locale par des irrigations locales de la vessie à l'aide d'une solution contenant du BCG.
Immunothérapie générale
L'immunothérapie générale consiste à injecter par voie générale des immunoglobulines, des cytokines ou des interférons recombinants, produits par génie génétique. Les interférons alpha et gamma, l'interleukine 2 étaient les cytokines les plus souvent utilisées[5]. L'interleukine 2 était indiquée dans le traitement du cancer du rein métastatique et dans le mélanome métastatique[6] ainsi qu'en traitement adjuvant des mélanomes de mauvais pronostic.
L'utilisation d'anticorps monoclonaux vise à empêcher la prolifération cellulaire en bloquant l'activité de certains récepteurs codés par des oncogènes. Des anticorps monoclonaux sont utilisés dans le traitement de certains cancers.
Le rituximab est indiqué pour le traitement de patients atteints de lymphomes folliculaires de stade III-IV en cas de chimiorésistance ou à partir de la deuxième rechute après chimiothérapie. Cet anticorps monoclonal se lie spécifiquement à l'antigène transmembranaire CD20, une protéine située sur les lymphocytes B et s'exprimant dans plus de 95 % des cellules B des lymphomes non hodgkiniens.
Le trastuzumab[7] est administré aux patients ayant un cancer du sein résistant au traitement habituel en raison de la surabondance d'un récepteur spécifique dans leurs cellules, appelé HER2. La présence de ce récepteur en surnombre entraîne la production en excès d'une protéine qui à son tour induit une multiplication incontrôlée des cellules.
L'immunothérapie est également utilisée dans le cadre du cancer du poumon métastatique parce qu'elle semble donner, avec le pembrolizumab, de meilleurs résultats que la chimiothérapie dans les stades avancés[8].
Efficacité
Un grand nombre de patients (environ la moitié[9]) ne réagissent pas à un traitement par immunothérapie. Cela est dû entre autres à une réaction d'auto-défense des cellules tumorales et à l'action de cellules venant inhiber les cellules T intervenant dans le processus d'immunothérapie, en particulier celle de cellules myéloïdes infiltrantes tumorales (TIM)[10].
Le taux de réponse durable (25 %) est environ deux fois supérieur qu'avec les traitements précédents[11],[12].
Autres immunothérapies
L'immunothérapie est également utilisée dans de nombreuses autres conditions pathologiques comme les maladies inflammatoires et neurodégénératives. Les anticorps ciblent par exemple la cytokine TNF-alpha dans la polyarthrite rhumatoïde, la protéine tau dans les tauopathies[13], ou le NGF dans l'arthrose canine et féline[14].
Effets secondaires de l'immunothérapie
Il semble y avoir une association intime entre l'auto-immunité avec les évènements indésirables liés au point de contrôle immunitaire et l'effet antitumoral des inhibiteurs de point de contrôle (ICI)[15]. Les toxicités de grade 3 ou plus entraîne un meilleure taux de réponse global, mais baisse la survie globale[15]. Les femmes recevant une immunothérapie présentent un risque accru d'effets secondaires graves de 50 % par rapport aux hommes[16].
Contreperformance du traitement anti-cancer chez une minorité de patients
Depuis 2012 environ, les immunothérapies, en dépit d'effets secondaires graves (mais comme il en existe pour la chimiothérapie), ont révolutionné le traitement de certains cancers tenaces[17] ; cependant, selon deux études récentes[18],[19], chez un petit nombre de patients atteints d'un cancer avancé, certains médicaments de l'immunothérapie qui visaient à traiter ce cancer (inhibiteurs de la PD-1,) peuvent au contraire accélérer très fortement (en une à deux semaines parfois) sa progression, pour des raisons encore mal comprises. Les auteurs appellent à une étude plus large et pluridisciplinaire de ce phénomène pour en comprendre les causes[17].
Les patients concernés par ce problème semblent porter une altération génétique rare (copies supplémentaires des gènes de lutte contre le cancer MDM2 ou MDM4). Un même phénomène est observé chez certaines souris de laboratoire « dont les tumeurs progressent rapidement après un traitement avec une immunothérapie »[17].
Des chercheurs de l'Institut Gustave Roussy de Villejuif (France) ont lancé une étude systématique de la croissance tumorale chez leurs patients et conclu en que sur 131 personnes ayant reçu des thérapies anti-PD-1, 9 % ont été victimes d'une « hyperprogression » de leur tumeur (plus souvent chez des plus de 65 ans)[17]. Le , Kurzrock et ses collègues confirment le phénomène : chez 155 personnes traitées avec des inhibiteurs de la PD-1 et d'autres immunothérapie, six patients présentaient des copies supplémentaires de MDM2 ou MDM4 et 10 présentaient des mutations du gène EGFR (associé au cancer). Il ne semblait pas dans ce cas y avoir de corrélation entre l'âge et une aggravation rapide de la maladie mais, chez quatre des patients ayant des gènes MDM2 ou MDM4 supplémentaires et chez deux des personnes atteintes de mutations EGFR, les tumeurs ont rapidement grossi lors du traitement[17].
Une hypothèse est que chez ces patients uniquement, le traitement libérerait des « facteurs de croissance » de tumeurs, pour des raisons qui restent alors à comprendre[17].
Effets neurologiques et psychiatriques
Les médicaments d'immunothérapies augmentent (plus ou moins selon le type de molécule mais de manière statistiquement significative) certaines comorbidités, notamment dans le cas de la polyarthrite rhumatoïde ; ils accroissent le risque de dépression (laquelle peut aggraver la douleur générale, de mauvais pronostic, le refus du traitement et une dégradation plus rapide de la qualité de vie du patient) ; ils peuvent également accroître le risque d'anxiété voire d'idées suicidaires et ce, plus fortement voire de manière « alarmante » pour certains médicaments (ex : méthotrexate, léflunomide, hydroxychloroquine et des médicaments dits biologiques (biotechnologiques) dans la littérature médicale anglophone ou médicaments antirhumatismaux modificateurs de la maladie DMARDs (pour Disease-modifying antirheumatic drug).
Le léflunomide provoquerait le moins de troubles de santé mentale selon une étude de 2013[20]. Dans une étude de 2013 basée sur 105 patients traités pour maladies rhumatismales, ceux qui prenaient des antirhumatismaux « modificateurs de la maladie » présentaient les taux les plus élevés de dépression, d'anxiété et d'idées suicidaires parmi tous les patients étudiés[20].
Vaccin
L'immunothérapie antimicrobienne, qui comprend la vaccination, implique l'activation du système immunitaire pour répondre à un agent infectieux.
Immunosuppression
La suppression immunitaire vise à tempérer voire supprimer une réponse immunitaire anormale par exemple dans le cadre des maladies auto-immunes ou à réduire une réponse immunitaire normale pour empêcher le rejet d'organes ou de cellules transplantés.
Immunothérapie allergénique
L'immunothérapie allergénique (ITA), ou hyposensibilisation, est le seul traitement qui permette de traiter les allergies respiratoires — allergies aux pollens, aux acariens, aux poils de chat, etc. — en s’attaquant à la cause même de la maladie[21]. En effet, l'ITA permet d'altérer le cours naturel de la maladie allergique et entraîne ainsi des rémissions de longue durée. Enfin, il est possible que l'ITA évite l'apparition de nouvelles sensibilisations, voire d'un asthme[22].
Le traitement se fait en augmentant graduellement les doses d'allergène (mithridatisation) pour permettre au système immunitaire de construire les anticorps correspondants (sous-classe IgG4). La dose de départ est souvent d'un facteur 1:10 000.
Selon l’Académie nationale de médecine[23], la désensibilisation précoce des patients allergiques permet de modifier l’histoire naturelle de la maladie en limitant l’acquisition de nouvelles sensibilisations ou en réduisant chez les enfants atteints de rhinite allergique le risque de développement ultérieur d’un asthme.
Deux formes d’administration du traitement existent : la voie injectable, la plus ancienne, sous-cutanée, faite en cabinet par un médecin toutes les 4 à 6 semaines ; et la voie sublinguale où l’on dispose, soi-même à domicile, quotidiennement, des gouttes sous la langue à jeun, selon la prescription de son allergologue. Plus pratique et présentant un excellent rapport bénéfice/risque, la désensibilisation sublinguale est la voie majoritairement utilisée aujourd'hui, bien qu'ayant une efficacité inférieure à la voie sous-cutanée[24] et un coût supérieur[25]. Depuis une quinzaine d’années, la voie sublinguale a connu un développement rapide, par la mise à disposition de traitements basés sur des extraits allergéniques administrés sous forme de gouttes et l'arrivée des premiers comprimés de désensibilisation au pollen de graminées avec AMM (autorisation de mise sur le marché).
La désensibilisation est aujourd'hui parfaitement reconnue et codifiée par un consensus international (ARIA ou « Allergic Rhinitis and its Impact on Asthma ») sous l'égide de l'OMS. Ce consensus recommande, avec un niveau de preuve élevé, l'utilisation de la voie sublinguale, chez les patients atteints de rhinite allergique pour qui la désensibilisation est indiquée[26].
Découverte par Leonard Noon et John Freeman en 1911, l'immunothérapie allergénique représente le seul traitement étiologique des allergies respiratoires. Il est le seul médicament connu pour traiter non seulement les symptômes mais aussi les causes de l’allergie respiratoire.
Notes et références
- 1 2 3 (en) Arturo Casadevall et Matthew D. Scharff, « Return to the Past: The Case for Antibody-Based Therapies in Infectious Diseases », Clinical Infectious Diseases, vol. 21, no 1, , p. 150–161 (ISSN 1058-4838, DOI 10.1093/clinids/21.1.150, lire en ligne, consulté le ).
- ↑ « Covid-19 : comment les dons d'anticorps pourraient guérir les malades », sur Sciences et Avenir (consulté le ).
- ↑ (en) « Immunology and Vaccine-Preventable Disease / Principles of Vaccination », sur CDC (consulté le ).
- 1 2 (en) Monika Joshi, Sumanta K Pal et Joseph J Drabick, « Novel Approaches in Cancer Immunotherapy — A Light at the End of the Tunnel », Discovery Medicine, vol. 21, no 118, (lire en ligne, consulté le ).
- ↑ « Patient education: Melanoma treatment; advanced or metastatic melanoma (Beyond the Basics) », sur www.uptodate.com (consulté le ).
- ↑ L'immunothérapie prolonge la survie de patients atteints de mélanome, lefigaro.fr, 3 juin 2014.
- ↑ « HERCEPTIN (trastuzumab), anticorps monoclonal - Traitement du cancer du sein précoce HER2+ », sur Haute Autorité de Santé (consulté le ).
- ↑ L'immunothérapie, «un tremblement de terre dans le traitement des cancers avancés», lefigaro.fr, 13 octobre 2016.
- ↑ « Prédire la réponse aux immunothérapies dans le cancer du poumon et le cancer colorectal | Fondation ARC pour la recherche sur le cancer », sur www.fondation-arc.org (consulté le ).
- ↑ Cleo Goyvaerts, « L'immunothérapie antitumorale : comment « apprendre » au cancer à déclencher sa propre guérison? », .
- ↑ (en) Elvire Pons-Tostivint, Aurélien Latouche, Pauline Vaflard et Francesco Ricci, « Comparative Analysis of Durable Responses on Immune Checkpoint Inhibitors Versus Other Systemic Therapies: A Pooled Analysis of Phase III Trials », JCO Precision Oncology, no 3, , p. 1–10 (ISSN 2473-4284, DOI 10.1200/PO.18.00114, lire en ligne, consulté le ).
- ↑ « Immunothérapie : 25 % des patients obtiennent une réponse prolongée | Institut Curie », sur curie.fr (consulté le ).
- ↑ « Un anticorps efficace contre la protéine Tau chez des souris atteintes d’Alzheimer », sur fondation-alzheimer.org, (consulté le ).
- ↑ (en) Paul Imrie, « Zoetis announces monoclonal antibody therapies for OA », sur vettimes.co.uk, (consulté le )
- 1 2 Syed Hussaini, Rania Chehade, Ronald Gabriel Boldt et Jacques Raphael, « Association between immune-related side effects and efficacy and benefit of immune checkpoint inhibitors - A systematic review and meta-analysis », Cancer Treatment Reviews, vol. 92, , p. 102134 (ISSN 1532-1967, PMID 33302134, DOI 10.1016/j.ctrv.2020.102134, lire en ligne, consulté le ).
- ↑ Joseph M. Unger, Riha Vaidya, Kathy S. Albain et Michael LeBlanc, « Sex Differences in Risk of Severe Adverse Events in Patients Receiving Immunotherapy, Targeted Therapy, or Chemotherapy in Cancer Clinical Trials », Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, vol. 40, no 13, , p. 1474–1486 (ISSN 1527-7755, PMID 35119908, PMCID 9061143, DOI 10.1200/JCO.21.02377, lire en ligne, consulté le ).
- 1 2 3 4 5 6 Heidi Ledford (2017) Promising cancer drugs may speed tumours in some patients Early studies fuel scientists’ determination to understand how immunotherapy may sometimes make disease worse ; Nature News 31 mars 2017 Lire en ligne.
- ↑ Champiat, S. et al. (2016), Hyperprogressive Disease Is a New Pattern of Progression in Cancer Patients Treated by Anti-PD-1/PD-L1 ; Clin. Cancer Res. https://dx.doi.org/10.1158/1078-0432.CCR-16-1741 (http://clincancerres.aacrjournals.org/content/early/2017/02/06/1078-0432.CCR-16-1741 résumé]).
- ↑ Kato, S. et al.(2017), Hyper-progressors after Immunotherapy: Analysis of Genomic Alterations Associated with Accelerated Growth Rate ; Clin. Cancer Res. https://dx.doi.org/10.1158/1078-0432.CCR-16-3133 (résumé).
- 1 2 (en) Natalia Pinho de Oliveira Ribeiro, Alexandre Rafael de Mello Schier, Ana Claudia Ornelas et Christina Maria Pinho de Oliveira, « Anxiety, depression and suicidal ideation in patients with rheumatoid arthritis in use of methotrexate, hydroxychloroquine, leflunomide and biological drugs », Comprehensive Psychiatry, vol. 54, no 8, , p. 1185–1189 (ISSN 0010-440X, DOI 10.1016/j.comppsych.2013.05.010, lire en ligne, consulté le ).
- ↑ (en) Van Overtvelt L. et al., « Immune mechanisms of allergen-specific sublingual immunotherapy », Revue Française d'allergologie et d'immunologie clinique, no 46, , p. 713-720.
- ↑ (en) Jacobsen L. et al., « Specific Immunotherapy has long-term preventive effect of seasonal and perennial asthma: 10 years follow-up the PAT study », Allergy, vol. 62, no 8, , p. 943-948 (PMID 17620073).
- ↑ André-Bernard Tonnel (Lille), L'allergie - Désensibilisation et nouvelles thérapeutiques. Quelles avancées ? Académie Nationale de Médecine : Séance à thème du mardi 18 octobre 2005.
- ↑ (en) Danilo Di Bona, Antonella Plaia, Maria Stefania Leto-Barone et Simona La Piana, « Efficacy of subcutaneous and sublingual immunotherapy with grass allergens for seasonal allergic rhinitis: A meta-analysis–based comparison », Journal of Allergy and Clinical Immunology, vol. 130, no 5, , p. 1097–1107.e2 (ISSN 0091-6749 et 1097-6825, PMID 23021885, DOI 10.1016/j.jaci.2012.08.012, lire en ligne, consulté le ).
- ↑ Le Figaro, Allergies : la désensibilisation n'est pas la solution miracle, 26 mai 2009.
- ↑ (en) Bousquet J et al. « Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen) » Allergy. 2008; 63 (S86) :8-160.
Voir aussi
Articles connexes
- Maladie sérique
- Sérum anti-lymphocytaire
- Jules Traeger
- Immunité passive
- Médicament biologique
- Immunoglobuline
- Antisérum
- Choc cytokinique
- Vaccin contre le cancer
- Structure lymphoïde tertiaire
- Tolérance (immunologie)
Liens externes
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :