_EM.jpg.webp)
| Groupe | Groupe I |
|---|---|
| Domaine | Monodnaviria |
| Règne | Shotokuvirae |
| Embranchement | Cossaviricota |
| Classe | Papovaviricetes |
| Ordre | Zurhausenvirales |
| Famille | Papillomaviridae |
ICTV, 2017
Genres de rang inférieur
- Alphapapillomavirus[1] - [2]
- αPV 1 (HPV-32 et 42)
- αPV 2 (HPV-3, 10, 28, 29, 77, 78, 94, 117, 125, 160)
- αPV 3 (HPV-61, 62, 72, 81, 83, 84, 86, 87, 89, 102 et 114)
- αPV 4 (HPV-2, 27 et 57)
- αPV 5 (HPV-26, 51, 69 et 82)
- αPV 6 (HPV-30, 53, 56 et 66)
- αPV 7 (HPV-18, 39, 45, 59, 68, 70, 85 et 97)
- αPV 8 (HPV-7, 40, 43 et 91)
- αPV 9 (HPV-16, 31, 33, 35, 52, 58 et 67)
- αPV 10 (HPV-6, 11, 13, 44 et 74)
- αPV 11 (HPV-34 et 73)
- αPV 13 (HPV-54)
- αPV 14 (HPV-71, 90 et 106)
- Betapapillomavirus
- βPV 1 (HPV-5)
- βPV 2 (HPV-9)
- βPV 3 (HPV-49)
- βPV 4 (HPV-cand92)
- βPV 5 (HPV-cand96)
- Gammapapillomavirus
- γPV 1 (HPV-4)
- γPV 2 (HPV-48)
- γPV 3 (HPV-50)
- γPV 4 (HPV-60)
- γPV 5 (HPV-88)
- Mupapillomavirus
- μPV 1 (HPV-1)
- μPV 2 (HPV-63)
- Nupapillomavirus
- νPV 1 (HPV-41)
La dénomination « papillomavirus humain » (PVH) ou virus du papillome humain (VPH, en anglais human papillomavirus, HPV) s'applique à différents virus à ADN de la famille des Papillomaviridae susceptibles d'infecter l'humain. On en connaît environ 200 génotypes différents ; certains se transmettent par contact cutané et infectent la peau, d'autres potentiellement plus dangereux sont sexuellement transmissibles.
Les manifestations cliniques de la contamination sexuelle les plus visibles sont les condylomes acuminés (dits également « verrues génitales », « végétations vénériennes » ou « crêtes de coq »), déjà décrits par Hippocrate. Elles sont principalement dues aux HPV 6 et 11[3]. Dans un premier temps, cette infection régresse spontanément dans 90 % des cas mais peut réapparaître par la suite tout au long de la vie d'une personne préalablement infectée[4]. Lorsque le virus est toujours présent deux ans après l'infection, pour certains génotypes (notamment les HPV 16, 18, 31, 33 et 35[5]), l'infection évolue en cancer du col de l'utérus dans 5 % des cas. Cette découverte a valu à Harald zur Hausen le Prix Nobel de physiologie ou médecine en 2008. L'infection par le papillomavirus humain peut aussi être un précurseur de la plupart des cancers anogénitaux[6], ainsi que des cancers de l'oropharynx et probablement de la cavité buccale et du larynx, contribuant à environ 600 000 cancers par an dans le monde et 250 000 décès prématurés[7],[8]. En France, plus de 6 000 nouveaux cas de cancers sont dus aux papillomavirus, chez des femmes dans 3/4 des cas (col de l’utérus, vulve, vagin, anus et sphère ORL) et chez les hommes pour 1/4 des cas (ORL, anus, pénis)[9].
Le préservatif n'est pas un mode de protection fiable contre le papillomavirus humain[10] ; la vaccination est de ce fait la seule prophylaxie efficace et recommandée par les autorités de santé. Si elle cible les souches les plus dangereuses pour l'humain, elle est inefficace sur les personnes déjà infectées. Le dépistage du cancer du col utérin, assorti d'un traitement en cas de présence de cellules précancéreuses ou cancéreuses, est un moyen efficace afin de diminuer le risque de mortalité une fois l'infection contractée. Cette dernière peut être récidivante tout au long de la vie de la personne infectée. Des frottis de dépistage réguliers sont indispensables en complément des vaccins.
En place depuis 2005, la vaccination préventive des adolescentes contre ce type de virus vise à réduire la prévalence de ce cancer. En France, la vaccination est recommandée entre 11 et 14 ans alors que l'OMS la recommande entre 9 et 13 ans[11], mais un rattrapage peut avoir lieu jusqu'à 19 ans[12]. Depuis 2019, l'OMS recommande d'élargir la vaccination aux jeunes hommes aux mêmes âges que les jeunes femmes, soit entre 11 et 14 ans avec un rattrapage jusqu'à 19 ans. En effet, près d'un homme sur trois serait porteur du virus[13].
Toutefois, en France, seuls 37 % des adolescents sont vaccinés contre le papillomavirus humain, dont moins de 10 % de garçons, un taux qui situe le pays au 37e rang parmi les 41 pays européens[14].
Histoire
Vers 1925, Georgios Papanicolaou décrivait des anomalies de la forme, de la taille et du noyau des cellules du col utérin en rapport avec le cancer de col de l’utérus mais sa découverte ne fut considérée en médecine que vingt ans plus tard. Ce dépistage cytologique avait une sensibilité moyenne (50 %[15]). Sa découverte fut le pilier du dépistage du cancer du col pendant des décennies.
À la fin du XXe siècle, Harald zur Hausen trouva la raison de ces modifications : une infection persistante par le papillomavirus. L'apparition au début des années 2000 d'un diagnostic virologique beaucoup plus sensible fait sur le même prélèvement endocervical que sur celui utilisé pour un frottis cytologique a fait que le diagnostic virologique est maintenant le seul utilisé dans beaucoup de pays. Le prélèvement pour ce test peut être fait par la femme elle-même.
La prévention de l'infection par HPV a été rendue possible en 2006 par la vaccination.
Les papillomavirus humains (VPH)
Ce sont des virus à ADN, petits et qui infectent les épithéliums. Ils sont particulièrement résistants dans le milieu extérieur (froid, solvants organiques, détergents). Le génome est constitué de 8 000 paires de bases. Le virion est non-enveloppé, la capside est à symétrie cubique constituée de 72 capsomères en structure icosaédrique, de 55 nm de diamètre ; il possède un ADN bicaténaire, circulaire, fermé, à réplication dans le noyau cellulaire.
Le papillomavirus est hautement spécifique de l'espèce hôte[18]. Ce virus se multiplie exclusivement dans les kératocytes, type cellulaire présent uniquement dans les cellules de l'épithélium malpighien non-kératinisé comme l'épithélium cervical ou vaginal et l'épithélium malpighien kératinisé comme l'épiderme. L'altération de la production de la kératine est un marqueur de la carcinogenèse[19]. Il ne se multiplie pas sur culture cellulaire[18].
Les papillomavirus humains appartiennent principalement au genre α-Papillomavirus. On en compte plus de 200 génotypes. 120 ont été identifiés et séquencés[20]. Ils ont une spécificité d'hôte étroite (spécifique d'une espèce), ainsi qu'une spécificité de tissus.
Ils sont désignés par un nombre croissant (HPV 1, HPV 2 etc.) donné en fonction de l'ordre chronologique de leur découverte.
Les virus HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 sont des virus oncogènes prouvés. Le type 16 est la cause d’environ 50 % des cancers du col utérin dans le monde et les types 16 et 18 représentent ensemble environ 70 % des cancers du col utérin. Certains types de HPV sont des oncogènes prouvés, découverte qui valut à Harald zur Hausen le Prix Nobel de physiologie ou médecine en 2008.
Le génome des virus génitaux code huit gènes (et autant de protéines)[21],[22].
Ce virus est particulièrement résistant. Dans les blocs opératoires, les interventions pour ablation chirurgicale de lésions cutanées condylomateuses sont toujours faites en dernier.
Épidémiologie et transmission du virus
Avec environ 4 500 nouveaux cas de cancers par an en France (col de l’utérus, vulve, vagin, anus et oropharynx)[23], les femmes sont les plus touchées par les cancers induits par différentes souches de papillomavirus mais les infections à VPH concernent également les hommes avec environ 1 750 nouveaux cas de cancers VPH-induits chaque année en France (anus, pénis et plus fréquemment oropharynx) avec un risque d’infection particulièrement élevé chez les hommes ayant des relations sexuelles avec des hommes.
Les papillomavirus humains cutanés sont souvent présents sur la peau normale de sujets sains. On parle d'infections cutanées asymptomatiques, qui apparaissent très tôt dans l'enfance. La plupart des infections à papillomavirus sont latentes ou transitoires. Les lésions induites par ces virus régressent spontanément la plupart du temps. Néanmoins, le caractère cancérigène du virus a été mis en évidence par la capacité du virus à s'intégrer au génome de la cellule pour produire des protéines qui inactivent celles (P53, RB) produites par les gènes suppresseurs de tumeurs[24]. Plus de 50 % des infections au VPH disparaissent en six à douze mois et 80 % sont guéries avant cinq ans[25].
La transmission peut se faire aussi par une sonde d'échographie endovaginale. Un protège-sonde doit être utilisé et non pas un préservatif.
La transmission périnatale d’une infection symptomatique semble rare. Lorsqu’elle survient, l’infection est associée à des lésions génitales et à des lésions des cordes vocales. On ignore la durée de la période d’incubation. Habituellement, la transmission périnatale devient cliniquement apparente au cours des deux premières années de vie.
Infections génitales
Ce sont les infections génitales qui ont été les plus étudiées. Le VPH est la principale cause d'infections sexuellement transmissibles (IST) aux États-Unis[26]. Bien que sa prévalence[27] soit élevée (près de 25 % de la population féminine pubère), elle est particulièrement importante chez la jeune femme de moins de 20 ans[28] :
- plus de la moitié des lésions de bas degré régressent spontanément en quelques années, 10 % évoluant vers des lésions de haut degré ;
- environ un tiers des lésions de haut degré régressent spontanément, 5 % évoluant vers un cancer.
On considère ainsi que la majorité des personnes sexuellement actives ont eu au moins une infection à papillomavirus à potentiel cancérogène élevé au cours de leur vie, surtout au cours des premières années de la vie sexuelle.
Le virus se transmet par contact direct avec une peau ou une muqueuse contaminée, par voie buccale, auto-inoculation (la transmission de verrues vulgaires est favorisée par le grattage) et par contact indirect (objets ou surfaces contaminés, locaux — douches, hammams, sièges de toilettes, piscines etc. — favorisant la propagation des verrues plantaires) ; la transmission est sexuelle dans le cas des condylomes anogénitaux ; la transmission du papillome laryngien s'effectue de la mère à l'enfant lors du passage dans la filière génitale.
De 1 % à 2 % des hommes et des femmes infectés présenteront des condylomes exophytiques cliniquement visibles.
La période d’incubation est d'environ deux à trois ans pour les condylomes exophytiques, exceptionnellement jusqu'à 4 ans après le rapport à risque.
Les lésions exophytiques cliniquement visibles sont rarement associées au cancer : seuls certains génotypes du VPH sont associés aux cancers du col de l’utérus, de la vulve, du pénis et au cancer anorectal. L'ADN de certains sérotypes de VPH serait présent dans au moins 80-90 % des lésions cervicales dysplasiques (néoplasies cervicales intra-épithéliales) et des cancers du col de l'utérus (HPV 16, 18, 31, 33 ou 35)[5]. Les génotypes (HPV 6 et 11) qui causent le plus souvent les condylomes exophytiques n’ont pas été associés à ces cancers.
Les patients infectés par le VIH présentent souvent des condylomes anogénitaux étendus qui répondent peu au traitement.
Complications : cancers directement ou majoritairement liés au VPH
5 % des cancers sont en rapport avec une infection par ce virus[29].
Six types de cancer sont directement liés aux VPH : col de l'utérus, vagin, vulve, pénis, gorge, anal. Aux États-Unis, chaque année, environ 44 000 nouveaux cas de cancers sont découverts dans des parties du corps où l'on trouve souvent le papillomavirus humain (HPV). Le HPV cause environ 34 800 de ces cancers.
Mécanisme moléculaire de l'oncogenèse
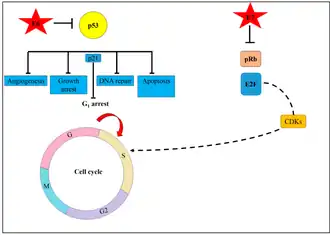
La principale raison pour laquelle le VPH perturbe le gène hôte est qu'il se réplique et survit dans le tissu hôte en exploitant la machinerie du cycle cellulaire hôte[30]. L'infection par le VPH et l'intégration du génome du VPH dans le chromosome hôte des cellules épithéliales cervicales sont des événements précoces clés de la progression néoplasique des lésions cervicales. Les oncoprotéines virales, principalement E6 et E7, sont responsables des premiers changements dans les cellules épithéliales[30]. Les protéines virales inactivent deux principales protéines suppressives de tumeurs, la p53 et la protéine du rétinoblastome (pRb). L'inactivation de ces protéines hôtes perturbe à la fois les mécanismes de réparation de l'ADN et l'apoptose, entraînant une prolifération cellulaire rapide[30]. Plusieurs gènes impliqués dans la réparation de l'ADN, la prolifération cellulaire, l'activité des facteurs de croissance, l'angiogenèse, ainsi que les gènes de mitogenèse deviennent fortement exprimés dans la néoplasie cervicale intraépithéliale et le cancer. Cette instabilité génomique stimule la progression vers un carcinome invasif[30].
L'activation de p53 active normalement l'inhibiteur de kinase dépendant de la cycline (p21) pour forcer les cellules à rester à l'arrêt G1[30]. Cependant, lors de l'infection par le VPH, l'E6 dégrade p53, ce qui fait entrer les cellules dans la phase S du cycle cellulaire[30]. Simultanément, l'oncoprotéine E7 se lie à la protéine du rétinoblastome (pRb). La liaison de E7 à pRb lui fait libérer E2F, un facteur de transcription qui active la kinase dépendante de la cycline (CDK). Cela entraîne une perte de contrôle du cycle cellulaire, permettant aux cellules de rentrer dans la phase S (réplication) du cycle cellulaire. Les cellules infectées se différencient et prolifèrent entraînant un risque élevé d'apparition de cellules dysplasiques[30].
Cancer du col de l'utérus
La présence d'un VPH oncogène est détectée dans près de 100 % des carcinomes in situ, une forme non-invasive.
L'infection, par les VPH oncogènes, est totalement asymptomatique mais elle sera longue à se guérir spontanément. Chez 90 % des femmes infectées, il faut attendre deux ans pour que le virus devienne indétectable[31]. C'est parmi les 10 % de femmes dont le virus est toujours détectable après deux ans que va se développer, très lentement, pour certaines d'entre elles, un cancer du col utérin après un processus de plusieurs années. Le délai entre l'infection par un VPH oncogène et la manifestation d'un cancer du col utérin invasif est de dix à trente ans.
La présence d'une infection à VPH oncogène est indispensable[32] pour développer un cancer du col de l'utérus mais n'est pas suffisante à elle seule[33],[32]. Le développement d'un cancer du col utérin nécessite des facteurs associés.
La survenue d'un cancer du col de l'utérus est le plus souvent le résultat d’un processus se déroulant sur 10–15 ans et en quatre étapes[34],[35] :
- infection productive initiale par un virus oncogène ;
- infection persistante (virus oncogène toujours détectable après deux ans) ;
- infection transformante ou pré-cancer ;
- cancer invasif.

À chaque phase de l'infection correspond des modifications de l'architecture de cet épithélium (dysplasie) :
- plus de la moitié des dysplasies de bas degré régressent spontanément en quelques années, 10 % évoluant vers des dysplasies de haut degré ;
- environ un tiers des dysplasies de haut degré régressent spontanément, 5 % évoluant vers un cancer.
On considère ainsi que la majorité des personnes sexuellement actives ont eu au moins une infection à papillomavirus à potentiel cancérogène élevé au cours de leur vie, surtout au cours des premières années de la vie sexuelle.
Cancer du vagin
Au Royaume-Uni, 75 % des cas de cancer du vagin sont causés par une infection aux VPH[36].
Une étude cas-témoins a montré que le risque de cancer du vagin est cinq fois plus élevé chez les femmes avec des anticorps anti-VPH 16 que chez celles qui n'en ont pas[37]. Le VPH 16 est présent dans 59 % des cancers du vagin, a montré une étude transversale[38].
Cancer vulvaire
Au Royaume-Uni, 69 % des cas de cancer vulvaire sont causés par une infection à VPH[36]. 5 % des cas de cancer vulvaire en Europe sont positifs pour le VPH, a montré une méta-analyse[39]. 81 % des cas de néoplasie intraépithéliale vulvaire (NIV) en Europe sont positifs pour le VPH[36].
Le VPH de type 16 est le type le plus courant dans les cas de cancer vulvaire dans le monde (32 %), suivi des VPH de types 33 (5 %) et 18 (4 %). Les cas de cancer vulvaire sont plus susceptibles d'être positifs pour le VPH chez les femmes plus jeunes[39].
Une étude de cohorte a montré que le risque de cancer vulvaire est plus élevé chez les femmes atteintes de verrues génitales que chez les femmes sans[40]. Cela est probablement dû à la co-infection avec des types de VPH à haut risque (les verrues génitales sont causées par des types de VPH à faible risque)[40].
Cancer du canal anal
Les hommes et les femmes atteints par le VPH ont un risque accru de développer un cancer anal. Environ 90 cas sur 100 de cancer anal sont liés à une infection au VPH[41].
Le risque de cancer anal peut être plus élevé chez les personnes participant à des comportements sexuels anaux, en conséquence, le risque de cancer anal est plus élevé chez les hommes ayant des rapports sexuels avec des hommes, par rapport aux autres hommes[42].
Cancer du pénis
Le VPH est retrouvé dans 60 % des cancers du pénis, principalement le VPH 16 et 18. Les autres facteurs de risque sont un affaiblissement du système immunitaire, certains traitements du psoriasis, l'absence de circoncision. Plus que l'absence de circoncision, c'est l'absence d'une hygiène de base et le tabac qui sont facteurs de risque[43].
Cancer de la gorge
Il existe une nette augmentation depuis les années 1970 de la pré-valence des cancers épidermoïdes oropharyngés malgré une diminution des intoxications alcooliques et tabagiques. Cette augmentation est en rapport avec des cancers VPH induits (KOHPV) et concerne les cancers de la loge amygdalienne et de la cavité buccale [44]. Les cancers oropharyngés VPH induits ont une présentation clinique différente des cancers ORL liés à l’alcool et au tabac :
| Caractéristiques cliniques du cancer de la gorge lié au HPV |
|---|
| Âge de survenue plus jeune (35—45 ans) |
| Tumeur primitive en général plus petite sans signe clinique |
| Ganglions cervicaux plus souvent présents, révélateurs et parfois volumineux |
| Niveau socioéconomique plus élevé |
| État général bon et peu de comorbidités |
| Cancer généralement lié aux pratiques sexuelles |
L'efficacité du vaccin contre les infections orales liées aux KOHPV est démontré par : sur 2 627 patients de 18 à 33 ans, la vaccination tétravalente réduit les infections orales à VPH de 88,2 %[45] ; chez des sujets de 17 à 45 ans, la recherche d’anticorps anti-VPH 16 et 18 dans la salive avant et sept mois après vaccination montre une séroconversion dans tous les cas[46] ; après la campagne australienne de vaccination, l’incidence d’une maladie ORL invalidante très difficile à traiter : la papillomatose laryngée juvénile a diminué de 2012 à 2016 de 0,16 à 0,022/100 000[47].
Il n’existe pas de prévention secondaire pour ce type de cancer.
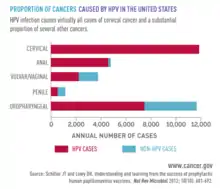
Nombre de cas de cancers attribuables au VPH par an aux États-Unis
Ce tableau du CDC montre que le cancer du col ne représente aux États-Unis que 50 % des cancers VPH-induits chez la femme[48].
Le cancer de l’oropharynx représente est le cancer VPH-induit le plus fréquent chez l'homme[48], représentant 80 % des cancers VPH-induits chez l'homme.
| Organe | Nombre moyen de cancers | Fréquence du VPH (%) | Nombre moyen de cancers directement dus au VPH |
|---|---|---|---|
| Col de l'utérus | 12 015 | 91 | 10 900 |
| Vagin | 862 | 75 | 600 |
| Vulve | 4 009 | 69 | 2 800 |
| Pénis | 1 303 | 63 | 800 |
| Anus | 6 810 | 91 | 6 200 |
| Femme | 4 539 | 93 | 4 200 |
| Homme | 2 270 | 89 | 2 000 |
| Oropharinx | 19 000 | 70 | 13 500 |
| Femme | 3 460 | 63 | 2 200 |
| Homme | 15 540 | 72 | 11 300 |
| Total | 43 999 | 79 | 34 800 |
| Femme | 24 886 | 83 | 20 700 |
| Homme | 19 113 | 74 | 14 100 |
Autres cancers étudiés
Les tumeurs malignes de l'œsophage sont des carcinomes de type épidermoïde ; les adénocarcinomes se développent quant à eux au niveau d'un œsophage de Barrett. Le VPH semble fortement impliqué dans l'étiologie des carcinomes épidermoïdes de l'œsophage (squamous cell carcinoma, SCC) : on y retrouve également des koïlocytes.
La première étude prouvant le rôle d'un papillomavirus dans la genèse de lésions œsophagiennes est une étude animale[49]. Les bovins des Highlands en Écosse présentent fréquemment des papillomes œsophagiens ; expérimentalement, une papillomatose a été induite par le papillomavirus bovin 4 (BPV4)[50]. Ces animaux développent fréquemment des cancers de l'œsophage, et 96 % des animaux qui présentent ce cancer sont également porteurs de papillomes induits par le BPV4. On a démontré que l'ingestion de fougères (qui sont riches en carcinogène et en immunosuppresseurs, par exemple l’azathioprine), était un facteur de la transformation maligne des papillomes[51].
Chez l'homme, on retrouve fréquemment le VPH par PCR dans les SCC (de 25 % à 40 % dans les études) de type 6, 11, 16, 18 et 30, mais le plus souvent de type 16[52]. Comme pour les lésions bénignes, on retrouve plus fréquemment le VPH dans les coupes de SCC en provenance de pays à risque élevé ou à haut risque, que dans celles provenant de pays à faible risque[53].
Il est actuellement admis que le VPH n'est qu'un cofacteur de carcinogénèse en ce qui concerne les carcinomes épidermoïdes de l'œsophage, agissant en synergie avec d'autres facteurs de risque (nitrosamines, mycotoxines, consommation d'opium, de tabac, d'alcool, etc.)[54].
70 % des cancers cervicaux seraient attribuables au VHP[55].
Manifestations cliniques des infections à papillomavirus
Manifestation au niveau des muqueuses
Au niveau du col de l'utérus
Une infection à papillomavirus peut être complètement asymptomatique et n'être découverte qu'à l'occasion d'un frottis de dépistage par les modifications cytologiques des cellules de l'épithélium malphighien du col. La première phase ou « infection productive initiale » par un virus oncogène ou pas se manifeste par des modifications pathognomoniques cellulaire aboutissant à une cellule nommée le kolocyte. Si une biopsie est pratiquée au niveau cervical, on peut trouver des modifications de l' épithélium cervical nommée CIN I ou lésion intra épithéliale de bas grade. Cette infection se guérit spontanément dans 90 % des cas, après un long moment (jusqu'à deux ans).
La majorité des femmes infectés par le virus ne présentent aucune anomalie cytologique.
Les lésions histologiques dites de bas grade (CIN 1) représentent l’expression transitoire d’une infection productive qui n’évolue que rarement et lentement (± cinq ans) vers une lésion histologique de haut grade. Ces lésions de bas grade ont une propension importante à régresser spontanément : environ 60 % ont disparu au bout de 3 ans et près de 90 %, après 10 ans de surveillance. Elles sont très fréquente chez les jeunes femmes.
Si le corps humain n'arrive pas à se débarrasser du virus (clairance virale), le virus va entraîner des modifications au niveau de l'ADN du noyau cellulaire s'accompagnant progressivement de modification atteignant toute la cellule. Au début ces lésions sont trop minimes pour connaître si elles sont en rapport avec une infection à VPH et le cytologiste exprimera son doute par le terme ASCUS acronyme anglais pour altération cellulaire de signification indéterminé. Puis, si la cellule malphigienne est profondément atteinte par le virus, son noyau grossit, la cellule perd sa forme allongée pour devenir ronde, le rapport nucléo-cytoplasmique s'inverse et devient supérieur à un. Si une biopsie est pratiquée, en fonction de la profondeur de l'atteinte de l'épithélium malpighien multicellulaire (plusieurs couches de cellules) l'anatomopathologiste parlera de CIN II CIN II+ ou CIN III. Tous ces termes sont regroupés sous le terme de lésion intra épithéliale de haut grade selon la nouvelle classification de Bethesda.
Condylome plan
Les lésions kératinisées sont légèrement surélevées.
Papillomatose laryngée juvénile
Maladie rare pouvant mettre en cause le pronostic vital par sa nature récurrente et sa localisation respiratoire. Elle apparaît après cinq ans ou survient chez des adultes jeunes de vingt à quarante ans. Elle est due aux VPH 6 et 11. La forme juvénile est probablement en rapport avec une transmission au cours de 'l’accouchement ce qui n'est pas le cas de la forme de l'adulte.
Papillomatose orale floride
Tumeurs bénignes de l'œsophage
Le papillomavirus humain (VPH) est également retrouvé au niveau d'autres épithéliums malpighiens[56], de la muqueuse oropharyngée mais surtout de la muqueuse œsophagienne. VPH y est souvent observé au sein de lésions bénignes ou malignes[57] où il induit la formation des cellules pathognomoniques de l'infection : les koïlocytes. Les lésions bénignes au niveau de l'œsophage sont des papillomes viraux (squamous cell papillomas, SCP).
L'implication du VPH est fortement suspectée au vu de l'existence d'une koïlocytose plus ou moins prononcée dans ces lésions mais la preuve n'en est apportée par PCR que dans 20 % des cas (0 % dans les pays à faible risque par exemple la Finlande[58], supérieur à 50 % dans les pays à haut risque par exemple la Chine lors d'une campagne de dépistage du cancer de l'œsophage[59].
Ceci permet de penser que le VPH (essentiellement les types 6, 11 et 16), s'il n'est pas suffisant pour induire la formation de papillomes, a très certainement un rôle de cofacteur dans l'apparition de ces tumeurs bénignes[60]. Il semble que très peu de papillomes puissent évoluer vers un carcinome épidermoïde[61].
Manifestation cutanée
De 1 % à 2 % des hommes et des femmes infectés présenteront des condylomes exophytiques cliniquement visibles. La période d’incubation est d'environ deux à trois ans pour les condylomes exophytiques, exceptionnellement jusqu'à quatre ans après le rapport à risque. Les lésions exophytiques cliniquement visibles sont rarement associées au cancer : seuls certains génotypes du VPH sont associés aux cancers du col de l’utérus, de la vulve, du pénis et au cancer anorectal. L'ADN de certains sérotypes d'HPV serait présent dans au moins 80-90 % des lésions cervicales dysplasiques (néoplasies cervicales intra-épithéliales) et des cancers du col de l'utérus (VPH 16, 18, 31, 33 ou 35)[5]. Les génotypes (VPH 6 et 11) qui causent le plus souvent les condylomes exophytiques n’ont pas été associés à ces cancers.
Verrues plantaires
Verrues vulgaires
Verrues planes
Condylome
Terme utilisé pour parler des verrues génitales.
Des excroissances sur la peau ou les muqueuses de la région anogénitale sont souvent multiples et polymorphes avec apparence exophytique variant entre une excroissance digitiforme ou en chou-fleur et une lésion papuleuse. Ils peuvent être exceptionnellement situés dans la zone orale[62]. Chez l'homme, ces verrues peuvent évoluer à long terme en cancer du pénis[63],[64].
La présence de condylomes anogénitaux chez un enfant doit faire discuter la possibilité de sévices sexuels.
Epidermodysplasie veruciforme
L'épidermodysplasie verruciforme (EV) ou syndrome de Lutz-Lewandowsk résulte d'une anomalie génétique. Une génodermatose rare sous l'effet du papillomavirus humain entraîne l'apparition de lésions cutanées polymorphes et présentant un risque élevé de cancer de la peau. Dans la plupart des cas, la maladie se transmet selon un mode autosomique récessif. Cependant, des modes de transmission liés au sexe et autosomiques dominants ont également été rapportés.
Un pêcheur indonésien, Dede Koswara[65], fut surnommé « l'homme-arbre » en raison de la spectaculaire infection qu'il a développée. Son corps entier s'est couvert d'excroissances ayant l'aspect de champignons ou de racines, faisant paraître sa peau telle de l'écorce. Il fut opéré en 2008, dans la perspective de retrouver un aspect et une vie normale[66]. Il est décédé le (sans lien avec cette maladie).
Condylome géant ou tumeur de Buschke-Loewenstein

Décrit initialement en 1925[67] sur le pénis, le condylome géant est parfois appelé tumeur de Buschke-Loewenstein en référence aux médecins les ayant décrits pour la première fois. Cette lésion envahit généralement les tissus locaux et ne se guérit pas spontanément. Malgré un développement envahissant local à croissance lente, le condylome géant est rarement métastatique[68] mais il a un taux élevé de récidive. Ce condylome est provoqué par les VPH 6 et 11.
La papulose bowénoïde
Papillomavirus et grossesse
Une étude de 2016 montre une prévalence globale du VPH dans les grossesses normales à terme à 17,5 % (IC à 95 %; 17,3 à 17,7) pour le col de l'utérus, à 8,3 % (IC à 95 % ; 7,6 à 9,1) pour le tissu placentaire, à 5,7 % (IC à 95 % ; 5,1 à 6,3) pour le liquide amniotique et 10,9 % (IC à 95 % ; 10,1 à 11,7) pour le sang de cordon ombilical[69].
Par contre, l'immuno-dépression de la grossesse ne semble pas empêcher la disparition du virus du fait de l'organisme. La clairance est la même que chez les femmes non-enceintes[70].
Effet de la grossesse sur les infections à VPH
Les lésions cutanées comme les condylomes acuminés peuvent avoir une croissance très accélérée au cours de la grossesse. Il est fréquent qu'ils se multiplient en nombre ou que leur taille s'accroisse fortement mais après l’accouchement ces condylomes régressent spontanément.
Les condylomes acuminés sont des lésions génitales symptomatiques causées par le virus du papillome humain. Les patientes qui ont des condylomes acuminés pendant la grossesse constituent un groupe à risque particulier. Pendant la grossesse, les sécrétions vaginales en contact avec la peau et les muqueuses sont plus abondantes[71], ce qui signifie que la vulve sera souvent en contact avec le VPH. Plusieurs facteurs associés à la grossesse peuvent favoriser la croissance de lésions induites par le VPH, par exemple les hormones de grossesse et l'immunodépression physiologique de la grossesse. Les condylomes acuminés pendant la grossesse sont normalement caractérisés par des verrues à croissance rapide[72].
Effet de l'infection virale en cas de grossesse
Selon une étude, les femmes ayant accouché prématurément et celles ayant eu une fausse couche ont une fréquence significativement plus élevée d'infection au VPH[69]. Cette étude a été confirmée par une autre qui lie le risque non à la présence de l'infection par VPH ou de lésion de bas grade mais uniquement à la présence de lésion de haut grade[73].
Transmission maternofœtale
La transmission du VPH de la mère à l'enfant au moment de la naissance a été démontrée en 1989. Chez environ 50 % des nouveau-nés issus d'une mère infectées par le VPH, celui-ci est retrouvé par PCR dans la cavité buccale du nouveau-né . Plus de 50 % de ces nouveau-nés étaient toujours porteurs du même type de VPH 6 mois après la naissance. La transmission du virus au moment du passage du fœtus dans la filière génitale maternelle est probablement la cause la plus fréquente mais une transmission transplacentaire est très probable car de l'ADN de VPH a été retrouvé dans le liquide amniotique avant toute rupture des membranes et dans le sang du cordon. L'apparition chez un bébé d'une papillomatose laryngée quelques semaines après la naissance plaide en faveur d'un passage transplacentaire.
Accouchement et infection papillomavirus
Dans les années 1980, certains proposaient une césarienne en cas de condylome cervical pour une papillomatose laryngée infection récurrente difficile à soigner. Au vu des connaissances actuelles, de la possibilité du typage du VPH (la papillomatose laryngée est due aux types 6 et 11), cette attitude est très contestable surtout la connaissance que l'infection VPH est le plus asymptomatique.
Effet sur le fœtus
il n'y a pas de malformation fœtale décrite en rapport avec une infection à papillomavirus. La croissance fœtale n'est pas altérée.
La transmission périnatale d’une infection symptomatique semble rare. Lorsqu'elle survient, l’infection est associée à des lésions génitales et à des lésions des cordes vocales. On ignore la durée de la période d’incubation. Habituellement, la transmission périnatale devient cliniquement apparente au cours des deux premières années de vie.
Pouvoir pathogène et génotype
Le pouvoir pathogène des papillomavirus humains dépend :
- du statut immunitaire de la personne infectée : les déficits immunitaires favorisent ce type d'infection (immunodépression congénitale, transplantations, VIH, traitements immuno-suppresseurs, grossesse) ;
- de l'existence d'un tabagisme ;
- de facteurs génétiques favorisant la transformation maligne des lésions dues aux VPH ;
- du type de VPH : les types VPH 6 et VPH 11 causent des lésions cutanées et muqueuses bénignes (verrues vulgaires, verrues plantaires, verrues planes, condylomes anogénitaux, verrues génitales, épidermodysplasie verruciforme et papillomes laryngiens) ; les types VPH 16, 18, 31, 33 et 35 sont associés à des néoplasies cervicales intra-épithéliales et au cancer du col de l'utérus.
Les VPH 16 et 18 sont les types les plus souvent associés à une lésion épithéliale de haut grade, à une transformation persistante de la maladie et à la progression vers un cancer invasif. Les sérotypes 16 et 18 du VPH causent 25 % des CIN I, 50 à 60 % des CIN 2 à 3 et 70 % des cancers du col de l'utérus[74].
Prévention
La vaccination est l'unique mode de prophylaxie efficace mais ne couvre pas l'ensemble des souches du virus ni les personnes déjà infectées par le virus. L'utilisation du préservatif n'est en revanche pas un mode de protection fiable pour se prémunir du virus[10]. Le risque de contamination est directement corrélé avec le nombre de partenaires sexuels[75], ce risque augmentant ainsi fortement à chaque partenaire supplémentaire. Certaines études suggèrent que la circoncision diminuerait le risque de transmission du virus[76] mais ne peut en aucun cas remplacer la vaccination. Les frottis de dépistage réguliers permettent de détecter l'infection une fois déclarée et d'envisager un traitement rapide. La Haute Autorité de santé (HAS) recommande l’utilisation du test VPH en première intention lors du dépistage du cancer du col de l’utérus à partir de 30 ans[77]. De manière préventive, il est recommandé de rechercher les HPV à haut risque, par un prélèvement cervical chez la femme de 30 à 65 ans[78]. De plus, en cas de test négatif, le recours au test VPH permet d’allonger l’intervalle entre deux dépistages — passant de tous les trois ans à tous les cinq ans après trente ans[77]. Avant trente ans, la HAS recommande toujours la recherche d'altération cellulaire par le frottis de 25 à 30 ans. Le dépistage est pour toutes les femmes de 25 à 65 ans, qu’elles soient vaccinées ou non.
En 2019, à la demande d'Agnès Buzyn, la HAS étudie la question de l'intérêt d'une vaccination plus systématique des garçons contre les papillomavirus[79]. La ministre note qu'en Australie, où elle est recommandée pour les jeunes hommes, la vaccination anti-VPH a permis une baisse drastique de la circulation du virus, et elle a annoncé qu'elle « suivrait l'avis de la HAS » à ce sujet[79]. Le , « la HAS recommande l’élargissement de la vaccination anti-VPH (…) à tous les garçons de 11 à 14 ans révolus (…), avec un rattrapage possible pour tous les adolescents et jeunes adultes de 15 à 19 ans révolus »[80].
La vaccination concerne les jeunes avant leurs premières relations sexuelles. Il protège contre les 9 souches les plus préoccupantes : HPV 6, 11, 16, 18, 31, 33, 45, 52 et 58. En France, la vaccination est recommandée entre 11 et 14 ans[81] alors que l'OMS la recommande entre 9 et 13 ans[11]. La vaccination ne manque pas d'intérêt à un âge plus avancé, chez des femmes qui n'ont jamais été infectées par au moins un des types viraux contenus dans le vaccin ; dans ce cas, le vaccin a la même efficacité protectrice que chez des sujets plus jeunes[82]. En France, le plan cancer 2014-2019 avait fixé une couverture minimale contre les VPH de 60 % chez les filles ; or, actuellement, le taux de couverture n'excède pas 30 % et il est le plus bas en Europe. La HAS recommande en la vaccination des garçons[83] avec maintien d’une recommandation vaccinale spécifique pour les hommes ayant des relations sexuelles avec des hommes jusqu’à 26 ans révolus[83]. La vaccination pour les filles est inchangée et est recommandée entre 11 et 14 ans, alors que l'OMS la recommande entre 9 et 13 ans[11], mais un rattrapage peut avoir lieu jusqu'à 19 ans[12]. La vaccination ne dispense pas de la poursuite du dépistage du cancer du col de l'utérus.
Plus récemment, au mois de mars 2023, le président Emmanuel Macron a décidé d'engager une campagne vaccinale contre ces virus responsables de lésion précancéreuses en s'attirant la critique de la sphère Antivax au sujet de risques éventuels concernant cette vaccination à l'instar des vaccins sur le Covid 19[84],[85],[86]. La fédération de la Ligue nationale pour la liberté des vaccinations soutient que le vaccin serait plus dangereux que la maladie[87]. Pourtant l'apparition de cancer n'intervient qu'au bout de 25 à 30 ans[88].
Traitement et prise en charge
Les condylomes sont souvent récurrents. Cependant, on observe une disparition complète des condylomes génitaux externes chez 80 % des patients qui en présentent. Il n'existe aucun traitement permettant la guérison d'une infection à papillomavirus. Après le traitement, il se peut que le virus soit toujours présent même si les condylomes ont disparu. Il est donc important de surveiller la réapparition des lésions pendant plusieurs mois après la résection.
Destruction par les agents physiques
La méthode la plus fréquemment utilisée est l’électrocoagulation au bistouri électrique, l’azote liquide voire l’exérèse aux ciseaux en cas de lésions peu nombreuses et de la marge anale.
Destruction par agents chimiques
Podophyllotoxine
Fluorouracil
Imiquimod
Traitement au cours de la grossesse
La cryothérapie associée à l’application de proanthocyanidines ont donné de bons résultats dans cette étude[89].
Notes et références
- ↑ (en) « Genus : Alphapapillomavirus / ICTV », sur ictv.global (consulté le ).
- ↑ https://ictv.global/ictv/proposals/2010.001a-kkkV.A.v2.Papillomaviridae.pdf
- ↑ « Le VPH, un virus très répandu: les condylomes, vous connaissez? », sur passeportsante.net. - Les VPH de type 6 et 11 causent des infections bénignes. Ils sont toutefois responsables de 90 % des cas de verrues génitales (condylomes). Ces verrues évoluent rarement en cancer. Mais elles peuvent causer la dysfonction sexuelle et même la dépression, en plus de perturber la vie de couple.
- ↑ Allodocteurs.fr - Papillomavirus : comment s'en protéger ? - 23/4/2018
- 1 2 3 (en) Walboomers JM, Jacobs MV, Manos MM. et al. « Human papillomavirus is a necessary cause of invasive cervical cancer worldwide » J Pathol. 1999;189:12-19.
- ↑ (en) Harald zur Hausen, « Papillomaviruses and cancer: from basic studies to clinical application », Nature Reviews Cancer, vol. 2, no 5, , p. 342–350 (ISSN 1474-175X et 1474-1768, DOI 10.1038/nrc798, lire en ligne, consulté le )
- ↑ (en) David Forman, Catherine de Martel, Charles J. Lacey et Isabelle Soerjomataram, « Global Burden of Human Papillomavirus and Related Diseases », Vaccine, vol. 30, , F12–F23 (DOI 10.1016/j.vaccine.2012.07.055, lire en ligne, consulté le )
- ↑ International Agency for Research on Cancer IARC. Monographs on the evaluation of carcinogenic risks to humans: biologic agents. Human papillomaviruses. Vol. 100B. Lyon, France: IARC; 2012.
- ↑ « Papillomavirus : la vaccination recommandée pour tous les garçons », sur Haute Autorité de Santé (consulté le )
- 1 2 Sudinfo.be - Le préservatif protège-t-il contre les infections à papillomavirus? - 20 novembre 2014.
- 1 2 3 20 minutes - Papillomavirus, l'OMS recommande la vaccination dès 9 ans - Par ailleurs le dépistage à partir de 18 ans des infections au papillomavirus, responsable de 99 % des cancers du col de l'utérus qui tue plus de 270 000 femmes par an, pourra se faire tous les cinq ans en cas de résultats négatifs, contre deux ans actuellement dans de nombreux pays.
- 1 2 Papillomavirus : pourquoi les jeunes garçons doivent aussi se faire vacciner.
- ↑ « Près un homme sur trois est porteur d'un papillomavirus humain », sur BFMTV,
- ↑ Florence Méréo, « Un patron brise les tabous du cancer », Le Parisien, no 24383, (lire en ligne)
- ↑ (en) Heidi M. Bauer, « Genital Human Papillomavirus Infection in Female University Students as Determined by a PCR-Based Method », JAMA: The Journal of the American Medical Association, vol. 265, no 4, , p. 472 (ISSN 0098-7484, DOI 10.1001/jama.1991.03460040048027, lire en ligne, consulté le ).
- ↑ Guan J, Bywaters SM, Brendle SA, Ashley RE, Makhov AM, Conway JF, Christensen ND, Hafenstein S, « Cryoelectron Microscopy Maps of Human Papillomavirus 16 Reveal L2 Densities and Heparin Binding Site », Structure, vol. 25, no 2, , p. 253–263 (PMID 28065506, DOI 10.1016/j.str.2016.12.001).
- ↑ (en) IARC, Biological Agents, (ISBN 978-92-832-1319-2 et 978-92-832-0134-2, lire en ligne).
- 1 2 François Denis, Les virus transmissibles de la mère à l'enfant, Paris, John Libey Eurotext, , 464 p. (ISBN 2-7420-0195-6, lire en ligne), p. 278 et 284.
- ↑ « Cervical Intraepithelial Neoplasia - an overview | ScienceDirect Topics », sur www.sciencedirect.com (consulté le ).
- ↑ (en) Bernard HU, Burk RD, Chen Z, van Doorslaer K, zur Hausen H, de Villiers EM. « Classification of papillomaviruses (PVs) based on 189 PV types and proposal of taxonomic amendments » Virology 2010;401(1):70-9. DOI 10.1016/j.virol.2010.02.002.
- ↑ (en) Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S, « Human papillomavirus and cervical cancer » Lancet 2007;370:890-907.
- ↑ Animation montrant le rôle des différents gènes au cours de l'infection d'un épithélium malpighien par HPV 16.
- ↑ « Recommandation sur l’élargissement de la vaccination contre les papillomavirus aux garçons », sur Haute Autorité de Santé (consulté le ).
- ↑ [vidéo] HPV Infection sur YouTube.
- ↑ (en) Ana Cecilia Rodríguez, Mark Schiffman, Rolando Herrero et Sholom Wacholder, « Rapid Clearance of Human Papillomavirus and Implications for Clinical Focus on Persistent Infections », JNCI: Journal of the National Cancer Institute, vol. 100, no 7, , p. 513–517 (ISSN 0027-8874, PMID 18364507, PMCID PMC3705579, DOI 10.1093/jnci/djn044, lire en ligne, consulté le ).
- ↑ (en) Weinstock H, Berman S, Cates W. « Sexually transmitted infections in American youth: incidence and prevalence estimates; 2000 » Perspect Sex Reprod Health 2004;36:6-10.
- ↑ L'estimation de la prévalence dépend en fait des techniques utilisées pour la détection des papillomavirus : recherche du génome, d'anticorps spécifiques. La présence de virus ne signifie pas pour autant qu'il y a infection symptomatique.
- ↑ (en) Eileen F. Dunne, Elizabeth R. Unger, Maya Sternberg, Geraldine McQuillan, David C. Swan, Sonya S. Patel, Lauri E. Markowitz. « Prevalence of HPV infection among females in the United States » JAMA. 2007;297:813-819.
- ↑ (en) Gillian Prue, « Protecting boys as well as girls by vaccinating against human papillomavirus may cut the incidence of genital warts and several cancers among both sexes », British Medical Journal, vol. 349, (DOI https://dx.doi.org/10.1136/bmj.g4834, résumé).
- 1 2 3 4 5 6 7 (en) Shandra Devi Balasubramaniam, Venugopal Balakrishnan, Chern Ein Oon et Gurjeet Kaur, « Key Molecular Events in Cervical Cancer Development », Medicina, vol. 55, no 7, , p. 384 (ISSN 1010-660X, PMID 31319555, PMCID PMC6681523, DOI 10.3390/medicina55070384, lire en ligne, consulté le ).
- ↑ (en) Mark Schiffman, John Doorbar, Nicolas Wentzensen et Silvia de Sanjosé, « Carcinogenic human papillomavirus infection », Nature Reviews Disease Primers, vol. 2, no 1, (ISSN 2056-676X, DOI 10.1038/nrdp.2016.86, lire en ligne, consulté le ).
- 1 2 (en) Jan M. M. Walboomers, Marcel V. Jacobs, M. Michele Manos et F. Xavier Bosch, « Human papillomavirus is a necessary cause of invasive cervical cancer worldwide », The Journal of Pathology, vol. 189, no 1, , p. 12–19 (ISSN 1096-9896, DOI 10.1002/(SICI)1096-9896(199909)189:13.0.CO;2-F, lire en ligne, consulté le ).
- ↑ (en) N. Munoz, F. X. Bosch, S. de Sanjose et L. Tafur, « The causal link between human papillomavirus and invasive cervical cancer: A population-based case-control study in Colombia and Spain », International Journal of Cancer, vol. 52, no 5, , p. 743–749 (ISSN 1097-0215, DOI 10.1002/ijc.2910520513, lire en ligne, consulté le ).
- ↑ (en) Alexander Meisels et Carol Morin, « Human papillomavirus and cancer of the uterine cervix », Gynecologic Oncology, vol. 12, no 2, , S111–S123 (ISSN 0090-8258, DOI 10.1016/0090-8258(81)90066-4, lire en ligne, consulté le ).
- ↑ Christine Bergeron, Guglielmo Ronco, Miriam Reuschenbach et Nicolas Wentzensen, « The clinical impact of using p16INK4aimmunochemistry in cervical histopathology and cytology: An update of recent developments », International Journal of Cancer, vol. 136, no 12, , p. 2741–2751 (ISSN 0020-7136, DOI 10.1002/ijc.28900, lire en ligne, consulté le ).
- 1 2 3 (en) Katrina F. Brown, Harriet Rumgay, Casey Dunlop et Margaret Ryan, « The fraction of cancer attributable to modifiable risk factors in England, Wales, Scotland, Northern Ireland, and the United Kingdom in 2015 », British Journal of Cancer, vol. 118, no 8, , p. 1130–1141 (ISSN 1532-1827, PMID 29567982, PMCID 5931106, DOI 10.1038/s41416-018-0029-6, lire en ligne, consulté le ).
- ↑ (en) J. J. Carter, M. M. Madeleine, K. Shera et S. M. Schwartz, « Human papillomavirus 16 and 18 L1 serology compared across anogenital cancer sites », Cancer Research, vol. 61, no 5, , p. 1934–1940 (ISSN 0008-5472, PMID 11280749, lire en ligne, consulté le ).
- ↑ (en) L. Alemany, M. Saunier, L. Tinoco et B. Quirós, « Large contribution of human papillomavirus in vaginal neoplastic lesions: A worldwide study in 597 samples », European Journal of Cancer, vol. 50, no 16, , p. 2846–2854 (DOI 10.1016/j.ejca.2014.07.018, lire en ligne, consulté le ).
- 1 2 (en) Hugo De Vuyst, Gary M. Clifford, Maria Claudia Nascimento et Margaret M. Madeleine, « Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta-analysis », International Journal of Cancer, vol. 124, no 7, , p. 1626–1636 (ISSN 1097-0215, PMID 19115209, DOI 10.1002/ijc.24116, lire en ligne, consulté le ).
- 1 2 (en) Maria Blomberg, Soren Friis, Christian Munk et Andrea Bautz, « Genital Warts and Risk of Cancer: A Danish Study of Nearly 50 000 Patients With Genital Warts », The Journal of Infectious Diseases, vol. 205, no 10, , p. 1544–1553 (ISSN 1537-6613 et 0022-1899, DOI 10.1093/infdis/jis228, lire en ligne, consulté le ).
- ↑ (en) « Risks and causes | Anal cancer », sur about-cancer.cancerresearchuk.org (consulté le ).
- ↑ (en) Andrew E. Grulich, I. Mary Poynten, Dorothy A. Machalek et Fengyi Jin, « The epidemiology of anal cancer », Sexual Health, vol. 9, no 6, , p. 504 (ISSN 1448-5028, DOI 10.1071/SH12070, lire en ligne, consulté le ).
- ↑ (en) « Risks and causes | Penile cancer », sur cancerresearchuk.org (consulté le ).
- ↑ « Vacciner les filles et les garçons contre le Papillomavirus humain (HPV) : une nécessité pour éliminer les cancers du col utérin mais aussi de l’oropharynx, de la cavité buccale et de l’anus », sur Académie nationale de médecine, (consulté le ).
- ↑ (en) Anil K. Chaturvedi, Barry I. Graubard, Tatevik Broutian et Robert K.L. Pickard, « Effect of Prophylactic Human Papillomavirus (HPV) Vaccination on Oral HPV Infections Among Young Adults in the United States », Journal of Clinical Oncology, vol. 36, no 3, , p. 262–267 (ISSN 0732-183X, PMID 29182497, PMCID PMC5773841, DOI 10.1200/JCO.2017.75.0141, lire en ligne, consulté le ).
- ↑ (en) Ligia A. Pinto, Troy J. Kemp, B. Nelson Torres et Kimberly Isaacs-Soriano, « Quadrivalent Human Papillomavirus (HPV) Vaccine Induces HPV-Specific Antibodies in the Oral Cavity: Results From the Mid-Adult Male Vaccine Trial », The Journal of Infectious Diseases, vol. 214, no 8, , p. 1276–1283 (ISSN 0022-1899, DOI 10.1093/infdis/jiw359, lire en ligne, consulté le ).
- ↑ Novakovic D, Cheng ATL, Zurynski Y, et al. ProspectiveStudy of the incidence of juvenile-onset recurrent respi-ratory papillomatosis after implementation of a nationalHPV vaccination program. J Infect Dis 2018;217:208—1.
- 1 2 (en-US) « How Many Cancers Are Linked with HPV Each Year? », sur cdc.gov, (consulté le ).
- ↑ (en) Jarrett WFH, McNeil PE, Grimshaw TR, Selman IE, McIntyre WIM. « High incidence area cattle cancer with a possible interaction between an environmental carcinogen and a papillomavirus » Nature 1978;274:215-217.
- ↑ (en) Jarrett WFH. « Environmental carcinogens and papillomaviruses in the pathogenesis of cancer » Proc R Soc Lond B. 1987;231:1-11.
- ↑ (en) Campo MS. « Papillomas and cancer in cattle » Cancer Surv. 1987;6:39-54.
- ↑ (en) Chang F, Syrjänen S, Shen Q, Ji HX, Syrjänen K. « Human papillomavirus (HPV) DNA in esophageal precancer lessons and squamous cell carcinomas from China » Int J Cancer 1990;45:21-25.
- ↑ (en) Chang F, Syrjänen SM, Wang I, Syrjänen K. « Infectious agents in the etiology of esophageal cancer » Gastroenterology 1992;103:1336-1348.
- ↑ (en) Miller BA, Davidson M, Myerson D, Icenogle J, Lanier AP, Tan J, Beckmann AM. « Human papillomavirus type 16 DNA in esophageal carcinomas from Alaska natives » Int J Cancer 1997;71:218-222.
- ↑ (en) « This Is How HPV Causes Cancer », Youtube, University of California, , p. 2min50 (lire en ligne)
- ↑ (en) Syrjänen K. et Syrjänen S. 2000. Papillomavirus infections in human pathology. J. Wiley and Sons, New York.
- ↑ (en) Syrjänen KJ. « Histological changes identical to thoses of condylomatous lesions found in esophageal squamous cell carcinomas » Arc Geschwulstforsch. 1982;52:283-292.
- ↑ (en) Chang F, Janatuinen E, Pikkarainen P, Syrjänen S, Syrjänen K. « Esophageal squamous cell papillomas. Failure to detect human papillomavirus DNA by in situ hybridization and polymerase chain reaction » Scand J Gastroenterol. 1991;26:535-45.
- ↑ (en) Li T, Lu ZM, Chen KN, Guo M, Xing HP, Mei Q, Yang HH, Lechner JF, Ke Y. « Human papillomavirus type 16 is an important infection factor in the high incidence of esophageal cancer in Anyang area of China » Carcinogenesis 2001;22:929-934.
- ↑ Chang et al., 1991.
- ↑ (en) Van Custen E, Geboes K, Vantrappen G. « Malignant degeneration of esophageal squamous papilloma associated with the human papillomavirus » Gastroenterol. 1992;103:1119-20.
- ↑ « Le condylome acuminé : a propos d’un cas clinique », sur Le courrier du dentiste, .
- ↑ Agence de la santé publique du Canada, « Le virus du papillome humain (VPH) et les hommes : Questions et réponses », sur aem, (consulté le ).
- ↑ http://sidasciences.inist.fr/?Cancer-du-penis-lie-au.
- ↑ (en) Dede Koswara, the 37-year-old known as "Tree Man".
- ↑ Article relatant l'opération.
- ↑ Buschke A, Lowenstein L. Über carcinomahnliche Condylomata Acuminata des Penis. Klin Wochenschr. 1925;4:726–728.
- ↑ Creasman C, Haas PA, Fox TA, Jr, Balazs M. Malignant transformation of anorectal giant condyloma acuminatum (Buschke-Löwenstein tumor) Dis Colon Rectum. 1989;32:481–487.
- 1 2 (en) Lea Maria Margareta Ambühl et Ulrik Baandrup, « Human Papillomavirus Infection as a Possible Cause of Spontaneous Abortion and Spontaneous Preterm Delivery », sur Infectious Diseases in Obstetrics and Gynecology, (PMID 27110088, PMCID PMC4826700, DOI 10.1155/2016/3086036, consulté le ).
- ↑ (en) Gintautas Domža, Živilė Gudlevičienė, Janina Didžiapetrienė et Konstantinas Povilas Valuckas, « Human papillomavirus infection in pregnant women », Archives of Gynecology and Obstetrics, vol. 284, no 5, , p. 1105–1112 (ISSN 0932-0067 et 1432-0711, DOI 10.1007/s00404-010-1787-4, lire en ligne, consulté le ).
- ↑ Cohen E, Levy A, Holcberg G, Wiznitzer A, Mazor M and Sheiner E: Perinatal outcomes in condyloma acuminata pregnancies. Arch Gynecol Obstet. 283:1269–1273. 2011.
- ↑ Wiley DJ, Douglas J, Beutner K, Cox T, Fife K, Moscicki AB and Fukumoto L: External genital warts: Diagnosis, treatment and prevention. Clin Infect Dis. 35(Suppl 2): S210–S224. 2002.
- ↑ (en) Marian C. Aldhous, Ramya Bhatia, Roz Pollock et Dionysis Vragkos, « HPV infection and pre-term birth: a data-linkage study using Scottish Health Data », Wellcome Open Research, vol. 4, , p. 48 (ISSN 2398-502X, PMID 30984880, PMCID PMC6436145, DOI 10.12688/wellcomeopenres.15140.1, lire en ligne, consulté le ).
- ↑ (en) Xavier Bosch et Diane Harper, « Prevention strategies of cervical cancer in the HPV vaccine era », Gynecologic Oncology, vol. 103, no 1, , p. 21–24 (ISSN 0090-8258 et 1095-6859, PMID 16919714, DOI 10.1016/j.ygyno.2006.07.019, lire en ligne, consulté le ).
- ↑ Moscicki AB, Hills N, Shiboski S, et al. Risks for incident human papillomavirus infection and low-grade squamous intraepithelial lesion development in young females. Jama. 2001; 285: 2995-3002.
- ↑ Wawer MJ, Tobian AAR, Kigozi G et Als. Effect of circumcision of HIV-negative men on transmission of human papillomavirus to HIV-negative women: a randomised trial in Rakai, Uganda, Lancet, 2011;377:209-218.
- 1 2 « Dépistage du cancer du col de l’utérus : le test HPV recommandé chez les femmes de plus de 30 ans », sur Haute Autorité de Santé (consulté le ).
- ↑ « Comment dépister le cancer du col de l'utérus », sur Biofutur (consulté le )
- 1 2 AFP, [SEAActu17h-20190123 Cancers : faut-il vacciner les garçons contre les papillomavirus ?], Sciences et avenir, .
- ↑ AFP, Papillomavirus humains : le vaccin bientôt étendu aux garçons ?, Le Monde.
- ↑ 3 % des premiers rapports sexuels ont lieu avant l'âge de 15 ans.
- ↑ (en) Nubia Munoz, Ricardo Manalastas, Punee Pitisuttithum, Damrong Tresukosol, Joseph Monsonego, Kevin Ault, Christine Clavel, Joaquin Luna, Evan Myers, Sara Hood, Olivier Bautista, Janine Bryan, Frank J. Taddeo, Mark T. Esser, Scott Vuocolo, Richard M. Haupt, Eliav Barr et Alfred Saah. « Safety, immunogenicity, and efficacity of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged 24-45 years : a randomised, double-blind trial » Lancet 2009; Vol. 373.
- 1 2 (en) « Health technology assessment (HTA) of extending the national immunisation schedule to include HPV vaccination of boys » [PDF], sur hiqa.ie (en), (consulté le ).
- ↑ « Efficacité, effets secondaires, démissions… Trois affirmations sur les vaccins anti-Covid passées au crible », sur tf1info.fr, (consulté le ).
- ↑ « La campagne pour le vaccin contre le papillomavirus réveille la sphère antivax », sur tf1info.fr, (consulté le ).
- ↑ La rédaction de TF1info, « Les gynécologues s'attaquent aux fake-news sur la vaccination contre les papillomavirus », sur www.tf1info.fr, (consulté le )
- ↑ Antoine Beau, « Vaccin contre le papillomavirus : la nouvelle offensive des antivax », sur lexpress.fr, (consulté le )
- ↑ Antoine Beau, « Papillomavirus : y a-t-il vraiment une hausse des cancers dans les pays ayant le plus vacciné ? », sur TF1info,
- ↑ (en) Li-Juan Yang, Dong-Ning Zhu, Yan-Ling Dang et Xiong Zhao, « Treatment of condyloma acuminata in pregnant women with cryotherapy combined with proanthocyanidins: Outcome and safety », Experimental and Therapeutic Medicine, vol. 11, no 6, , p. 2391–2394 (ISSN 1792-0981 et 1792-1015, PMID 27284325, PMCID PMC4887779, DOI 10.3892/etm.2016.3207, lire en ligne, consulté le )
Voir aussi
Bibliographie
- « Human Papillomaviruses », IARC Monographs on the Evaluation of Carcinogenic Risks to Humans (monographies du CIRC), volume 64, 1995.
- « Human Papillomaviruses », IARC Monographs on the Evaluation of Carcinogenic Risks to Humans (monographies du CIRC), volume 90, 2007.
- « Les papillomavirus humains », La revue Prescrire, no 280, pages 112-117, .
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ICD9Data.com
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) ICD-10 Version:2016
- (en) NCI Thesaurus
- (en) PatientLikeMe
- (cs + sk) WikiSkripta
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- Site du Centre national français de référence des HPV, Institut Pasteur
- Site grand public sur tous les aspects du HPV HPV : Les réponses à vos questions
- « Papillomavirus : la fin à portée de vaccin », La Science, CQFD, France Culture, 6 septembre 2023.