Les pectines (du grec ancien πηκτός / pêktós, « épaissi, caillé »), ou plus largement les substances pectiques, sont des polyosides, rattachées aux glucides. Ce sont des composés exclusivement d’origine végétale. Les pectines sont présentes en grande quantité dans les parois primaires des dicotylédones, et en particulier dans les parois végétales de nombreux fruits et légumes[1]. Elles sont extraites industriellement des coproduits de l'industrie des jus de fruits, principalement des agrumes et en moins grande quantité des marcs de pomme[2].
La pectolyse est la lyse de pectines par des enzymes pectolytiques.
Composition chimique

Ce sont des polysaccharides caractérisés par un squelette d’acide α-D-galacturonique et de faibles quantités de α-L-rhamnose plus ou moins ramifiés. Le modèle généralement accepté décrit les pectines comme un enchaînement de deux structures majoritaires: une chaîne principale homogalacturonique (ou "zone lisse", dénommée HG) et une chaîne rhamnogalacturonique (ou "zone hérissée", dénommée RG)[3],[4].
Les homogalacturonanes sont la principale chaîne qui compose les pectines (représentant en règle générale plus de 60 % des pectines)[3]. Ce sont des polymères d’acide α-D-galacturonique liés en (1→4). La longueur de ces chaînes peut aller de 70 à 100 résidus d’acide galacturonique dans le citron, la betterave sucrière ou dans la pomme[5], c’est-à-dire présentant des masses molaires de l’ordre 12 à 20 kDa. La fonction carboxylique des acides α-D-galacturoniques peut être sous forme acide, ou ionisés par différents cations dont le calcium, ou estérifiée par du méthanol. Par ailleurs les acides galacturoniques peuvent être acétylés en O-2 et /ou O-3[3]. En fonction de ces estérifications, les pectines sont caractérisées par un degré de méthylation (DM) et un degré d’acétylation (DA) qui correspond au rapport des acides galacturoniques estérifiés (méthylés ou acétylés) sur les acides galacturoniques totaux. D’un point de vue fonctionnel, on distingue trois catégories de pectines :
- si un degré de méthylation est inférieur à 5 % (DM<5) il s'agit d'acides pectiques ;
- si le degré de méthylation est inférieur à 50 % (DM<50), il s'agit de pectines faiblement méthylées ;
- si le degré de méthylation est supérieur à 50 % (DM>50), il s'agit de pectines hautement méthylées (HM).
Le degré d’estérification des pectines a un impact sur la flexibilité de la molécule : plus le degré d’estérification est faible, plus la pectine est rigide[6],[7]. Il a également un fort impact sur leurs propriétés de gélification. Les pectines sont synthétisées sous forme fortement méthylée[4] et c'est donc sous cette forme (DM d'environ 70 à 80) qu'elles sont en général présentes dans les parois végétales.
Le squelette de la zone rhamnogalacturonique est construit par la répétition d'un dimère d'acide galacturonique et rhamnose, avec la structure suivante ...α-D-GalA-(1→2)-α-L-Rha-(1→4)- α-D-GalA-(1→2)-α-L-Rha-(1→4)[8]. Ces zones rhamnogalacturoniques présentent de plus des ramifications composées essentiellement de galactose et d'arabinose, portées par la fonction alcool en C3 ou C4 du rhamnose[3].
Deux structures présentes en quantité moindre présentent des ramifications sur la chaîne homogalacturonique.Les homogalacturonanes peuvent être substitués par des unités simples de β-D-xylose lié sur le C3 des acides galacturoniques. Ces zones sont appelées xylogalacturonanes[3].
Les rhamnogalacturonanes de type II ont été isolés d'hydrolysats enzymatiques de parois[9] et ainsi nommés car le rhamnose et l'acide galacturonique sont leurs principaux constituants ; cependant cette dénomination est trompeuse, car ils sont caractérisés par un squelette homogalacturonique portant des ramifications complexes. Les rhamnogalacturonanes de type II sont constitués d’un enchaînement de huit résidus d’acide galacturoniques liés en α-(1→4), substitués par quatre chaînes latérales d’oligosaccharides (A, B, C et D). La chaîne latérale B est liée au cinquième résidu d’acide galacturonique par le carbone 2, en partant de l’extrémité réductrice du squelette, tandis que la chaîne D est principalement liée par le carbone 3 du sixième résidu d’acide galacturonique[10]. Ces rhamnogalacturonanes comportent 12 oses différents dont certains sont rares tels que l’apiose, le 2-O-méthyl- L-fucose, le 2-O-méthyl-D-xylose, l’acide acérique (3-C-carboxy-5-deoxy-L-xylose), le Kdo (acide 3-deoxy-D-manno-octolosonique) et le Dha (acide 3-deoxyD-lyxo-heptulosarique)[9]. Leur structure est très conservée dans l'ensemble des plantes terrestres, et ils jouent un rôle majeur dans l'intégrité et la cohésion des parois végétales, où ils permettent la réticulation des chaînes pectiques par l'intermédiaire de ponts borates[4],[11].
Propriétés chimiques
Les molécules d’acide uronique possèdent des fonctions carboxyles. Cette fonction confère aux pectines la capacité d’échanger des ions. Dans le cas des parois végétales, ces ions sont surtout le calcium provenant de la circulation apoplasmique. Ces ions bivalents ont la capacité de former des ponts calciques entre deux groupements carboxyles de deux molécules de pectine différentes. La cellule contrôle la proportion de fonction carboxyle. En effet, elle peut estérifier de manière réversible ses fonctions en les méthylant par une pectine-méthylestérase. Selon la proportion de monomères méthylés ou non, la chaîne est plus ou moins acide. Cette acidité est également contrôlée par des pompes à protons régulé notamment par l’auxine. La concentration forte en protons provoque alors le remplacement du calcium.
Une forte proportion de fonction carboxyle dans un pH alcaline favorise la cohésion des molécules de pectines entre elles. Des chaînes peuvent ainsi se lier et les pectines forment alors un gel. De même qu’une augmentation de la méthylation couplé à une forte acidité favorise le relâchement de la pectine. Expérimentalement, les chercheurs peuvent interrompre cette gélification en enlevant artificiellement le calcium. Ceci est réalisé lors de l’extraction par l’EDTA, qui est un chélateur puissant du calcium. Cela peut également être réalisé aussi si on diminue le pH.
Rôles physiologiques
Les pectines sont un des constituants de la paroi végétale. Elles sont également le composé prédominant au sein de la lamelle moyenne. Elles maintiennent ensemble les cellules des tissus végétaux. Les pectines jouent un rôle structural dépendant des conditions ioniques du milieu (rapport H+/Ca2+). Les chaînes formées sont reliées entre elles pour constituer un réseau ou gel. Cet ensemble permet d’emmagasiner une grande quantité d’eau. L’hydrolyse des pectines est remarquable lors de la maturation des fruits lorsque les fibres de cellulose deviennent plus lâches.
Applications industrielles
L’hydrolyse des pectines est nécessaire pour permettre la clarification spontanée des jus de fruits ou des moûts avant fermentation alcoolique comme dans le cas de l’élaboration du vin rosé. Elle est alors réalisée par enzymage.
Intérêt culinaire

La pectine du commerce, dont celle souvent utilisée pour épaissir les confitures et les gelées, est extraite du marc de pommes desséchées. Elle est vendue sous forme liquide ou de cristaux. On trouve aussi du sucre gélifiant, préadditionné de pectine. L’union européenne autorise l’utilisation de la pectine comme texturant alimentaire, sous le numéro E440. La réussite des confitures et des gelées dépend de la proportion de sucre, de pectine et d’acides contenus dans les fruits utilisés.
Une étude[12] publiée en 2002 n’a pas trouvé d’interaction moléculaire spécifique entre composés odorants et pectine, mais confirme que la pectine, même à faible dose (0,1 %) ne modifie pas les composés odorants; elle les bloque ou en freine l’extraction spontanée dans les confitures ou gelées lorsqu’ils sont volatils et/ou hydrophobes. Ces molécules odorantes sont encagées dans le maillage tridimensionnel des molécules de pectines, mais elles sont pour partie relâchées et reconnues par les récepteurs olfactifs lorsque la confiture ou la gelée est mangée.
Modification génétique
Des chercheurs américains ont modifié le génome de la tomate. Cette modification porte sur les gènes qui codent la formation des pectines. Ceci se traduit par un pourcentage de pectines moindre dans les tomates transgéniques. Cette déficience en pectine permet d’obtenir des tomates plus fermes plus longtemps. Ces tomates sont les premiers végétaux transgéniques comestibles mis sur le marché américain.
Intérêt médical
La pectine a des propriétés entérosorbantes, c’est-à-dire qu’elle peut absorber certains métaux lourds et radionucléides lors de son passage dans le tube digestif. Cette propriété pourrait être liée à sa capacité à échanger des ions. Elle semble aussi pouvoir limiter l'entérocolite induite par certains toxiques absorbés avec l'alimentation, dont des médicaments tels que le méthotrexate[13]
La pectine est, selon des scientifiques biélorusses ayant travaillé sur les conséquences de la catastrophe de Tchernobyl, capable d’aider l’organisme à ne pas absorber certains radionucléides, dont le césium 137 radioactif, et ceci, sans les effets secondaires des chélateurs chimiques, mais avec d’autres effets. Elle semble aussi pouvoir aider l’organisme à mieux ou plus rapidement se débarrasser du Césium qu’il contient.
Son efficacité est controversée voire douteuse[14], mais la pectine est par exemple utilisée en complément alimentaire chez les enfants vivant dans les zones exposées aux retombées de Tchernobyl, qui sont victimes de pathologies liées à l’accumulation du césium 137 ingéré avec la boisson ou la nourriture. Vassili Nesterenko[15] cite[16] une expérience ayant porté sur 64 enfants du district bélarus de Gomel, très contaminé par les retombées de Tchernobyl. Ces enfants ont passé un mois dans un sanatorium où ils n’ont consommé que de la nourriture non contaminée. Un groupe-témoin a pris de la pectine matin et soir ; l’autre, un placebo. Après un mois, les enfants du groupe pectine ont vu leur taux de césium 137 diminuer de 62,6 %. Dans l’autre groupe, le césium n’a baissé que de 13,9 %[17].
Nesterenko a comparé les comprimés effervescents ukrainiens de pectine de pomme à des algues connues (spiruline) pour leur capacité de fixer le radiocésium, ainsi qu’à une préparation développée à Minsk, tirée des résidus séchés de pomme, obtenus après l’extraction du jus. Les experts du Centre de Recherche de la Commission Européenne à Ispra ont analysé cette préparation et noté qu’elle contient 15 à 16 % de pectine. Mélangée à de l’eau ou du lait, cette forme galénique est mieux acceptée et tolérée par les enfants et au moins aussi efficace que les tablettes effervescentes d’Ukraine, et beaucoup plus efficaces que la spiruline. Ces résultats ont justifié le développement par l'Institut BELRAD de cette poudre enrichie de vitamines et d’oligoéléments, sous le nom de Vitapect. Vitapect a été enregistré en Biélorussie et donné aux enfants de villages fortement contaminés, pour des cures de trois à quatre semaines. Environ 200 000 enfants de Biélorussie ont reçu cette préparation, avec un contrôle radiamétrique du Cs137 incorporé, avant et après la cure.
Nesterenko a aussi démontré que 3 à 4 cures de 4 semaines de pectine par an, distribué aux enfants dans les écoles de villages hautement contaminés, parvenaient à maintenir la charge en Cs137 au-dessous du seuil de 50 becquerels par kilogramme de poids (Bq/kg), seuil à partir duquel Bandajevsky observe des lésions irréversibles au niveau du cœur, de l’œil, du système immunitaire et endocrinien, ou d’autres organes[18],[19].
L’Association pour le contrôle de la radioactivité dans l’Ouest a également trouvé que des enfants ayant reçu de la pectine lors de leur séjour en France ont vu leur contamination au césium 137 baisser de 31 % en moyenne contre seulement 15 % chez ceux qui n’en ont pas reçu hors la part naturellement présente dans l’alimentation. Toujours selon l’ACRO, la pectine augmente et accélère l'élimination du césium, mais moins rapidement que le disent ceux qui l’ont promue[20].
Des ONG aident les familles à se fournir en « Vitapect », pour que leurs enfants puissent en faire des cures régulières (trois par an idéalement, selon les promoteurs de la pectine).
Digestion
L'être humain ne sécrète pas lui-même d'enzymes dégradant la pectine (l'une des molécules les plus difficiles à dégrader de notre alimentation) ; c'est le microbiote intestinal qui permet sa digestion, et il est en partie sélectionné par la présence des pectines[21]. Les microbes symbiotiques[22] et processus responsables de cette digestion ont été récemment (publication 2017) identifiés, en particulier le rôle d'une bactérie intestinale dénommée Bacteroides thetaiotaomicron a été mis en évidence[23],[24].
Dégradation
La pectine est un polysaccharides fragile[25], et est en particulier dépolymérisée par des chauffages même modérés en milieu légèrement acide à neutre. Cette dépolymérisation joue un rôle important dans l'attendrissement de la texture des légumes lors de leur cuisson[26]. Cette dépolymérisaton est due au phénomène dit de "béta-élimination" qui nécessite la présence d'acides galacturoniques méthylés. En effet, la présence du méthyle rend plus labile l'hydrogène porté par le C-5, et en présence d'ions hydroxydes (OH-) ceci conduit à une trans-élimination avec perte d'un électron et formation d'une double liaison en C4-C5, et rupture de la liaison glycosidique.
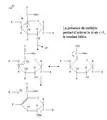 Mécanisme chimique de la béta-élimination des pectines
Mécanisme chimique de la béta-élimination des pectines Schéma de la bétaélimination
Schéma de la bétaélimination
De nombreuses espèces phytopathogènes (ex[27] : Erwinia carotovora, bactérie phytopathogène résistante au froid) sécrètent probablement de tels enzymes, nécessaires pour attaquer les cellules végétales. L’utilisation de ces enzymes est à la base de la clarification des jus de fruits comme lors de l’opération de débourbage dans la vinification des vins blancs et des vins rosés.
Notes et références
- ↑ (en) Voragen AG.J., Pilnik W., Thibault J.-F., Axelos M.A.V. et Renard C.M.G.C., Pectins, in : Food Polysaccharides and Their Applications, New-York, Marcel Dekker, , 287-339 p.
- ↑ (en) May C.D., « Industrial pectins : sources, production and applications », Carbohydrate Polymers, vol. 12, , p. 79-99
- 1 2 3 4 5 (en) Voragen A.G.J., Coenen G.J., Verhoef R.P. et Schols H.A., « Pectin, a versatile polysaccharide present in plant cell walls », Structural Biochemistry, vol. 20, , p. 263‑275
- 1 2 3 (en) Caffall K.H. et Mohnen D., « The structure, function, and biosynthesis of plant cell wall pectic polysaccharides », Carbohydrate Research, vol. 344, , p. 1879-1900
- ↑ (en) Thibault J.-F., Renard C.M.G.C., Axelos M.A.V., Roger P. et Crépeau M.-J., « Studies of the Length of Homogalacturonic Regions in Pectins by Acid-Hydrolysis », Carbohydrate Research, vol. 20, , p. 271‑286.
- ↑ (en) Morris G.A., Foster T.J. et Harding S.E., « The effect of the degree of esterification on the hydrodynamic properties of citrus pectin », Food Hydrocolloids, vol. 14, , p. 227-235
- ↑ (en) Axelos M.A.V. et Thibault J.-F., « Influence of the substituents of carboxyl groups and of the rhamnose content on the solution properties and flexibility of pectins », International Journal of Biological Macromolecules, vol. 13, , p. 77-82
- ↑ (en) Renard C.M.G.C., Lahaye M., Mutter M., Voragen F.G.J. et Thibault J.-F., « solation and characterisation of rhamnogalacturonan oligomers generated by controlled acid hydrolysis of sugar-beet pulp. », Carbohydrate Research, vol. 305, , p. 271-280
- 1 2 (en) Darvill A.G., McNeil M. et Albersheim P., « Structure of Plant Cell Walls VIII. A New Pectic Polysaccharide. », Plant Physiology, vol. 62, , p. 418-422
- ↑ (en) Vidal S., Doco T., Williams P., Pellerin P., York W.S., O'Neill M.A. et Albersheim P., « Structural characterization of the pectic polysaccharide rhamnogalacturonan II: evidence for the backbone location of the aceric acid-containing oligoglycosyl side chain. », Carbohydrate Research, vol. 326, , p. 277-294
- ↑ (en) Ishii T., Matsugana T., Pellerin P., O'Neill M.A., Darvill A. et Albersheim P., « The Plant Cell Wall Polysaccharide Rhamnogalacturonan II Self-assembles into a Covalently Cross-linked Dimer », Journal of Biological Chemistry, vol. 274, , p. 13098‑13104
- ↑ Flavour release from pectin gels: Effects of texture, molecular interactions and aroma compounds diffusion (REGA Barbara ; GUICHARD Elisabeth ; VOILLEY Andrée, in Sciences des aliments, 2002, vol. 22, no 3, p. 235-248, 14 p. ISSN 0240-8813, (anglais) Fiche Inist.
- ↑ (en) Mao Y, Kastrari B, Nabaeks, Wang LR, Adari D, Roos G. Stenram U, Molin G, Bengmark S et B. Jeppson, « Pectin supplemented external dietreduces the severity of methotrexate induced enterocolitis in rat » J Gastroenterol. 1996;31(6):558-67.
- ↑ Jean-René Jourdain, « Evaluation de l’emploi de la pectine chez les enfants vivant sur les territoires contaminés par le césium - Etat de l’art et analyse critique des publications »
 [PDF], sur irsn.fr, (consulté le )
[PDF], sur irsn.fr, (consulté le ) - ↑ Directeur de l’institut indépendant de Radioprotection Belrad.
- ↑ Laure Noualhat, « La pomme contre l'atome : Et si la pectine était un remède pour les enfants vivant dans les zones contaminées par Tchernobyl ? Reportage en Biélorussie », Libération, (lire en ligne)
- ↑ (en) Nesterenko VB, Nesterenko AV, Babenko VI, Yerkovich TV, Babenko IV, « Reducing the 137Cs-load in the organism of "Chernobyl" children with apple-pectin », Swiss Med Wkly, vol. 134, nos 1-2, , p. 24-7. (PMID 14745664, lire en ligne [PDF])
- ↑ (en) YI Bandazhevsky, « Chronic Cs-137 incorporation in children's organs », Swiss Med Wkly, vol. 133, nos 35-36, , p. 488-90. (PMID 14652805, lire en ligne [PDF])
- ↑ Bandajevsky Y.I. & Bandajevskaya G. « Myopathies au Césium 137 » Cardinale 2003;15(8):40-3.
- ↑ Page de l’ACRO consacrée à la pectine (décembre 2004).
- ↑ Koropatkin, N. M., Cameron, E. A. & Martens, E. C. (2012) How glycan metabolism shapes the human gut microbiota. Nat. Rev. Microbiol. 10, 323–335
- ↑ Martens, E. C. et al. Recognition and degradation of plant cell wall polysaccharides by two human gut symbionts. PLoS Biol. 9, e1001221 (2011)
- ↑ Didier Ndeh & al. (2017) Complex pectin metabolism by gut bacteria reveals novel catalytic functions (résumé)
- ↑ Mirjam Czjzek (2017) Biochemistry: A wine-induced breakdown ; Nature 22 Mars 2017 ; doi:10.1038/nature21901
- ↑ (en) Albersheim P., « Instability of pectin in neutral solutions », Biochemical and Biophysical Research Communications, vol. 1, , p. 253-256
- ↑ Sila D.N. et al., « Pectins in Processed Fruit and Vegetables: Part II - Structure-Function Relationships », Comprehensive Reviews in Food Science and Food Safety, vol. 8, , p. 86-104 (DOI DOI: 10.1111/j.1541-4337.2009.00070.x)
- ↑ Fiche Inist concernant une étude de l’université de Rouen.